龙葵茎叶中澳洲茄碱及澳洲茄边碱的超声辅助提取工艺优化
2024-02-21赵玥琪徐铭阳郝婧玮许丽颖刘斗南
赵玥琪,徐铭阳,郝婧玮,许丽颖,刘斗南
( 1.牡丹江师范学院生命科学与技术学院,黑龙江 牡丹江 157011;2.吉林农业大学农学院,长春 130000;3.牡丹江师范学院化学化工学院,黑龙江 牡丹江 157011)
龙葵(SolanumnigrumL.),茄科一年生草本植物,浆果、叶子可食用。全株皆可入药,散瘀消肿、利尿降压、清热解毒、祛痰止咳等作用[1-2]。龙葵中含有多种生物活性成分,因其抗肿瘤作用日益成为研究热点[3-4]。研究表明,具抗肿瘤作用的主要活性成分为龙葵中的甾体生物碱,包括澳洲茄碱、澳洲茄边碱、β-澳洲茄边碱等[5-7]。实验证明,澳洲茄碱、澳洲茄边碱在体外抗肿瘤过程中可有效抑制肿瘤细胞的增殖和生长[8-10]。澳洲茄碱、澳洲茄边碱有游离态和结合态两种形式[11],经加酸处理可将结合态澳洲茄碱、澳洲茄边碱水解出来[12],但龙葵茎叶中澳洲茄碱、澳洲茄边碱的酸水解工艺未见报导。利用超声波辅助提取法提取龙葵茎叶中的澳洲茄碱、澳洲茄边碱,考察提取时间、料液比、乙醇浓度,酸水解条件对龙葵茎叶中澳洲茄碱、澳洲茄边碱提取率的影响,优化其提取条件,以期提高龙葵茎叶的利用率,为进一步开发龙葵资源提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验药材。龙葵茎叶(牡丹江地区野生资源,经实验室鉴定为茄科茄属龙葵)。采收时间:2022年9月。
1.1.2 实验仪器。鼓风干燥箱(上海-恒科学仪器有限公司,DHG-9140A);电子天平(赛多利斯科学仪器北京有限公司,FA2304);数控超声波清洗器(昆山市超声仪器有限公司,KQ-400DB);电热恒温水浴锅(上海-恒科技有限公司,HWS28型);高效液相色谱(waters公司,2695)。
1.1.3 实验试剂。澳洲茄碱、澳洲茄边碱标准品,纯度≥98%(成都普菲德生物技术有限公司);无水乙醇、盐酸、硫酸、甲醇,均为分析纯,乙腈为色谱纯;水为超纯水。
1.2 实验方法
1.2.1 龙葵茎叶干燥。龙葵茎叶部分置于背阴处自然风干5~7 d后,放入鼓风干燥箱,温度设定为50 ℃,烘干至恒重,粉碎机粉碎密封于背光处保存备用。
1.2.2 提取时间考察。称取干重5.0 g样品,80%乙醇,料液比1∶20,温度40 ℃,分别超声波震荡10、20、30、40、50、60、70 min。
1.2.3 料液比考察。称取干重5.0 g样品,80%乙醇、温度40 ℃、提取时间40 min,料液比分别设置为1∶5、1∶10、1∶15、1∶20、1∶40,进行超声波辅助提取。
1.2.4 乙醇浓度考察。称取干重5.0 g样品,料液比1∶20、温度40 ℃、提取时间40 min,乙醇浓度分别为:10%、20%、30%、40%、50%、60%、70%、80%、90%、100%。
1.2.5 最优单因素条件下提取率考察。以单因素实验结果为依据,设定提取条件。
1.2.6 酸水解考察。称取干重5.0 g样品,温度80 ℃,配置5%盐酸乙醇溶液、10%盐酸乙醇溶液、20%盐酸乙醇溶液作为提取溶剂。其余条件参考乙醇提取单因素实验结果;称取干重5.0 g样品,温度80 ℃,配置2.5%硫酸乙醇溶液、5%硫酸乙醇溶液、10%硫酸乙醇溶液作为提取溶剂。其余条件参考乙醇提取单因素实验结果。
1.2.7 实验处理。将1.2.2、1.2.3、1.2.4、1.2.5、1.2.6实验所得提取液各取1 mL,经离心机离心取上清液。采用HPLC含量测定法,测定澳洲茄碱、澳洲茄边碱含量。色谱条件为,色谱柱:Venusil XBP C18(250 mm×4.6 mm,5μm);流动相:乙腈-2 mmol/L 磷酸钠水溶液(39∶61);流速:1.0 mL/min;进样量20 μL;柱温:30 ℃;检测波长203 nm。
2 结果与分析
2.1 单因素对澳洲茄碱、澳洲茄边碱含量的影响
2.1.1 澳洲茄碱标准曲线建立。以峰面积为纵坐标,澳洲茄碱浓度为横坐标,双方的线性回归方程为:y= 7×107x-872038,相关系数R2= 0.9997,说明澳洲茄碱标准品在0.1~2.0 mg/mL范围内,峰面积与澳洲茄碱浓度呈现良好的线性关系。如图1所示。
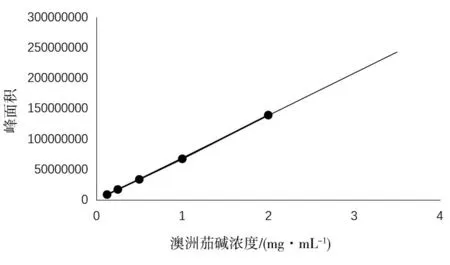
图1 澳洲茄碱标准曲线
2.1.2 澳洲茄边碱标准曲线建立。以峰面积为纵坐标,澳洲茄边碱浓度为横坐标,双方的线性回归方程为:y=7×105x-232112,相关系数R2= 0.9999,说明澳洲茄边碱标准品在0.1~2.0 mg/mL范围内,峰面积与澳洲茄边碱浓度呈现良好的线性关系。如图2所示。
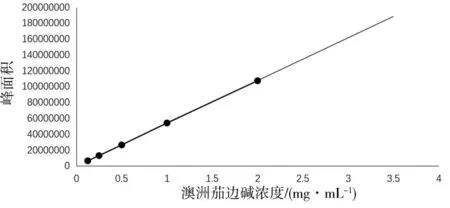
图2 澳洲茄边碱标准曲线
2.1.3 提取时间对提取率的影响。由图3所示,在料液比1∶20、温度40 ℃、80%乙醇提取条件下,提取率随时间增加呈先升高后下降趋势,在60 min达到最高,分别为澳洲茄碱0.221%、澳洲茄边碱0.131%,故最优提取时间为60 min。
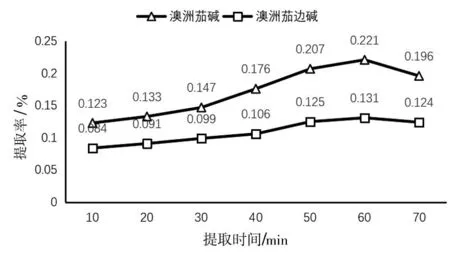
图3 提取时间对提取率的影响
2.1.4 提取料液比对提取率的影响。由图4所示,在提取温度40 ℃、提取时间40 min、80%乙醇提取条件下,提取率随料液比减小呈现先升高后下降趋势,料液比1∶20时,提取率达到最高,分别为澳洲茄碱0.227%、澳洲茄边碱0.138%,故最优料液比为1∶20。
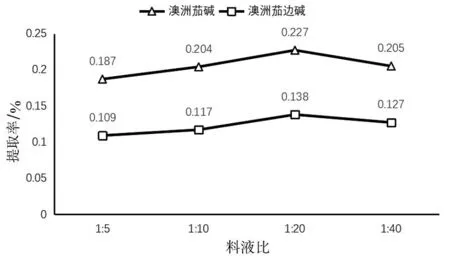
图4 料液比对提取率的影响
2.1.5 乙醇溶液浓度对提取率的影响。由图5所示,在料液比1∶20、温度40 ℃、时间40 min提取条件下,提取率随增加乙醇溶液浓度增加呈先升高后下降趋势,乙醇浓度为80%时,提取率达到最高,分别为澳洲茄碱0.224%、澳洲茄边碱0.136%,故最优乙醇溶液浓度为80%。
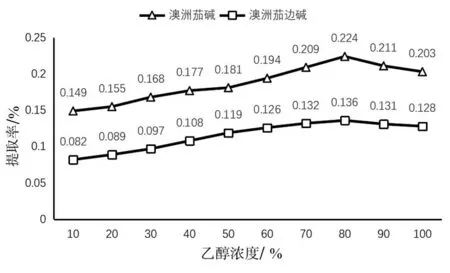
图5 乙醇溶液浓度对提取率的影响
2.1.6 最优单因素条件下提取率。在80%乙醇、提取时间60 min、提取温度40 ℃、料液比1∶20提取条件下,龙葵茎叶中澳洲茄碱、澳洲茄边碱的含量分别为0.229%、0.141%。
2.1.7 酸水解对提取率的影响。如图6和图7所示,随着水解酸浓度的增加,提取率呈上升趋势。结果显示,在酸水解作用下,澳洲茄碱、澳洲其边碱提取率均有所提高。在所设定条件范围内,料液比1∶20、提取时间60 min、温度80 ℃、10%硫酸乙醇溶液为提取溶剂时,澳洲茄碱、澳洲茄边碱提取率最高,分别为0.275%、0.168%。
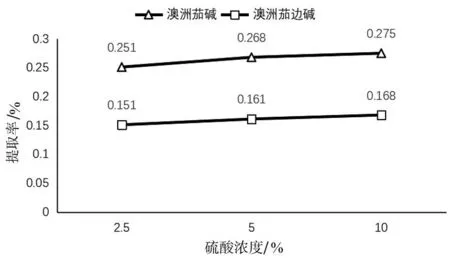
图6 硫酸水解对提取率的影响

图7 盐酸水解对提取率的影响
3 结论
实验结果表明,采用超声波辅助提取法,优化提取条件可有效提高龙葵茎叶中澳洲茄碱、澳洲茄边碱的提取率。
以乙醇作为提取溶液,控制温度40 ℃,防止温度过高至乙醇挥发,影响提取效果。通过单因素实验考察,获得最佳提取条件:乙醇浓度80%、提取时间60 min、提取温度40 ℃、料液比1∶20,龙葵茎叶中澳洲茄碱、澳洲茄边碱的含量分别为0.229%、0.141%,证实提取工艺稳定、可靠。
实验首次采用酸水解法优化提取工艺。加热反应有利于促进酸水解反应的进行,并缩短反应时间,故实验选择80 ℃为提取温度。在料液比1∶20、提取时间60 min、提取温度80 ℃条件下,以10%硫酸乙醇作为提取溶液,澳洲茄碱与澳洲茄边碱提取率分别为0.275%、0.168%。与乙醇提取相比,提取率分别提高1.2倍、1.19倍。实验证明,在酸水解作用下,可使结合态澳洲茄碱、澳洲茄边碱中糖苷键断裂,转化为游离态,进而有效提高龙葵茎叶中澳洲茄碱、澳洲茄边碱的提取率。超声辅助酸水解提取条件有待进一步优化。
