基于Wnt/β-catenin 信号通路探索芪蛭通络方对糖尿病肾病大鼠肾间质纤维化的作用机制
2024-02-21申晨卉常蕊蕊檀金川
申晨卉 常蕊蕊 张 尧 杨 冰 檀 淼 唐 淼 檀金川
(1.河北中医药大学研究生学院,河北石家庄 050200;2.河北省中医院,河北石家庄 050011;3.河北医科大学第四医院,河北石家庄 050010;4.河北医科大学第二医院,河北石家庄 050004)
糖尿病肾病(diabetic kidney disease,DKD)是由糖尿病(diabetes mellitus,DM)迁延日久发展而来,最终可能会演变为慢性肾脏病(chronic kidney disease,CKD)和终末期肾脏病(end stage renal disease,ESRD)[1],对人类健康造成了巨大的威胁。DKD的病理变化包括结节性或弥漫性肾小球硬化、肾小管炎症、萎缩和肾间质纤维化(renal interstial fibrosis,RIF)[2]。其中,肾间质纤维化是DKD晚期主要的病理改变,同时也是促进疾病进展的一个重要因素。肾间质纤维化是纤维化基质的沉积和因严重或持续损伤而形成的疤痕[3],持续的纤维化状态会损害肾脏组织结构和器官功能。DKD是一种多系统性疾病,其发病过程涉及多个细胞因子和分子信号通路的相互作用,其中Wnt/β-连环蛋白(β-catenin)信号通路的异常可能是DKD发生发展的重要病理机制之一,该通路在进化上高度保守,在高糖状态下被异常激活,加剧足细胞损伤程度,从而引起肾间质纤维化。相关研究表明,抑制Wnt/β-catenin信号通路的异常激活可起到延缓RIF进展的作用[4],从而延缓DKD进程。
大量研究证实,中医药可通过调控Wnt/β-catenin信号通路延缓肾间质纤维化,从而发挥对DKD的治疗作用[5-7]。基于赵玉庸教授提出的“肾络瘀阻”理论[8],河北省名中医檀金川教授进一步提出DKD病机总属脾肾两虚、浊瘀互结,并总结经验方芪蛭通络方(黄芪、烫水蛭、党参、丹参、川芎、全蝎、地龙、茯苓、醋龟甲)以健脾补肾、化浊祛瘀,临床疗效显著[9]。前期药理研究证实,单味药黄芪、丹参、川芎、地龙均具有抑制肾纤维化作用[10],因此本研究观察复方芪蛭通络方对DKD模型大鼠肾间质纤维化的影响,并以Wnt/β-catenin信号通路为切入点探究其作用机制,以为临床运用该方治疗DKD提供依据。
1 实验材料
1.1 实验动物及饲料 SPF级8周龄雄性SD大鼠,体质量为(150±20)g,购自河北医科大学实验动物中心,动物合格证号:SCXK(冀)2018-004,饲养于河北医科大学第四医院实验动物中心。饲养环境:(20±2)℃,(50±10)%湿度,12 h/12 h明暗交 替,自由进食。本研究经河北中医药大学动物伦理委员会批准(批号:DWLL202302010)。普通饲料,购自河北医科大学动物实验中心,合格证号SCXK(冀)2018-003。高糖高脂饲料,购自吉林赛诺生物有限公司,批号:20180819。
1.2 实验药物 芪蛭通络方,药物组成:黄芪25 g,烫水蛭3 g,党参15 g,丹参12 g,川芎9 g,全蝎3 g,地龙9 g,茯苓12 g,醋龟甲15 g。使用颗粒剂,购自广东一方制药有限公司,批号分别为:1109623,1110473,1092273,1101773,1104393,1102783,1106103,1101343,1055703。临用前使用蒸馏水配制成0.1215 g/mL、0.2430 g/mL、0.4860 g/mL的溶液。厄贝沙坦片,浙江华海药业股份有限公司生产,批号:YBH06232017,规格:75 mg/片,临用前碾碎,溶于蒸馏水中,配制成浓度为1.4 mg/mL的混悬液。
1.3 主要试剂 链脲佐菌素(STZ,批号:S0103),美国Sigma-Aldrich公司;β-肌动蛋白(actin)抗体(批号:AF7018),美 国Affinity Biosciences公 司;24 h尿蛋白定量(24 h-UTP)试剂盒(批号:C035-2-1)、肌酐测定试剂盒(批号:C011-2-1)、血尿素氮(BUN)测试盒(批号:C013-2-1),南京建成生物工程研究所;苏木素-伊红(HE)染色液(批号:G1120)、马松(Masson)染色液(批号:G1340),北京索莱宝科技有限公司;一抗Wnt1试剂(批号:40023)、一 抗β-catenin试 剂(批 号42536),美 国GeneTex公 司;一 抗GSK-3β试 剂(批 号:YT2082),美 国Immunoway Biotechnology公司;一抗CTGF试剂(批号:MAB91901-100),美国R&D Systems公司;二抗(批号SC2357),美国圣克鲁斯生物技术有限公司;RIPA裂解液(批号:09271919023),上海碧云天生物技术有限公司;PBS缓冲液粉末(批号:19022401),北京中杉金桥生物技术有限公司。
1.4 主要仪器 H-7650型透射电子显微镜、7170A全自动生化分析仪,日本日立有限公司;稳豪型血糖仪,美国强生有限公司;Multiskan FC型酶标仪,美国赛默飞世尔科技公司;BX53显微镜,日本奥林巴斯有限公司;RM-2126RT切片机,上海徕卡公司;Mini PROTEAN型电泳槽、Mini Trans-Blot电泳转移池,美国BIO-RAD公司;Kodak Image Station 2000MM成像系统,美国柯达公司。
2 实验方法
2.1 造模与分组 SD大鼠适应性喂养后予造模:高糖高脂饲料喂养4周,禁食12 h,腹腔注射1% STZ溶液35 mg/kg,3 d后尾静脉处取血测血糖(GLU),GLU≥16.7 mmol/L即为DM造模成功,造模成功的大鼠继续高糖高脂饲料喂养4周,定期测量GLU及24 h-UTP,第4周末随机处死1只大鼠,观察肾组织,若24 h-UTP>30 mg,且肾组织存在病理改变,即为DKD造模成功[11]。取造模成功的大鼠50只,随机分为模型组、厄贝沙坦组及芪蛭通络方低、中、高剂量组,每组10只。造模同时另取10只大鼠作为正常组,予普通饲料喂养4周,腹腔注射等体积柠檬酸缓冲液,继续普通饲料喂养4周。
2.2 给药 依据人与大鼠体表面积折算法计算大鼠的药物临床等效剂量[12]:芪蛭通络方低、中、高剂量组给药剂量分别为1.215、2.430、4.860 g/kg,厄贝沙坦组给药剂量为14 mg/kg。每日上午各给药组大鼠按10 mL/kg的剂量分别灌胃给予相应药物,正常组和模型组灌胃等体积蒸馏水,每日1次,连续8周。
2.3 取材 末次给药后约5 h处死各组大鼠。处死前1日用代谢笼收集大鼠24 h尿液用于检测24 h-UTP;末次给药后禁食不禁水5 h,尾静脉取血测GLU;随后采用异氟烷吸入的方式麻醉大鼠,于腹主动脉处取血,分离血清置于-80 ℃冰箱保存备用;取出双肾,生理盐水冲洗后用滤纸吸干,冰上取左肾皮质,4%多聚甲醛固定,用于HE、Masson、免疫组化(IHC)染色;右肾保存于-80 ℃冰箱拟用于蛋白免疫印迹(Western blot)法检测。
2.4 指标检测
2.4.1 血糖及肾功能指标检测 取各组大鼠血清,使用全自动生化分析仪检测大鼠BUN、Scr水平;尾静脉取血,使用血糖仪测GLU;采集24 h尿液,使用双缩脲法检测24 h-UTP。
2.4.2 肾脏病理学检查
2.4.2.1 HE染色观察肾脏病理学改变 取各组大鼠部分左肾组织浸泡于4%多聚甲醛48 h,乙醇脱水,石蜡包埋,切片,经二甲苯、无水乙醇、95%乙醇、85%乙醇进行逐级脱蜡水化,苏木素染色1 min,流水冲洗,1%盐酸酒精分化,流水冲洗,1%氨水水溶液返蓝,流水冲洗,伊红染色,最后乙醇脱水,二甲苯透明,中性树胶封片,置于光学显微镜下观察肾组织形态学改变并拍照记录。
2.4.2.2 Masson染色观察肾脏病理学改变 按照HE染色步骤将切片脱蜡水化,铁苏木素染色8 min,流水冲洗,1%盐酸酒精分化10 s,流水冲洗返蓝,丽春红染色8 min,流水冲洗,磷钼酸处理,苯胺蓝复染,1%冰醋酸分化,最后乙醇脱水,二甲苯透明,中性树胶封片,置于光学显微镜下观察肾组织形态学改变并拍照记录。
2.4.3 免疫组化法检测肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达 取各组大鼠部分冷冻左肾组织,切片,烤片,二甲苯及乙醇脱蜡水化,抗原修复,PBS洗涤,加入内源性过氧化物酶阻断剂,山羊血清封闭,加入一抗(1∶500),4℃孵育过夜,复温,PBS清洗,加入二抗,37℃孵育30 min,PBS清洗,DAB避光显色,流水冲洗,苏木素再次染色,乙醇脱水,二甲苯透明,中性树脂封片,使用Image J软件进行半定量分析。
2.4.4 Western blot法 检 测 肾 组 织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达 取各组大鼠右肾组织100 g,研磨均匀,置于无菌离心管中,加入RIPA裂解液,提取肾组织总蛋白,制胶、上样、电泳、电转转膜,室温封闭2 h,分别加入Wnt1抗体(1∶1000)、β-catenin抗 体(1∶1000)、CTGF抗 体(1∶2000)、GSK-3β抗 体(1∶1000)、β-actin抗 体(1∶5000),4℃孵育过夜,TBST洗膜后加二抗(1∶2000),室温孵育2 h,再次洗膜,采用ECL法进行显色,Image J软件分析各组条带灰度值。
2.5 统计学方法 使用SPSS 27.0 统计软件对数据进行分析。本研究所有计量资料均符合正态分布,采用均值±标准差(±s)表示,组间比较采用单因素方差分析(One-way ANOVA),方差齐则采用Tukey法,方差不齐则采用Games-Howell检验。以P<0.05 为差异有统计学意义。
3 实验结果
3.1 各 组 大 鼠GLU、Scr、BUN、24 h-UTP水 平 比较 模型组大鼠GLU、Scr、BUN、24 h-UTP水平均明显高于正常组(P<0.01);各给药组大鼠上述指标均明显低于模型组(P<0.01);芪蛭通络方中、高剂量组大鼠GLU、Scr、BUN水平均明显低于厄贝沙坦组(P<0.01),高剂量组24 h-UTP水平明显低于厄贝沙坦组(P<0.01);芪蛭通络方对DKD模型大鼠血糖及肾功能指标的改善作用表现出一定的剂量依赖性。见表1。
表1 各组大鼠GLU、Scr、BUN、24 h-UTP水平比较(±s)
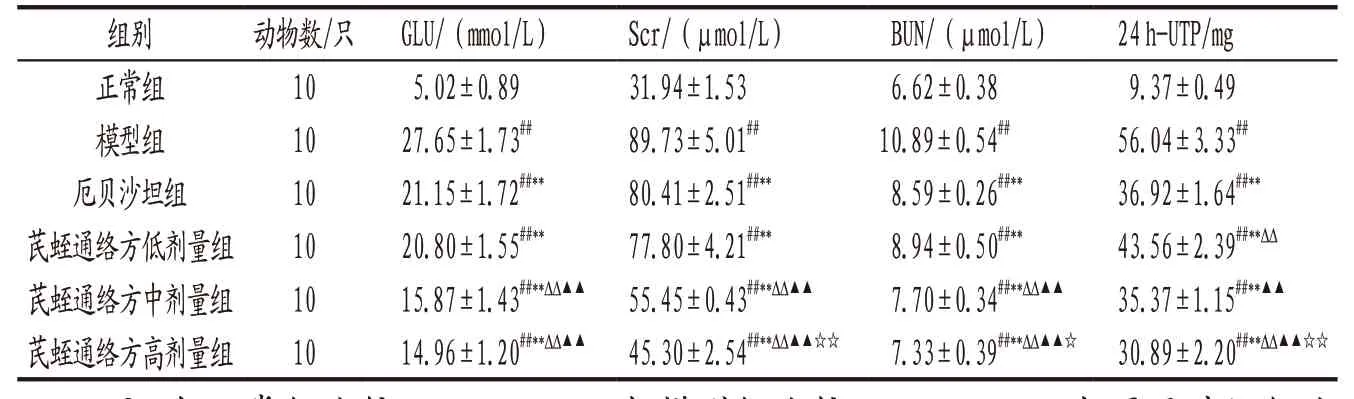
表1 各组大鼠GLU、Scr、BUN、24 h-UTP水平比较(±s)
注: 与正常组比较,##P<0.01;与模型组比较,**P<0.01;与厄贝沙坦组比较,ΔΔP<0.01;与芪蛭通络方低剂量组比较,▲▲P<0.01;与芪蛭通络方中剂量组比较,☆P<0.05,☆☆P<0.01。
组别 动物数/只 GLU/(mmol/L) Scr/(μmol/L) BUN/(μmol/L) 24 h-UTP/mg正常组 10 5.02±0.89 31.94±1.53 6.62±0.38 9.37±0.49模型组 10 27.65±1.73## 89.73±5.01## 10.89±0.54## 56.04±3.33##厄贝沙坦组 10 21.15±1.72##** 80.41±2.51##** 8.59±0.26##** 36.92±1.64##**芪蛭通络方低剂量组 10 20.80±1.55##** 77.80±4.21##** 8.94±0.50##** 43.56±2.39##**ΔΔ芪蛭通络方中剂量组 10 15.87±1.43##**ΔΔ▲▲ 55.45±0.43##**ΔΔ▲▲ 7.70±0.34##**ΔΔ▲▲ 35.37±1.15##**▲▲芪蛭通络方高剂量组 10 14.96±1.20##**ΔΔ▲▲ 45.30±2.54##**ΔΔ▲▲☆☆ 7.33±0.39##**ΔΔ▲▲☆ 30.89±2.20##**ΔΔ▲▲☆☆
3.2 各组大鼠肾组织病理形态比较 HE染色结果显示:正常组大鼠肾小球结构正常,形态规则,肾小管排列有序,未见炎性细胞浸润;模型组大鼠肾小球结构遭到破坏,体积增大,大量的炎性细胞浸润,基底膜增厚,系膜区变宽,间质区弥漫性水肿,肾小管扩张;芪蛭通络方低剂量组大鼠肾组织病理形态较模型组变化不大,肾小球体积增大,系膜区增宽,基底膜增厚,肾小管扩张;芪蛭通络方中、高剂量组及厄贝沙坦组大鼠肾小球体积虽有增大但较模型组减小,系膜扩张和基底膜较模型组明显变薄,肾小管排列相对紧密整齐,其中芪蛭通络方高剂量组和厄贝沙坦组改善最为明显。见图1。
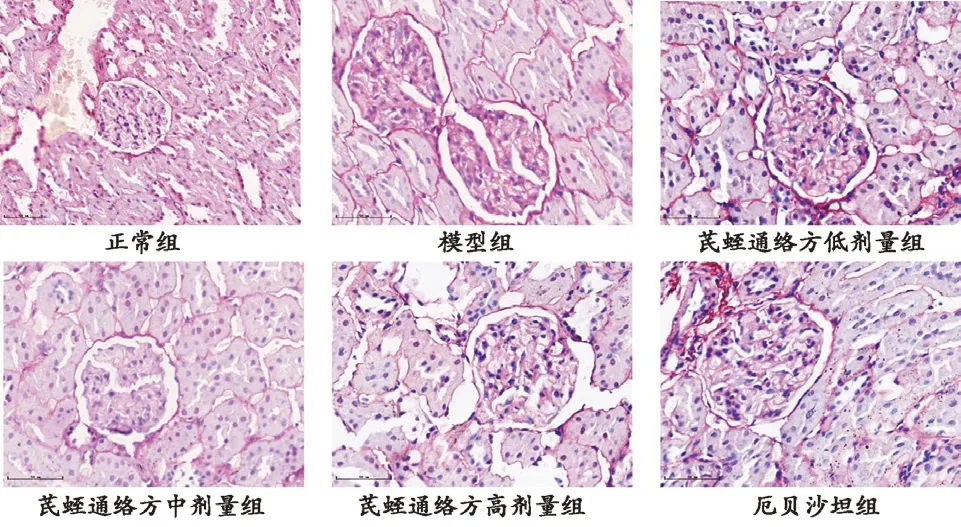
图1 HE染色各组大鼠肾组织病理形态(×400)
Masson染色结果显示:模型组大鼠肾组织蓝色胶原纤维分泌增多且伴病理损伤;芪蛭通络方低剂量组大鼠肾组织胶原纤维沉积稍有减少;芪蛭通络方中、高剂量组及厄贝沙坦组大鼠肾组织胶原纤维明显减少,以芪蛭通络方高剂量组改善最为明显。见图2。
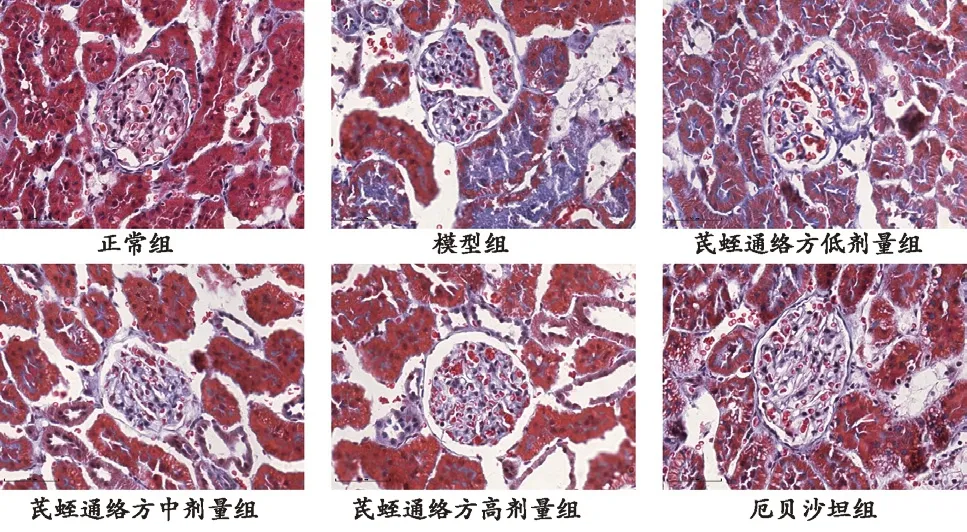
图2 Masson染色各组大鼠肾组织病理形态(×400)
3.3 各组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达比较 免疫组化法结果显示:模型组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达均明显高于正常组(P<0.01);各给药组大鼠上述指标均明显低于模型组(P<0.01);芪蛭通络方高剂量组与厄贝沙坦组大鼠上述指标均明显低于芪蛭通络方低、中剂量组(P<0.01);芪蛭通络方高剂量组大鼠上述指标均明显低于厄贝沙坦组(P<0.05,P<0.01);芪蛭通络方对DKD模型大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达的抑制作用表现出一定的剂量依赖性。见表2、图3~图6。

图3 各组大鼠肾组织Wnt1蛋白表达比较(IHC,×400)

图5 各组大鼠肾组织CTGF蛋白表达比较(IHC,×400)

图6 各组大鼠肾组织GSK-3β蛋白表达比较(IHC,×400)
表2 免疫组化法各组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白相对表达量比较(±s)

表2 免疫组化法各组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白相对表达量比较(±s)
注: 与正常组比较,##P<0.01;与模型组比较,**P<0.01;与厄贝沙坦组比较,ΔP<0.05,ΔΔP<0.01;与芪蛭通络方低剂量组比较,▲▲P<0.01;与芪蛭通络方中剂量组比较,☆☆P<0.01。
组别 动物数/只 Wnt1 β-catenin CTGF GSK-3β正常组 10 0.288±0.002 0.252±0.009 0.311±0.008 0.229±0.007模型组 10 0.387±0.003## 0.485±0.016## 0.521±0.024## 0.404±0.017##厄贝沙坦组 10 0.331±0.006##** 0.311±0.010##** 0.380±0.003##** 0.264±0.010##**芪蛭通络方低剂量组 10 0.371±0.002##**ΔΔ 0.396±0.010##**ΔΔ 0.476±0.010##**ΔΔ 0.338±0.010##**ΔΔ芪蛭通络方中剂量组 10 0.349±0.004##**ΔΔ▲▲ 0.361±0.009##**ΔΔ▲▲ 0.414±0.011##**ΔΔ▲▲ 0.288±0.005##**Δ▲▲芪蛭通络方高剂量组 10 0.307±0.006##**ΔΔ▲▲☆☆ 0.288±0.007##**Δ▲▲☆☆ 0.353±0.009##**Δ▲▲☆☆ 0.244±0.003**Δ▲▲☆☆
蛋白免疫印迹法结果显示:模型组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达水平均明显高于正常组(P<0.01);各给药组大鼠上述蛋白表达水平均明显低于模型组(P<0.05,P<0.01);芪蛭通络方高剂量组大鼠肾组织Wnt1、GSK-3β蛋白表达水平均明显低于厄贝沙坦组(P<0.01,P<0.05),β-catenin、CTGF蛋白表达水平与厄贝沙坦组比较差异无统计学意义(P>0.05);芪蛭通络方对DKD模型大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白表达的抑制作用表现出一定的剂量依赖性。见表3、图7。
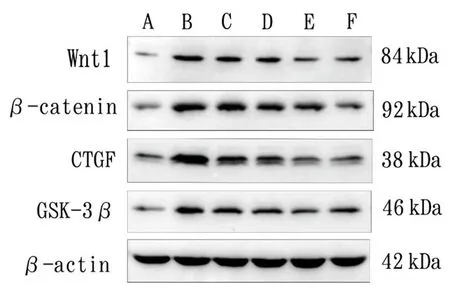
图7 各组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白条带图
表3 蛋白免疫印迹法各组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白相对表达量比较(±s)

表3 蛋白免疫印迹法各组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白相对表达量比较(±s)
注: 与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与厄贝沙坦组比较,ΔP<0.05,ΔΔP<0.01;与芪蛭通络方低剂量组比较,▲▲P<0.01;与芪蛭通络方中剂量组比较,☆P<0.05,☆☆P<0.01。
组别 动物数/只 Wnt1 β-catenin CTGF GSK-3β正常组 10 0.229±0.043 0.246±0.043 0.311±0.050 0.317±0.050模型组 10 0.922±0.057## 0.878±0.168## 0.919±0.116## 0.714±0.038##厄贝沙坦组 10 0.513±0.090##** 0.534±0.058##** 0.463±0.057#** 0.590±0.043##**芪蛭通络方低剂量 10 0.796±0.064##*ΔΔ 0.679±0.051##* 0.621±0.073##**Δ 0.616±0.027##*芪蛭通络方中剂量 10 0.722±0.092##**ΔΔ 0.559±0.071##** 0.521±0.067##** 0.574±0.034##**芪蛭通络方高剂量 10 0.387±0.059#**Δ▲▲☆☆ 0.410±0.026#**▲▲☆ 0.346±0.038**▲▲☆ 0.424±0.058#**ΔΔ▲▲☆☆
4 讨论
DKD发病隐蔽,早期仅有持续的微量白蛋白尿及肾小球高滤过率,极易忽视,若不及时加以干预,可能导致肾间质纤维化,最终进展为尿毒症。目前DKD发病机制尚不清晰,西医亦无特异性治疗,主要以降压、控糖、减少蛋白尿等对症治疗为主,起不到关键作用。近年来中医药治疗DKD疗效显著,诸多研究表明中药复方辨证施治,多靶点整体调节,可在根本上增强体质,顾护正气,减轻肾纤维化程度,降低死亡率[13]。
DKD以肾病综合征、高血压等临床表现为主,可归属于中医学“水肿”“虚劳”等范畴。檀金川教授根据多年临证经验提出DKD病机总属本虚标实,以脾肾两虚为本,湿、浊、瘀互结为标[14]。《诸病源候论》云:“夫水肿病者,皆由荣卫痞涩,肾脾虚弱所为。”脾虚无以运化,肾虚则气化不利、开阖失司,致使精微下注,水液代谢失常,发为蛋白尿、水肿;《血证论》[15]曰:“故气不得通,不能载水津上升,是以发渴,名曰血渴,瘀血去则不渴矣……”湿浊内蕴,气血运行不畅,气滞则血瘀,血瘀则湿浊内生,三者相互影响、胶着,共同作用,推动疾病进展。芪蛭通络方以健脾补肾、化浊祛瘀为出发点。方中黄芪、党参健脾益气,现代药理研究表明黄芪有增强免疫、改善肾脏微循环、降低蛋白尿的功效[16],为临床治疗肾脏病常用中药;醋龟甲滋阴潜阳,在补肾的同时亦能顾护肝阴;丹参、川芎相须为用,活血祛瘀,丹参中的丹酚酸、鞣酸等成分具有降血脂、抗炎的作用[17];茯苓健脾宁心、利水消肿;虫类药烫水蛭、全蝎、地龙,善行走窜之势,搜风通络化浊,檀师临床善用此类药物,因其活血化瘀力强,又能引诸药直达病所[18]。
DKD发病机制与高糖环境、血流动力学改变、氧化应激及炎症反应等有关,多种信号通路的异常激活可导致DKD细胞损伤、细胞外基质过剩[19]。研究表明,Wnt/β-catenin信号通路在DKD肾纤维化中起着关键作用[20],通过介导上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)来引发RIF。该通路在正常肾脏中处于沉默状态,Wnt1、β-catenin、CTGF、GSK-3β蛋白表达很低或无表达[21],GSK-3β、β-catenin参与细胞增殖、分化及凋亡[22]。GSK-3β作为Wnt/β-catenin信号通路中的传递器之一,以“破坏复合物”的形式存在,在磷酸化β-catenin后再降解方面发挥着重要作用。研究表明,GSK-3β在纤维化的肾小管上皮细胞中高度表达,特异性的GSK-3β抑制剂可以减少GSK-3β表达,缓解RIF[23]。在高糖条件下,Wnt/β-catenin信号通路可被异常激活,Wnt1蛋白在肾脏中表达水平增加,此时Wnt1与其跨膜受体卷曲受体家族蛋白(Fzd)、低密度脂蛋白受体相关蛋白(LRP)5和6 结合,蓬乱蛋白(Dishevelled,Dvl)被激活,GSK-3β被磷酸化,导致β-catenin不能降解而积累转移到细胞核,然后与转录因子聚合成复合物,诱导靶基因的过度表达,从而促进EMT的进程,进而引发RIF[24-25]。CTGF是一种促纤维因子,大量实验证明,CTGF作为预测RIF进展的指标,其表达随着DKD的进展而增加[21]。CTGF下游可促进成纤维细胞合成、分泌大量胶原纤维,并通过与Wnt通路LRP6结合以异常激活Wnt通路,从而加重RIF[26]。孔维玮[27]发现Nrf2可以通过下调CTGF表达水平来抑制Wnt通路以减轻RIF程度。由此表明,Wnt1、β-catenin、CTGF、GSK-3β蛋白均在RIF进展中发挥着重要的作用。本研究结果表明,模型组大鼠肾组织Wnt1、β-catenin、CTGF、GSK-3β蛋白含量均明显高于正常组,与前述报道一致;芪蛭通络方及厄贝沙坦对上述指标均有明显的干预作用,推测这可能是其干预DKD的作用机制,其中芪蛭通络方高剂量对上述指标的改善或明显优于厄贝沙坦,或与厄贝沙坦相当,部分指标甚至接近正常组水平。本研究部分指标免疫组化法与蛋白免疫印迹法检测结果存在不一致的现象,推测可能与样本量偏小或者样本误差有关,未来将进一步观察若延长给药时间,芪蛭通络方高剂量是否较厄贝沙坦疗效显著。
本实验通过高糖高脂饮食与STZ注射制备DKD大鼠模型,选取临床疗效显著的厄贝沙坦为阳性药物。结果表明,芪蛭通络方及厄贝沙坦对DKD大鼠血糖及肾功能指标、肾组织病理改变均有明显的改善作用,说明两种药物对DKD均有治疗作用,而芪蛭通络方疗效更优。在对比芪蛭通络方各剂量组各指标的检测结果发现,芪蛭通络方对DKD大鼠血糖、肾功能指标、肾组织病理改变的改善作用均表现出一定的剂量依赖性,提示药物浓度与治疗效果可能存在着正相关,可为临床用药剂量提供参考。
综上,我们推测芪蛭通络方高剂量可抑制Wnt/β-catenin信号通路的激活,减少Wnt1、CTGF活性,防止GSK-3β磷酸化,使泛素介导的β-catenin磷酸化后降解而处于沉默状态,从而起到减轻RIF、保护肾脏的作用。然而本研究仍存在一定的局限性,如样本量偏少、给药和观察期较短等,同时中药复方成分复杂,可能涉及多个信号通路,下一步本课题组将增加样本量,延长给药时间,进一步挖掘芪蛭通络方通过作用于其他靶点延缓RIF,保护肾脏的作用机制。
