芒果AP2/ERF转录因子MiERF2基因的克隆及表达分析
2024-02-21魏玲寇明睿李雯
魏玲 寇明睿 李雯
关键词:芒果;ERF转录因子;生物信息学分析;亚细胞定位;表达分析
AP2/ERF转录因子超家族存在于众多植物中,在植物生长发育方面具有重要功能,该家族蛋白特征明显,含有典型的AP2/ERF结构域,具有结合DNA的功能[1]。ERF最早是从烟草中分离发现的,功能域主要由4个部分构成,依次为转录调控功能域、DNA结合功能域、寡聚化位点功能域和核定位信号功能域[1]。AP2/ERF转录因子与其他转录因子区分的主要依据是该家族成员均包含有1个或多个由60~70个高度保守的氨基酸组成的AP2/ERF结构域,该结构域是ERF行使转录调控的关键[2]。AP2/ERF家族转录因子根据其含有的结构域数量和是否含有其他类型结构域这2个依据,将其分为4个亚族(AP2、DREB、ERF、RAV)和单独成员(Soloist)[3-5]。AP2亞家族划分的依据是氨基酸序列中含有2个串联的相似度很高的AP2/ERF结构域;DREB和ERF亚家族相似度很高,序列中均只含有1个AP2/ERF保守结构域,主要区分依据是ERF亚家族第14位是丙氨酸,第19位是天冬氨酸,而DREB亚家族则分别是缬氨酸和谷氨酸;RAV亚家族中含有2个不同的结构域,分别是AP2/ERF结构域和B3结构域,可以结合不同元件发挥多种调控作用;而Soloist亚家族中虽然也包含1个AP2/ERF结构域,但与其他几类亚家族的结构域差异很大,对Soloist亚家族的研究报道也很少[3,6-7]。AP2亚家族成员的基因主要参与植物侧根形成和开花等过程,ZHANG等[8]研究发现油菜BrAP2a和BrAP2b能够修复拟南芥ap2-5突变体花冠缺陷。DREB亚家族可以参与调控植物干旱及低温等非生物胁迫响应,田文等[9]的研究表明小麦TaDREB27-A-2等5个基因参与了小麦的热胁迫反应;王雷立等[10]研究发现基于玉米转录水平分析结果显示与胁迫响应相关的DREB亚家族基因多数下调表达。ERF亚家族参与调控乙烯应答机制,也参与植物非生物胁迫响应。研究表明香蕉MaERF9与乙烯合成呈正相关,并且可以通过调控乙烯合成促进香蕉果实成熟[11],而猕猴桃AcERF1则与其果实成熟呈负相关[12]。RAV亚家族在植物开花、种子发育等方面起重要调控作用,研究表明拟南芥RAV1与种子发育和开花时间呈负相关,此外,过表达AtRAV1还能延缓拟南芥侧根和莲座叶的发育[13-14],而在拟南芥中过表达白菜NGA1则可以显著抑制拟南芥根、花、子叶和叶片的发育[15]。
芒果是漆树科芒果属植物[16],果香沁人心脾,果皮色泽艳丽,果形饱满,果肉细腻香甜,营养物质丰富,维生素含量高,具有较高的营养价值,被誉为“热带果王”,深受人们喜爱。世界粮农组织(FAO,2020年)统计数据显示,全球芒果种植面积约为6.543×106hm2,位居世界第五,芒果产量约为5.502×107t,仅次于柑橘、香蕉、葡萄、苹果,是热带地区主要的经济作物之一。芒果作为典型的呼吸跃变型水果,在贮藏及销售过程中会释放大量乙烯,使得果实容易腐烂,导致贮藏期短,不易保存,对芒果的商品价值造成影响,制约了芒果产业的发展。挖掘与芒果成熟衰老相关的AP2/ERF转录因子家族基因并对其功能进行解析,为研究果实采后成熟衰老的调控机制提供理论依据。因此,本研究通过PCR扩增技术,以采后贵妃芒果为试材,克隆获得1个AP2/ERF转录因子MiERF2基因,对其进行生物信息学分析和亚细胞定位研究,并对其在不同采收成熟度下乙烯利处理后的基因表达量进行检测,为进一步分析MiERF2转录因子在芒果采后成熟过程中的功能以及芒果贮藏保鲜研究提供理论依据。
1材料与方法
1.1材料
供试芒果品种为贵妃芒,采摘于海南省陵水黎族自治县英州镇万丰村景鹏万丰基地种植园。分2次采摘6成熟芒果(花后100d)和8成熟芒果(花后130d)。选取大小均匀一致、无机械损伤、无病虫害的芒果,立即运回实验室。芒果剪留0.5cm果柄,用0.1%的氯消净清洗并浸泡20min,晾干,用400μg/mL乙烯利(ETH)溶液浸泡5min,报纸包裹密封于塑料桶中24h后取出晾干。以不做任何处理的芒果为对照,随机选取10个芒果为1组,装入保鲜袋中,贮藏在(251)℃,相对湿度85%~90%的培养箱中,每3d取1次样,用液氮将所取样品速冻后保存在‒80℃超低温冰箱备用。
1.2方法
1.2.1RNA提取与MiERF2基因全长克隆以芒果果肉为材料,提取RNA并逆转录成cDNA,果肉RNA提取采用改良的CTAB法[17],cDNA的合成使用逆转录试剂盒(MonScriptTMRTIIIAll-in-OneMixWithdsDNase)。利用DNAMAN6.0软件设计MiERF2的特异性引物(MiERF2-F:5‒ATGCAGAAGTCCTCCAAGCG-3,MiERF2-R:5‒TTAAGAACTATGACAATTTCCAGTTG-3)。参照TOYOBO高保真酶说明书,利用PCR扩增得到MiERF2的ORF序列,扩增产物用1%琼脂糖凝胶电泳检测,并用胶回收试剂盒(中科瑞泰琼脂糖凝胶DNA回收试剂盒)回收目标条带,得到纯化产物。纯化产物连接pMD19-T载体(TaKaRapMD19-TVectorCloningKit)并转化大肠杆菌感受态(吐露港,E.coliDH5α),挑选阳性菌落送中美泰和生物技术(北京)有限公司测序。
1.2.2MiERF2生物信息学分析利用ExPASyProtParam、NetPhos3.1Server、SignalP-4.1、TMHMMServerv.2.0等软件分析蛋白理化性质、磷酸化位点、信号肽及跨膜结构;利用SMART、SOPMA、SWISS-MODEL软件分析MiERF2蛋白的结构;利用DNAMAN6.0软件进行多序列比对;利用MEME5.5.0分析motif结构,motif数设为10;利用MEGA11.0.8软件采用邻接法构建系统进化树。
1.2.3亚细胞定位采用洋葱内表皮转化法进行亚细胞定位分析[18],略有修改。采用双酶切法构建到PCAMBIA1302-GFP(35S::GFP)载体上,生成35S::MiERF2-GFP融合表达载体,酶切位点选用NcoI和BglII,将重组质粒转化GV3101农杆菌制备OD600为0.8~1.0的悬浮液,将洋葱内表皮(1.5cm1.5cm)浸泡在悬浮液中减压10min,用滤纸吸去洋葱内表皮上多余的菌液,将其转移到铺有滤纸的MS固体培养基上,放置在25℃培养箱中避光培养2d后制成玻片,在荧光生物摄像显微镜下观察荧光信号。
1.2.4MiERF2的表达分析利用DNAMAN6.0软件设计定量引物(qMiERF2-F:5-CGCAACAACATTAACGAGTCA-3,qMiERF2-R:5-CCACTTTCCCTCCCAAATTCA-3),内参基因为Actin(Actin-F:5-ATCTGCTGGAAGGTGCTGAG-3,Actin-R:5-CCAAGCAGCATGAAGATCAA-3),使用试剂盒(MonAmpTMChemoHSqPCRMix)进行RT-qPCR扩增,利用2‒ΔΔCT法计算基因的相对表达量。
1.3数据处理
使用WPSOffice2022软件进行数据统计与计算,使用SPSS26软件进行差异显著性分析,使用GraphPadPrism8进行相对表达量作图。
2结果与分析
2.1MiERF2基因的克隆及其蛋白的理化性质分析
克隆得到1个开放阅读框(ORF)长度为915bp的基因,该基因编码305个氨基酸,命名为MiERF2。对MiERF2蛋白理化性质进行预测,结果显示,MiERF2蛋白分子式为C1449H2259N433O470S11,分子量为33618.16Da,总原子数为4622,理论等电点为7.66。由氨基酸组成可以得知,带负电残基数量(Asp+Glu)为29个,带正电残基数量(Arg+Lys)为30个,脂肪族氨基酸指数为52.66;亲水性总平均值(GRAVY)为‒0.796,为亲水蛋白;不稳定性指数为47.13,为不稳定蛋白。
2.2MiERF2蛋白结构分析
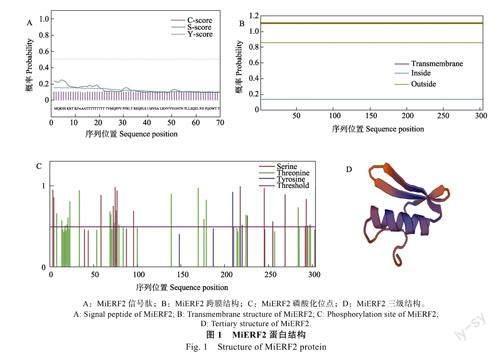
预测结果显示,MiERF2蛋白中不存在信号肽(图1A),也并未发现跨膜区域(图1B)。MiERF2蛋白的磷酸化可能发生在丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)位点上(图1C),主要为苏氨酸位点,说明此蛋白发挥调控功能可能是以苏氨酸位点的磷酸化修饰为主。MiERF2包含1个AP2保守结构域,属于AP2/ERF家族转录因子,其二级结构以无规则卷曲为主,占比为66.12%,α-螺旋占比为24.67%,延长链占比为7.89%,β-折叠占比为1.32%。蛋白的三级结构模型中包含有3个β折叠和1个α-螺旋(图1D),此为AP2结构域的典型三维结构。
2.3MiERF2蛋白motif分析及同源序列比对
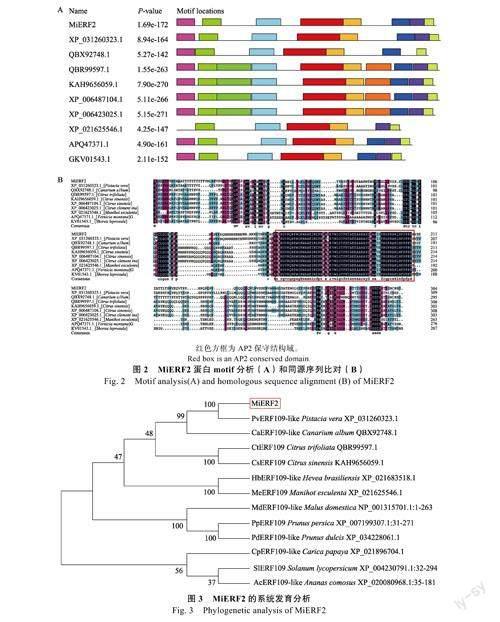
选取9个与MiERF2同源性较高的ERF转录因子进行motif分析,结果显示,所有motif结构相似,有4种motif在所有蛋白中都含有,与MiERF2所含的motif数目和种类一致的有3种,分别为阿月浑子、木油桐、皴皮婆罗双(图2A)。氨基酸同源序列比对结果显示,其氨基酸序列中仅含有1个AP2保守结构域,且在该结构域中的第14位和第19位氨基酸为丙氨酸(A)和天冬氨酸(D)(图2B)。上述结果表明MiERF2蛋白属于ERF亚家族成员。
2.4MiERF2蛋白质的系统进化分析
选取漆树科植物、模式植物、热带植物等不同物种ERF基因构建进化树,结果显示,芒果MiERF2与同为漆树科的阿月浑子ERF109-like聚在一起,亲缘关系最近,其次是橄榄、枳和甜橙,而热带植物番木瓜、菠萝以及模式植物番茄则与芒果MiERF2亲缘关系较远(图3)。
2.5亚细胞定位结果分析
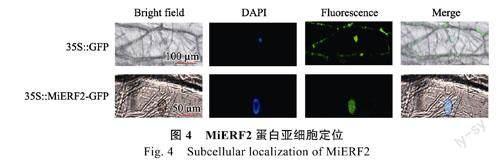
35S::GFP对照洋葱内表皮细胞中的细胞核和细胞壁均检测到了绿色荧光信号,而35S::MiERF2-GFP融合蛋白的绿色荧光信号仅出现在细胞核中(图4),这表明芒果MiERF2蛋白在洋葱内表皮细胞中定位于细胞核,符合转录因子所具有的核定位特征。
2.6MiERF2基因的表达特征分析
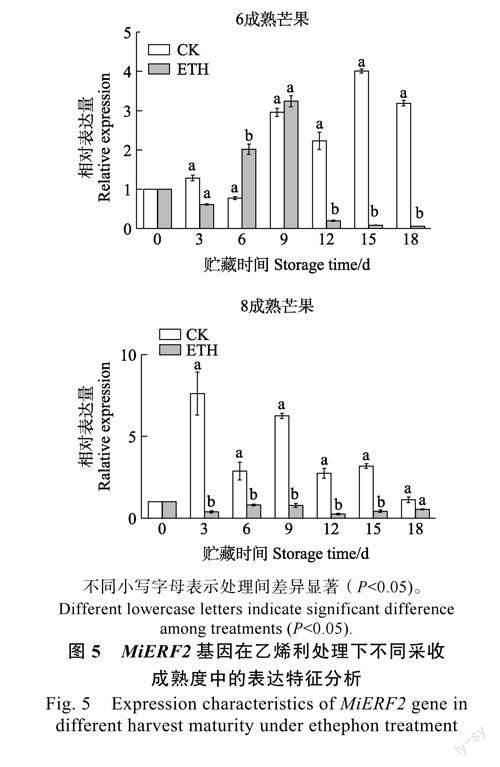
在乙烯利处理下不同采收成熟度中的MiERF2基因表达结果显示,在6成熟芒果中MiERF2基因的表达量总体呈现先上调后下调的趋势,对照组在15d达到最大值,而ETH处理组在9d时达到最大值后迅速下降,且处理组中MiERF2基因的表达量只在6d时显著高于对照组,在12d后均显著低于对照组;在8成熟芒果中对照组MiERF2基因的表达量呈现先上调后下调的趋势,而ETH处理组呈波动趋势,对照组在3d达到最大值,处理组则不明显,相较于对照组,除18d外,处理组MiERF2基因的表达水平在整个贮藏期中始终显著低于对照组(图5)。MiERF2基因在不同成熟度中表达模式不同,在对照和处理中存在显著差异,表明MiERF2基因可能在芒果采后成熟衰老过程中发挥负调控作用。
3讨论
新的研究发现蓝藻、线虫和病毒中也存在着AP2结构域[19],但AP2/ERF转录因子在植物中的研究最为广泛。AP2/ERF转录因子能够识别和结合多种不同的顺式作用元件,从而发挥调控作用。ZHAO等[20]研究发现了1个水稻ERF3基因,OsERF3基因能够促进水稻根冠的形成;腾飞[21]研究发现影响拟南芥合子胚发育的OsERF055基因能导致胚胎发育滞后,从而无法形成正常的合子胚。AP2/ERF转录因子还能加速叶片衰老[22]、加速果实褪绿[23]、防止果实提前软化[24]以及果实木质化[25]等。目前已经在许多物种中鉴定到AP2/ERF转录因子,如在苹果中鉴定了259个ERFs[26];桃中鉴定了131个ERFs[27];柑橘中鉴定了126个[28]。ERF亚家族是AP2/ERF超家族中最大的一个家族,在乙烯信号转导的最后一步作为反式作用因子发挥着重要调控作用,它可以结合启动子中多种顺式元件,如DRE/CRT、GCC-box、ERE和ATCTA元件[29-31]。易萍等[32]在台农1号芒果中鉴定了1个MiERF113基因,该基因属于ERF亚家族成员,其蛋白不存在信号肽和跨膜结构,与阿月浑子亲缘关系最近,该研究与本研究结果相似。本研究鉴定的MiERF2基因也属于ERF亚家族,蛋白具有亲水性,性质不稳定,不存在信号肽,也没有跨膜结构;MiERF2蛋白的二级和三级结构预测其包含α-螺旋、β-折叠、延长链及无规则卷曲,以无规则卷曲为主,并且具有AP2结构域的典型三维结构,系统进化分析发现其与同为漆树科的阿月浑子ERF109-like亲缘关系最近。
果实采收成熟度是影响果实品质的主要因素之一,采收偏早,易造成果实品质和风味欠佳;采收偏晚,易使果实硬度下降,运输效果和耐贮性变差。高豪杰等[33]研究结果显示1-MCP处理同一品种芒果后,相比采收成熟度低的果实,采收成熟度高的果实病情指数高、色度值高、果实硬度低,不耐贮藏。生产上往往采用乙烯利进行催熟,乙烯利处理会促进果实成熟,加速果实变软,使果实硬度降低,如甜瓜[34]等,因此本研究选取了6成熟和8成熟2种采收成熟度芒果,分别用乙烯利进行处理,以研究MiERF2基因的表达模式。而陈明敏等[35]检测了6个芒果ERF转录因子在不同浓度乙烯利处理下的表达情况,发现处理后有5个基因表达量高于对照,1个基因表达量低于对照;陈永萍等[36]通过番木瓜转录组分析发现,差异表达的ERF家族成员基因中,乙烯利处理后有5个ERF转录因子表达量高于对照,2个ERF转录因子的表达量低于对照,与本研究结果相似。本研究鉴定的MiERF2基因定量结果表明,在不同成熟度中表达模式并不相同,且MiERF2的表达量在乙烯利处理后与对照相比差异显著。在6成熟芒果贮藏后期,对照组MiERF2基因表达量显著高于处理组,在8成熟芒果采后贮藏过程中,对照组MiERF2的表达量相对较高,处理组MiERF2的表达量则一直处于較低水平。上述结果表明MiERF2可能在芒果成熟过程中发挥着负调控作用,而关于MiERF2基因后续的功能验证还有待更深入的研究。
