广西金花茶根系丛枝菌根真菌染色方法探讨
2024-02-21许诗萍高日芳张金莲宋娟李冬萍何苑皞曾诗媛陈廷速
许诗萍 高日芳 张金莲 宋娟 李冬萍 何苑皞 曾诗媛 陈廷速

关键词:金花茶;根系;丛枝菌根真菌;染色
金花茶(Camellianitidissima)属于山茶科山茶属植物,是国家一级保护植物和世界珍稀观赏植物[1-2],素有“植物界大熊猫”“茶族皇后”的美称,具有较高的观赏性以及极大的市场开发潜力[3]。金花茶植物含有黄酮类、多糖、茶多酚等多种活性成分[4-6]以及丰富的天然微量元素[7],具有降血脂、降血糖、抗氧化、抗肿瘤等多种功效[8-11]。金花茶自然分布区域窄,采种困难,近年来人们过度开发,导致其野生资源减少[12-13],寻找高效的人工种植方法,快速繁殖金花茶优良种苗[14-16],以期大幅度提高规模化种植金花茶的产量,精深开发金花茶新一代医药保健产品[17-18],造福人类的健康极具重要的科研价值。
丛枝菌根(arbuscularmycorrhiza,AM)真菌广泛分布于土壤中,是一类专性活体营养共生菌[19]。许多研究表明,AM真菌不仅能促进宿主植物对水分和土壤矿质元素(尤其是磷、锌、铜等)的吸收和利用,还能增强宿主植物对贫瘠、干旱、病虫害等不良环境的抵抗能力,以及改善土壤的理化性状,促进植物生长,提高植物品质和产量[20-21]。探究AM真菌与金花茶根系所形成的互惠共生体,有助于金花茶菌根种苗的应用,可以为提高金花茶存活率、解决其生长慢产量低的问题提供思路。目前,国内外有关AM真菌在金花茶上的侵染状况尚无报道,但同属于山茶科山茶属的茶树根际均有AM真菌定殖,能形成典型的AM真菌结构[22],AM真菌能增强茶树的耐盐性[23]、抗旱性[24]、抗重金属胁迫能力[25]。
丛枝菌根真菌通常从植物的幼嫩根系进行侵染,多数情况下是从根系成熟区的根毛、根表皮短细胞或细胞间隙侵入,形成丛枝、泡囊、根内菌丝等典型的菌根结构。部分根内菌丝顶端膨大形成圆形、椭圆形泡囊或菌丝二分叉式生长形成丛枝结构,有些根内菌丝在细胞内形成螺旋状菌丝圈。根内菌丝、泡囊可存在于细胞中,也可存在于细胞间隙,而丛枝只存在于细胞中,后期处于消解状态,呈海绵状,泡囊壁薄,内含不同形态的油滴等内含物[26-28]。通常认为深色有隔菌丝和微菌核是深色有隔内生真菌(darkseptateendophytes,DSE)在植物根内的2种典型特征结构。深色有隔菌丝分布于根的表皮、皮层的胞间和胞内,颜色深浅不一,常见深棕色至浅棕色,随着菌丝的延伸,颜色可能逐渐变浅。菌丝壁较厚,具明显的横隔,菌丝直或曲,常伴有树枝状随意隆起的分枝。微菌核由细胞壁加厚的膨大的细胞紧密堆积形成,形状大小不一,颜色多为深棕色,同一微菌核团块的颜色也有深浅变化。分布于根的表皮、皮层细胞中或细胞间隙,有时可见与其相连的菌丝[29]。
由于几乎所有的AM真菌接种试验均涉及菌根发育状况观察与侵染率测定,因此人们十分重视其观察与测定方法研究,相继建立了台酚蓝染色法和酸性品红染色法来观察植物根系AM真菌的侵染状况。如PHILLIPS等[30]和KORMANIK等[31]分别利用台酚蓝和酸性品红染色法观察根系AM真菌,但AM真菌结构和周围的根皮层组织均染上了相近的颜色,使二者颜色反差不大,不利于观察拍照。吴强盛等[32]利用台酚蓝染柑橘的根样可以清楚地看到AM真菌的各个结构,但是未能拍到柑橘根清晰的丛枝结构。VIERHEILIG等[33]将醋酸墨水染色法应用于根系AM真菌染色,并指出台酚蓝和酸性品红均为致癌疑似物。唐燕等[34]用苯胺蓝染色液对腋花杜鹃的根系进行染色,能清楚地观察到AM真菌和内生真菌的侵入,并能观察到AM真菌菌丝、泡囊和深色有隔内生真菌菌丝。不同种、属的植物根系结构存在差异,因此前人的染色方法并不一定适用于金花茶。
本研究以广西防城港市原生金花茶科技有限公司金花茶资源圃的金花茶(品种名为防普金花茶)根系为样品,比较和评价苏丹红Ⅳ、酸性品红、苯胺蓝、台酚蓝、醋酸墨水5种常用染色剂对其AM真菌的染色效果,以建立安全、可靠、理想的染色方法,为金花茶根系的AM真菌研究提供支持。
1材料与方法
1.1材料
选取种植多年的金花茶健康植株根系。于2021年7月29日采自广西防城港市原生金花茶科技有限公司金花茶资源圃种植基地,清水冲洗干净后置于50%乙醇溶液,室温保存。
1.2方法
1.2.1染色剂配制染色剂各成分比例参考李冬萍等[35]的方法。(1)苏丹红Ⅳ:0.1g苏丹红Ⅳ+10mL95%乙醇+10mL甘油;(2)酸性品紅:0.05g酸性品红+100mL乳酸-甘油-蒸馏水(1∶1∶1)混剂;(3)苯胺蓝:0.1g苯胺蓝+100mL95%乙醇;(4)台酚蓝:0.05g台酚蓝+100mL乳酸-甘油-蒸馏水(1∶1∶1)混剂;(5)醋酸墨水:95mL5%冰乙酸+5mLQuink牌纯黑墨水(上海派克笔有限公司)。
1.2.2根系菌根染色参考文献[19]的方法,对以上5种染色剂进行根系菌根染色试验,略作改进。取保存于50%乙醇溶液的根系,清水冲洗干净并将水分控干。(1)透明:将金花茶的3~4级根(直径1~2mm)剪成约1cm长,加入20%KOH溶液完全浸泡根系,于90℃水浴120min,清水冲洗3次并控干水分。(2)脱色:加入碱性H2O2(30mL10%H2O2+3mL氨水+567mL蒸馏水)室温脱色60min,用清水冲洗3次并控干水分。(3)酸化:加入5%冰乙酸,室温酸化5min,清水冲洗3次并控干水分。(4)染色:用5种染色剂分别进行染色处理,66℃水浴染色60min,并用清水漂洗数次。(5)褪色:用4℃清水浸泡12h以上,备用,因酸性品红染色后极易褪色,故该染色组免去褪色步骤,需及时制片观察。
1.2.3制片与显微观察将脱色处理后的根段置于载玻片上,用尖嘴镊子挑出金花茶根的坚硬组织,剩余组织平展在载玻片上,盖上盖玻片,然后用镊子轻轻敲压使平展均匀。每个处理制片3张,3次重复。使用尼康EclipseCi-L和DS-Ri2观察、拍照。
2结果与分析
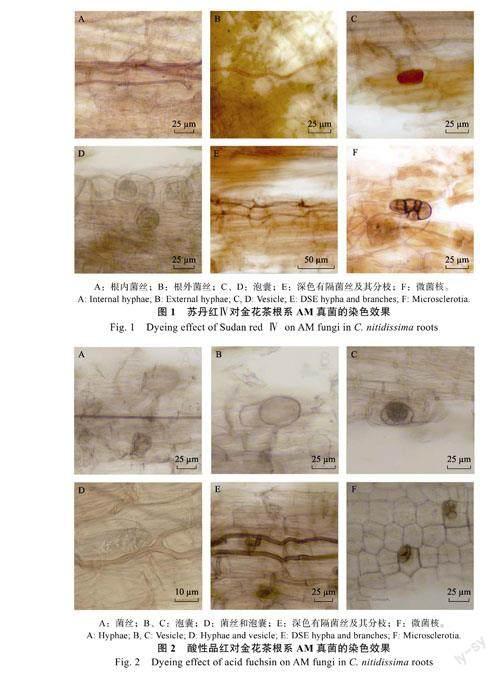
2.1苏丹红Ⅳ染色
用苏丹红Ⅳ染色时,根内和根外的AM真菌菌丝着色均不明显(图1A,图1B);部分泡囊主体被染成橘黄色,观察不到内含物(图1C);另一部分泡囊着色不明显,但能观察到内含物(图1D);DSE的菌丝和微菌核着色不明显(图1E),可观察到微菌核的油滴状内含物(图1F)。
2.2酸性品红染色
酸性品红将AM真菌菌丝和部分泡囊及二者的连接处染成肉粉色,与背景反差不明显,泡囊可观察到内含物(图2A~图2D)。DSE的菌丝和微菌核与背景反差明显(图2E,图2F)。
2.3苯胺蓝染色
用苯胺蓝染色时,AM真菌菌丝和泡囊呈蓝色,边缘清晰,观察不到泡囊内含物(图3A~图3C)。丛枝呈浅蓝色的海绵状,边缘模糊,但根皮层也被染上了相同或略浅的颜色(图3D,图3E)。深色有隔内生真菌的菌丝与背景反差明显,易观察(图3A)。还分辨出一种未知真菌结构(图3F)。
2.4台酚蓝染色
用台酚蓝染色后,根皮层细胞为浅蓝色,AM真菌菌丝和泡囊呈略深的蓝色,可观察到泡囊内含物(图4A~图4C)。能轻易分辨不同形态的丛枝(图4D,图4E)。细胞内的菌丝圈清晰可见(图4F,图4G)。DSE的菌丝和微菌核染色效果不明显(图4H,图4I)。
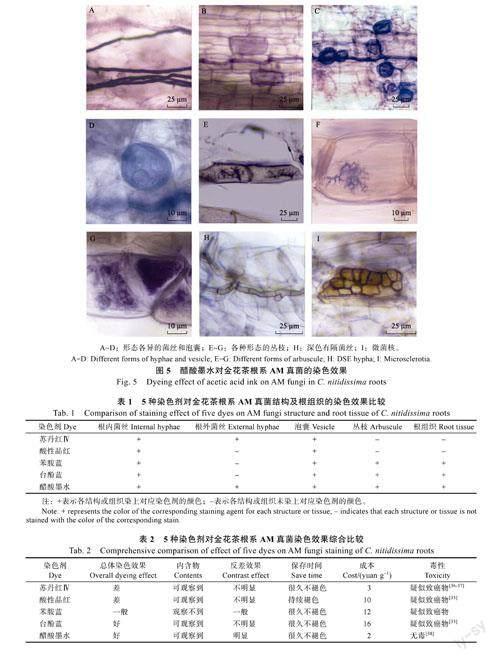
2.5醋酸墨水染色
经醋酸墨水染色的AM真菌结构均清晰可见,AM真菌根内和根外菌丝均呈紫色,走向明显(图5A,图5B)。泡囊和不同形态的丛枝均染上深浅不一的蓝紫色,均与浅色的背景反差大,易观察,泡囊可观察到内含物(图5B~图5G)。DSE的菌丝和微菌核清晰(图5H,图5I)。以上各种典型结构在低倍镜下均能清晰地观察到。
2.65种不同染色剂的染色效果比较
比较5种染色剂分别对金花茶根系AM真菌结构及根组织的染色效果,结果显示,每种染色剂均使根内菌丝和泡囊染色,丛枝的染色情况与根组织很接近,酸性品红染色的结构数量最少,醋酸墨水能使金花茶根系AM真菌的所有典型结构染色(表1)。
观察5种染色剂对金花茶根系AM真菌结构的染色效果,结果显示,不同染色剂对AM真菌结构染色的清晰度、反差效果、保存时间以及染色剂的成本、毒性等方面存在较大差别(表2)。
3讨论
根系菌根的染色效果直接影响菌根定殖分析的准确性,因此找到稳定可靠、染色对象与背景反差大、安全无毒的染色方法,十分必要。
在光学显微镜下,观察5种染色剂对金花茶根系AM真菌结构的染色效果,结果表明,不同染色剂对AM真菌结构染色的清晰度、稳定性、反差效果等方面存在较大差异。当采用苏丹红Ⅳ染色时,泡囊外轮廓模糊,很难观察到完整的泡囊结构,也不易观察到泡囊和AM真菌菌丝的相对位置,染色不均;AM真菌菌丝染色清晰度不高,不易辨别其形态;未观察到丛枝结构。而在枳砧纽荷尔脐橙[39]根系AM真菌染色中,可观察到丛枝在细胞内呈淡粉色,其原因可能是取样的根系无丛枝结构或者丛枝染色非常浅,难以鉴别。酸性品红染色后,泡囊和AM真菌菌丝着色浅,在脱色阶段,皮层组织与AM真菌结构同步脱色且速度极快,若不能及时观察,需放回酸性品红染液中常温复染,复染时间在10h以上效果较好,操作繁琐。汪茜等[40]和覃晓娟等[41]采用酸性品红分别观察生姜根系和香蕉根系,也出现同样的现象。而高秀兵等[22]采用酸性品红观察茶树根系,可清楚地观察到菌丝、泡囊、丛枝等AM真菌结构,推测是染色剂的具体使用步骤或对不同科、属植物的着色效果不同而导致观察结果有差异。用苯胺蓝染色时,AM真菌结构的颜色与根内的皮层细胞相近且略深,与背景反差小,看不到泡囊内含物,但唐燕等[34]可以清楚地观察到腋花杜鹃的泡囊内含物,其原因可能是苯胺蓝未能使金花茶根系的泡囊内含物染色,或者取样根系的泡囊处于内含物不明显的生理阶段。用台酚蓝染色,可辨别AM真菌的菌丝形态。在66℃水浴加热1h的条件下,染色效果很强,根段整体呈现灰蓝色,细胞壁颜色更深,只能观察到染成深蓝色的AM真菌菌丝和深褐色的DSE菌丝;将染色操作换成66℃水浴加热15min后,清水浸泡下根皮层细胞褪色效果较好,能分辨不同形态的丛枝,但染色清晰度不高,这与香蕉根系AM真菌染色方法[41]的报道一致,猜测是根系皮层组织与AM真菌结构同步褪色的缘故,说明台酚蓝对AM真菌结构的染色无特异性。采用醋酸墨水染色时,金花茶根系经清水浸泡12h后,大部分的皮层细胞已褪至浅紫色,而AM真菌各结构仍然保持鲜亮的蓝紫色。清水浸泡36h后,皮层细胞接近完全脱色,丛枝等典型的AM真菌结构边缘清晰,能轻易分辨海绵状和二分叉式的丛枝,染色效果稳定不褪色。
从5种染色剂的染色效果来看,每种染色剂均能使根内菌丝和泡囊染色,说明这2个结构比较常见,也较容易染上色,具体的染色机理需要进一步探讨。苏丹红Ⅳ和酸性品红均未能使丛枝和根组织染上明显的颜色,结合这2种染色剂对其他结构的染色情况,可以初步得出这2种染色剂均不是理想的染色剂的结论。醋酸墨水能使金花茶根系AM真菌的所有典型结构染色,也能使根组织染上颜色,表明醋酸墨水的染色能力强。在染色能力方面,苯胺蓝和台酚蓝并不比醋酸墨水逊色,但是醋酸墨水对根组织的染色在清水中就能迅速褪色,并且可以使AM真菌结构染上的颜色保持鲜亮,在浅色的背景上很容易进行进一步观察。
5种染色剂均能分辨出AM真菌與DSE的主要原因:一是本次样品中DSE侵染的范围广,未出现取样的根系无特征结构的情况;二是作为背景的根组织,在染色的透明和脱色步骤成功脱去本色,而DSE的2种典型结构(即深色有隔菌丝和微菌核)颜色深,未受到20%KOH溶液和碱性H2O2溶液的明显影响,后期也不易被染色,与背景反差明显;三是DSE的菌丝具明显的横隔特征。有文献报道,在显微镜下观察经苏丹红Ⅳ染色的DSE,能看到DSE透明菌丝中的油滴体[29]。本研究中能观察到浅色微菌核的油滴体,在DSE菌丝里却未观察到。其原因可能是DSE菌丝颜色太深,掩盖了油滴体的颜色,或者油滴体只出现在DSE结构的特定阶段,而能在微菌核里看到油滴体,可能原因是DSE的菌丝和微菌核成分相近,结构相似,文献报道有时可见与微菌核相连的菌丝[29]也可印证这个猜测。DSE菌丝分布于根的表皮、皮层的胞间和胞内[29],而本研究中的DSE菌丝在视觉上相对完整紧凑地出现在根组织的上方,且沿根的纵轴方向延伸,形成菌丝网络,可能原因是在制片时过于用力,压碎了根组织,影响了后续的观察和拍照,同时能判断出此根段中的DSE菌丝均为胞间菌丝。在苯胺蓝染色时,还分辨出第三种真菌的未知真菌结构,疑似链格孢属(Alternaria)真菌的分生孢子[42],因该种真菌侵染程度不深,未留下更多可供观察和分析判断的结构。
此外,Quink牌墨水由淡黄色的喹啉黄(CI47005,CIFoodyellow13)、橙色的日落黄(CI15985,CIFoodyellow3)和蓝色的阴丹士林蓝(CI69800,CIFoodBlue4,又名蓝蒽酮)3种染料组成,安全无毒[38]。从保存时间、成本、毒性、操作复杂程度等方面考虑,醋酸墨水染色法均更优于其他4种染色方法,因此醋酸墨水较其他几种染色剂更适用于金花茶根系AM真菌的染色观察。
