我国斯里兰卡木薯花叶病毒的分子特征及致病性分析
2024-02-21王国芬李超萍时涛吴会杰蔡吉苗李博勋陆翠梅黄贵
王国芬 李超萍 时涛 吴会杰 蔡吉苗 李博勋 陆翠梅 黄贵




关键词:斯里兰卡木薯花叶病毒;分子特征;侵染性克隆;致病性
木薯是热带地区薯芋类作物,为世界第六大粮食作物,是世界热区10余亿人口的主要粮食。全球有100多个国家种植木薯,2021年木薯总收获面积超过3000万hm2,总产量达3.06亿t[1];我国木薯种植主要集中在广西、广东、云南、海南、福建和江西等华南及西南地区,以生产淀粉、变性淀粉和乙醇等为主。但我国的木薯原料生产仍然供不应求,每年向东南亚进口的木薯淀粉及木薯干片占世界木薯贸易量的70%以上[2]。
由双生病毒引起的木薯花叶病毒病(cassavamosaicdisease,CMD)是世界木薯种植业中危害最严重的病害之一,病原属双生病毒科(Geminiviridae)菜豆金黄色花叶病毒属(Begomovirus)木薯花叶双生病毒(Cassavamosaicgeminiviruses,CMGs),共有9个种多个重组变种[3]。双生病毒的基因组结构为环状单链DNA(ssDNA),根据其数量分为单组份和双组份病毒。单组份双生病毒只包含1条长度为2.6~2.8kb的环状ssDNA,双组份则包含2条长度为2.5~2.8kb的环状ssDNA,即DNA-A和DNA-B,木薯花叶双生病毒CMGs大部分都是双组份病毒[4]。双组份双生病毒的基因组结构包括编码区和非编码区,DNA-A编码外壳蛋白(coatprotein,CP)、运动蛋白(movementprotein,MP)、复制相关蛋白(replication-associatedprotein,Rep)、转录激活子(transcriptionalactivator,TrAP)、复制增强子(replicationenhancer,REn),以及C4蛋白;DNA-B编码核穿梭蛋白(nuclearshuttlingprotein,NSP)和MP。双组份双生病毒以DNA-A中是否含有AV2编码的运动蛋白(movementprotein,MP)区分“旧世界”和“新世界”病毒[5]。
木薯花叶双生病毒(CMGs)最早在非洲中西部发生危害,现在广泛分布于非洲大陆、马达加斯加半岛、西亚半岛、印度洋诸岛及东南亚[6],2018年,我国海南、云南、广东、广西、福建和贵州等地陆续发现木薯花叶病毒病[7-8],经检测发现由斯里兰卡木薯花叶病毒(SLCMV)引起[9]。也有报道发现由其他双生病毒,如烟草曲茎病毒(TbCSV)、中国胜红蓟黄脉病毒(AYVCNV)及其卫星分子在云南红河地区引起木薯叶片皱缩、畸形等症状[10]。WANG等[11]报道了福建分离物HN7的基因组序列,经过分析不同来源SLCMV分离物全基因组序列,发现AC1序列及其编码的氨基酸序列有部分差异。但由于国内病毒分离物较少,尚未就国内分离物和东南亚分离物在基因结构及其致病性差异做深入分析。本研究对来自海南、贵州的SLCMV分离物进行全基因组测序,并通过侵染性克隆的构建,比较SLCMV不同致病力分离物对普通烟草的致病能力差异,为进一步分析不同来源的SLCMV分离物之间的序列结构特征及其致病性提供研究基础。
1材料与方法
1.1材料
1.1.1供试样品2020—2021年,分别在海南海口、儋州和贵州兴义的木薯种植基地采集具有皱缩、褪绿等表现疑似感染木薯花叶病毒病的木薯叶片样品136个,无症状健康叶片样品10个,经检测鉴定阳性样品序列高度相似,因此分别从海口地区的样品中选取3个、儋州和贵州兴义各选取1个代表性样品进行全基因组序列及结构分析。
1.1.2载体及植物材料载体pCAMBIA1300(p1300),具有kan和Rif抗性,由中国农业科学院郑州果树研究所吴会杰副研究员馈赠。pGEM-TEasy载体购自北京全式金生物技术有限公司。野生型普通烟(N.tabacum)种子由中国热带农业科学院环境与植物保护研究所提供,于白天气温28℃,夜间23℃,相对湿度75%和光周期L∶D=14h∶10h的人工气候室中种植,生长2~4周后进行接种试验。
1.1.3试剂农杆菌感受态细胞GV3101,上海唯地科技有限公司;TaqDNA及LA聚合酶、AlkalinePhosphatase去磷酸化酶、HindⅢ、PstⅠ和BamHⅠ等内切酶,寶日医生物技术(北京)有限公司;DNA凝胶回收试剂盒,生工生物工程(上海)股份有限公司;dNTPs、DNALadderMaker,天根生化科技(北京)有限公司;T4DNA连接酶,南京诺唯赞生物科技有限公司;其他试剂均为国产分析纯。引物及参考序列SLCMV-Colombo的DNA-A(AJ314737)及DNA-B(AJ314738)全基因序列合成由华大基因股份有限公司完成。
1.2方法
1.2.1引物设计及合成通过特异性引物SL12/13扩增样品目标序列,目标序列测序后,设计背靠背测序引物对SLCMV全基因进行扩增、测序,并进一步设计SLCMV的侵染性克隆所需引物(表1)。
1.2.2病毒的检测、克隆及全基因组测序采用改良CTAB一步法提取病样基因组DNA[9]。分别对SLCMVDNA-A/B进行扩增,将获得的序列进行测序,拼接后获得SLCMVDNA-A/B的基因组全长序列,应用Lasergene-MegAlign、Lasergene-EditSeq和MEGA7.0软件对基因组分子特征和序列及氨基酸相似性进行分析。
1.2.3构建SLCMV侵染性克隆质粒以编号为SLCMV-DG1922分离物DNA为模板,分别用0.6A-HindⅢ-F/A-PstI-R和0.6B-HindⅢ-F/B-BamHI-R扩增DG1922DNA-0.6A/0.6B目的片段,用相应的HindⅢ、PstⅠ和BamHⅠ双酶切后分别与pCAMBIA1300(p1300)载体连接,转化E.coil;阳性转化子用相应的引物检测,并提取质粒酶切验证;分别用1A-PstⅠ-F/A-PstⅠ-R1和B-BamHⅠ-F/B-BamHⅠ-R扩增DG1922DNA-A/B目的片段,与经过酶切及磷酸化处理后的DG1922-0.6A/0.6B连接,转化E.coil,检测DG1922-1.6A/1.6B阳性克隆,提取质粒进行酶切验证。分别获得SLCMV-DG1922pCAMBIA1300-1.6A(DG1922-A)及SLCMV-DG1922pCAMBIA1300-1.6B(DG1922-B)的侵染性克隆质粒。为比较不同分离物的致病性,同步进行SLCMV-ColombopCAMBIA1300-1.6A(Col-A)和SLCMV-ColombopCAMBIA1300-1.6B(Col-B)的构建试验。
1.2.4SLCMV侵染性克隆致病力評价将经双酶切和测序筛选确认的侵染性克隆DG1922-A/B和Col-A/B阳性质粒,通过冻融法(冰浴5min,液氮5min,37℃水浴5min,4℃冰水浴5min)分别转入100μLGV3101(pSoup)农杆菌感受态细胞中,菌落PCR筛选验证阳性转化子。然后接种于含有卡那霉素(100μg/mL)和利福平(25μg/mL)的LB培养基内,28℃摇床过夜培养,4000r/min离心10min收集沉淀,弃上清,沉淀用农杆菌悬浮缓冲液(10mmol/LMES、10mmol/LMgCl2、150μmol/LAs)重悬,利用紫外分光光度计将菌液OD600调至1.0。28℃培养箱静置4h,用浸润法接种5~6叶期的普通烟(N.tabacum),接种量为200μL/叶,每株接种3片叶。定期观察记录烟草症状的变化,以接种不带质粒的空载宿主缓冲液及清水处理为对照。每处理接种植株6株,试验重复3次。参照1.2.2方法,提取各处理的病毒DNA,并进行分子检测。
2结果与分析
2.1样品采集及检测
2020—2021年,在海南海口、儋州和贵州兴义的木薯种植基地调查发现,部分木薯种质叶片呈现明显的花叶斑驳、叶片卷曲等疑似感染SLCMV症状。共采集有症状叶片样品136个,无症状样品10个,经核酸抽提PCR检测后,结果显示部分有症状的样品可检测到大小为1kb左右的特异性条带。无症状样品则无目的条带(图1)。
2.2我国SLCMV基因组序列相似性分析
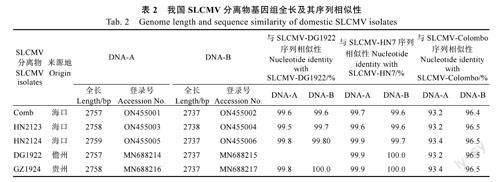
将检测阳性样品分离物编号,并用自行设计的环状DNA背靠背测序引物进行PCR扩增,对扩增产物进行测序、拼接,获得DNA-A和DNA-B双链全基因组序列并上传GenBank获得序列登录号(表2)。序列相似性比对结果表明5个代表性分离物之间DNA-A序列的相似性为99.5%~99.8%,DNA-B序列的相似性性为99.6%~100%;WANG等[11]报道的SLCMV-HN7福建分离物DNA-A和DNA-B的序列相似性为99.6%~99.9%和99.6%~100%;斯里兰卡早期报道[12]的SLCMVColombo分离物之间的相似性较低,仅为93.2%~93.4%和96.4%~96.5%。
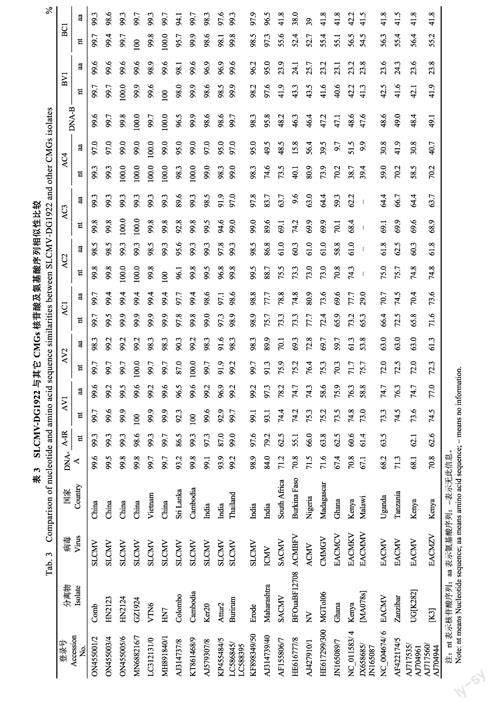
以SLCMV-DG1922分离物为代表,与不同地区SLCMV分离物及其他10个木薯双生花叶病毒进行基因和氨基酸序列比对,分析其序列相似性。结果表明,DG1922双组份的DNA序列与柬埔寨、泰国和越南的SLCMV分离物在全基因组、非编码区及各基因编码区序列的相似性在97.0%~100.0%之间,与印度和斯里兰卡早期的SLCMV分离物的相似性较低为86.5%~98.6%;SLCMVDG1922的DNA-B组份与印度木薯花叶病毒株系(ICMV)的编码区序列相似性较高,为95.0%~97.6%。除了ICMV,DG1922的两个组份与其他9个非洲木薯花叶病毒序列之间的相似性均低于80.0%(表3)。
2.3我国SLCMV基因组结构特征
基因组结构分析结果显示,我国的几个SLCMV分离物都属于典型的“旧世界”双组份菜豆花叶病毒(Oldworldbipartitebegomoviruses),具有双组份单链DNA(ssDNA)。DNA-A组份全长2757~2758bp,DNA-B组份全长2737~2738bp。共编码8个开放阅读框(ORFs),病毒DNA-A正义链AV1编码外壳蛋白(CP),AV2编码运动蛋白(MP),互补链AC1编码复制相关蛋白(Rep)、AC2编码转录激活子(TrAP)、AC3编码复制增强子(REn)和AC4蛋白;DNA-B正义链BV1编码核穿梭蛋白(NSP)、互补链BC1编码运动蛋白(MP)。双组份的DNA-A和DNA-B的LIR中存在一段约200bp的保守序列,为基因间隔区(IR)/共同序列(CR)都含有AATTGGAGACA重复序列、TATABox和TAATATT↓AC茎环结构(图2A)。序列差异显示,我国SLCMV分离物与其他SLCMV的主要结构性差异显示在基因间隔区(IR)、AV1、AV2及AC3四个区域,与SLCMV-Colombo和SLCMV-Erode的基因序列相似性低于95.0%,而DNA-B则和其他不同来源的SLCMV分离物一样与ICMV保持了较高的同源性,序列同源性均高于95.0%(表3)。
进一步分析不同来源SLCMVDNA-A上编码复制相关蛋白(Rep)的AC1基因,发现本研究的几个SLCMV分离物DG1922、GZ1924、Comb、HN2123、HN2124以及WANG等[11]报道的SLCMV-HN7,在AC1基因序列的3末端都有一致的C→T点突变,从而使其编码的氨基酸末端的提前终止(CAA→TAA),导致Rep蛋白羧基端缺失了7个氨基酸。包括SLCMV-Colombo和SLCMV-Erode在内的多个东南亚SLCMV分离物在该位点都保守地存在QGPTQGS七个氨基酸序列(图2B)。
2.4侵染性克隆在烟草上的致病性
为验证SLCMV-DG1922和SLCMV-Colombo致病性上的差异,试验对构建的侵染性克隆DG1922-A/B和Col-A/B进行烟草接种,分别对2个分离物的A/B组份进行重组和交叉重组接种,Mock为接种农杆菌悬浮缓冲液空白对照。结果如图3所示。第一,接种7d后,所有接种的烟草叶片都表现出叶片向下卷曲,接种点附近叶片组织黄化褪绿现象。第二,Col-A/B致病性强,接种17d和27d后,以Col-A为主的重组体植株症状典型,接种Col-A/B和Col-A/DG1922-B的植株新抽叶片均为叶片向下卷曲,叶背出现耳突,扭曲变形和植株矮化。第三,DG1922-A/B致病性弱,接种17d和27d后,以DG1922-A组份为主的重组体症状不典型,致病性弱,接种DG1922-A/B和DG1922-A/Col-B的植株新抽叶片无明显症状,植株生长正常。第四,感病症状越典型,植株生长越矮,强致病株系的DNA-A影响症状产生,而DNA-B则可能协同DNA-A组份影响株高,各重组体接种对株高影响大小顺序为Col-A/DG1922-B>Col-A/B>DG1922-A/Col-B>DG1922-A/B。值得一提的是,接种Col-A/B和DG1922-A/Col-B的植株,虽然症状表现为明显的典型和不典型,但是平均株高分别为21.75cm和22.98cm,差异不显著,接种DG1922-A/B对烟草的症状和株高的影响均不明显。分别取接种后的叶片进行PCR检测,结果表明,仅显示症状的2个接种植株(Col-A/B和Col-A/DG1922-B)能检测到目标病毒的DNA,对照及其他组份的接种体植株均未检测到目标病毒。
3讨论
本研究对木薯地自然发病的木薯花叶病株进行了PCR检测、病毒分离物全基因组序列测定及致病性验证。PCR检测样品存在SLCMV侵染,全基因组序列分析表明,病毒分离物Comb、HN2123、HN2124、DG1922和GZ1924都含有双组份DNA-A和DNA-B,属于典型的“旧世界”烟粉虱传双生病毒。全基因组序列与中国HN7MH891840、柬埔寨CambodiaKT861468和越南VTN6LC312131三个分离物相似性均在99.7%以上,AV2和AC2编码区氨基酸序列的相似性较低为98.3~98.5%,其余的均在99.0%以上;与斯里兰卡、印度的部分分离物编码区和氨基酸序列的相似性在87.0%以上;与印度木薯花叶病毒株系的相似性在86.5%~99.7%之间;与其他非洲木薯花叶病毒的相似性均在80.9%以下,具有较强的种系差别。聚类分析能将包括本研究的5个SLCMV与其他10个CMGs进行严格的种系分类[3,9]。
本研究中的SLCMV分离物具有DNA-A和DNA-B双组份结构特征,编码8个ORFs,包括AV2基因,属于典型的“旧世界”类病毒[4]。根据国际病毒分类委员会(ICTV,2021)最新分类,菜豆金黄色花叶病毒属(Begomovirus)作为双生病毒科(Geminivirus)最大的一个属,具有双组份和单组份的基因组结构特征,双组份的begomovirses中,具有AV2编码基因的为“旧世界”(OldWorld)类病毒,不具有AV2编码的为“新世界”(NewWorld)类病毒[4]。DNA-A链编码的6个蛋白分别为CP蛋白的AV1基因,参与病毒移动的AV2基因,互补链上编码Rep蛋白的AC1基因,编码TrAP蛋白的AC2基因,编码REn的AC3基因和参与症状及病毒系统运动的AC4基因;DNA-B链编码2个蛋白,BV1编码核穿梭蛋白(NSP),互补链的BC1编码运动蛋白(MP)[13]。
本研究较为详细地比较了我国SLCMV与其他SLCMV的主要结构性差异,而且证实了现阶段引起我国木薯斯里兰花叶病毒病的病原主要为SLCMV弱致病力株系。雙生病毒的Rep蛋白由AC1编码,是病毒在植物中复制不可缺少的蛋白质,Rep蛋白通过与宿主蛋白和其他病毒蛋白的相互作用,对病毒DNA复制的起始、延伸和终止进行调控[14]。2020年WANG等[11]比较研究了SLCMV-HN7和SLCMV-Colombo对本氏烟的致病能力,并通过序列比对AC1编码Rep基因缺失互补突变验证,推测SLCMV-HN7致病力弱是由于Rep蛋白在C末端缺失了7个氨基酸,导致其致病力降低。本研究对我国分离物Comb、HN2123、HN2124、DG1922和GZ1924的序列分析发现,所有分离物都在编码Rep蛋白的AC1基因序列的3´端存在C→T点突变,使得Rep蛋白的翻译提前终止(CAA→终止密码子TAA),导致RepC末端缺失7个氨基酸。试验进一步通过SLCMV-Colombo和SLCMV-DG1922侵染性克隆接种普通烟的症状表现,也得到了类似的结果,SLCMV-DG1922双组份接种烟草17d以后,不能使新抽叶片产生致病症状,而SLCMV-ColA/B重组体和ColA/DG1922B交叉重组体则表现出典型的叶片向下翻卷和植株矮化的现象。
中国SLCMV分离物的DNA-A组份致病力弱,但是DNA-B组份可能协同强致病力株系的DNA-A组份起到增强其致病性,并对株高产生影响。GenBank中已经公布的SLCMV与SLCMVColombo分离物在序列上均存在较大差异性,来自柬埔寨、越南和泰国的多个分离物中也存在Rep蛋白羧基端的差异,均对当地的木薯产业造成了严重影响[15]。SAUNDERS等[12]研究发现SLCMVColombo的DNA-A组份可以单独引起烟草产生症状,而且与SLCMVDNA/B和ICMVDNA/B的重组体和交叉重组体其致病率和致病力都显著高于ICMV。PATIL等[16]则在用其他的SLCMV分离物接种烟草的研究中指出,SLCMVDNA-B和ICMVDNA-B在与DNA-A重组接种烟草后,能侵染烟草产生叶片向上翻卷和叶脉增厚的症状特征,是由于接种后会产生一些缺陷DNA(defDNA),这些defDNA可影响(增强或者减弱)双生病毒对烟草的症状反应。而本研究3次重复试验都显示交叉组合的ColA/DG1922B表现出更强的致病力和植株矮化现象,表明我国分离物的DNA-B组份在ColDNA-A致病能力上可能起到了一定的增强作用,但从症状上,均为出现叶片向上蜷曲和叶脉增厚的现象,在PCR检测中也未发现defDNA。
SLCMV属于双生病毒,在田间木薯的感染经由媒介昆虫烟粉虱传播,病毒与介体和寄主之间的相互影响会导致不同分离物在寄主上的症状表现[13],WANG[11]、SAUNDERS[12]、PATIL[16]及本研究的接种都仅在烟草叶片上完成,无法通过浸润法接种木薯叶片引起花叶症状。本研究中弱致病分离物DG1922双组份DNA-A/B在接种烟草后的第7天,接种叶片是有症状的,但是在第17和27天以后,植株就恢复正常生长状态了,且随着老叶掉落,新抽出来的叶片上检测不到病毒,表明弱致病分离物在病毒转运过程中受阻,不能成功从接种点运送到其他叶片上,从而不能成功引起新抽叶片的症状。另一方面,基因和氨基酸序列比对结果显示,相比AC1(97.8%)的基因及氨基酸序列相似性,SLCMV-DG1922与SLCMVColombo还有5个基因(AC2、BC1、AC3、AV1和AV2)序列的相似性较AC1低。因此SLCMV不同致病力株系在烟草上产生的致病性差异除了Rep蛋白羧基端的缺失外,是否可能还存在其他的影响因素,如参与病毒移动的AV2、参与症状及病毒系统运动的AC4基因和编码运动蛋白(MP)等;而作为弱致病力株系的我国多个分离物,在我国存在一定的分布(福建、海南、贵州等地),加上其症状不一定非常典型,增加了其调查和监测的难度,需进一步引起足够重视。
