长链非编码RNA LINC00641在恶性肿瘤发生发展中的作用机制研究进展
2024-02-20郭梦梦明道靖任一鸣钱信行杨室淞王聪聪陆沛文张晋辉曾宪涛
郭梦梦,明道靖,任一鸣,钱信行,杨室淞,王聪聪,陆沛文,张晋辉,袁 帅,习 舒,4,曾宪涛,3,4
1.河南大学淮河医院泌尿外科(河南开封 475000)
2.武汉大学中南医院循证与转化医学中心(武汉 430071)
3.河南大学淮河医院普外科(河南开封 475000)
4.武汉大学中南医院泌尿外科(武汉 430071)
恶性肿瘤已成为人类健康的首要杀手[1]。基因突变或表达异常导致细胞获得维持增殖信号传导、逃避生长抑制因子、抵抗细胞死亡、实现复制永生、诱导血管生成以及激活侵袭和转移的能力,进而导致肿瘤发生和进展[2]。了解肿瘤发生发展的机制,探索高特异性和高敏感性的分子靶标,对于癌症的诊断和治疗具有重要作用。
1 LINC00641概述
非蛋白质编码基因约占总基因组序列的98%[3]。非编码RNA是指不具有编码蛋白质功能的RNA分子,通过作用于DNA、RNA和蛋白质发挥功能[4-5]。长链非编码RNA(long noncoding RNA, lncRNA)是一种长度大于200个核苷酸,不参与蛋白质翻译,而具有特定功能的RNA分子[6]。lncRNA可根据其在亚细胞中的定位而执行不同的功能,当其位于细胞核中时,它调节染色体结构,参与染色质重塑,并可调控转录;当其在细胞质中时,它调节mRNA的稳定性,参与转录后修饰,调节翻译,并影响翻译后修饰[7]。LINC00641是lncRNA中的一种,位于染色体14q11.2。Li等人最早在膀胱癌中报道了LINC00641的作用和机制[8]。随后,也有综述针对LINC00641在肿瘤中的作用进行总结,但近年来陆续有新的研究发现LINC00641在多种肿瘤中异常表达,调控肿瘤的进展[9]。
2 LINC00641在不同恶性肿瘤中的作用
2.1 LINC00641与呼吸系统恶性肿瘤
呼吸系统恶性肿瘤在全球范围内的发病率和致死率逐年上升,已严重危害人类身体健康,其中肺癌仍然是全球与恶性肿瘤死亡相关的重要原因[10]。LINC00641在呼吸系统肿瘤中已有研究,目前主要在肺癌和鼻咽癌中有所报道。
肺癌根据病理学分类可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC是最普遍的肺癌类型。研究发现GAS5和MALAT-1等作为生物标志物比传统的肿瘤标志物癌胚抗原(CEA)在检测早期NSCLC方面更具优势[11]。因此,lncRNA有望成为新的用于肺癌诊断的生物标志物。Dong等[12]分析了癌症基因组图谱(TCGA)数据库中509个肺腺癌(LUAD)、473个肺鳞状细胞癌组织和49个邻近非癌性肺组织中mRNA、lncRNA和microRNA的表达谱,研究发现了差异最显著的lncRNA(包括DElncRNA、LINC00641和AC004947.2),并在此基础上构建了失调的lncRNA-miRNAceRNA网络,预测结果显示靶基因PIGA、AHCYL1和ATP1B2可以被LINC00641 与miR-1285-3p竞争性调控,同时发现LINC00641可以通过与miR-6860相互作用来调控网络中MAP3K3、SHRK004M和FGD3的表达,进而影响肺癌的发生发展。Li等[13]在NSCLC细胞中发现了LINC00641的表达下调,功能实验显示LINC00641抑制了NSCLC的细胞增殖并诱导细胞凋亡,表明LINC00641在 NSCLC中发挥了肿瘤抑制作用;机制研究确定LINC00641通过竞争结合miR-424-5p从而上调PLSCR4的表达,在NSCLC中起到竞争性内源性RNA(ceRNA)的作用;进一步研究表明,过表达miR-424-5p 和干扰PLSCR4可以逆转LINC00641介导的细胞过程。因此,LINC00641可以通过ceRNA网络在NSCLC中发挥抑癌作用。Xi[14]等报道了LINC00641在肺癌组织中下调,且其下调与肺腺癌的不良预后有关,并验证了LINC00641可通过HuR蛋白调节N-钙粘蛋白水平,最终影响上皮细胞间质转化(EMT)。LINC00641低水平表达促进肿瘤进展的同时,也增加了肿瘤细胞对铁死亡诱导剂的敏感性,提示铁死亡有望成为LINC00641低表达肿瘤的治疗新策略。
鼻咽癌(nasopharyngeal carcinoma,NPC)是由鼻咽黏膜的上皮细胞恶化而来,是一类具有种族和地理分布特征的恶性肿瘤。EB病毒感染、遗传、饮食和环境已被证实是NPC的相关风险因素[10]。在NPC中多种lncRNA表达发生改变,且lncRNA在鼻咽癌的恶性进展中起重要作用[15]。Ren等[16]发现miR-378a-3p可靶向FOXD1,并负调控鼻咽癌细胞中FOXD1的表达从而抑制NPC细胞的增殖、侵袭和迁移;LINC00641被鉴定为miR-378a-3p的ceRNA,正向调节NPC细胞中FOXD1的表达。综上,LINC00641通过LINC00641/miR-378a-3p/FOXD1轴,促进鼻咽癌细胞的恶性进展。
2.2 LINC00641与消化系统恶性肿瘤
我国消化道恶性疾病的发病例数和死亡例数逐年上升[17]。虽然临床上已有多种胃肠道肿瘤早期筛查标志物,包括甲胎蛋白(AFP)、CEA、碳水化合物抗原19-9(CA19-9)、糖类抗原CA72-4等[18],然而这些生物标志物的敏感性和特异性不高,造成肿瘤检出率低,病人预后差。LINC00641在胃癌和结直肠癌中已有部分研究,为未来胃肠道肿瘤的标志物研究提供了一定研究基础。
全球范围内,胃癌发病率在消化系统常见的恶性肿瘤中居于第四位,也是癌症相关死亡的第三大原因[19]。lncRNA容易从体液(例如血液和胃液)中通过非侵入性方法获得,且具有高特异性和高敏感性,因此它们是未来早期筛查、诊断和预后的潜在生物标志物[20]。近年来,有研究证实,多种lncRNA在胃癌中表达异常且影响肿瘤的恶性进展和治疗的敏感性[21]。Hang等[22]发现,LINC00641在胃癌组织中比正常组织高表达,并与患者的预后相关;细胞功能实验表明,干扰LINC00641表达抑制了胃癌细胞的活力并促进了细胞凋亡,而在胃癌细胞中过表达LINC00641则作用与之相反;机制实验发现,LINC00641竞争性抑制miR-429的表达,随后上调了Notch-1,证实了LINC00641通过调节 miR-429/Notch-1 轴促进胃癌的恶性进展。胃腺癌预后不良部分原因是化疗失败,尤其是以奥沙利铂为基础的化疗,然而奥沙利铂耐药的具体机制尚不清楚。 Hu等[23]通过体内外检测发现在奥沙利铂耐药的胃癌细胞系中LINC00641表达较高,而miR-582-5p表达下调,说明LINC00641抑制了miR-582-5p的表达;在生物学功能方面,干扰LINC00641的表达可抑制细胞恶性生物学行为;对耐药机制进行研究发现, LINC00641下调可抑制LC3 II的表达,促进LC3 I和p62表达,证明了自噬过程受到抑制,使胃癌细胞对奥沙利铂更敏感。综上所述,在胃癌中LINC00641通过与miR-429和miR-582-5p相互作用来发挥其生物学功能。
结直肠癌(colorectal cancer,CRC)是全球最常见的恶性肿瘤之一,也是全球癌症相关死亡的第二大原因。lncRNAs为CRC的诊治提供了新的靶点[24]。Xia等[25]从TCGA数据库下载了429 例CRC样本和 37 例配对的正常样本,从具有显著差异表达的lncRNAs中筛选出15 种与焦亡和预后相关的 lncRNAs(包括LINC00641)。Xue等[26]进一步证明了LINC00641在CRC组织中上调,是CRC总生存期的不利因素。实验表明,敲低 LINC00641 抑制 HCT116和SW620细胞的增殖和迁移能力。LINC00641可以竞争性地结合miRNA-424-5p,从而消除其对PLSCR4表达的抑制作用;敲低PLSCR4可抑制HCT116和SW620细胞的增殖和迁移。这与LINC00641在肺癌中报道一致[13]。Hong等[27]同样发现了LINC00641在CRC组织和细胞系中显著上调,且上调提示预后较差。值得注意的是,HCT116和SW480细胞的增殖和迁移能力在体外和体内都在敲除LINC00641后受到显著抑制,说明LINC00641在 CRC 中发挥促癌作用。在机制上,LINC00641可以竞争性地结合miR-450b-5p,从而消除miR-450b-5p对GOLPH3表达的抑制作用。LINC00641参与CRC恶性进展的生物学过程,并有可能作为结直肠癌治疗及预后的分子生物学标志物。
2.3 LINC00641与泌尿系统恶性肿瘤
在泌尿系统中,恶性肿瘤主要有肾癌、膀胱癌、PCa、睾丸生殖细胞瘤和非生殖细胞瘤,除了睾丸恶性肿瘤,LINC00641在其他泌尿系统肿瘤中均有报道。
肾细胞癌(renal cell cancer,RCC)起源于肾实质,是一组化疗耐药性癌症,具有不同的病理分型、分子特征、临床结果和治疗预后,是泌尿系统中最致命的肿瘤[28]。Zhang等[29]通过48例肾细胞癌及癌旁组织的测序结果发现LINC00641在肾细胞癌组织和细胞系中表达量显著升高,并且其高表达与TNM分期相关。此外,干扰LINC00641表达显著抑制了细胞增殖迁移和侵袭能力,并提高了RCC细胞在体外的凋亡率。同时,在动物实验中也有相同结果。在作用机制上,干扰LINC00641通过miRNA-340-5p抑制了肾细胞癌细胞的增殖和侵袭能力,这些结果表明,LINC00641通过吸附miR-340-5p促进了RCC的进展。
膀胱癌是一种女性发病率高于男性的恶性肿瘤[30]。lncRNAs可以激活或抑制癌症相关信号通路,对膀胱癌的恶性演变产生重要的影响[31]。Li等[8]证实LINC00641在膀胱癌组织中表达显著低于癌旁组织,且下调提示预后较差。随后,通过体外实验证明了上调LINC00641显著抑制膀胱癌细胞的增殖、迁移、侵袭。异种移植实验还证实,LINC00641过表达抑制了体内膀胱癌的生长。在机制上,LINC00641竞争性结合miR-197-3p以促进抑癌基因KLF10的表达,从而导致PTEN/PI3K/AKT这一信号通路失活。这项研究阐明了在膀胱癌中LINC00641/miR-197-3p/KLF10/PTEN/PI3K/AKT这一新型信号通路级联反应,有望成为膀胱癌诊断和治疗的新靶点。
前列腺癌(prostate cancer,PCa)在全球男性恶性肿瘤中居于第二位[32]。多年来一直使用前列腺特异性抗原(PSA)检测作为PCa的监测指标[33]。近期的研究探索了体液中lncRNAs是否可以作为无创性肿瘤标志物,研究结果提示,PCa中差异lncRNAs可作为其诊断、治疗和预后的新指标[34]。Huang等人[35]检索TCGA数据库中PCa组织和正常组织中的差异lncRNAs,最终筛选出6个具有独立预后因子的lncRNAs(AC245884.1、LINC01524、AL807752.4、AP000844.2、AC016590.1、LINC00641)。Liu等[36]用ENCORI数据库分析了PCa组织和正常组织中LINC00641的差异表达,发现与正常组织相比LINC00641和VGLL4在PCa组织中的表达下调,而miR-365a-3p 的表达升高。功能上,LINC00641的过表达在体外抑制PCa细胞增殖和侵袭能力。在机制上,LINC00641通过调节miR-365a-3p/VGLL4轴抑制PCa发生发展。然而,LINC00641在PCa组织中的表达也有不同的研究结果。例如,Sajjadi等[37]比较了43对PCa组织与癌旁正常组织,检测到PCa组织中LINC00641表达量显著上调。尽管不同研究团队发现LINC00641在PCa中呈现不同的表达变化,但由于以上研究所纳入的样本量均较少,因此需要更大样本量的研究进一步验证LINC00641在PCa中的表达趋势,进而探索LINC00641在PCa中的临床意义。
2.4 LINC00641与生殖系统恶性肿瘤
女性生殖系统恶性肿瘤包括子宫颈癌、子宫内膜癌、卵巢癌和乳腺癌等。研究证明LINC00641在子宫颈癌、卵巢癌和乳腺癌中都扮演重要角色。
子宫颈癌主要由人乳头瘤病毒(HPV)感染所致[38]。子宫颈癌易向远处发生转移导致预后较差[39],因此,研究子宫颈癌恶性进展的分子机制对于提高宫颈癌的治疗效果具有重大意义。Zhang等[40]报道了LINC00641在子宫颈癌细胞中表达下调。过表达LINC00641后,细胞的增殖、迁移和侵袭能力以及EMT受到抑制,而细胞凋亡速率增加。进一步实验验证,LINC00641通过靶向miR-378a-3p/CPEB3抑制子宫颈癌的发展。
卵巢癌是一种异质性肿瘤,卵巢癌的特点是隐蔽较难发现,约70%的卵巢癌确诊时处于疾病晚期。Li等[41]对24例上皮性卵巢癌患者的癌组织和癌旁正常组织测序发现,LINC00641在卵巢癌组织中的表达量显著低于正常组织,且在TNM分期中差异显著。过表达LINC00641显著抑制了卵巢癌细胞的增殖和迁移能力。双荧光素酶报告实验表明,LINC00641能与miR-320a相互作用,上调miR-320a能消除LINC00641过表达对卵巢癌细胞的抑制作用。因此,LINC00641可作为一种肿瘤抑制基因,靶向miR-320a抑制卵巢癌细胞的增殖和侵袭。
乳腺癌发病率位居女性癌症的首位[42]。Mao等人[43]利用生物信息学分析发现LINC00641在乳腺癌组织中的表达降低,并且LINC00641表达水平与TNM分期呈负相关。过表达LINC00641能显著抑制肿瘤细胞的恶性生物学行为(例如增殖、迁移和侵袭),同时LINC00641可以作为内源竞争性RNA吸附miR-194-5p,进而抑制乳腺癌的进展。
2.5 LINC00641与神经系统恶性肿瘤
常见的神经系统恶性肿瘤有星形细胞瘤、胶质瘤、神经鞘瘤、垂体瘤、脑膜瘤、胶质母细胞瘤(glioblastoma multiform,GBM)等[44],目前研究报道LINC00641在胶质瘤和GBM中可能发挥重要作用。
胶质瘤是最常见的中枢神经系统肿瘤[44]。Zhang等人[45]通过对中国脑胶质瘤基因组图谱计划(CGGA)和TCGA数据库中的临床样本信息进行分析,证明了LINC00641可以用于预测胶质瘤患者的预后,且具有较高的准确率。Tao等人[46]通过TCGA和CGGA的数据库在神经胶质瘤患者中鉴定出9种EMT相关的lncRNA(HAR1A、LINC00641、LINC00900、MIR210HG、MIR22HG、PVT1、SLC25A21-AS1、SNAI3-AS1和 SNHG18),并构建了lncRNA介导的ceRNA网络,表明lncRNA-miRNA-mRNA的复杂相互作用可能是神经胶质瘤EMT进展的潜在原因。Chen等人[47]通过对TCGA的数据进行了单变量Cox回归分析,确定了LINC00641在胶质瘤中的低表达与预后不良相关。Yang等人[48]也发现在胶质瘤组织和细胞系中LINC00641表达降低,并通过实验发现,在胶质瘤细胞中过表达LINC00641能够抑制细胞增殖,促进细胞凋亡。进一步探究LINC00641作用机制发现,LINC00641可以作为ceRNA结合miR-4262,促进NRGN的表达,产生抑癌作用。总之,LINC00641作为抑癌基因可通过靶向miR-4262/NRGN轴在胶质瘤中发挥作用,为胶质瘤患者提供了新的诊断和治疗思路。
GBM是恶性胶质瘤中侵袭性最高的一种,且死亡率高[49-50]。Liang等[51]基于多个生物信息学数据库中的GBM表达谱,通过LASSO Cox PH模型确定了6种预后相关的lncRNA(C20orf166-AS1、LINC00645、LBX2-AS1、LINC00565、LINC00641和PRRT3-AS1),基于这些lncRNAs构建风险评估模型,将生存率具有显著差异的患者划分为不同的风险组,通过lncRNA-mRNA网络机制和通路富集分析表明LINC00641与GBM预后密切相关。Amer 等[52]对35例GBM患者和15例健康个体的血样进行lncRNA的检测和对比,结果发现GBM中LINC00641的表达量与健康组相比显著增加,表明LINC00641在GBM中有望成为血液源性的生物标志物。
2.6 LINC00641与运动系统恶性肿瘤
运动系统器官包括骨、骨连接和骨骼肌,其中骨易发恶性肿瘤,骨常见的原发肿瘤包括骨肉瘤、软骨肉瘤、骨巨细胞瘤、尤文瘤、多发性骨髓瘤和骨转移瘤等[53]。其中,骨肉瘤(osteosarcoma,OS)好发于儿童和成年人,在男性中略多见,具有高度侵袭性,早期也极易发生转移[54]。Tang等人[55]为了验证LINC00641对OS耐药的影响,收集了58例OS患者的肿瘤组织和癌旁正常组织,并根据患者的耐药情况将其分为化疗敏感组(n=24)和化疗耐药组(n=34)。测序发现OS组织中LINC00641的表达与正常组织相比显著升高,特别是在顺铂(DDP)耐药的肿瘤组织中尤其高。体外细胞实验发现,敲低LINC00641可以有效抑制DDP的耐药情况。相关机制研究进一步证明LINC00641可与miR-320d直接结合,促进MCL1的表达。因此,LINC00641可以通过miR-320d/MCL1轴导致OS细胞的DDP耐药,进而影响OS的治疗效果。
2.7 LINC00641与造血系统恶性肿瘤
急性髓系白血病(acute myeloid leukemia,AML)常见于成人,其发生是由于染色体易位以及参与血细胞增殖和分化的基因发生突变导致低分化髓系细胞的积累[56]。Wang等[57]探索AML样本和细胞系中LINC00641的表达模式,发现LINC00641在AML样本和细胞系中高度表达。干扰LINC00641可抑制AML细胞的增殖、迁移和侵袭,阻滞细胞周期并诱导细胞凋亡。LINC00641竞争性结合miR-378a促进ZBTB20的表达,从而促进白血病细胞的恶性生物学行为。上述表明LINC00641通过miR-378a/ZBTB20轴发挥作用,这一发现为AML的治疗提供了新的方向。
2.8 LINC00641与内分泌系统恶性肿瘤
甲状腺癌是内分泌系统常见的恶性肿瘤,虽然预后良好,但发病率持续上升,严重影响患者的生活质量[58]。在甲状腺癌的进展过程中,lncRNA作为重要的调节分子,多方面参与了甲状腺癌的发生发展[59]。Rao等[60]通过对Co-lncRNA数据库中的12个健康人群样本和83个甲状腺癌样本的临床信息和测序结果进行整理,发现LINC00641在甲状腺癌中表达下调且与患者无病生存期密切相关,并参与RNA代谢调节,但该结果仍需通过扩大临床样本量进行更深入的验证。
2.9 LINC00641与其他恶性肿瘤
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是最常见的非黑色素瘤皮肤癌之一[61]。Liu等[62]发现LINC00641在CSCC细胞系中的表达相比于正常永生化角质形成细胞明显下调。实验发现,过表达LINC00641会下调miR-424的表达从而抑制CSCC细胞系A431的增殖和迁移。在动物实验中LINC00641的过表达同样通过抑制miR-424的表达来抑制与增殖和迁移相关蛋白的表达,从而抑制肿瘤体积。因此,LINC00641通过下调miR-424抑制CSCC的进展。LINC00641在不同恶性肿瘤中的作用总结见表1。
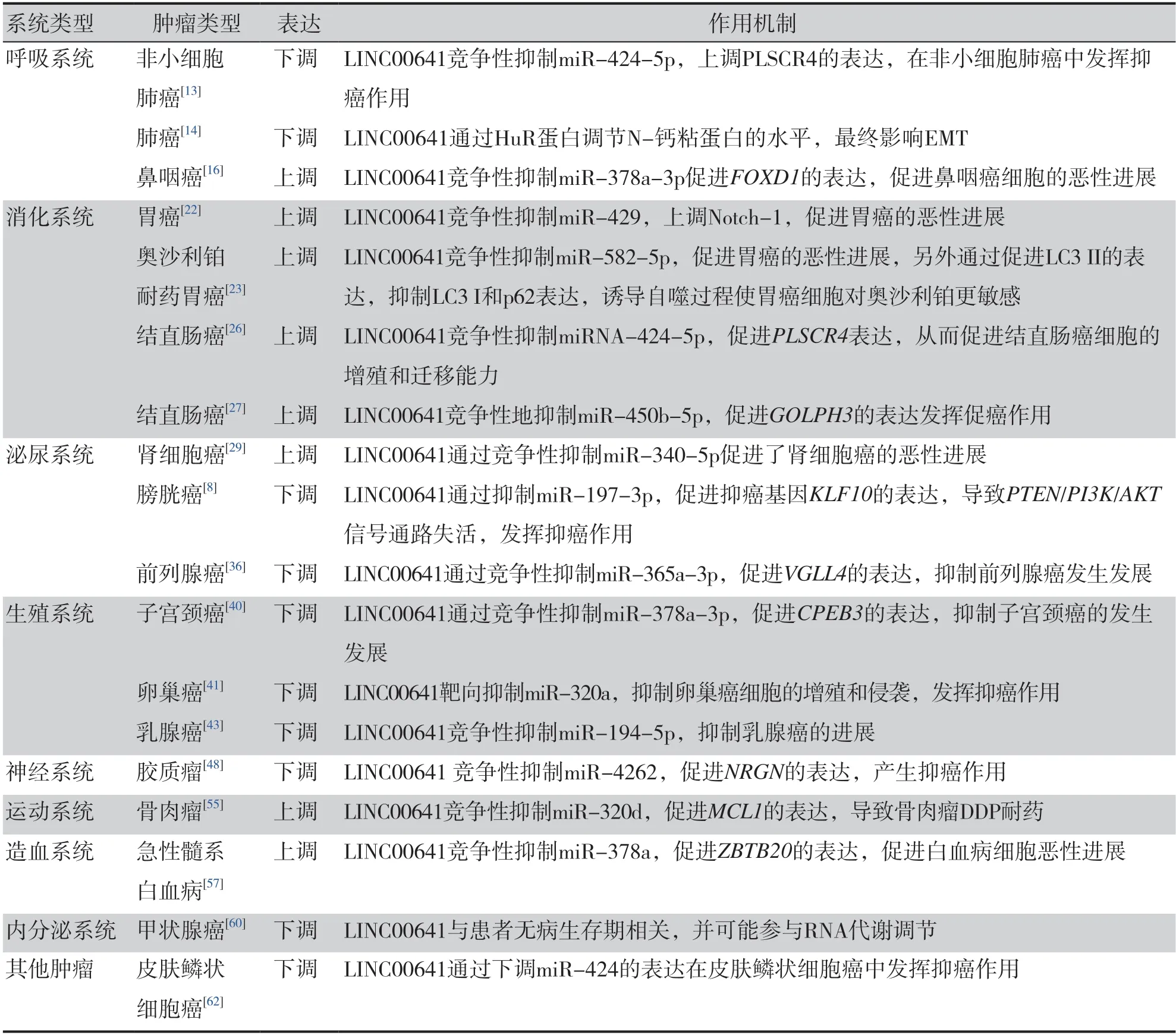
表1 LINC00641在恶性肿瘤中的作用和机制Table 1.Role and mechanism of LINC00641 in malignant tumors
3 结语
早期诊断可为恶性肿瘤患者选择最佳治疗方案[63],深入研究肿瘤发生发展的分子机制可探索更多的生物标志物用于肿瘤早期诊断和治疗。然而上述LINC00641研究是在组织细胞中进行的,检测实体瘤中基因表达水平是一种创伤性检查,需要从手术或活检标本中获得。因此从血液或体液中检测癌症基因的液体活检已经引起了越来越多的关注[64]。多种细胞在体液中释放外泌体,如血液、尿液和唾液等[65-67]。由于收集方法方便,它们可作为临床无创检测工具。多项的研究表明,细胞外lncRNA主要被包裹在特定的亚细胞物质中(特别是外泌体),外泌体递送的lncRNA在癌症诊断和预后中发挥重要作用[68]。通过EVLncRNAs 3.0数据库查询发现LINC00641属于外泌体lncRNA的一种,因此预测LINC00641可通过体液检测发挥无创性液体活检的作用[69]。
此外,LINC00641在多种肿瘤组织中异常表达,且在不同肿瘤中具有不同的表达模式,这可能与组织特异性或者临床样本人群不同有关。因此,今后的研究可探索寻找不同肿瘤中LINC00641表达上调或下调的原因。近年来研究发现,菌群(如肠道菌群、口腔菌群)在生物体内广泛影响疾病的发生发展。例如,肠道菌群可参与雄激素的合成影响PCa治疗抵抗[70];此外研究发现细菌内毒素又称细菌脂多糖(lipopolysacchairide,LPS)可作为炎症诱导剂,诱导炎症微环境的形成[71]。lncRNAs在致病性感染中的作用已有报道[72],然而,微生物诱导lncRNAs表达改变的机制尚不清楚。目前,多项研究已表明LPS通过lncRNAs影响肿瘤的进展[73-82],虽然目前未有报道LPS与LINC00641之间的直接关系,但这也为未来的研究提供了一个方向。
此外LINC00641在多数肿瘤中的具体调控机制尚不清楚,目前针对LINC00641的研究主要集中在ceRNA机制上,然而近期的研究也发现,LINC00641主要定位于细胞核,因此细胞核内LINC00641的作用机制还有很大的探索空间。随着新技术不断发展、多学科的联合应用,对LINC00641的认识会越来越完整、准确,有望使其成为一种新型肿瘤分子生物标志物。
