铅对大鼠皮质神经元γ-氨基丁酸A型受体介导电流及GABA能突触传递的抑制作用
2024-02-20高文良张红袁谊郭蕊刘兴阳邓显华孙灏
高文良,张红,袁谊,郭蕊,刘兴阳,邓显华,孙灏
(1.济南市第二妇幼保健院,山东济南 271100;2.安徽师范大学生命科学学院,安徽芜湖 241000;3.厦门大学医学院,福建厦门 361005)
谷氨酸是快速兴奋性突触传递的主要神经递质,其受体分为两大类:一类为离子型谷氨酸受体,包括N-甲基-D-天冬氨酸受体、海人藻酸受体和α-氨基-3-羟基-5-甲基-4-异唑受体;另一类属于代谢型谷氨酸受体,它们与膜内G 蛋白偶联,被激活后通过信号转导系统起作用,产生较缓慢的生理反应[1]。而γ-氨基丁酸(γ-aminobutyric acid,GABA)被认为是快速抑制性突触传递的主要神经递质。GABA 受体分为GABA A,B 和C 型,A 型和C 型属于离子型受体,其中C型仅存在于视觉通路;而B型为G 蛋白偶联代谢型受体[2]。GABA A 型受体(GABAA受体)是哺乳动物中枢神经系统中最主要的抑制性受体,具有十分复杂的结构,包括5个主要的结合结构域。这些结合位点位于或接近氯离子通道、苯二氮类、巴比妥类和印防己毒素及甾醇类麻醉剂的结合位点。GABA系统与癫痫和焦虑症的发病密切相关[3-5]。GABAA受体的激活导致氯离子内流并抑制神经元放电。因此,GABAA受体功能的调节会改变神经元的兴奋性[6]。
铅(pb)是一种生物毒性和神经毒性金属,广泛存在于周围环境。慢性铅暴露可导致学习和认知功能障碍,在中枢神经系统的发育早期危害更大[7-8]。流行病学研究证实,儿童铅暴露与认知功能缺陷之间存在很强的相关性,这些缺陷会持续到成年期[9-10]。有关铅中毒机制研究一直是毒理学领域的研究热点,但铅作用于GABAA受体的机制研究甚少。为明确铅对抑制性突触传递的作用,本研究利用全细胞膜片钳技术在培养细胞水平和脑片水平检测Pb2+对大鼠皮质神经元GABAA受体以及突触传递的影响。
1 材料与方法
1.1 动物、试剂和主要仪器
实验用SD 大鼠购自厦门大学动物实验中心,动物使用许可证号:SYXX(闽)2018-0010,动物实验均经厦门大学动物伦理审查委员会批准。大鼠在通风良好、温度23~25 ℃、湿度约50%的环境中饲养,自由饮食和饮水。取出生后0 d的SD 大鼠皮质神经元用于原代皮质神经元的培养;15~19 d日龄雄性SD大鼠用于电生理实验脑片样本的制备。
胰蛋白酶、多聚赖氨酸、阿糖胞苷、三磷酸腺苷二钠(Na2-ATP),三磷酸鸟苷三钠(Na3-GTP)、B27、6-氰基-7-硝基喹喔啉-2,3-二酮(6-cyano-7-nitroquinoxaline-2,3-dione,CNQX)、D-2-氨基-5-磷戊酸(D-2-amino-5-phosphonovaleric acid,AP-5)和荷包牡丹碱(bicuculine)购自美国Sigma 公司;DMEM、胎牛血清、F-12、neuronbasal 培养基和青霉素/链霉素购自美国Gibco 公司;河豚毒素购于河北水产公司;醋酸铅和其他常见的无机盐,如氯化钾、氯化钙、氯化镁、氯化钠等购自国药集团化学试剂有限公司。
VT1200S型振动切片机,美国Leica公司;P-97型电极拉制仪,美国Sutter 公司;膜片钳系统,美国Axon和Sutter公司;Axon 700B实验使用放大器和DIC正置相差荧光显微镜,日本Olympus公司。
1.2 原代神经元的培养和电生理记录
分离出生后0 d SD大鼠皮质神经元[11]。手术分离脑皮质组织,用0.25%胰蛋白酶37 ℃处理15 min,细胞悬浮于DMEM 中用吸管机械分离。将多聚赖氨酸包被的盖玻片置于培养皿中,在DMEM 培养基中添加10%胎牛血清,10% F-12 和100 kU·L-1青霉素/链霉素。培养24 h后,将培养基更换为neuronbasal 培养基(1.0 mL)并添加2%的B27,每3~4 d换液1次。培养4 d后加入阿糖胞苷(10 mg·L-1)用以阻断非神经元细胞的分裂。培养神经元保持在37 ℃湿润环境并通以95%空气和5% CO2的混合气。取培养7~14 d神经元进行电生理记录。
记录培养神经元时,标准外液包含(mmol·L-1):NaCl 150,KCl 5,CaCl22,HEPES 10 和葡萄糖10,用Tris 碱调整pH 值为7.4。细胞内液成分(mmol·L-1):NaCl 30,KCl 120,CaCl20.5,MgCl21.0,HEPES 10 和EGTA 5.0,使用Tris 碱将pH 值调整为7.2。醋酸铅首先溶于蒸馏水,使用前用生理盐水稀释到最终浓度。加药方式采取Y型管法快速给药[12],该方法允许在20 ms 内全部交换单个细胞周边溶液。实验时采用氧饱和人工脑脊液(artificial cerebrospinal fluid,ACSF)持续灌流,Y 管给药瞬间转为生理盐水稀释药液浸润整个被记录细胞,从而激发和记录GABAA受体介导的电流(IGABA)。给药浓度由低到高,待完全洗脱后再依次添加更高浓度药液。
1.3 脑片的制作和电生理记录
脑片标本可保持相对完整的突触连接。为此取15~19 d日龄雄性SD 大鼠进行脑片标本制备[13]。用乙醚麻醉大鼠,掐指反射消失后立即处死,迅速取出大脑,放入低温(约0 ℃)含氧ACSF中。ACSF 含(mmol·L-1):NaCl 125,NaHCO325,KCl 2.5,NaH2PO41.25,CaCl22.0,MgCl21.5,葡萄糖25,使用95% O2和5% CO2的混合气饱和ACSF。冠状脑切片厚度350 μm,室温下孵育1 h,再转移至膜片钳记录台进行电生理数据记录,氧饱和ACSF持续灌流(吊瓶式重力灌流,2 mL·min-1)。
大鼠皮质锥体神经元全细胞记录在电压钳模式下进行(24~26 ℃)。玻璃电极使用1.5 mm 外径的玻璃毛细管拉制。充有电极内液的记录电极电阻约为3~6 MΩ。电极内液(mmol·L-1):葡萄糖酸钾122,NaCl 5,CaCl20.3,MgCl22.0,EGTA 1.0,HEPES 10,Na2-ATP 5,和Na3-GTP 0.4,用KOH调pH 值为7.2~7.4,蔗糖调节渗透压至约280 mOsm·kg-1。Pb2+(10 μmol·L-1)处理前和处理5 min 后分别进行自发抑制性突触后电流(spontaneous inhibitory post-synaptic currents,sIPSC)和微小抑制性突触后电流(miniature inhibitory postsynaptic currents,mIPSC)(灌流液中另加入1.0 μmol·L-1的河豚毒素用以阻断Na+通道)的记录,每数据记录10 min,三通用于切换ACSF 和10 μmol·L-1的Pb2+溶液(溶于ACSF)。记录膜电位控制在0 mV,ACSF 中另加入CNQX 20 μmol·L-1和AP-5 50 μmol·L-1用以阻断兴奋性突触传递。电流钳模式下记录动作电位(action potential,AP)。待记录细胞状态稳定,向胞内注入电流,从-40 pA起始,以20 pA的电流梯度注入,每次注入时长1 s,间隔1 s,直至180 pA 止。随后统计所诱导动作电位频率。实验中70%~90%串联电阻得到补偿。
1.4 数据分析
GABA 的电流激活曲线(Pb2+处理和无Pb2+处理)使用最小二乘法,根据改良的Michaelis-Menten方程(I=ImaxCh(Ch+EC50h)]拟合而成。Imax为最大响应电流,C为药物浓度,EC50为激活50%最大响应电流时的药物浓度,h为表观Hill系数。Pb2+的浓度-效应曲线采用公式I=Imax(IC50)h(Ch+IC50h)拟合,式中IC50为Pb2+引发50%最大抑制作用时的浓度,其余参数同上[14]。在统计学分析中,采用双因素方差分析,组间两两比较采用成对t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 不同浓度Pb2+对大鼠皮质神经元GABA 激活电流的影响
原代培养的大鼠皮质神经元的电生理记录显示,在-60 mV 下,由GABA 激活的IGABA几乎存在于所有测试的神经元中。而IGABA可以被荷包牡丹碱10 μmol·L-1完全阻断(数据略)。单独Pb2+(1~100 μmol·L-1)处理时,Pb2+未激发明显可见电流。预先给予Pb2+(1~100 μmol·L-1)处理30 s后再加入GABA(100 μmol·L-1)所激活IGABA明显小于GABA单独激活的IGABA(图1A),洗脱后电流大小基本恢复(图2A),表明Pb2+可逆性抑制了IGABA,IC50为(68±20)μmol·L-1,希尔系数为0.91±0.11。Pb2+浓度为1,5,10,50和100 μmol·L-1对IGABA的抑制后电流分别为GABA 100 μmol·L-1单独激活电流的(98±4)%(n=5),(91±15)%(n=6),(82±14)%(n=7,P<0.05),(61±15)%(n=7,P<0.01)和(39±34)%(n=8,P<0.01)(图1B)。由此可见,随浓度升高,Pb2+对神经元IGABA的抑制作用增强。

Fig.1 Effect of Pb2+ on γ-aminobutyric acid(GABA)A receptor induced currents(IGABA)in cultured neurons of SD rats.The holding potential(VH)was -60 mV.Pb2+ 10,50 or 100 μmol·L-1 was pre-applied for 30 s before co-application with GABA 100 μmol·L-1.A:sample traces of IGABA recorded from one neuron in the presence of Pb2+.±s,n=5-8.B:concentrationresponse relationship for Pb2+-induced inhibition of IGABA.
2.2 Pb2+对大鼠皮质神经元不同浓度GABA 激活IGABA电流的影响
在Pb2+50 μmol·L-1和无Pb2+条件下,检测GABA激活的IGABA的改变。图2A 显示,与无Pb2+组比较,Pb2+50 μmol·L-1对GABA 100 和500 μmol·L-1激活的IGABA具有抑制作用。图2B 显示,Pb2+使IGABA的浓度-效应曲线显著右移,EC50由无Pb2+组的(20±6)μmol·L-1增大到(87±39)μmol·L-1,且GABA最大激活电流被明显抑制(n=8,P<0.01),提示Pb2+对GABA受体的抑制属于非竞争性抑制。
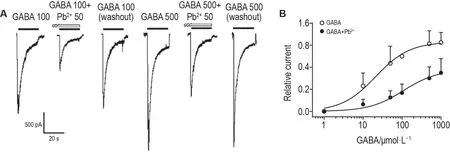
Fig.2 Effect of Pb2+ on concentration-response relationship of IGABA.All currents were normalized to the peak amplitude of the current evoked by GABA at 100 μmol·L-1.A:sample recordings that show effects of Pb2+ 50 μmol·L-1 on the peak amplitude of IGABA activated by GABA 100 μmol·L-1 and by GABA 500 μmol·L-1.The traces from left to right were IGABA activated by GABA 100 μmol·L-1(control),IGABA activated by GABA 100 μmol·L-1 with Pb2+ 50 μmol·L-1,IGABA activated by GABA 100 μmol·L-1(washout),IGABA activated by GABA 500 μmol·L-1(control),IGABA activated by GABA 500 μmol·L-1 with Pb2+50 μmol·L-1 and IGABA activated by GABA 500 μmol·L-1(wash out),respectively.B:concentration-response relationship for IGABA in the absence and presence of Pb2+50 μmol·L-1.±s,n=5-8.
2.3 Pb2+降低大鼠脑片神经元slPSC的频率
为记录大鼠脑片sIPSC,膜片钳的钳制电压设置在0 mV。荷包牡丹碱10 μmol·L-1可完全阻断sIPSC,证明所记录成分为GABA 能的突触传递(图略)。图3A 和3B所示,与无Pb2+组比较,Pb2+10 μmol·L-1可逆地降低神经元sIPSC 的频率(P<0.01),但对振幅无明显影响。图3C 显示,Pb2+10 μmol·L-1导致事件间隔(event intervals)累积概率曲线有一个明显的右向平移,但并未改变振幅的累积概率曲线。
2.4 Pb2+未影响大鼠脑片神经元mlPSC 的频率和振幅
实验采用sIPSC 记录的相同条件,在灌流液中加入河豚毒素1.0 μmol·L-1,阻断钠离子通道和动作电位,以记录大鼠脑片神经元mIPSC。图4 结果显示,与无Pb2+组比较,Pb2+10 μmol·L-1对大鼠脑片神经元mIPSC的频率和振幅均无明显影响,提示Pb2+对突触行为的影响需要AP的支持。
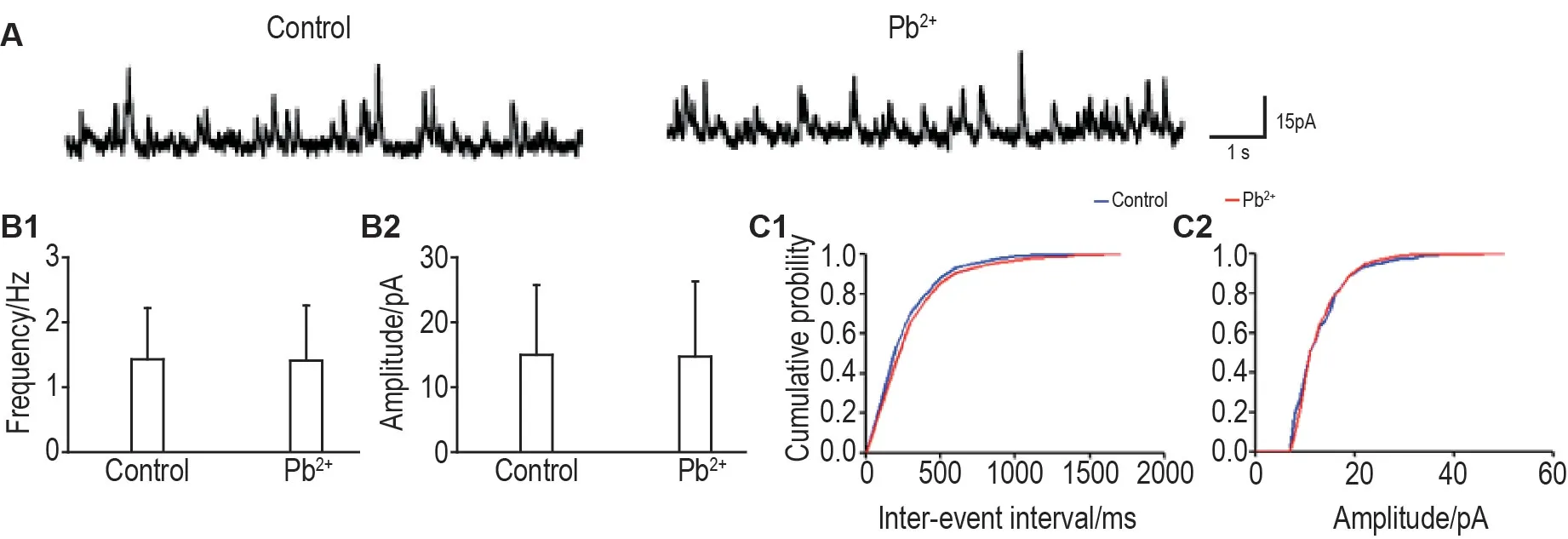
Fig.4 Effect of Pb2+ exposure on miniature inhibitory post-synaptic currents(mlPSCs)in cortical neurons of slices.CNQX 20 μmol·L-1,AP-5 50 μmol·L-1 and tetrodotoxin 1.0 μmol·L-1 were added to ACSF to block AMAP,NMDA and sodium receptors respectively.A:representative traces of mIPSCs recording from cortical neurons treated with Pb2+ 10 μmol·L-1;B:quantification of mIPSCs frequency(B1)and amplitude(B2).±s,n=8.C:cumulative distribution curves of mIPSCs frequency(C1)and amplitude(C2)from cortical neurons treated with Pb2+10 μmol·L-1.
2.5 Pb2+降低大鼠脑片神经元诱发动作电位的频率
电流钳模式下记录Pb2+对大鼠脑片神经元AP的影响。图5A 和5B 显示,与无Pb2+组比较,Pb2+10 μmol·L-1明显降低大鼠脑片神经元AP 的频率(P<0.01),表明Pb2+对皮质神经元的整体兴奋性具有明显的抑制作用。
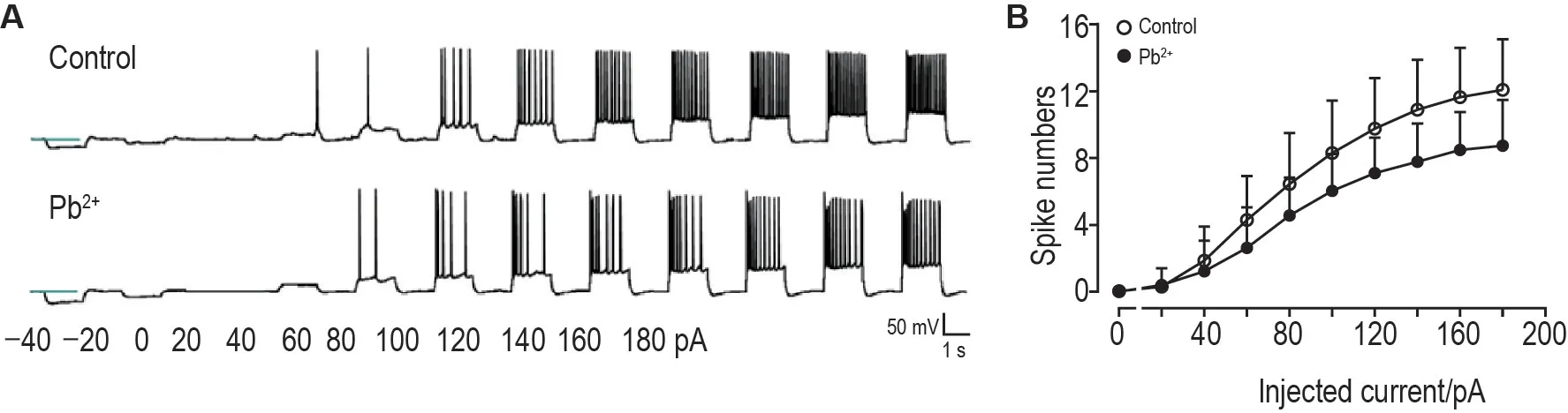
Fig.5 lnhibitory effect of Pb2+ on firing rate of cortical neurons of brain slices.A:representative traces of firings with or without Pb2+ 10 μmol·L-1 which were induced by current injection from -40 pA to 180 pA with step of 20 pA;B:statistical results of firing numbers against sequential current injection.±s,n=25.
3 讨论
在大脑发育过程中,早期铅暴露极大地影响突触的功能。已知的铅诱导神经毒性机制为破坏神经递质释放,从而影响神经递质受体的表达和功能[15-16]。例如,慢性铅暴露导致对N-甲基-D-天冬氨酸受体抑制[17-18]和突触传递抑制[19-20]以及突触可塑性损害[21]。另一些研究表明,铅可阻断某些类型的电压门控型钙离子通道[22-23]、钠离子通道[24]和钾离子通道[25-26],然而铅作用于GABAA受体的机制研究甚少。
本研究首先采用原代培养大鼠神经元,用细胞全细胞膜片钳技术观察了铅对大鼠皮质神经元IGABA的影响。实验结果表明,Pb2+10,50和100 μmol·L-1对GABA 激活的神经元IGABA的抑制作用增强,而单独使用Pb2+并不能激活任何可检测到的电流,提示Pb2+对GABA 激活的IGABA的抑制作用是一种调节作用,必须在GABAA受体被激活的情况下才能起效。从Pb2+对于GABA 激活电流曲线的影响可以看出,其对GABA 激活的最大IGABA也有抑制作用,同时明显增加了GABA 的EC50值,提示Pb2+是通过非竞争性机制抑制神经元的IGABA。鉴于Pb2+对IGABA快速且可逆的抑制,从时间上推测该作用经由受体介导胞内信号转导或受体表达减少实现的可能性不大,因而推测其有可能通过改变GABAA受体的构象而降低GABAA受体和其配体的亲和力,从而起到抑制IGABA的作用。
相对于原代培养细胞,脑片是更接近生理状态的标本,在脑片中可保持相对完整的突触连接。因此,本研究随后用全细胞膜片钳技术检测了Pb2+对大鼠脑片神经元抑制性突触传递的影响。与原代培养神经元的记录所不同的是,钳制电压设置在0 mV。在此电压下,IGABA较为显著,有利于IPSC 的记录。原代培养神经元的实验中,Pb2+使用由低到高5 个浓度(1,5,10,50 和100 μmol·L-1),旨在拟合Pb2+抑制GABA 激活IGABA的浓度-效应曲线,并未考量铅中毒的实际生理浓度,其IC50值并不适合作为脑片灌流时Pb2+处理的浓度。因此,对脑片灌流状态下Pb2+浓度的设定依据相关文献[27]和美国疾病控制中心对儿童铅中毒的定义[28](血铅浓度≥1.2 μmol·L-1),将Pb2+的浓度定为10 μmol·L-1,检测Pb2+对大鼠脑片神经元sIPSC 和mIPSC 的影响,同时也检测了Pb2+对AP 的影响。结果表明,Pb2+对sIPSC 的频率而不是振幅具有抑制作用,这提示Pb2+参与了突触前的改变。有文献报道,斑马鱼胚胎发育期Pb2+暴露,影响一系列GABA 相关基因的表达,其中包括GABA 囊泡转运体(vesicular GABA transporter,vgat)基因,从而影响突触前递质的转运和释放[29]。但本研究在mIPSC 记录中并未发现Pb2+对sIPSC频率的影响,于是推测Pb2+有可能通过减少AP 依赖的GABA 释放来破坏GABAA受体介导的突触传递。因此,本研究进一步评估了Pb2+对AP 的作用。结果显示,Pb2+有效抑制了电流注入所诱发AP的发生频率。据报道,出生后大鼠的铅暴露导致中脑区域多巴胺能神经元放电减少[30],该结果与本研究AP 的实验结果相似,提示Pb2+有可能通过抑制AP而影响突触前囊泡的释放。Ruan 实验室的一项研究结果表明,慢性低水平铅暴露增加海马锥体神经元的放电频率[31],该结果与本研究结果完全相反,这可从铅暴露模型的不同和所记录神经元种类的不同来解释两者之间的差异。本研究Pb2+为急性给药,作用迅速且可逆,可能的机制是对钠、钾和钙等离子受体的快速调节以及GABAA受体的变构调节。而慢性铅中毒模型产生影响的机制十分缓慢,可以是信号转导以及基因调控和蛋白表达等,其内在机制可能截然不同,而且铅对神经元受体的影响是全方位的,其内在机制也各有不同。
本研究中在原代培养神经元水平和脑片水平均证实了Pb2+对GABAA受体的抑制作用。所不同的是,在原代培养神经元上,Pb2+很可能是通过变构调节来改变GABAA受体的构象,从而非竞争性抑制IGABA;而在脑片水平,Pb2+仅仅抑制sIPSC 的频率而非振幅,提示突触前机制参与其中。相比sIPSC 频率的改变,Pb2+处理后mIPSC 频率和振幅皆未改变,因此有理由认为Pb2+正是通过抑制AP 进而抑制AP 依赖的囊泡释放,表现为突触后电流数目的减少,从而降低sIPSC 的频率。Ruan 实验室的另一项研究显示,Pb2+通过抑制海马锥体神经元突触前电压依赖性钙通道来抑制AP 的发生[27],也从侧面支持了本研究结果。然而,不同浓度的Pb2+处理以及不同的Pb2+暴露方式,往往在对突触传递的影响中扮演重要的角色。有实验室用培养神经元探讨慢性Pb2+暴露对海马神经元E/I平衡的影响,发现Pb2+1.0 μmol·L-1抑制mEPSC 的频率却增加mIPSC 的频率[32]。该实验室另一项研究证实,Pb2+对海马突触传递的抑制源于细胞周期蛋白依赖性激酶5 对突触蛋白1 的磷酸化[33],该报道中Pb2+5 μmol·L-1同时抑制mEPSC和mIPSC。
本研究结果显示,Pb2+对大鼠皮质神经元IGABA有明显抑制作用,其内在机制可能通过对GABAA受体的变构调节,这与脑片实验中Pb2+仅抑制大鼠脑片皮质神经元sIPSC 的频率而未抑制振幅似乎矛盾。实际上,原代神经元的培养采用很高的Pb2+浓度(50 μmol·L-1),而用于激活IGABA的GABA 浓度也高达100 甚至1000 μmol·L-1。脑片实验中Pb2+浓度仅为10 μmol·L-1。更为关键的是,脑片状态下突触区域GABA 的浓度仅限于自身突触前囊泡的释放,其作用范围也仅限于突触范围,其浓度和作用空间无法与原代神经元培养实验相比。在培养过程中,原代培养神经元部分形成了有效的突触连接,但神经元的形态和功能已经发生了很大的改变,其生理功能的完整性距离脑片标本有很大的差距,这也是造成Pb2+作用机制差异的主要原因。因此,在脑片实验中未能检测出Pb2+对突触后GABAA受体明显的抑制效应也属合理。
综上所述,Pb2+对原代培养神经元IGABA具有抑制作用;在脑片实验中,Pb2+通过抑制皮质神经元的AP 实现对sIPSC 频率的抑制;两者均可能是铅神经毒性的内在机制之一。大鼠皮质原代培养的神经元虽然也能形成有效的突触连接,但相对于脑片天然的突触连接仍然有本质的不同。本研究2项不同类型实验的探究均有利于获得更多铅中毒机制的信息。鉴于突触活动是发育早期建立稳定突触连接的关键机制,Pb2+很可能通过影响突触区域GABAA受体构象、干扰自发的递质释放,从而对神经元成熟以及可塑性产生持久影响,从而造成铅的神经毒性。
猜你喜欢
杂志排行
中国药理学与毒理学杂志的其它文章
- Element profiles of benzo[a]pyrene malignantly transformed 16HBE cells and joint effects of copper with cisplatin or vinorelbine on cell proliferation
- 基于细胞代谢组学的柴胡皂苷b2对皮质酮诱导PC12细胞损伤的保护作用研究
- miR-152-3p表达下调降低紫杉醇耐药人卵巢癌细胞A2780T对紫杉醇的耐药性
- α-鹅膏蕈碱在大鼠体内的毒代动力学与组织分布特征
- 环状RNA在大脑功能调控及药物成瘾中的作用研究进展
- PD-1/PD-L1单抗药物抗肿瘤免疫治疗相关不良反应及超进展疾病研究进展
