基于细胞代谢组学的柴胡皂苷b2对皮质酮诱导PC12细胞损伤的保护作用研究
2024-02-20李萌施浩陈佳俊吕家乐秦雪梅杜冠华周玉枝
李萌,施浩,陈佳俊,吕家乐,秦雪梅,杜冠华,4,周玉枝
(山西大学1.中医药现代研究中心,2.化学生物学与分子工程教育部重点实验室,3.地产中药功效物质研究与利用山西省重点实验室,山西太原 030006;4.中国医学科学院药物研究所,北京 100050)
抑郁症是一种复杂的精神疾病,临床症状主要表现为抑郁心境、情绪低落、认知障碍甚至自杀倾向,严重威胁人类健康[1]。目前临床常用抗抑郁药物如选择性5-羟色胺和去甲肾上腺素再摄取抑制剂等,存在见效慢、作用靶点单一、且常伴有认知功能损害等不良反应[2-3]。中药在抑郁症的治疗中具有多成分、多靶点且毒副作用小的独特优势[4-6],因此,从中药中开发具有良好抗抑郁活性的天然化合物日益得到研究者们的关注。柴胡(Bupleurum chinenseDC.)是伞形科植物柴胡的干燥根,具有解表退热、疏肝解郁等功效,临床应用较广[7]。柴胡皂苷是柴胡的主要活性成分,具有抗抑郁[8]、抗癫痫[9]、治疗神经性疼痛[10]和调节免疫[11-12]等药理作用。柴胡皂苷的活性成分包括柴胡皂苷a(saikosaponin a,SSa)、SSb2 和SSd 等[13],其中柴胡总皂苷[14]、SSa[15-16]和SSd[17-18]的抗抑郁作用已有文献报道。李军等[19]研究发现,SSd 在柴胡煎煮过程中进入煎液几乎全部转化为SSb2。同时,本课题组前期研究发现,SSb2 生物利用度的提高与柴胡-白芍药对的抗抑郁作用增效有关[20],提示SSb2 有潜在的抗抑郁活性。为此,本研究采用皮质酮(corticosterone,CORT)诱导的PC12 细胞损伤模型探讨SSb2的神经保护作用。
CORT 是一种在机体受到应激反应时释放的糖皮质激素,它能够引起海马神经元的凋亡,在抑郁症的发生过程中发挥重要作用[21]。PC12 细胞具有脑神经元的典型特征,使用高浓度CORT 与其共培养能诱导PC12 细胞损伤,模拟抑郁症的神经元损伤状态[22],该模型已经被广泛应用于抑郁症的体外研究[23-25]。代谢组学可以反映机体由病理或生理刺激产生的内源性代谢产物的变化,是系统生物学的重要组成部分[26]。它可基于高通量质谱技术、聚类指数分析和数据处理,筛选和识别与疾病表型相关的差异代谢物,被广泛应用于抑郁症生物标志物的研究领域[27]。目前,越来越多研究者通过细胞代谢组学技术研究药物的作用机制,包括CORT 诱导PC12细胞损伤的代谢组学研究[28-29]。
综上所述,本研究采用CORT 诱导的PC12 细胞损伤模型,运用细胞药理学和基于超高效液相色谱-四级杆-飞行时间质谱(ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF-MS)的代谢组学技术探讨SSb2 的神经保护作用,旨在为抗抑郁药物的研发提供新的实验依据。
1 材料与方法
1.1 药品、试剂和主要仪器
SSb2(批号:18053005,高效液相色谱纯度≥98%),成都普菲德生物技术有限公司;CORT,成都华夏化学试剂有限公司;青霉素、链霉素、胰酶、胎牛血清和RPMI 1640 培养基,美国HyClone 公司;二甲亚砜、MTT 和多聚赖氨酸,美国Sigma-Aldrich公司;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(货号:A020-2-2)、细胞凋亡荧光Hoechst33342/PI 双染试剂盒(货号:G023-1-1)、谷氨酸检测试盒(货号:A074-1-1)和谷氨酰胺酶活性试剂盒(货号:A124-1-1),南京建成生物工程研究所;Annexin V-FITC/PI 细胞凋亡试剂盒,江苏凯基生物技术股份有限公司;LC-MS 级乙腈和高效液相色谱级甲酸,美国Thermo Fisher Scientific公司。
LC-20AD型超高效液相色谱仪,日本Shimadzu公司;Triple TOF 5600质谱仪,美国ABSciex公司;HF Safe1800 生物安全柜、HF90 CO2培养箱和Neofuge 1600R 台式高速离心机,中国力康生物医疗科技控股有限公司;Nikon Eclipse Ti-S 荧光倒置显微镜,日本Nikon 公司;SCIENTZ-12N 真空冷冻干燥机和UP-250 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;M200 多功能酶标仪,瑞士Tecan公司;高速冷冻离心机,上海力新仪器有限公司;FACS CaliburⅡ流式细胞仪,美国BD Biosciences公司。
1.2 细胞培养
低分化PC12 细胞,中国科学院上海生命科学研究院细胞资源中心。实验使用第10~15 代的PC12 细胞,培养于含有10%胎牛血清、青霉素10 kU·L-1和链霉素10 kU·L-1的RPMI 1640 培养基,置于37 ℃,5% CO2的培养箱中培养,每2~3 d传代1次。
1.3 PC12细胞CORT损伤模型构建、分组和给药
为筛选CORT 的最佳造模浓度和SSb2 对正常PC12 细胞的毒性,取对数生长期的PC12 细胞,以2×108L-1的密度接种于经多聚赖氨酸包被的96孔培养板,每孔100 μL。①将细胞分为细胞对照组、CORT 组和SSb2 组。细胞对照组用RPMI 1640 培养基培养24 h;CORT组用CORT 100~800 μmol·L-1孵育24 h;SSb2 组用SSb2 1.5625,3.125,6.25,12.5,25,50 和100 μmol·L-1孵育24 h。MTT 法检测细胞存活率,筛选出CORT 的最佳造模浓度和SSb2的无毒浓度范围进行后续实验。②将细胞分为细胞对照组(RPMI-1640 培养基孵育24 h)、模型组(CORT 400 μmol·L-1孵育24 h)、模型+SSb2 组(SSb2 1.5625,3.125,6.25,12.5 和25 μmol·L-1预处理3 h,去上清,然后加入CORT 400 μmol·L-1及SSb2 1.5625,3.125,6.25,12.5 和25 μmol·L-1共孵育24 h),MTT 法检测细胞存活率,微板法检测PC12细胞LDH释放率。
1.4 MTT法检测细胞存活率
取对数生长期的PC12 细胞,以2×108L-1的密度接种于经多聚赖氨酸包被过的96孔培养板内,每孔100 μL。CORT损伤模型构建和分组给药同1.3,每组6 复孔。吸去孔中液体后,每孔加入含MTT 0.5 g·L-1的RPMI 1640培养基100 μL,继续培养4 h,弃上清,每孔加入DMSO 100 μL 溶解沉淀物,微孔板振荡器混匀10 min,用酶标仪在波长570 nm 条件下测定吸光度值(A570nm)。细胞存活率(%)=(实验组A570nm-空白对照组A570nm)/(细胞对照组A570nm-空白对照组A570nm)×100%。实验重复3次。
1.5 微板法检测PC12细胞LDH释放率
取对数生长期的PC12 细胞,以2×108L-1的密度接种于24 孔培养板内,每孔500 μL,培养24 h后,将细胞分为细胞对照组、模型组和模型+SSb2组(给药方式同1.3②),每组6复孔,培养24 h,收集细胞培养液,每孔中加入细胞裂解液(含1% Trition X-100的PBS)500 μL,按照试剂盒说明书进行样本处理,用酶标仪在波长450 nm 条件下测定各组样本吸光度值(A450nm)。LDH 释放率(%)=细胞培养液A450nm/(细胞培养液A450nm+细胞裂解液A450nm)×100%。实验重复3次。
1.6 Annexin V-FlTC/Pl 流式细胞术检测PC12 细胞凋亡率
取对数生长期的PC12 细胞,以2×108L-1的密度接种于6孔培养板内,每孔2 mL,培养24 h后,将细胞分为细胞对照组、模型组和模型+SSb2 12.5 μmol·L-1组(给药方式同1.3②),每组设3复孔。培养24 h后,吸去细胞培养液。用1×Annexin V-FITC/PI工作液孵育15 min,流式细胞仪分析细胞凋亡率。
1.7 UPLC-Q-TOF-MS 法检测PC12 细胞代谢组变化
1.7.1 细胞药物处理和UPLC-Q-TOF-MS样本制备
取对数生长期的PC12细胞,以2×108L-1的密度接种于10 cm 培养皿内,每皿10 mL,培养24 h 后,将细胞分为细胞对照组、模型组和模型+SSb2 12.5 μmol·L-1组(给药方式同1.3②),每组6皿。各组分别培养24 h 后,去除细胞培养液;PBS 洗细胞2次,培养皿放置在冰上并加2 mL甲醇水(4∶1),用细胞刮板刮下细胞,置于-80 ℃冰箱过夜,取出后于冰上超声破碎,以18 000×g4 ℃离心20 min,取上清;在细胞沉淀物添加500 μL 甲醇水(4∶1),涡旋1 min,以18 000×g4 ℃离心5 min,取上清液;合并2 次上清液并冻干。冻干的样品用100 μL 甲醇水(4∶1)复溶,旋涡2 min,超声10 min,4 ℃,18 000×g离心10 min,将上清液收集于液相小瓶中。另各取上述3组样本20 μL,混合后作为质量控制样本。
1.7.2 UPLC-Q-TOF-MS测试分析条件
流动相:A(水,含0.1%甲酸),B(乙腈,含0.1%甲酸);流动相梯度:0~2 min,0%~2%B;2~3 min,2%~35%B;3~10 min,35%~70%B;10~29 min,70%~98% B;29~31 min,98% B;31~33 min,98%~2%B;33~35 min,2%B。流速为0.2 mL·min-1,总色谱运行时间35 min,柱温30 ℃,进样量5 μL,使用Waters Acquity UPLC HSS T3 柱(1.8 μm,2.1 mm×100 mm)。
电喷雾离子源(ESI),正(+)、负(-)离子模式下分别扫描。离子喷雾电压为3.5 kV(+)和4.5 kV(-);离子源温度450 ℃,辅助气为N2;气帘气、雾化气和辅助气压力分别为30,55 和55 psi;气流速:35 arb,辅助气流速:10 arb;碰撞能量(CE)采用45 eV(+)和-45 eV(-);去簇电压(DP)为60 V(+)和60 V(-)V。选择数据依赖性采集(IDA)模式,选取响应值超过100 cps 的4 个最高峰进行二级质谱扫描并开启动态背景扣除(DBS)以减少干扰,m/z采集范围100~1500。
1.7.3 UPLC-Q-TOF-MS数据处理
将采集得到的UPLC-Q-TOF-MS 数据原始文件导入One-MAP(http://www.5omics.com)在线软件进行数据格式、电离模式设置,获取匹配和对齐的峰值数据,将得到的峰面积进行总峰面积归一化,再将归一化后的数据导入SIMCA-P13.0软件进行主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discrimination analysis,PLS-DA)和正交投影偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)。用OPLS-DA模型变量的变量权重值(variable important in projection,VIP)>1以及独立样本t检验(studentttest)P<0.05 为标准,筛选差异代谢物。通过HMDB(http://www.hmdb.ca),Mass bank(http://massbank.eu)和Pubchem(https://pubchem.ncbi.nlm.nih.gov)在线数据库并结合二级离子碎片对筛选出的差异代谢物进行鉴定指认。使用MetaboAnalyst 4.0(https://www.metaboanalyst.ca)对差异代谢物所涉及代谢通路进行富集分析。
1.8 比色法检测PC12 细胞谷氨酸含量和谷氨酰胺酶活力
取对数生长期的PC12细胞,以2×108L-1的密度接种于6孔培养板内,每孔2 mL,培养24 h后,将细胞分为细胞对照组、模型组和模型+SSb2 12.5 μmol·L-1组(给药方式同1.3②)。各组加药后继续培养24 h,收集细胞,采用比色法按照试剂盒说明进行操作,使用分光光度计在420 nm 处检测吸光度(A420nm)值,计算各组谷氨酸含量和谷氨酰胺酶活力。
1.9 统计学分析
2 结果
2.1 不同浓度CORT 和SSb2 对PC12 细胞存活率的影响
CORT 造模浓度筛选结果显示,与细胞对照组相比,当CORT 浓度为400 μmol·L-1时细胞存活率降低至(55±6)%(P<0.01)(图1A)。因此,选择CORT 400 μmol·L-1作为造模浓度。SSb2 细胞毒性实验结果显示,与细胞对照组相比,SSb2 浓度高于50 μmol·L-1时,PC12 细胞存活率显著降低(P<0.01)(图1B)。因此,选择SSb2 1.5625~25 μmol·L-1进行后续研究。
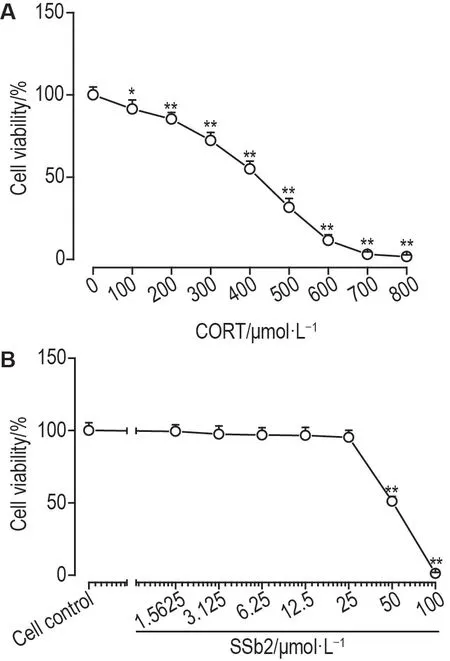
Fig.1 Effects of different concentrations of corticosterone(CORT,A)and saikosaponin b2(SSb2,B)on viability of PC12 cells by MTT assay.PC12 cells were treated with different concentrations of CORT or SSb2 for 24 h.Cell viability(%)=(A570 nm of experimental group-A570 nm of blank control group)/(A570 nm of cell control group-A570 nm of blank control group)×100%.±s,n=6.*P<0.05,**P<0.01,compared with cell control(0 μmol·L-1)group.
2.2 SSb2 对CORT 损伤PC12 细胞的存活率和LDH释放率的影响
MTT 实验结果(图2A)显示,与细胞对照组相比,模型组细胞存活率显著减少(P<0.01),与模型组相比,模型+SSb2(3.125,6.25 和12.5 μmol·L-1)组细胞存活率均显著增加(P<0.05,P<0.01),其中SSb2浓度为12.5 μmol·L-1时作用最强。LDH释放率实验结果(图2B)显示,与细胞对照组相比,模型组LDH释放率显著增加(P<0.01);而与模型组相比,模型+SSb2组(3.125,6.25 和12.5 μmol·L-1)的LDH 释放率均显著降低(P<0.01),其中SSb2 浓度为12.5 μmol·L-1时的作用最强。结合细胞存活率及LDH 释放率的结果,选择SSb2 12.5 μmol·L-1进行后续研究。
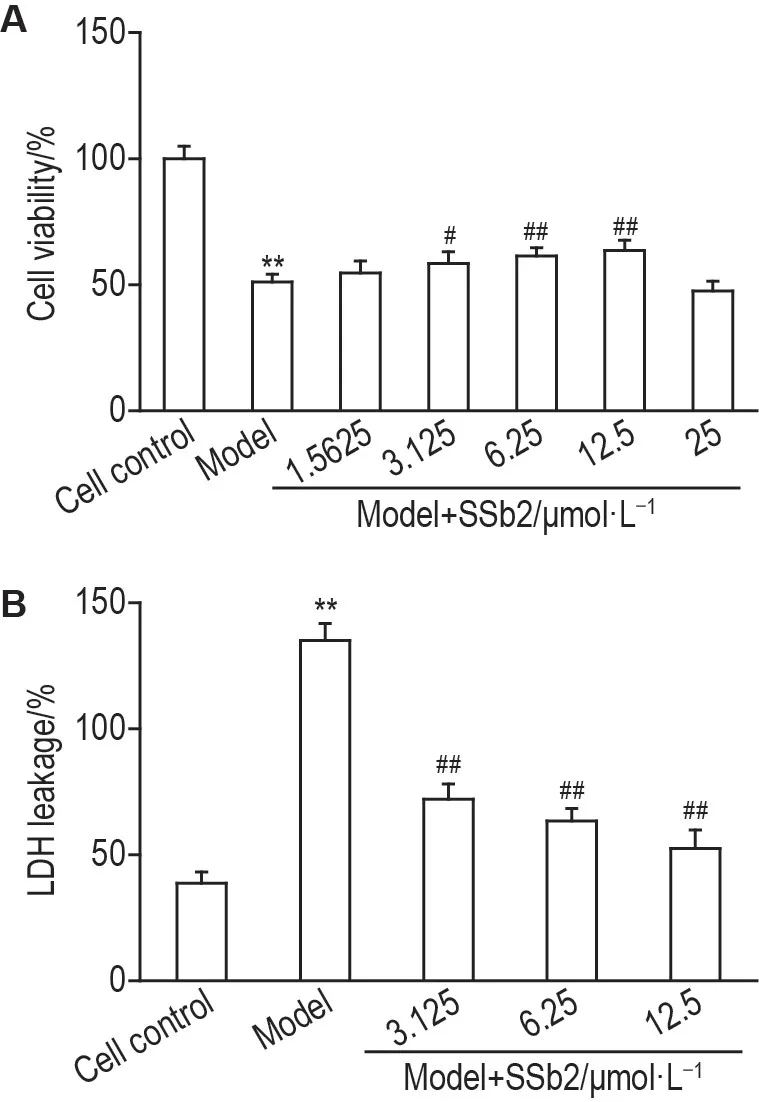
Fig.2 Effects of SSb2 on cell viability(A)and lactate dehydrogenase(LDH)leakage(B)in CORT injured PC12 cells by MTT and LDH assays.PC12 cells were divided into cell control,model and model+SSb2 groups.The cell control group and model group were cultured with RPMI-1640 medium or CORT 400 μmol·L-1 for 24 h,respectively.The model+SSb2 group was co-incubated with CORT 400 μmol·L-1 and SSb2(3.125,6.25 and 12.5 μmol·L-)for 24 h after the pretreatment with SSb2 for 3 h.LDH leakage(%)=A450 nm of cell culture supernatant/(A450 nm of cell culture supernatant+A450 nm of cell lysis solution)×100%.±s,n=6.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with model group.
2.3 SSb2对CORT损伤PC12细胞凋亡的影响
流式细胞检测结果显示(图3),与细胞对照组相比,模型组细胞凋亡率显著升高(P<0.05);与模型组相比,模型+SSb2 12.5 μmol·L-1组细胞凋亡率显著降低(P<0.05)。
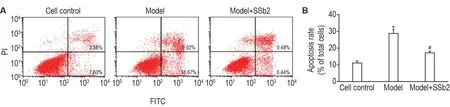
Fig.3 Effects of SSb2 on cell apoptosis in CORT-injured PC12 cells by flow cytometry assay.See Fig.2 for the PC12 cell treatment except that the dose of SSb2 was 12.5 μmol·L-1.±s,n=3.*P<0.05,compared with cell control group;#P<0.05,compared with model group.
2.4 SSb2对CORT损伤PC12细胞代谢的影响
2.4.1 代谢轮廓分析
将细胞对照组、模型组和模型+SSb2 组细胞UPLC-Q-TOF-MS 代谢轮廓数据进行多元统计分析。无监督的PCA 分析结果显示(图4A),在正、负离子模式下,细胞对照组和模型组细胞样本各自聚为一类,且能完全分离,表明在CORT 作用下PC12细胞的代谢轮廓发生改变。模型+SSb2 组与模型组明显分开,并与细胞对照组靠近,表明SSb2 能调节CORT损伤PC12细胞的代谢紊乱。进一步构建有监督的PLS-DA模型验证实验对各组进行代谢轮廓分析,通过参数R2和Q2来检验模型的可靠性和过度拟合程度。PLS-DA 模型验证分析结果表明,正离子模式下的R2=0.816,Q2=0.464,负离子模式下R2=0.935,Q2=0.485,且正、负离子模式下的Q2所在的回归线都交于y 轴的负半轴(图4B),表明模型稳定性良好,不存在过度拟合现象,有良好的预测能力和可靠性。

Fig.4 Multivariate data analysis from ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry(UPLC-Q-TOF-MS).See Fig.3 for the PC12 cell treatment.A:principal component analysis(PCA)score plots;B:validation plot obtained from 200 permutation tests for the partial least squares discrimination analysis(PLS-DA)models.A1 and B1:positive ion mode,A2 and B2:negative ion mode.
2.4.2 差异代谢物分析
为筛选出CORT 损伤PC12细胞前后的差异变量,使用模型组和细胞对照组构建有监督的OPLSDA 模型。并结合OPLS-DA 模型中VIP>1 和独立样本t检验P<0.05 为标准筛选细胞对照组与模型组之间潜在的差异代谢物。进一步根据细胞代谢物的m/z、分子式、保留时间、二级碎片离子并通过在线数据库(HMDB,Massbank 和Pubchem)对细胞对照组与模型组之间显著变化的差异代谢物进行指认,最终获得19 个潜在差异代谢物(表1),其中胆碱、谷氨酰胺、D-蛋氨酸、脯氨酸、乳酸和鸟氨酸的含量增加,谷氨酸、酪氨酸、肌酸、异亮氨酸、L-色氨酸、N-甲基烟酰胺、烟酰胺、3-氨基苯甲酸、柠檬酸、N-乙酰天冬氨酸、2-氧代己酸、苯丙氨酸和葡萄糖的含量减少。与模型组相比,模型+SSb2 组谷氨酸、肌酸、N-乙酰天冬氨酸、L-酪氨酸、柠檬酸、L-异亮氨酸的含量显著减少,乳酸、谷氨酰胺和胆碱的含量显著增加(P<0.05,P<0.01)(图5)。
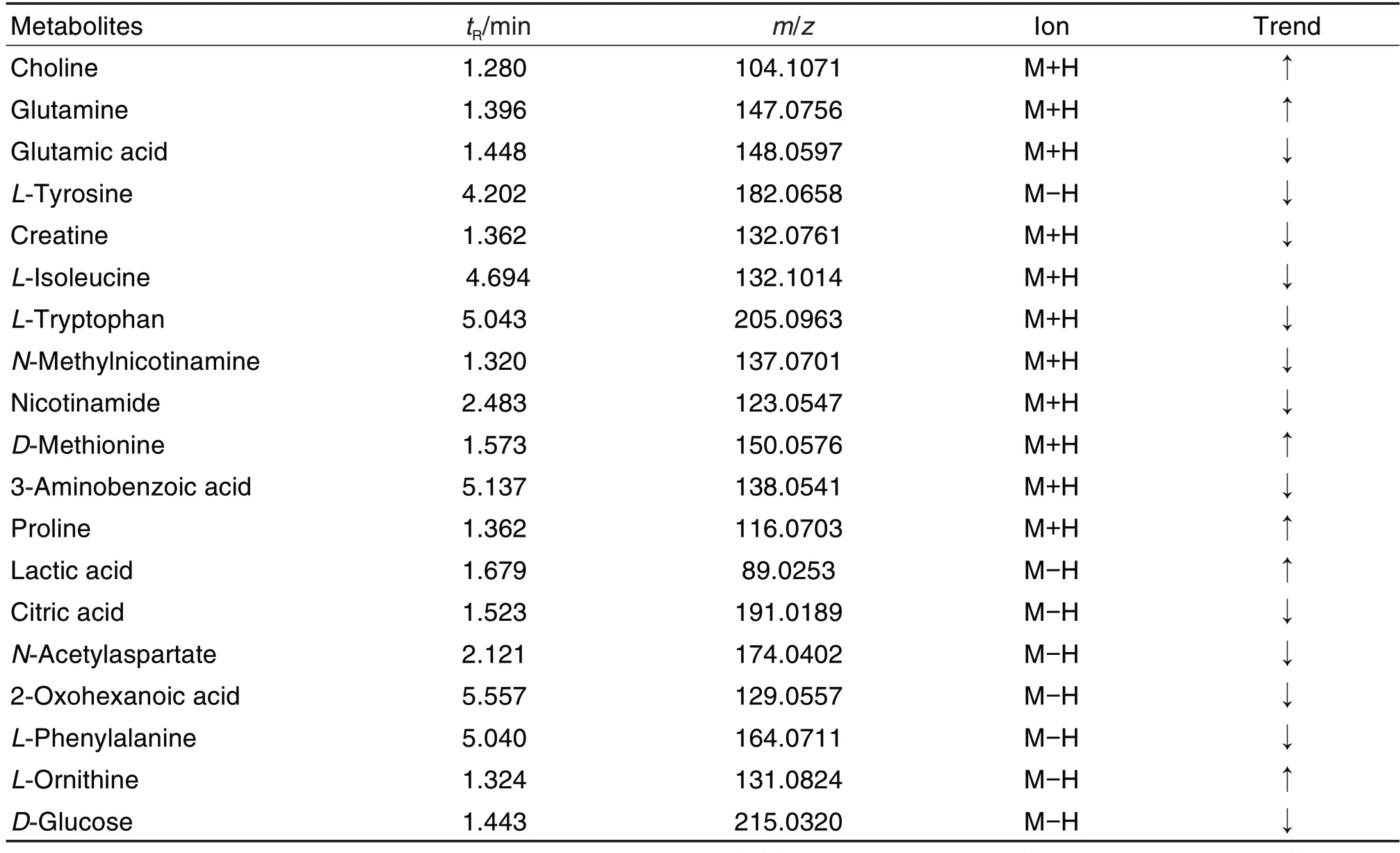
Tab.1 Differential metabolites associated with CORT-injured PC12 cells detected by UPLC-Q-TOF-MS.
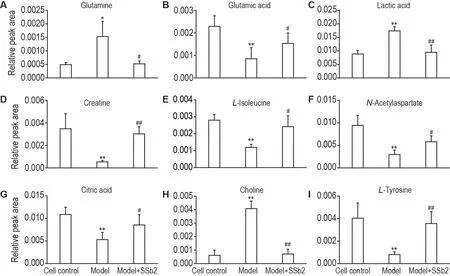
Fig.5 Comparison of relative peak areas of potential biomarkers in UPLC-Q-TOF-MS in PC12 cells.See Fig.3 for the PC12 cell treatment.±s,n=6.*P<0.05,**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with model group.
2.4.3 差异代谢物的代谢通路分析
使用在线软件MetaboAnalyst 4.0 对差异代谢物进行代谢通路分析(图6),代谢通路影响值(pathway impact)由拓扑分析计算得到,影响值和-lgP分别表示代谢通路的重要性和通路富集分析的显著性水平。将影响值大于0.1作为筛选条件,最终筛选出5条代谢通路,包括D-谷氨酰胺和D-谷氨酸代谢;苯丙氨酸、酪氨酸和色氨酸生物合成;丙氨酸、天冬氨酸和谷氨酸代谢;酪氨酸代谢;精氨酸生物合成。
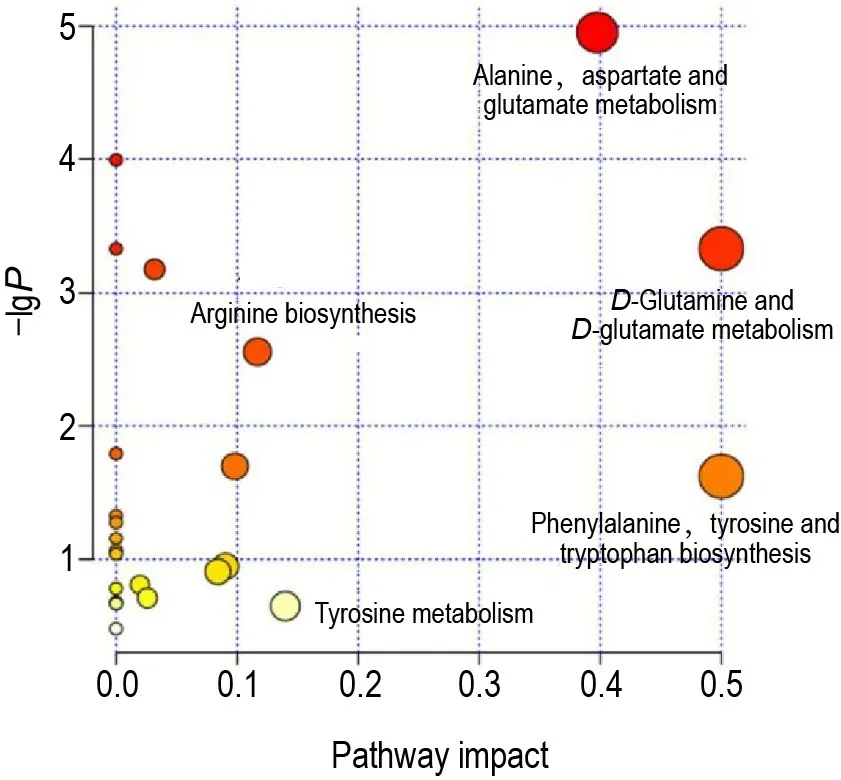
Fig.6 Summary of metabolic pathway analysis of SSb2 on CORT-injured PC12 cells.See Fig.3 for the PC12 cell treatment.Each point represents one metabolic pathway;the size of dot and shades of color represnt correlations with the impact on the metabolic pathway.
2.4.4 SSb2 对CORT 损伤PC12 细胞谷氨酸含量和谷氨酰胺酶活性的影响
比色法检测结果(图7)显示,与细胞对照组相比,模型组谷氨酸含量和谷氨酰胺酶活性显著降低(P<0.01);而与模型组相比,模型+SSb2 组谷氨酸含量(P<0.01)和谷氨酰胺酶活性均显著增加(P<0.05)。
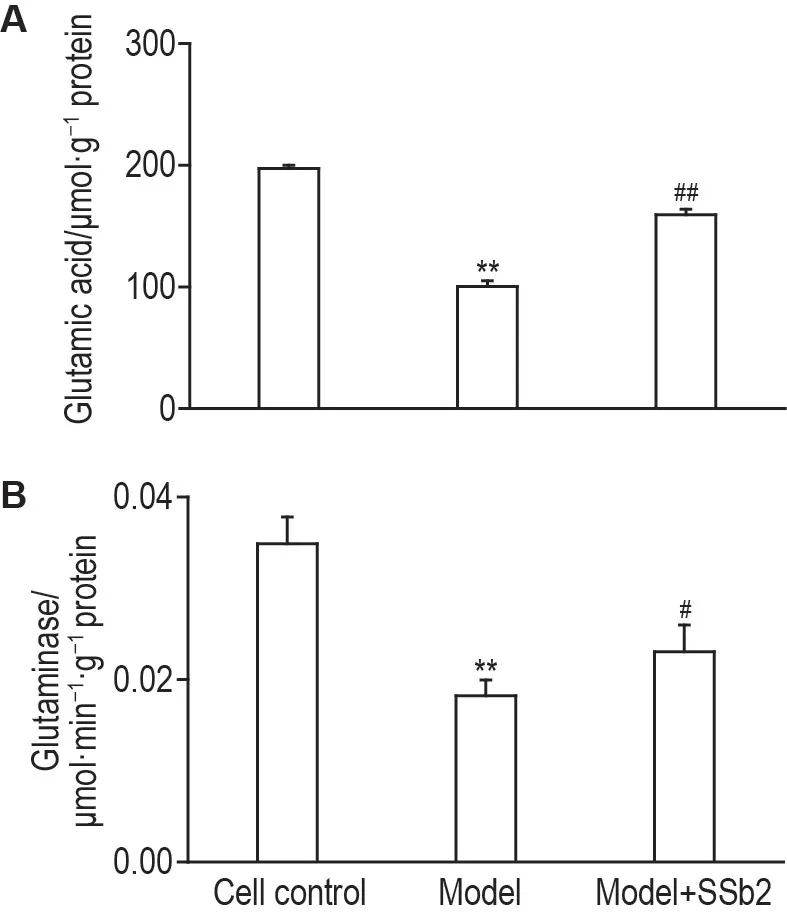
Fig.7 Effects of SSb2 on glutamic acid contents(A)and glutaminase activity(B)in CORT-injured PC12 cells by ultraviolet colorimetry.See Fig.3 for the PC12 cell treatment.±s,n=6.**P<0.01,compared with cell control group;#P<0.05,##P<0.01,compared with model group.
3 讨论
本研究采用PC12 细胞建立CORT 损伤模型,以CORT 400 μmol·L-1作为造模剂量。与模型组相比,模型+SSb2 组细胞存活率显著升高,LDH 释放率显著降低,说明SSb2对CORT诱导的PC12细胞损伤具有保护作用,且SSb2浓度为12.5 μmol·L-1时具有最佳保护作用。细胞代谢组学研究结果表明,SSb2 显著改善CORT 诱导PC12 细胞代谢紊乱,主要涉及5 条代谢通路,分别为D-谷氨酰胺和D-谷氨酸代谢,苯丙氨酸、酪氨酸和色氨酸的生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,酪氨酸代谢,以及精氨酸生物合成。
氨基酸作为神经递质、代谢调节剂和神经调节剂在中枢神经系统中发挥重要作用,与神经递质有关的氨基酸代谢物有色氨酸、酪氨酸、苯丙氨酸、谷氨酸和谷氨酰胺等[30]。谷氨酸是一种分布于中枢神经系统的兴奋性神经递质,与抑郁症的发生密切相关[31]。它由神经元中的谷氨酰胺在磷酸盐活化的谷氨酰胺酶作用下合成,然后释放到突触间隙以发挥生物效应。丙氨酸也可在丙氨酸转移酶的作用下转化为谷氨酸,释放的谷氨酸通过谷氨酸转运体被吸收到星形胶质细胞后,在谷氨酰胺酶的作用下转化为谷氨酰胺,从而完成谷氨酰胺-谷氨酸循环[32]。谷氨酰胺-谷氨酸循环作为胶质细胞-神经元通信的一部分,是维持中枢神经系统谷氨酸稳态的关键[33]。大量动物和临床研究都表明,谷氨酰胺-谷氨酸循环系统参与了抑郁症发生的病理生理学过程[34-36]。有文献报道,阻断正常大鼠星形胶质细胞谷氨酸的摄取后会导致认知障碍和快感缺失等抑郁症状[37];与正常大鼠相比,习得性无助抑郁模型大鼠大脑皮质、纹状体、海马体切片中谷氨酸摄取量明显减少[38],杏仁核中的谷氨酰胺合成酶活性降低[39]。Son 等[40]在慢性束缚应激诱导的抑郁小鼠模型中发现,菠菜提取物后能通过降低模型组小鼠血液CORT 水平和增加前额叶皮质中的谷氨酸水平发挥抗应激和抗抑郁特性。Gruenbaum 等[41]也在综述中提出,抑郁症是一种与谷氨酸系统相关的精神疾病,并建议治疗应指向通过恢复谷氨酰胺-谷氨酸循环系统来稳定谷氨酸系统。本研究代谢组学和紫外比色法检测结果均显示,CORT 处理PC12 细胞后,谷氨酸和谷氨酰胺水平降低;给予SSb2 治疗后,2 种指标均得到升高。提示SSb2 可能通过调节谷氨酸-谷氨酰胺循环的稳态发挥对PC12细胞的神经保护作用。
代谢组学研究结果表明,除D-谷氨酰胺和D-谷氨酸代谢通路外,苯丙氨酸、酪氨酸和色氨酸生物合成代谢通路也与SSb2 的神经保护作用存在联系。在该通路中,酪氨酸含量变化与SSb2 神经保护作用有关。酪氨酸经酪氨酸羟化酶催化可生成3,4 二羟苯丙氨酸(多巴),多巴经多巴脱羧酶催化生成多巴胺(dopamine,DA),而DA 与抑郁症的发生、发展密切相关[42]。因此,作为DA 的重要合成前体,酪氨酸的含量变化也被认为与抑郁症发生相关[43-44]。本研究发现,CORT 作用于PC12 细胞使酪氨酸含量降低,给予SSb2 治疗后酪氨酸水平显著回调,提示SSb2 可能通过调节酪氨酸的生物合成影响神经递质DA的产生,从而发挥对PC12细胞的神经细胞保护作用。
抑郁症的发生发展与能量代谢障碍、线粒体功能障碍密切相关,三羧酸循环和糖酵解是能量代谢的2 个重要途径[45]。研究表明,抑郁症患者脑内葡萄糖代谢显著降低,神经元活动被抑制,产能减少[46]。本研究中模型组细胞乳酸含量显著升高,柠檬酸含量显著降低,表明CORT 损伤的PC12 细胞中三羧酸循环和糖酵解代谢的紊乱。而给与SSb2后三羧酸循环和糖部分代谢产物均恢复至细胞对照组水平。
需要注意的是,本研究采用CORT 诱导PC12细胞损伤模型在体外状态下研究SSb2 的神经保护作用是局限的,后续需要进一步建立抑郁动物模型探究SSb2 的体内药效以及潜在作用机制。另外,本研究用于评价SSb2药效的生化指标为LDH释放率和细胞凋亡率,后续还需进行多细胞模型、多药效指标的综合评估,进一步考察SSb2 的神经保护作用及量效关系。不仅如此,本研究采用的UPLCQ-TOF-MS 非靶向代谢组学技术只限于对差异代谢物进行定性分析,不能准确反映代谢物的含量变化。因此,之后还需使用代谢物标品通过靶向定量分析对SSb2 调节的差异代谢物进行定量,进一步明确SSb2发挥神经保护作用的机制。
猜你喜欢
杂志排行
中国药理学与毒理学杂志的其它文章
- Element profiles of benzo[a]pyrene malignantly transformed 16HBE cells and joint effects of copper with cisplatin or vinorelbine on cell proliferation
- miR-152-3p表达下调降低紫杉醇耐药人卵巢癌细胞A2780T对紫杉醇的耐药性
- 铅对大鼠皮质神经元γ-氨基丁酸A型受体介导电流及GABA能突触传递的抑制作用
- α-鹅膏蕈碱在大鼠体内的毒代动力学与组织分布特征
- 环状RNA在大脑功能调控及药物成瘾中的作用研究进展
- PD-1/PD-L1单抗药物抗肿瘤免疫治疗相关不良反应及超进展疾病研究进展
