环状RNA在大脑功能调控及药物成瘾中的作用研究进展
2024-02-20杨茜茜高菲菲杨潇宇高靖麒张玉向阎春霞
杨茜茜,高菲菲,杨潇宇,高靖麒,张玉向,阎春霞
(1.西安交通大学医学部法医学院,陕西西安 710061;2.国家卫健委法医学重点实验室,陕西西安 710061;3.西安交通大学中国西部科技创新港生物证据研究院,陕西西安 710100)
在人类基因组中约2%的基因编码蛋白质,绝大部分DNA 序列转录产生的是非编码RNA[1]。环状RNA(circular RNA,circRNA)是一类特殊的非编码RNA,由称为反向剪接(back-splicing)的非规范剪接事件产生。20世纪70年代后期,借助电子显微镜的高分辨率成像,circRNA 在真核生物的细胞质中首次被发现[2]。然而,circRNA 在当时被认为是异常剪接产生的副产物,并没有受到关注[3]。近年来,核糖体RNA 耗尽的高通量RNA 测序和高灵敏circRNA 芯片技术的发展为circRNA 的检测提供高效平台。借助circRNA注释的特异性生物信息学算法,研究人员已在哺乳动物中鉴定出丰富的circRNA。circRNA 在中枢神经系统大量表达,尤其在神经元突触中显著富集,且在神经发育和神经发生过程中动态调节[4]。circRNA 在神经系统生理功能及神经精神疾病的发生机制中具有重要的调控作用,如阿尔茨海默病(Alzheimer disease,AD)[5]、药物成瘾[6]和重度抑郁症[7]等。药物成瘾是一种以强迫性觅药和用药为特征的慢性复发性脑疾病,涉及前额叶皮质(prefrontal cortex,PFC)、腹侧被盖区(ventral tegmental area,VTA)和伏隔核(nucleus accumben,NAc)等构成脑奖赏环路的多个相关脑区的神经适应性变化。有研究发现,脑内circRNA参与调控药物成瘾,为研究毒品的作用机制开辟了新思路。本文综述了circRNA的生物发生和功能机制,探讨circRNA 在大脑功能调控和药物成瘾中的潜在作用和研究进展,以期为药物成瘾防治提供新靶点。
1 环状RNA的生物合成和功能
1.1 生物合成
circRNA 在哺乳动物真核转录组中广泛表达,并显示出细胞或组织类型的特异性[8]。根据来源基因组序列,circRNA 通常被分为3 种亚型,分别是外显子circRNA、内含子circRNA 和外显子-内含子circRNA[9]。除胞核基因组外,线粒体基因组也产生一类circRNA,即线粒体circRNA[10]。目前认为,除内含子circRNA 以标准线性剪接方式形成内含子套索外,大部分外显子来源circRNA通过前体mRNA的反向剪接产生[11]。反向剪接是一种特殊形式的剪接方式,主要用于circRNA 环化。在反向剪接过程中,前体mRNA下游外显子3′端受体剪接位点与上游外显子5′端供体剪接位点共价结合形成单链闭合环状结构。因此,circRNA 不具有5′端帽子结构与3′端多聚腺苷酸尾巴,其结构比mRNA分子更稳定并耐受核酸外切酶介导的降解[12]。
研究表明,在反向剪接过程中,内含子配对驱动的环化受顺式作用元件和反式作用因子的共同调节[12]。位于侧翼内含子内的反向重复序列负责顺式调节。反向重复Alu 序列(Alu sequence)可使上、下游外显子的剪接位点彼此靠近并促进反向剪接。侧翼长内含子和丰富的互补序列为反式作用因子提供更多潜在结合位点。反式因子通常可以促进circRNA 表达,多种RNA 结合蛋白如信号转导与RNA 激活家族成员Quaking(QKI)、肉瘤融合蛋白(fused in sarcoma,FUS)和核不均一核糖核蛋白等,可与侧翼内含子中的特定基序结合,在circRNA 生物合成的反式调节中起重要作用。此外,白细胞介素增强子结合因子3的蛋白异构体核因子90 和核因子110 可通过稳定内含子促进circRNA产生[13]。相反,RNA 特异性腺苷脱氨酶及ATP 依赖性RNA 解旋酶A 可抑制内含子序列环化,阻止circRNA 生物合成[14-15]。基因表观遗传修饰也能对circRNA 合成产生直接影响,如敲低DNA 甲基转移酶3B 引起独立于宿主基因线性转录本的circRNA表达改变[16]。此外,circRNA两侧的同源序列、剪接位点和功能元件与circRNA跨物种的高保守性也密切相关[17]。
1.2 功能
circRNA 可通过多种机制发挥功能调控作用。位于细胞质的circRNA 可作为竞争性内源性RNA(competitive endogenous RNA,ceRNA),通过海绵吸附微RNA(microRNA,miRNA)调节下游靶基因的表达[18]。位于细胞核的circRNA 可调节宿主基因或其他基因的转录[19-20]。circRNA 还可作为吸附蛋白质的海绵或诱饵[5,21-23]、酶-底物反应的支架[24-25]或将蛋白质募集到特定位置发挥作用[26],部分circRNA 还具有翻译多肽的潜力[27-28]。总之,circRNA 可在转录、转录后和蛋白质翻译等水平调控基因表达,广泛参与机体重要生命过程。
在神经系统中,部分circRNA 展现出典型的miRNA 海绵活性[18]。小脑变性相关蛋白1 反义转录物(cerebellar degeneration-related protein 1 antisense,CDR1as)是发挥miRNA 分子海绵作用的经典circRNA,具有70 多个miR-7 保守结合位点。在AD 患者的海马中,CDR1as 的下调将释放出游离的miR-7 抑制泛素结合酶E2 A(ubiquitin conjugating enzyme E2 A,UBE2A)表达,从而调节神经组织淀粉样变病理过程[29]。CDR1as/miR-7轴也参与调控帕金森病(Pakinson disease,PD)患者大脑黑质中α-突触核蛋白的积累和聚集[30]。circRNA 与蛋白质相互作用的首次报道是黑腹果蝇编码肌盲样蛋白1(muscle blind-like protein 1,Mbnl1)的反馈调节研究[21]。Mbnl1通过结合circMbl的侧翼内含子可促进circMbl 的生成。过表达的circMbl 导致Mbnl1的线性剪接减少,同时circMbl会与过量的Mbnl1结合,反而抑制Mbnl1参与功能调控。部分神经系统circRNA 还可以作为RNA 结合蛋白的调控因子,如circHomer1a 与一种高度保守的神经元特异性RNA 结合蛋白Hu 抗原D(Hu antigen D,HuD)结合,影响HuD 在额叶皮质神经元突触中的表达[23],circSTAG1 可捕获N6-甲基腺嘌呤(N6-methyladenosine,m6A)去甲基化酶烷基化修复同源物5 并减少其向细胞核的易位[22],circ-Cwc27 与富含嘌呤元件结合蛋白α(purine-rich element binding protein alpha,PUR-α)结合,增加PUR-α 在细胞质中的保留,并抑制其募集到AD 相关基因的启动子[5]。
此外,部分circRNA 与蛋白质的相互作用不会抑制蛋白质功能,而是形成参与基因调控的复合物,如circFOXO3通过与细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)和CDK 抑制剂1A相互作用,通过影响CDK2功能来促进细胞周期进程[24];circACC1 充当AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)全酶的RNA 成分,通过与调节性AMPK 的β 和γ 亚基形成三元复合物来稳定和促进AMPK 酶活性[25]。细胞核内circKcnt2通过将核小体重塑及组蛋白去乙酰化酶复合物募集到碱性亮氨酸拉链转录激活因子的启动子上来抑制其基因表达,从而促进结肠炎消退[26]。研究表明,定位于人类细胞核的circRNA,如源自锚蛋白重复结构域52(ankyrin repeat domain 52,ANKRD52)的ci-ankrd52、源自真核翻译起始因子3亚基J(eukaryotic translation initiation factor 3 subunit J,EIF3J)的circEIF3J 和源自多聚腺苷酸结合蛋白相互作用蛋白2〔poly(A)binding protein interacting protein 2,PAIP2A〕的circPAIP2,主要通过与RNA 聚合酶Ⅱ和U1 小核糖核蛋白复合物相互作用分别调控亲本基因ANKRD52,EIF3J和PAIP2A的转录[19-20]。
最近研究表明,circRNA 除可发挥多种非编码作用外,部分外显子衍生的circRNA 具有内部核糖体进入位点和开放阅读框,可被翻译成蛋白质或多肽[28]。然而,核糖体结合并不总能促使circRNA 自身的翻译,如源自多聚腺苷酸结合蛋白1〔poly(A)binding protein nuclear 1,PABPN1〕的环状RNA circPABPN1[31]可调节其同源线性PABPN1mRNA的翻译而非自身翻译。此外,m6A是RNA修饰最丰富的类型,除具有调节circRNA稳定性的经典功能,还可使用m6A修饰位点的短序列作为内部核糖体进入位点,以不依赖帽的方式驱动circRNA翻译[27]。
2 环状RNA 参与调控大脑生理功能及神经系统疾病
相对于其他组织,circRNA 在脑中显著富集,表现出高丰度、动态表达和时空调节等特征[32],在小脑、海马、PFC 和嗅球区域大量表达[8]。在哺乳动物大脑中,已知约20%蛋白质编码基因可产生circRNA[21]。在人脑背外侧PFC(dorsolateral PFC,dlPFC)中已鉴定出超过9 万种circRNA[33],根据序列同源性和反向剪接位点特征,中枢神经系统circRNA 被认为在哺乳动物间有较高的保守性[8,34]。尽管大多数circRNA 的生物学功能尚未明确,但越来越多的证据表明,circRNA 对于大脑生理功能至关重要,并通过多种机制广泛参与神经精神类疾病的调控。
2.1 参与调控神经发育
Rybak-Wolf 等[8]发现,在人类和小鼠等哺乳动物大脑,以及人源和鼠源的体外神经元中,都有大量高度保守的同源circRNA 表达。部分circRNA在小鼠畸胎瘤细胞P19、人神经母细胞瘤细胞SH-SY5Y 的分化阶段差异表达,表明突触富集的circRNA 在大脑发育和神经元分化中具有重要作用。大脑富含的多种circRNA 与神经递质功能、神经元成熟和突触活动有关,如人类妊娠中期胎儿大脑中circRNA 表达上调与其大脑发育呈现同步变化[35],并且大量circRNA 在突触发生期间表达丰度改变,宿主基因的GO 功能注释结果与突触功能显著相关等。此外,Maass 等[36]鉴定了339个源自大脑皮质的circRNA,其中141个仅在皮质中表达。值得注意的是,这些大脑皮质特异circRNA 通常来自神经疾病相关基因。总之,脑中circRNA 参与神经分化和突触可塑性的动态调节,在脑生理功能调节中发挥重要作用。
2.2 参与大脑衰老进程
大脑衰老机制复杂,受多重因素共同调控,其中随年龄和环境变化的表观遗传被认为是重要的调控环节。研究表明,部分circRNA 在老年小鼠突触体中表达丰度增加,表现出年龄依赖的独特表达模式[37]。衰老是人认知能力下降的主要原因,通常与PFC 和海马中突触可塑性的改变有关[38]。有研究揭示circRNA在衰老进程中显示出年龄偏倚的动态变化,并且衰老相关circRNA 与其宿主mRNA 表达水平存在负性调节[39-40]。例如,circGRIA1 是一种灵长类动物保守的circRNA,由谷氨酸离子型受体α-氨基-3-羟基-5-甲基-4-异恶唑丙酸亚基1(GRIA1)衍生,在老年雄性猕猴的PFC 和海马中表达增加。功能上,circGRIA1 通过顺式作用于宿主基因启动子,负向调节GRIA1 mRNA 和蛋白质表达,从而介导年龄诱导的钙稳态失衡、突触发生减少和突触可塑性缺陷[40]。电压门控钙通道在维持钙稳态和神经元细胞信号传递中有重要作用。circ-CACNA1E 和circCACNA2D1 是年龄相关钙通道基因衍生的circRNA,在衰老恒河猴大脑中显著增加,并且与宿主基因线性mRNA 表达呈负相关。敲低circCACNA2D1 和circCACNA1E 可逆转衰老导致的钙通道基因表达水平下降。因此,circRNA 表达变化可能对衰老过程中大脑功能失调极为重要。随着越来越多的神经系统功能性circRNA 被鉴定,进一步证实circRNA 的时空动态表达对于大脑生理稳态的维持至关重要。
2.3 参与调控神经退行性疾病
大脑中circRNA表达失调被认为在神经退行性疾病的发病机制中发挥重要作用。CDR1as在健康的人脑中表达量丰富,在AD 患者的大脑中表达量显著下调[41]。CDR1as 除可通过miR-7/UBE2A 调控轴介导β-淀粉样蛋白的水解外[29],还可抑制NF-κB的翻译并诱导其细胞质定位,以下调泛素C 端水解酶L1 的方式促进β-淀粉样前体蛋白(β-amyloid precursor protein,APP)和APP 裂解酶1 的降解[42]。此外,Mo 等[43]研究表明,源自APP基因β-淀粉样蛋白编码区的circRNA通过调节糖原合酶激酶3β 的表达促使tau 蛋白磷酸化,并促进其聚集成神经纤维缠结,在AD 发病机制中发挥重要作用。PD 是发病率仅次于AD 的第二大神经退行性疾病。Jia 等[44]发现,PD 模型小鼠多脑区circRNA 表达谱显著改变。源自盘状大同源相关蛋白4(discs large homologous affinity protein 4,DLGAP4)的circDLGAP4 在PD 患者大脑中显著下调,circDLGAP4 可通过miR-134-5p/CREB 轴激活下游靶基因,发挥神经保护作用[45]。源自溶质载体家族8 成员a1(solute carrier family 8 member a1,SLC8A1)的circSLC8A1 在PD 患者大脑黑质中表达上调,circSLC8A1 可通过miR-128/AGO2 轴在氧化应激中发挥作用,参与调节PD 发病机制[46]。肌萎缩性侧索硬化症可导致脑干和脊髓选择性运动神经元(motor neurons,MN)的丧失。D′ambra 等[47]在MN 中检测到源自肝癌衍生生长因子相关蛋白3(hepatoma-derived growth factor-related protein 3,HDGFRP3)的circHDGFRP3。研究结果显示,在携带突变型FUS的MN 中,circHDGFRP3 沿神经突的运输被阻滞在FUS 聚集体中[47],丰富肌萎缩性侧索硬化症的发病机制假说。总之,多种circRNA 通过调节疾病相关肽的产生和降解、神经自噬、神经炎症和氧化应激等生物功能,在神经退行性疾病的发生发展中发挥重要作用,为疾病提供诊疗靶点。
2.4 参与调控精神疾病
非编码RNA 在精神类疾病的发病机制中起重要作用,包括重度抑郁症、双相情感障碍(bipolar disorder,BD)和精神分裂症(schizophrenia,SCZ)等[48]。Mahmoudi 等[33]对SCZ 患者尸检脑组织的RNA 测序分析显示,circRNA 表达在dlPFC 中具有多样性,但SCZ 患者的表达谱复杂程度降低,circRNA 总体呈现下调趋势。全基因组关联分析(genome-wide association studies,GWAS)通过在人类基因组范围内筛选与精神类疾病显著相关的单核苷酸多态性(single nucleotide polymorphism,SNP)位点,推动了对精神类疾病的病因关联机制的研究。Liu等[49]开展的关联研究结果显示,将dlPFC中circRNA 的表达水平与SNP 相结合,可鉴定出丰富的受遗传变异调节的circRNA数量性状位点(circRNA quantitative trait loci,circQTL)。研究发现,circQTL SNP 可通过改变规范剪接位点或反向互补序列的匹配来调控circRNA 的产生。此外,circQTL SNP 显著富集与各种复杂疾病相关的GWAS 变异,其中circQTL SNP 的一个子集与精神分裂症的GWAS 信号高度相关。起源自荷马支架蛋白1(homer scaffold protein 1,HOMER1)的circHomer1a是一种显著富集于神经元并在物种间进化保守的circRNA。circHomer1a 在健康人额叶皮质中大量表达,而在SCZ 和BD 患者额叶皮质中显著下调,且其表达变化与SCZ 的发病年龄呈正相关。进一步分析表明,circHomer1a 通过与神经元RNA 结合蛋白HuD 相互作用可调节突触可塑性以及和重度抑郁症等精神疾病相关基因mRNA 异构体的表达。BD 或SCZ 患者临床上表现出与眶额皮质(orbitofrontal cortex,OFC)功能密切相关的认知功能障碍,而敲低OFC 脑区circHomer1a 可损害OFC 介导的对认知和行为灵活性的调节[23]。自闭症谱系障碍(autism spectrum disorder,ASD)患者大脑内也存在疾病相关的基因表达失调。一项关于ASD 的circRNA 表达谱研究揭示,源自腺嘌呤-胸腺嘧啶丰富结构域1A(AT-rich interactive domain 1A,ARID1A)的circARID1A 在患者尸检大脑皮质中显著上调。circARID1A 可通过竞争性结合miR-204-3p 间接调节ASD 风险基因的表达,从而影响记忆巩固和加强的动态过程[50]。此外,采用慢性不可预见性应激诱导小鼠抑郁模型研究显示,小鼠海马内过表达源自基质抗原1 的circRNA(stromal antigen 1 circRNA,circSTAG1)可显著改善小鼠抑郁样行为,其机制为过表达circSTAG1 可捕获胞浆内m6A 去甲基化酶AlkB 同源物5,抑制其胞核转运,由此引发胞核内脂肪酸酰胺水解酶的甲基化修饰,脂肪酸酰胺水解酶mRNA 上的m6A 修饰增多并诱导其降解,从而缓解小鼠抑郁样行为[22]。值得注意的是,外周血circRNA 表达异常也参与中枢神经系统疾病的调控。研究发现,源自迪格弗-梅尔基奥尔-克劳森综合征蛋白(Dymeclin,DYM)编码基因的circRNA(circDYM)在重度抑郁症患者血液中表达显著降低,过表达circDYM可抑制miR-9活性,导致下游靶标同源E6-AP 羧基末端结构域E3 泛素蛋白连接酶1 表达增加,促进热休克蛋白90 泛素化,导致小胶质细胞活化减少,从而改善抑郁样行为[7]。以上研究表明,circRNA 可作为精神类疾病潜在的分子标记和治疗靶点。
3 环状RNA在药物成瘾中的作用
药物成瘾是由药物滥用所引起的慢性、复发性脑疾病,主要表现为不计后果地觅药、强迫性用药及撤药后出现强烈的戒断症状,导致长久的躯体和精神依赖[51]。近来研究表明,长期药物滥用诱导的突触可塑性改变导致牢固的病理性成瘾记忆和与成瘾相关的持久行为异常[52]。大脑中富集的circRNA 对成瘾过程中神经适应性改变有重要调节作用。尽管circRNA在神经退行性疾病中被广泛研究,但其在药物成瘾中的生物学功能最近才被部分揭示(表1)。
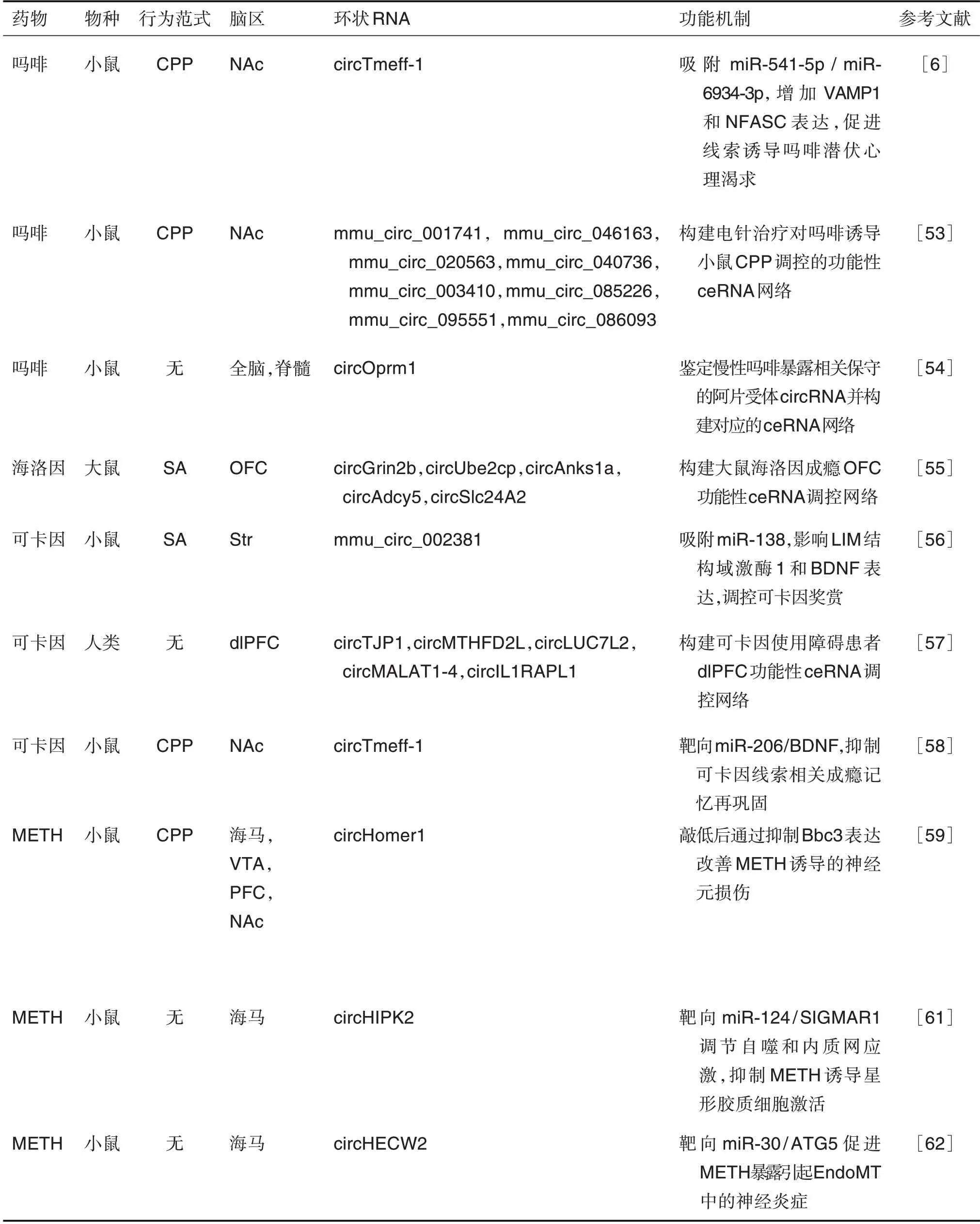
表1 环状RNA在药物成瘾中的调控作用
3.1 环状RNA与阿片类药物成瘾
采用条件性位置偏爱(conditioned place pref-erence,CPP)范式建立环境线索相关奖赏记忆模型,Zhang 等[53]首次检测电针治疗对吗啡依赖小鼠NAc 中circRNA 表达谱的改变,并预测了关键差异circRNA 的潜在结合miRNA。Irie 等[54]在啮齿动物和人类的大脑、脊髓和神经母细胞瘤细胞中均检测到来源于μ 阿片受体基因Oprm1的circRNA(circOprm1)。在小鼠慢性吗啡暴露后,circOprm1表达水平显著增加。基因序列分析表明,circOprm1具有潜在的miRNA结合位点,可通过竞争性内源性RNA 网络发挥调控作用。此外,其他阿片受体基因,如δ 阿片受体基因Oprd1,κ 阿片受体基因Oprk1和阿片类药物相关伤害感受素受体基因Oprl1均产生类似的circRNA。Floris 等[55]从大鼠的OFC 中鉴定出海洛因相关的差异表达circRNA,其中circGrin2b,circUbe2cp,circAnks1a,circAdcy5和circSlc24A2 差异最为显著,且不受其他精神兴奋剂的调节,表现出对阿片类药物的特异性反应。GO 分析和KEGG 通路富集分析表明,失调circRNA 的宿主基因主要富集到突触可塑性相关通路,如内吞循环、长时程增强和谷氨酸能突触传递等。Yu 等[6]发现,circTmeff-1 在吗啡诱导CPP 戒断后的NAc 核心中高表达,且与条件线索诱导的吗啡潜伏心理渴求密切相关。在吗啡长期戒断后,circTmeff-1可作为miRNA的分子海绵,吸附NAc核心中的miR-541-5p和miR-6934-3p,促进下游靶分子囊泡相关膜蛋白1(vesicle associated membrane protein 1,VAMP1)和神经成束蛋白(neurofascin,NFASC)的表达,从而促进线索诱导的吗啡潜伏心理渴求。
3.2 环状RNA与可卡因成瘾
Bu 等[56]利用circRNA 芯片研究可卡因自身给药小鼠纹状体circRNA 表达谱的变化,结果显示,mmu_circRNA_002381 和mmu_circRNA_003834在给药组中显著上调,而mmu_circRNA_002520显著下调。预测结合miRNA 进一步揭示,上述circRNA 均包含丰富的miRNA 应答元件,能够与多种突触可塑性和成瘾相关的miRNA 结合,其中mmu_circRNA_002381 包含10 个miR-138 的miRNA应答元件,功能验证发现mmu_circRNA_002381参与调节LIM 结构域激酶1 和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的转录,有助于可卡因诱导的神经可塑性的调节。Chen等[57]探究circRNA 在可卡因使用障碍患者dlPFC中的功能作用和调节机制。富集分析表明,可卡因诱导的差异circRNA主要在细胞反应、受体信号、蛋白修饰和轴突发生等相关通路富集。circRNAmiRNA-hub 基因调控子网络进一步揭示了关键差异表达circRNA 的ceRNA 调控机制,为可卡因使用障碍的发病机制提供新见解。Shen 等[58]使用可卡因诱导的CPP 范式建立环境线索相关记忆再巩固小鼠模型,可卡因诱导的记忆提取显著增加NAc核心circTmeff-1 水平;进一步实验证明,敲低circTmeff-1 通过释放miR-206,抑制下游靶分子BDNF的表达,从而抑制可卡因相关记忆的再巩固。
3.3 环状RNA与甲基苯丙胺成瘾
Li 等[25]揭示甲基苯丙胺(methamphetamine,METH)处理初级皮质神经元后的差异circRNA 表达谱,并在METH 诱导的成瘾小鼠模型中筛选验证了circHomer1 和circTlk1,首次揭示circRNA 在METH 诱导的神经元损伤和成瘾中的作用。circHomer1 的宿主基因Homer1是中枢神经系统即刻早期基因编码的突触后致密物主要支架蛋白,广泛表达于中枢神经系统。在METH 依赖小鼠脑内,circHomer1 表达显著上调,且与CPP 分数密切相关,敲低circHomer1 可下调靶基因Bcl-2 绑定组件3(Bcl-2-binding component 3,Bbc3)表达,减轻METH 诱导的神经元损伤[59]。此外,Boroujeni等[60]发现,暴露于METH 会影响大鼠运动协调性并显著改变小脑的circRNA 表达谱,基于宿主基因的功能分析揭示了差异circRNA 参与METH 诱导的神经毒性和运动活动缺陷。此外,Huang 等[61]研究发现源自同源结构域相互作用蛋白激酶2 的circHIPK2 与METH 诱导的星形胶质细胞活化密切相关。实验证明circHIPK2 通过竞争性结合miR-124促进下游靶标Sigma非阿片细胞内受体1(sigma non-opioid intracellular receptor 1,SIGMAR1)的表达。特异性敲低海马circHIPK2,通过靶向miR-124/SIGMAR1 轴调节自噬和内质网应激,明显抑制METH 诱导的星形胶质细胞活化,为药物滥用背景下神经炎症的治疗提供潜在靶点。在自噬相关蛋白5(autophagy related 5,ATG5)的研究中发现,circHECW2 与miR-30 的结合导致ATG5 的表达增加,以非自噬的作用途径促进内皮-间充质转化中的神经炎症[62]。上述结果表明,circRNA 参与调控精神兴奋剂诱导的神经病理学改变和介导成瘾行为表型。
4 结语
随着高通量测序技术的迅速发展和生物信息学分析的不断创新,circRNA被揭示可通过ceRNA、结合蛋白质和翻译多肽等多种功能机制广泛参与神经系统疾病的调控。circRNA 的组织特异性、时空特异性、疾病特异性、及相对稳定性等特征,使其有望成为药物成瘾等神经精神类疾病诊疗的重要靶点。未来的研究方向包括对circRNA在各类疾病中的特殊定位、运输、在活细胞中的降解以及在单细胞水平上的时空表达模式进行探究。在治疗应用方面,随着体外环化工艺的不断提升,circRNA 作为核酸药物开发领域的新兴分子,有望克服mRNA 面临的诸多挑战,实现基因治疗的精准递送和特异调控。
目前,药物成瘾领域的circRNA 研究主要集中于不同成瘾性药物诱导的脑区差异表达谱分型,针对调控成瘾机制的深入研究较少。借助于日趋成熟的体内外circRNA 表达调节手段,建立动物模型以探究circRNA 在成瘾行为中的具体调控作用,并开发基于circRNA的治疗策略是未来研究的重要方向。通过深入研究药物成瘾诱导的circRNA失调如何介导强迫性觅药和戒断后复吸等行为,可以更好地为药物成瘾的诊疗提供新思路和新方法。
