淫羊藿素联合吗啡对骨癌痛小鼠的镇痛效应研究*
2024-02-20杨雪伟袁贤达孙琳琳邢国刚
杨雪伟 袁贤达 田 越 孙琳琳 蔡 捷 孟 坤△ 邢国刚△
(1 北京大学神经科学研究所,北京大学基础医学院神经生物学系,教育部/卫健委神经科学重点实验室,北京100191;2 北京盛诺基医药科技股份有限公司,北京 102206;3 北京大学第一医院内分泌科,北京 100034)
骨癌痛(bone cancer pain, BCP)是一种严重的慢性疼痛,通常由原发性骨癌或骨转移所引起[1]。当原发肿瘤发展到中晚期时,癌细胞侵袭骨组织并破坏骨结构,会引发剧烈的骨癌痛[2]。许多肿瘤晚期会出现骨转移,特别是乳腺癌和前列腺癌[3],骨转移导致的骨骼弱化,进而引发严重的骨癌痛[4]。约80%的癌症病人在疾病晚期会经历癌痛[5],骨癌痛是晚期癌症病人最常见的慢性疼痛类型之一[6],严重影响病人的日常功能和生活质量[7]。正确的癌痛治疗可以显著提高病人对治疗的耐受性,改善生活质量[8]。目前研究表明,骨癌痛的机制包括伤害性和神经性成分,涉及外周、中枢和神经胶质调节以及破骨细胞的过度活化[9]。然而,癌痛的机制和疼痛信息的处理仍然不完全清楚,因此这是一个尚未满足的医疗需求[10]。此外,超过一半的转移性癌痛病人报告目前可用的药物治疗不足以充分缓解疼痛[11]。另外,骨癌痛通常使用阿片类药物治疗,虽然在急性疼痛的缓解上有效,但长期使用却伴随着一系列的不良反应,如便秘、呼吸抑制、耐受性和成瘾[12]。因此,开发新的治疗药物,既可以治疗癌症又可以控制癌痛,具有巨大的社会意义,是当前亟待解决的重大问题。
淫羊藿素(icaritin, ICT)是一种异戊烯基黄酮类化合物,是中药小檗科植物淫羊藿的主要活性单体成分,具有多种药理和生物学活性[13]。近年来,淫羊藿素因其抗肿瘤作用而备受关注,包括抑制胶质母细胞瘤、肝癌、肾癌、肺癌、卵巢癌和骨肉瘤等[14,15]。其具体作用机制包括激活TRAIL 或Fas-caspase-3/8凋亡途径进而促进细胞凋亡[16],以及抑制晚期肝癌细胞中的IL-6/JAK/STAT3 通路,增强效应T 细胞功能,从而发挥抗肿瘤作用[17]。最近,淫羊藿素已被中国国家药品监督管理局批准用于晚期肝癌的治疗[18]。此外,研究表明淫羊藿素可以通过多种途径和靶点调节炎症细胞因子的产生,干扰免疫细胞功能,发挥强大的抗炎和免疫调节功能[19]。淫羊藿素还具有较强的神经保护作用、骨保护作用和抗炎作用[20]。然而,关于淫羊藿素是否对骨癌痛具有镇痛作用尚未见报道。本研究旨在通过构建BCP 小鼠模型,探究淫羊藿素对BCP 小鼠的镇痛效应,以及淫羊藿素与吗啡联合用药的镇痛效应。通过测定BCP小鼠的机械痛阈、冷痛潜伏期以及自发痛阈,明确淫羊藿素以及淫羊藿素与吗啡联合用药对BCP 小鼠的镇痛效应,为淫羊藿素用于临床治疗癌痛的应用提供重要指导。
方 法
1.实验动物
本实验使用8 周龄的雄性C57BL/6J 小鼠。实验动物由北京大学医学部实验动物科学部提供(动物许可证号:SYXK(京)2021-0064)。在SPF 条件下饲养,饲养环境保持在25 ℃室温,50%~60%的湿度,12 小时的光照/黑暗循环下,让小鼠自由进食和饮水。所有动物实验均按照国际疼痛学会的指导方针进行[21],并经北京大学医学部伦理委员会批准(动物伦理审批号:BCJB0019)。在整个实验过程中,尽量减少动物的不适和使用量。
2.主要试剂与仪器
淫羊藿素(由北京珅诺基医药科技股份有限公司提供)、吗啡、胎牛血清、抗生素混合液、DMEM 培养基、磷酸盐缓冲液(phosphate buffered saline, PBS)、超净台、恒温细胞孵育箱、细胞计数仪、vonFrey 机械测痛仪、冷痛测痛仪、自发痛测痛仪。
3.细胞培养与细胞悬液制备
小鼠路易斯肺癌 (lewis lung carcinoma, LLC) 细胞系由国家生物医学实验细胞资源库北京协和细胞资源中心提供。本实验首先从液氮中取出LLC 细胞,在37℃水浴锅中快速融化后,在37℃,5% CO2,含有10%胎牛血清和1%抗生素的DMEM 培养基中培养。将培养成熟的LLC 细胞用PBS 洗涤3 次后,用0.25%胰蛋白酶消化3 min,随后使用含有胎牛血清的DMEM 终止消化,并使用1000 转离心3 分钟后用PBS 重悬。将重悬的细胞悬液用细胞计数仪进行计数,并制备成浓度为4×106个/ml 的LLC 细胞悬液。
4.建立BCP 小鼠模型
采用Wang 等[22]报道的方法。首先,使用3 %异氟醚麻醉小鼠,暴露膝关节。用微量注射器将10 μl LLC 细胞悬液(4×106个/ml)缓慢注入小鼠左侧股骨远端骨髓腔内,对照组仅注射等量PBS,注射后停针2 min。任何在肿瘤细胞接种后14 天表现出运动缺陷或缺乏痛觉过敏反应的小鼠以及在实验中死亡的小鼠均被排除在研究之外。
5.实验分组与流程
(1)将48 只小鼠按随机数字表法分为Naïve组 (n= 16)、PBS 组 (n= 16)和BCP 组 (n= 16)。每组小鼠在接种LLC 细胞前(第0 天),以及在接种LLC 细胞后第3、7、10、14 和21 天,分别测定自发抬足次数和抬足保护时间、冷刺激缩足潜伏期以及vonFrey 机械痛阈。
(2)将80 只小鼠制作成BCP 模型,按随机数字表法分为7 组,在BCP 造模后第7 至14 天进行淫羊藿素给药,每日2 次(间隔12 h)共14 次,根据给药剂量不同,7 组分别为Vehicle 组 (n= 11)、淫羊藿素 25 mg/kg 组 (n= 12)、淫羊藿素 50 mg/kg组 (n= 12)、淫羊藿素 100 mg/kg 组 (n= 11)、淫羊藿素 200 mg/kg 组 (n= 11)、淫羊藿素 400 mg/kg 组(n= 11)、淫羊藿素 800 mg/kg 组 (n= 12)。每组小鼠在接种LLC 细胞前(第0 天),在接种LLC 细胞后第3、7、10、14、15、16、18 和21 天,以及在停药后(给药第7 天,即BCP 造模后第14 天)第0 h、3 h、6 h、12 h、24 h 分别测定自发抬足次数和抬足保护时间、冷刺激缩足潜伏期以及vonFrey 机械痛阈。
(3)将72 只小鼠制作成BCP 模型,按随机数字表法分为8 组,在BCP 造模后第7 至14 天进行淫羊藿素和吗啡联合用药,每日2 次(间隔12 h)共14 次,根据给药剂量不同,8 组分别为Vehicle组 (n= 9)、吗啡10 mg/kg 组 (n= 9)、吗啡20 mg/kg组(n= 9)、淫羊藿素 200 mg/kg 组 (n= 9)、淫羊藿素 200 mg/kg +吗啡1 mg/kg 组(n= 9)、淫羊藿素 200 mg/kg +吗啡2 mg/kg 组 (n= 9)、淫羊藿素200 mg/kg + 吗啡4 mg/kg 组 (n= 9)、淫羊藿素200 mg/kg +吗啡8 mg/kg 组 (n= 9)。每组小鼠在接种LLC 细胞前(第0 天),以及在接种LLC 细胞后第3、7、10、14、15、16、18 和21 天,分别测定自发抬足次数和抬足保护时间、冷刺激缩足潜伏期以及vonFrey 机械痛阈。
(4)将84 只小鼠制作成BCP 模型,按随机数字表法分为7 组,在BCP 造模后第7 至14 天进行淫羊藿素和吗啡联合给药,每日2 次(间隔12 h)共14 次,根据给药剂量不同,7 组分别为Vehicle组(n= 12)、吗啡10 mg/kg 组 (n= 12)、淫羊藿素 100 mg/kg (n= 12)、淫羊藿素 100 mg/kg +吗啡1 mg/kg 组 (n= 12)、淫羊藿素 100 mg/kg +吗啡2 mg/kg 组 (n= 12)、淫羊藿素 100 mg/kg +吗啡4 mg/kg 组 (n= 12)、淫羊藿素 100 mg/kg +吗啡8 mg/kg 组 (n= 12)。每组小鼠在接种 LLC 细胞前(第0 天),以及在接种LLC 细胞后第3、7、10、14、15、16、18 和21 天,分别测定自发抬足次数和抬足保护时间、冷刺激缩足潜伏期以及vonFrey 机械痛阈。
6.药物配置与给药
淫羊藿素的配置与给药:分别对每只小鼠称量体重,并根据体重计算每次给药剂量,称量相应剂量淫羊藿素粉末,加入对应体积的玉米油作为溶剂,使用震荡混匀仪震荡20 min 后静置,用玉米油定容至固定体积后再震荡10 min,随后按照每次给药剂量进行分装后放4℃保存。给药方式为灌胃给药,对照小鼠灌胃给予对应体积的玉米油。
吗啡配置与给药:分别对每只小鼠称量体重,并计算每次给药剂量,称量相应剂量吗啡粉末,加入对应体积的PBS 作为溶剂,使用震荡混匀仪震荡5 min 后用PBS 定容至固定体积,随后按照每次给药剂量进行分装后放4 ℃保存。给药方式为皮下注射,对照组小鼠皮下注射对应体积的PBS。
7.痛行为学检测
在安静环境下,将小鼠置于底部为玻璃平台的塑料隔室中,适应 30 min 后开始测量。随后在不给予任何刺激的情况下,记录10 min 内小鼠左足自发的抬足、舔足、甩足或者跛行的次数以及持续时间作为自发痛行为的判断指征。
冷刺激行为学装置用于测定冷痛潜伏期。在安静环境下,将小鼠置于底部为玻璃平台的塑料隔室中,适应 30 min 后开始测量。将装有干冰仪器置于玻璃平台下方,垂直接触小鼠左后爪下方玻璃。干冰接触的最长时间设置为20 s,以防止不必要的组织损伤。对冷刺激的突然抬足、舔足、甩足被认为是阳性反应,每只小鼠进行3 次测量,每次测量间隔至少10 min,记录产生阳性反应所需的时间,3次结果的平均值被记录为冷痛潜伏期。
vonFrey 机械测痛仪用于测定机械痛阈。在安静环境下,将小鼠置于底部为铁丝网格的塑料隔室中,适应30 min 后开始测量。vonFrey 纤维丝(0.02、0.04、0.07、0.16、0.4、0.6、1.0 和2.0 g)垂直施压于小鼠左后爪正中央并保持5 s。对vonFrey 纤维丝刺激的突然缩抬足、舔足、甩足被认为是阳性反应,每个克数的细丝均测量5 次,每次测量间隔至少10 min,产生3 次阳性反应所需的最小克数被记录为机械痛阈。
在给药期间,痛行为学检测统一在当天第1 次给药后3 h 开始。在停药期间,痛行为学检测时间点与给药期间保持一致。
8.统计学分析
通过GraphPad Prism 9.0 软件进行数据的统计分析并绘图,数据分析结果使用均数±标准误(±SEM)表示。行为学数据采用双因素重复测量方差分析(two-way repeated measures ANOVA)。P< 0.05 认为差异具有统计学意义。
结 果
1.BCP 小鼠模型的建立及评价
为了评价BCP 小鼠模型的建立是否成功,分别在造模后第0、3、7、10、14、21 天进行疼痛行为学测定。行为学结果显示,与Naïve 组及PBS 组相比,BCP 组小鼠在LLC 细胞接种后7~14 天,小鼠左侧(荷瘤侧)后爪对机械刺激缩足反射阈值(mechanical withdrawal threshold, MWT)(见图1A)以及对冷痛刺激的缩足潜伏期 (paw withdrawal latency,PWL)(见图1B)均降低;而同侧后爪的自发缩足次数和抬足保护时间增加(见图1C, 1D),提示小鼠左侧后爪出现了明显的痛觉过敏,并且在行为学检测至造模后第21 天,小鼠痛觉过敏仍持续存在。这些结果表明BCP 小鼠模型建立成功。
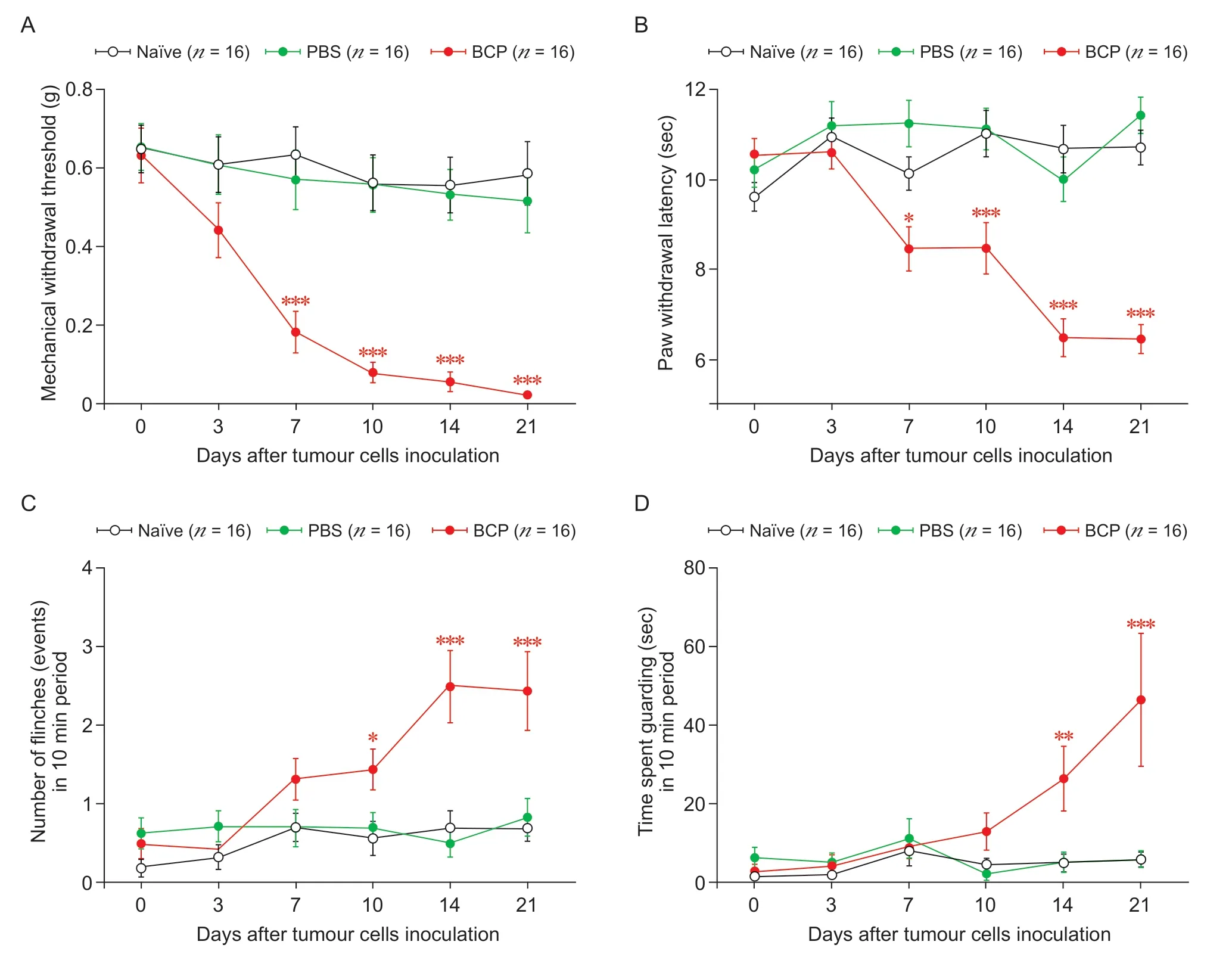
图1 BCP 小鼠模型的建立及评价Fig.1 Establishment and assessment of a BCP mouse model
2.淫羊藿素对BCP 小鼠的镇痛效应及EC50 测定
为了探究淫羊藿素对BCP 小鼠的镇痛效应,给予不同剂量的淫羊藿素,检测其对BCP 小鼠的镇痛效应,并绘制时间-剂量效应曲线。结果显示,与Vehicle 组相比,从给药后第3 天开始(即BCP造模后第10 天),给予淫羊藿素剂量在50 mg/kg以上的BCP 模型组小鼠,其左侧(荷瘤侧)后爪对MWT 以及对冷痛刺激的PWL 均明显增加(见图2A, 2B)。与Vehicle 组相比,从给药后第7 天开始(即BCP 造模后第14 天),给予淫羊藿素剂量在50 mg/kg 以上的BCP 模型组小鼠,其同侧后爪的自发抬足次数以及抬足保护时间均明显减少(见图2C, 2D)。这些结果表明,淫羊藿素对BCP 小鼠具有明显的镇痛效应。
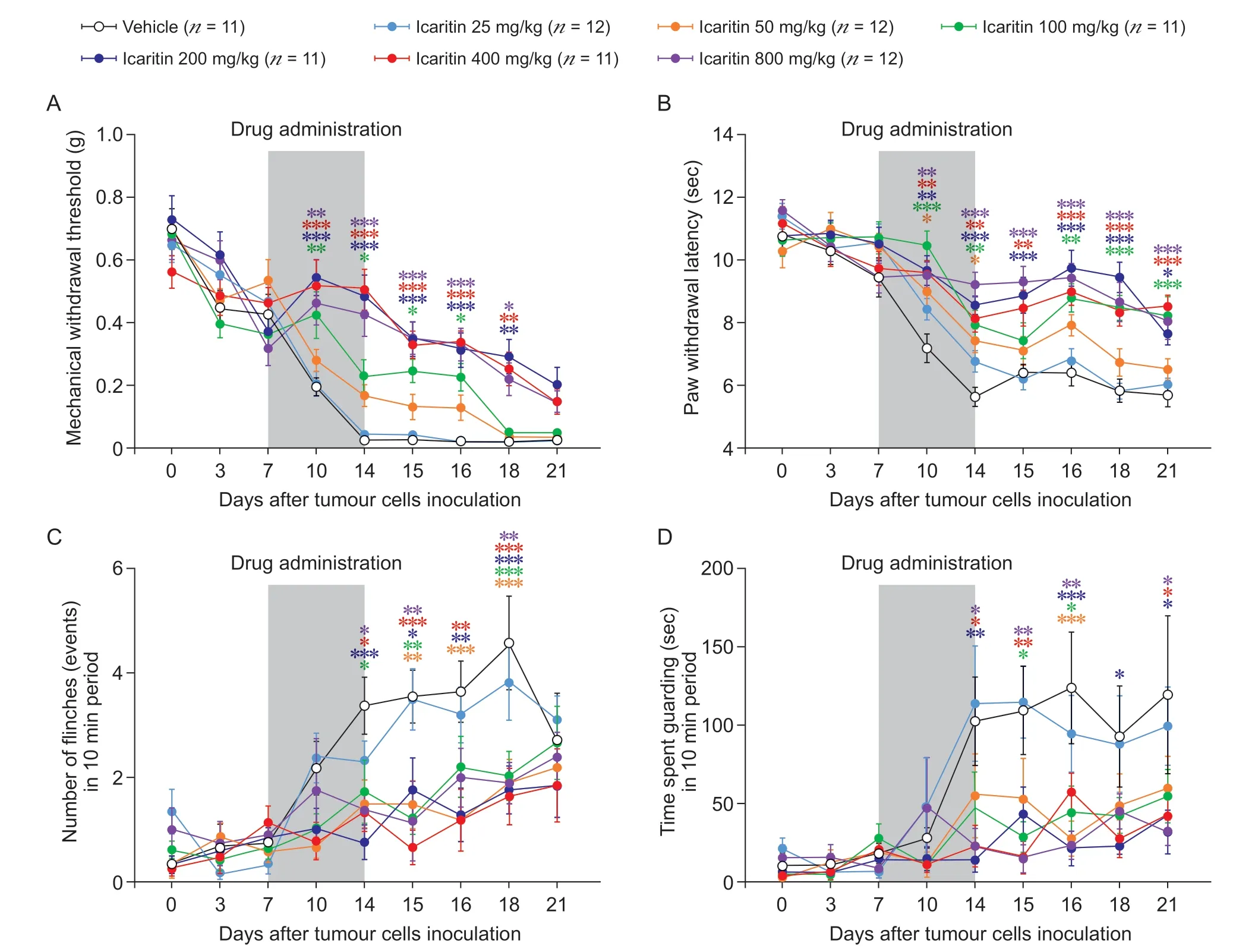
图2 淫羊藿素对BCP 小鼠的镇痛效应Fig.2 The analgesic effect of icaritin on BCP mice
为了探究在停药后24 h 以内淫羊藿素对BCP小鼠的镇痛效应,在BCP 模型组小鼠给予淫羊藿素7 天后,分别在停药后第0 h、3 h、6 h、12 h、24 h进行痛阈检测。结果显示,在停药后24 h 以内的多个时间点,淫羊藿素均能增加BCP 小鼠同侧后爪对MWT 和对冷痛刺激的PWL(见图3A, 3B),并减少自发缩足次数和抬足保护时间(见图3C, 3D)。结果表明,在停药24 h 以内淫羊藿素对BCP 小鼠的镇痛效应稳定,无明显波动。

图3 淫羊藿素对BCP 小鼠停药后镇痛效应及EC50 确定Fig.3 The analgesic effect of icaritin on BCP mice and the determination of EC50
为了进一步确定淫羊藿素对BCP 小鼠镇痛效应的EC50(concentration for 50% of maximal effect),选取在淫羊藿素停药后第2 天(即BCP 造模后第15 天),测定小鼠同侧后爪对MWT 以及冷痛刺激的PWL,分别绘制剂量-效应曲线。结果显示,淫羊藿素对BCP 小鼠机械痛镇痛效应的EC50为68.22 mg/kg(见图3E),对BCP 小鼠冷痛镇痛效应的EC50为98.95 mg/kg(见图3F)。综合以上结果,提示淫羊藿素对BCP 小鼠镇痛效应的EC50约为70~100 mg/kg。
3.全效剂量淫羊藿素(200 mg/kg)联合吗啡用药的镇痛效应
为了探究淫羊藿素与吗啡联合用药对BCP 小鼠的镇痛效应,使用2 倍EC50的全效剂量淫羊藿素(200 mg/kg)与吗啡联合用药,并进行痛阈检测。机械痛行为学结果显示,在BCP 造模后第10天以及第14 天,与单独使用淫羊藿素(200 mg/kg)相比,淫羊藿素(200 mg/kg)与吗啡联合用药能够提高淫羊藿素对BCP 小鼠的镇痛效应,其镇痛效应与10 mg/kg 吗啡和20 mg/kg 吗啡的镇痛效应接近。此外,联合用药对BCP 小鼠的镇痛效应可以稳定地持续至停药后第7 天(见图4A)。同样地,冷痛及自发痛行为学结果也显示,在BCP 造模后第10 天以及第14 天,与单独使用淫羊藿素(200 mg/kg)相比较,淫羊藿素(200 mg/kg)与吗啡联合用药对BCP 小鼠的镇痛效应与200 mg/kg 淫羊藿素组以及10 mg/kg吗啡组和 20 mg/kg 吗啡组接近,并且在联合用药组,对BCP 小鼠的镇痛效应也可以稳定地持续至停药后第7 天(见图4B-D)。以上结果表明,2 倍EC50的全效剂量淫羊藿素(200 mg/kg)与吗啡联合用药可以显著延长停药后对BCP 小鼠的镇痛效应(即停药后镇痛效应)。

图4 全效剂量淫羊藿素(200 mg/kg)联合吗啡用药的镇痛效应Fig.4 Analgesic effects of icaritin at a full-effect dose (200 mg/kg) in combination with morphine
4.半效剂量淫羊藿素(100 mg/kg)联合吗啡用药的镇痛效应
为了探究淫羊藿素与吗啡联合用药是否能够减少吗啡的用药剂量,使用半效剂量淫羊藿素(100 mg/kg)与吗啡联合用药。在造模后第14 天,分别测定各组小鼠同侧后爪的机械痛阈(见图5A)、冷痛阈(见图5B)以及自发痛行为(见图5C, 5D)。结果发现,100 mg/kg 淫羊藿素+ 4 mg/kg 吗啡组以及100 mg/kg 淫羊藿素+ 8 mg/kg 吗啡组对BCP 小鼠的镇痛效应优于100 mg/kg 淫羊藿素+ 1mg/kg 吗啡组以及100 mg/kg 淫羊藿素+ 2 mg/kg 吗啡组,并且前两组的镇痛效应均能接近10 mg/kg 吗啡组。以上结果提示,100 mg/kg 淫羊藿素与吗啡联合用药,在达到10 mg/kg 吗啡的镇痛效应时,最多可以减少60%的吗啡用药剂量。
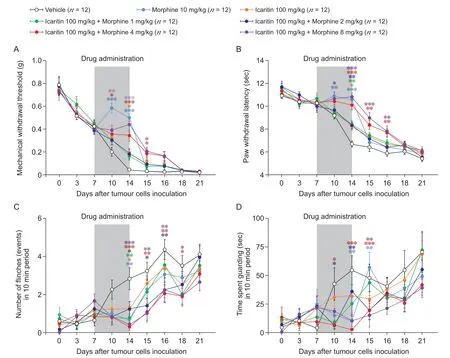
图5 半效剂量淫羊藿素(100 mg/kg)联合吗啡用药的镇痛效应Fig.5 Analgesic effects of icaritin at a half-effect dose (100 mg/kg) in combination with morphine
讨 论
骨癌痛是由原发性骨肿瘤或骨转移引起的癌性疼痛,被认为是慢性疼痛中最严重和最难治疗的类型之一[23]。研究表明,约四分之三的晚期癌症病人经历过中重度疼痛[24],并且约有一半以上的转移性癌痛病人通过药物治疗无法缓解[11]。因此,迫切需要开发新的治疗药物用于减轻疼痛并提高生活质量。建立与骨癌痛病人状况相似的实验动物模型对开发针对骨癌痛的镇痛药物至关重要[25]。本研究采用Wang 等[22]报道的方法,将Lewis 肺癌细胞接种于小鼠股骨骨髓腔内,以建立BCP 小鼠模型。该模型可部分还原骨癌痛病人的疼痛状态,并可以比较好地用于模拟BCP 的发生机制,目前已经在许多骨癌痛的临床前研究中采纳应用。在我们的实验中观察到,BCP 小鼠在造模后第7~21 天其荷瘤侧后爪的MWT 和PWL 显著低于对照组,且疼痛呈逐渐加重的趋势。在造模后的第10 天至第21 天,BCP 小鼠自发抬足次数以及抬足保护时间显著增加。综合这些结果表明BCP 小鼠模型的成功建立。
已有研究表明,淫羊藿素具有强大的抗肿瘤[26]和抗炎[27]等作用,但迄今为止尚未发现淫羊藿素在骨癌痛治疗方面的相关研究报道。为了探究淫羊藿素对BCP 小鼠的镇痛效应,我们选择在小鼠BCP造模后第7~14 天灌胃给予淫羊藿素,结果发现淫羊藿素在BCP 造模后第10~18 天明显增加BCP 小鼠的MWT 和PWL,同时减少了自发抬足次数以及抬足保护时间,表明淫羊藿素对小鼠BCP 有明显的镇痛效应。为了评估淫羊藿素镇痛效应的持续性和稳定性,本研究在小鼠BCP 造模后第14 天,即在第7 天给药停止后的不同时间点(0 h、3 h、6 h、12 h、24 h)进行了疼痛行为学检测,结果表明,在停药后24 h 以内,淫羊藿素对BCP 小鼠的镇痛效应相对稳定,没有明显波动。因此,我们选取在淫羊藿素停药后第2 天(即BCP 造模后第15 天),测定小鼠同侧后爪对机械痛刺激的缩足阈值以及对冷痛刺激的缩足潜伏期,分别绘制了剂量-效应曲线。根据实验结果,我们推断出淫羊藿素对BCP 小鼠镇痛效应的EC50约为70~100 mg/kg。值得注意的是,淫羊藿素对机械刺激与冷刺激镇痛效应敏感性存在差异,这可能与淫羊藿素在不同痛敏行为中的作用靶点不同有关。
为了研究淫羊藿素与吗啡联合用药对BCP 小鼠的镇痛效应,本研究首先建立了BCP 小鼠模型,在BCP 造模后第7~14 天进行给药,分别给予吗啡或淫羊藿素与不同剂量吗啡联合用药。使用2 倍EC50的全效剂量淫羊藿素(200 mg/kg)与不同剂量吗啡联合用药,结果显示,200 mg/kg 淫羊藿素与不同剂量吗啡联合用药均对BCP 小鼠产生良好的镇痛效应,且与单独给予吗啡的镇痛效应接近。这可能是因为200 mg/kg 淫羊藿素已经达到吗啡最大镇痛效应的相同效果(即天花板效应),因此200 mg/kg淫羊藿素与吗啡联合用药没有显著增强镇痛效应。然而,在停止给药后(即在BCP造模后第14~21天),与单独给予吗啡或者淫羊藿素相比,200 mg/kg 淫羊藿素与吗啡联合用药对BCP 小鼠的镇痛效应仍然持续存在。这些结果表明,2 倍EC50的全效剂量淫羊藿素(200 mg/kg)与吗啡联合用药可显著延长停药后的镇痛效应。需要注意的是,相同剂量的淫羊藿素在多次行为学实验中对BCP 小鼠的镇痛效应存在差异,这可能与不同批次实验中小鼠的个体差异有关。
为了探究淫羊藿素与吗啡联合用药在达到吗啡最大镇痛效应时可以减少的吗啡用药剂量,本研究采用半效剂量淫羊藿素(100 mg/kg)与不同剂量吗啡联合用药。结果显示,100 mg/kg 淫羊藿素与4 mg/kg 吗啡以及8 mg/kg 吗啡联合用药对BCP 小鼠的镇痛效应与10 mg/kg 吗啡的镇痛效应相似。因此,这些结果表明,100 mg/kg 淫羊藿素与吗啡联合用药最多可以减少60%的吗啡使用量,且达到与10 mg/kg吗啡相同的镇痛效应。
本研究探究了淫羊藿素对BCP 小鼠的镇痛效应以及淫羊藿素与吗啡联合用药的镇痛效应。为了明确淫羊藿素对癌痛镇痛效应的稳定性,计划使用KPPC小鼠模型[28]等不同癌痛模型进一步进行研究,以加深对淫羊藿素在癌痛治疗方面的了解。此外,本文尚未深入探究淫羊藿素对BCP 小鼠镇痛作用的潜在机制。未来将进一步探究淫羊藿素对BCP 小鼠肿瘤的影响,并深入探讨对淫羊藿素镇痛效应的具体机制。
利益冲突声明:作者声明本文无利益冲突。
