慢性内脏痛及诱发负性情绪的神经回路研究进展 *
2024-02-20常晓丽张海燕张丽丽陈少宗
常晓丽 张海燕 张丽丽 陈少宗△
(1 山东中医药大学针灸推拿学院,济南 250355;2 山东中医药大学针灸研究院,济南 250355)
内脏痛是指内脏器官障碍所引起的疼痛,其发生率高达20%。肠易激综合征(irritable bowel syndrome, IBS)所导致的腹部疼痛是临床IBS 病人就医的首要原因。疼痛是一种有意识的主观体验,包含了疼痛感觉和情感体验两个维度[1]。流行病学研究显示,IBS 病人普遍伴有负性情绪[2]。焦虑抑郁等心身症状会导致IBS 病人病情更加严重、疗效更为不佳,严重威胁人民的身体健康。据估计,与IBS相关的年度直接和间接成本在中国高达1230 亿人民币。因此,IBS 内脏痛及其负性情绪发病机制的研究及防治,具有极大的医学和社会意义。
《2020 年中国肠易激综合征专家共识意见》与国际共识一致明确指出IBS 是多因素共同引起的肠-脑互动异常的结果。IBS 病人感觉传入通路对各种刺激的敏感性异常增高,然而对其机制的研究大多集中于外周和脊髓,对脑回路机制认识相对不足。特定的大脑功能,如疼痛感觉加工和调控、情绪或认知调节,是脑区之间动态交互的结果。探究内脏疼痛信号在大脑中的传导通路,将有助于慢性内脏痛的靶向治疗。光遗传学和化学遗传学这两种高度特异性的神经元干预技术的出现,为确定特定神经元活动和意识行为之间的因果关系提供了强有力的工具。最近的研究开始揭示慢性内脏痛及其诱发负性情绪的复杂神经回路,并证实疼痛的阈值和幅度可以通过记忆、注意和情感脑回路之间的相互作用来调节。
前扣带回(anterior cingulate cortex, ACC)和杏仁核在认知、情绪和疼痛等方面的功能受到越来越多研究者的关注。因此,本文将主要围绕上述核团,从神经回路水平,总结并分析IBS 啮齿类动物模型内脏痛及诱发负性情绪脑回路的最新发现,以期为内脏痛神经回路机制方面的研究提供新方向,为临床IBS 及其他内脏痛的治疗提供新思路。
一、IBS 内脏痛动物模型
建立典型、稳定、可重复的动物疾病模型是进一步研究内脏痛的重要基础。目前常用的构建IBS啮齿类动物模型的方法主要包括应激刺激、物理刺激和化学刺激。生命早期的应激事件是成年期身心疾病的重要危险因素。新生期母爱剥夺和新生期结直肠刺激是常用的模拟早期应激/童年创伤的应激模型。研究表明,当幼崽达到成年后表现出内脏高敏感,对压力的反应性增加,以及焦虑和抑郁样行为[3,4]。在成年期,急性或慢性心理应激,躯体应激(如感染、炎症)和威胁生命应激(如强奸、战争、环境灾害等)是触发IBS 发生发展的重要因素。目前,应用最广泛的急性心理应激模型是避水应激和部分束缚应激;慢性避水应激,慢性束缚应激和慢性不可预知的温和刺激是常用的慢性心理应激模型。急性应激诱发的内脏疼痛持续时间较短,不适合IBS 内脏痛的长期观察和研究。慢性应激刺激影响实验动物的心理和生理状态,导致胃肠功能紊乱,内脏高敏感以及焦虑抑郁样行为的出现。感染后IBS 模型包括寄生虫感染(如急性原发线虫、巴西日本曲霉和小隐孢子虫)和细菌感染(如空肠弯曲杆菌、肠沙门氏菌和弯曲杆菌)两类。2, 4, 6-三硝基苯磺酸、乙酸或芥子油是常用的制备炎症后IBS 模型的化学物质。新生期母爱剥夺和新生期结直肠刺激可以模拟生命早期应激对成年大鼠和小鼠内脏痛、情绪和社会行为的影响,因此,目前研究者主要通过以上方法建立IBS 模型探讨内脏痛及负性情绪的神经回路机制。然而,在IBS 模型应用中存在以下问题:绝大多数的IBS 实验研究采用与人类种属差异较大的大小鼠为研究对象,尚未发现应用高级灵长类动物的研究,可传递性可能较差;另外,大多数研究以雄性动物为研究对象,而临床女性IBS 的发病率约为男性的2 倍,因此建议釆用雌雄各半的实验动物更为符合临床特点。
结直肠扩张是实验室和临床评估肠道感觉最广泛使用的刺激方法,结直肠扩张刺激引起的腹部肌肉收缩通常称为内脏运动反应,是检测内脏痛应用最广的参数。目前,腹部撤回反射和腹部肌电记录是评估内脏运动反应的主要方法。神经元细胞电生理记录、离体肠管神经肌肉的收缩反应、心血管反射等也是验证内脏高敏感性的手段。另外,IBS 内脏痛引起的负性情绪常用条件位置偏好/厌恶来评估。旷场、高架十字迷宫、糖水偏好、强迫游泳等测试也常用于评估疼痛引起的焦虑抑郁症状。
二、内脏痛及诱发负性情绪的神经回路
1.ACC
ACC 是处理啮齿类动物和人类慢性疼痛感觉和情绪成分的核心。大量研究结果表明慢性疼痛或重度抑郁症病人ACC 神经元活动发生重大变化。功能磁共振成像结果显示,IBS 病人ACC 激活[5]。同样,动物实验也发现内脏高敏感大鼠的ACC 对结直肠扩张的反应增强。进一步研究发现,ACC谷氨酸能神经元直接参与内脏敏感性的调节[6,7]。ACC 与众多脑区存在广泛的功能连接,共同构成ACC 的神经回路。这些复杂的神经回路联系为ACC 调控IBS 的内脏痛和负性情绪提供了良好的结构基础(见图1A)。
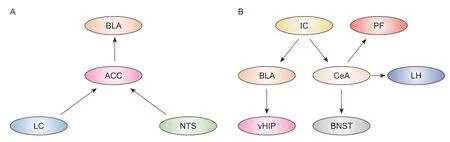
图1 调控慢性内脏痛及诱发负性情绪的神经回路
(1)蓝斑 (locus coeruleus, LC)-ACC:LC 去甲肾上腺素能系统是中枢神经系统中去甲肾上腺素的主要来源,主要参与调节疼痛、注意力、觉醒、学习和记忆等过程[8]。急性疼痛触发LC 神经元强烈的应激反应,经脊髓介导产生内源性镇痛,同时通过其上行传出神经促进厌恶、警觉和威胁觉察。ACC接受来自LC 的广泛投射,LC-ACC 连接的改变与抑郁严重程度呈负相关[9]。化学遗传学阻断投射到ACC 的LC 去甲肾上腺素能神经元可完全逆转抑郁样行为[10]。将结直肠扩张与条件位置回避实验相结合可以将习得内脏疼痛与特定位置的记忆联系,对接受结直肠扩张训练的场所产生厌恶并予以回避,直接反映了内脏刺激引起疼痛的情感成分,并产生了相当大的厌恶联想学习和记忆[11]。选择性损毁LC 去甲肾上腺素能神经元会破坏内脏伤害性厌恶记忆的形成。进一步研究发现,光遗传学激活或沉默LC 投射到ACC 的神经元可增强或减弱学习记忆的形成,以及LC 和ACC 中原癌基因蛋白c-Fos 的表达[12]。这些数据表明,自下而上的LC 到ACC神经元通路产生的去甲肾上腺素是内脏痛诱发厌恶行为的原因。Iqbal 等[13]进一步指出ACC 星形胶质细胞糖原无氧酵解产生的L-乳酸,是疼痛厌恶记忆形成不可或缺的因素。通过去甲肾上腺素β2受体,结合LC投射至ACC神经元所释放的去甲肾上腺素,调控ACC 神经元突触可塑性,从而影响内脏疼痛厌恶记忆的形成和巩固[12]。虽然该研究提供了一些关于内脏痛觉记忆形成的新机制,但这些机制的临床应用可能需要进一步的研究,比如如何通过调控去甲肾上腺素信号来改善内脏疼痛症状或相关疾病。
(2)孤束核 (nucleus tractus solitarii, NTS)-ACC:NTS 位于迷走神经背核的背外侧,是内脏感觉初级中枢。内脏信息通过双侧迷走神经传递到NTS,进而传递到更高级的脑中枢,这些脑中枢被认为介导了疼痛的情绪方面[14,15]。越来越多的证据表明胃肠道和胰腺伤害性刺激诱导NTS c-Fos的过度表达[16,17]。本实验室观察到IBS 大鼠NTS 存在异常升高的theta振荡。在伤害性结直肠扩张刺激期间,theta 振荡相对能量显著提高,且在结直肠扩张刺激结束后,中枢反应后效应较长(数据未发表)。
NTS 神经元可以投射到ACC,为皮层疼痛中心可以直接被NTS 处理的内脏传入激活提供了证据。此外,来自NTS 的上行纤维更多地支配ACC中表达钙/钙调蛋白依赖性蛋白激酶II-的神经元,而不是表达谷氨酸脱羧酶67-的神经元[16,17]。在慢性胰腺炎小鼠中,激活的NTS-ACC 回路加重内脏疼痛和焦虑样行为,抑制该回路能够减轻内脏疼痛和焦虑样行为[17],表明该神经回路参与慢性内脏痛的痛觉过敏及其诱发的焦虑情绪。以上结果为内脏痛在大脑皮质的调节提出了新见解,并找到ACC 可作为神经调节干预治疗内脏痛及诱发负性情绪的潜在靶点。
(3)基底外侧杏仁核(basolateral nucleus of the amygdala, BLA)-ACC:在IBS 病人中,内脏刺激改变了杏仁核的活性[18]。BLA 是杏仁核中最大的核团,参与疼痛信息的接收、整合和编码,是边缘系统和皮层区域之间疼痛信号处理的中枢。大量动物实验表明IBS 大鼠BLA 谷氨酸能神经元突触活性增强[19]。
BLA 的前部与ACC 区域显示出密集、直接和相互的连接[20]。许多证据表明theta 节律(4~10 Hz)参与促进脑区之间的信息传递,并且在疼痛感知和认知功能中的作用也得到了认可。内脏高敏感的大鼠BLA-ACC 突触长时程增强减弱,ACC 锋电位与BLA theta 振荡之间的相位关系受损[21]。交叉相关分析显示,内脏高敏感导致BLA 和ACC 之间theta振荡的同步化受到抑制,表明它们之间动态信息传递松散,进而可能破坏神经网络组装并影响突触可塑性,导致认知功能受损[21]。该研究有一个潜在的混杂问题,即所获得的电生理记录不是在内脏痛动物的决策任务中进行的。直接评估内脏痛动物决策相关的电生理变化,能够为未来的研究提供强有力的证据。此外,化学遗传或光遗传激活BLA-ACC投射缓解了MK-801 小鼠(精神分裂症动物模型)的社交缺陷,并增强了其在新物体识别测试中的认知能力,而化学遗传或光遗传抑制BLA-ACC 投射则在一定程度上恶化了其精神分裂症表型。
最新文献报道,慢性神经病理性疼痛导致投射到ACC 的BLA 神经元过度活跃,并增加了ACC和BLA 之间的功能连接,这对慢性疼痛诱导的抑郁样行为是十分必要的。不仅如此,BLA-ACC 通路的反复激活足以激活ACC 中的谷氨酸能神经元和γ-氨基丁酸(γ-aminobutyric acid, GABA)能神经元,使动物逐渐出现抑郁样表型[20]。然而,在该模型中,BLA-ACC 通路并不是机械超敏反应和驱动持续性疼痛行为所必需的。ACC 对慢性神经病理性疼痛的调节可能依赖于BLA 以外的脑区[20]。综上所述,我们推测躯体和内脏信息可汇聚到BLAACC 同一神经元,其突触可塑性发生改变可能是BLA-ACC 通路同时参与躯体痛和内脏痛及其负性情绪调控的机制。
2.杏仁核
杏仁核是大脑边缘系统的重要脑区,主要包括BLA 和中央杏仁核(central amygdala, CeA),在负性情绪处理(如焦虑、抑郁和恐惧)、奖赏、学习记忆及认知功能中发挥重要作用。在IBS 病人和焦虑症病人中杏仁核都被持续激活[22,23],因此,杏仁核与其上下游脑区所形成的神经网络在调控内脏疼痛及其诱发的负性情绪中具有关键作用(见图1B)。
(1)BLA-腹侧海马 (ventral hippocampus, vHPC):BLA 是负责接收和整合外部信息的枢纽,由谷氨酸能神经元(约占85%)和GABA 能神经元组成。啮齿类动物研究显示,BLA 对vHPC 产生了致密的单突触谷氨酸能投射,这种功能连接与焦虑情绪的产生密切相关。激活BLA-vHPC 投射能够增加小鼠焦虑样行为,而抑制BLA-vHPC 投射可改善小鼠的焦虑样行为[24]。慢性应激选择性增加投射至vHPC 的BLA 神经元c-Fos 的表达,减弱小电导钙激活的钾离子通道功能,下调含δ 亚基的GABA 受体介导的紧张性抑制电流,导致BLA-vHPC 神经元兴奋性显著升高,增加小鼠焦虑样行为[25,26]。另一项研究显示,慢性束缚应激显著增加了BLA-vHPC 神经元微小兴奋性突触后电流,即兴奋性突触传递增强,同时还伴随着神经元树突分枝增多,树突棘密度增加,且这种变化与应激所致的过度焦虑显著正相关[19]。
不同空间位置的杏仁核对海马的支配在焦虑行为的调控中具有截然不同的作用。BLA 和vHPC CA1 (vCA1) 沿其头、尾和浅深轴具有细胞和功能多样性。头侧BLA (aBLA) 和尾侧BLA (pBLA)分别支配vCA1 的深层钙结合蛋白1 阴性 (Calb1-) 和浅层钙结合蛋白1 阳性神经元 (Calb1+)[27]。光刺激pBLA-vCA1Calb1+对小鼠具有抗焦虑作用,改善阿尔茨海默病模型小鼠的焦虑症状;激活aBLA-vCA1Calb1-会诱发小鼠的焦虑样行为[27]。此外,最新文献报道BLA-vHPC 神经回路对于形成恐惧消退记忆是必不可少的,恐惧消退记忆依赖于BLA 投射vHPC 形成场景和刺激安全表征,BLA-vHPC 回路促进恐惧消退记忆的提取,而不是强化恐惧记忆[28]。vHPC 对BLA 同样具有单突触谷氨酸能投射,但研究发现,vHPC-BLA 在生理状态下并不参与焦虑样行为的调控,而主要参与恐惧及恐惧共情相关行为的调控[29]。因此,杏仁核和海马之间相互作用功能失调,则可能损伤恐惧记忆消退学习过程,导致持续性恐惧,继而诱发焦虑症等精神疾病。然而,该回路在IBS诱发的焦虑、恐惧消退记忆等行为中的作用目前尚未报道,是未来值得研究的一个方向。
(2)岛叶 (insular cortex, IC)-杏仁核:IC 是整合内脏自主活动的高级中枢,被称为“内脏脑”。影像学研究表明,IBS 病人IC 的厚度减少和灰质体积降低,与IBS 较长的病程和内脏高敏感有关[30]。在IBS 病人或啮齿类动物中,IC 在静息状态和结直肠扩张刺激时持续激活[30]。特异性抑制IC 锥体细胞的兴奋性可同时降低腹部痛觉过敏和疼痛诱发的焦虑行为[31]。除此之外,IC 对于处理厌恶性和奖赏性刺激以及协调适应性行为反应也是至关重要,是恐惧记忆和消退记忆的潜在调控中枢[32]。IC 通过整合来自身体的信息,对恐惧情绪进行双向调节,从而保持恐惧情绪的平衡[33]。Wang 等[34]进一步观察到IC-CeA 和IC-伏隔核投射神经元分别在恐惧记忆和消退记忆中发挥关键作用,这些神经元集群之间存在记忆行为依赖的交互抑制,可能构成机体切换正负情绪的神经回路机制。
此外,IC 谷氨酸能神经元向BLA 发出纤维投射,该投射以同侧为主,并参与调节BLA 内兴奋性/抑制性神经元的活性。选择性抑制IC 向BLA 投射的谷氨酸能神经元活性,或者条件性凋亡IC-BLA通路突触后的谷氨酸能神经元均能够显著缓解与慢性神经病理性疼痛小鼠同窝小鼠的共情痛,反之则会加剧该小鼠共情痛的发生和维持。利用磷酸化核糖体亲和沉淀测序方法筛选到突触结合蛋白2 和Rab 相互作用分子3 是共情状态下控制IC-BLA 通路突触活性的关键分子[35]。总之,IC-杏仁核回路可能在内脏痛诱发的负性情绪调控中具有重要作用,需要未来的研究进一步证实。
(3)CeA:CeA 被认为是杏仁核信号的输出核团,与下丘脑外侧区(lateral hypothalamus, LH),终纹床核(bed nucleus of stria terminalis, BNST),丘脑束旁核(parafascicularnucleus, PF)等核团形成广泛的纤维联系,对疼痛和相关情绪反应(例如恐惧和焦虑)的整合起重要作用。临床研究显示,IBS 病人的下丘脑和杏仁核被显著激活。CeA GABA 能神经元投射到LH 促食欲素神经元。化学遗传学激活正常小鼠的LH 和CeA 的GABA 能神经元后,该小鼠表现出与IBS 小鼠相似的行为学缺陷(胃肠道功能障碍和抑郁样行为),给予GABA 受体拮抗剂后可以缓解这些症状。CeA-LH GABA 神经元的激活抑制了LH 促食欲素神经元的激活[22]。这些结果提示CeA-LH 回路中的GABA 能神经元通过释放GABA 神经递质调控下游促食欲素神经元的活动,进一步调控小鼠的抑郁样表型和胃肠道功能。BNST 和CeA 起源相同,属于泛杏仁核,包含许多亚区和特定的神经细胞。BNST 与自主神经和神经内分泌功能有关,对情绪和心境有显著影响。在焦虑症病人和IBS 病人中,BNST 和CeA 神经元活动发生改变。CeA 接受来自外界环境的感觉信息,并直接投射到BNST,激活CeA-BNST 促进雄性大鼠内脏痛[36]和焦虑、抑郁样行为的发生[37]。众所周知,BNST 是调节性别差异行为的关键脑区。因此,上述结果是否适用于雌性大鼠或者CeA-BNST 是否是IBS 性别差异行为的关键神经回路仍有待研究。此外,CeA GABA 能神经元与PF 谷氨酸能神经元存在单突触的直接连接。张智教授团队在慢性束缚应激诱导的疼痛抑郁共病模型中进一步观察到CeA GABA 能神经元活性增加,对PF 谷氨酸能神经元的输入增加,使得PF 中谷氨酸能神经元活性降低,并且对次级躯体感觉皮质(second somatosensory cortex, S2) 传递减弱,即CeA-PF-S2 三级神经回路参与调控疼痛抑郁共病的形成[38]。在该研究中,研究者运用慢性束缚应激法制备疼痛抑郁共病模型,关注躯体痛与抑郁共病的神经回路。值得注意的是,慢性束缚应激也是制备IBS 的常用方法,虽然该研究未能评估内脏痛,但我们推测CeA-PF 参与慢性内脏痛及其抑郁的调控。综上所述,CeA 相关投射形成神经网络在慢性内脏痛及诱发负性情绪中具有重要作用,这些复杂的神经回路之间如何精密协作值得进一步研究。
三、展望
综上所述,慢性内脏痛及诱发负性情绪神经回路的研究加深了我们对慢性内脏痛与负性情绪交互恶化的理解。随着更多高端科研工具的发展和各种神经科学技术的联合应用,相信研究者们在慢性内脏痛及诱发负性情绪方面能够取得更大的进展。针对目前该研究领域存在的问题,我们对未来研究提出以下几点建议:①女性患IBS 和焦虑抑郁的风险较男性高。然而,目前关于内脏痛及诱发负性情绪神经回路的实验结果是在雄性啮齿类动物中获得的,这可能并不完全适用于雌性啮齿类动物,上述神经回路对IBS 内脏痛及负性情绪的调控是否存在性别差异值得探讨,同时研究者应采用雌雄各半的研究方案,加大对雌性动物的研究力度;②科学研究转化临床的过程,是每个科研团队最终的研究目的,这同样也是疼痛和脑科学的重要研究方向。因此,釆用与人类种属差异较小的动物构建IBS 模型,进行跨物种比较,增强可传递性是至关重要的;③不同的神经元群体混杂在同一脑区,但它们通过投射到不同的下游靶点来调节内脏痛的疼痛感知和情绪方面。核团介导内脏痛痛觉和负性情绪的神经元是否是同种神经元,将是未来有趣的研究方向。单细胞测序联合空间转录组测序对神经元细胞类型进行分类将促进该研究的发展;④脑区之间形成复杂的神经回路调控内脏痛及其负性情绪,在同种动物模型中这些神经回路是否同时发生变化,是否有优先及主次之分是未知的。探讨神经回路之间的精细协作将为内脏痛的治疗提供新思路。
利益冲突声明:作者声明本文无利益冲突。
