弥散加权成像联合动态增强MRI 预测肝细胞癌经TACE 联合射频消融治疗后复发
2024-02-16胡舟朝张晓东俞南南陈本宝
胡舟朝,张晓东,俞南南,陈本宝
(1.浙江省舟山医院介入诊疗中心,浙江 舟山 316021;2.舟山市中医院放射科,浙江 舟山 316000)
肝细胞癌(hepatocellular carcinoma,HCC)为肝脏最常见恶性肿瘤之一,在原发性肝癌中约占90%[1-2];TACE 为治疗HCC 的一线方案,针对体积较大、病灶较多的HCC 患者还可联合射频消融进行治疗。准确判断HCC 治疗后复发对于指导临床治疗决策及评价预后具有重要意义[3-4]。本研究观察弥散加权成像(diffusion weighted imaging,DWI)联合动态增强MRI预测HCC 经TACE 联合射频消融治疗后复发的价值。
1 资料与方法
1.1 研究对象 回顾性分析2018 年3 月—2021 年4月于浙江省舟山医院接受TACE 联合射频消融治疗的80 例HCC 患者,男46 例、女34 例,年龄32~77 岁、平均(64.2±5.8)岁;均合并肝硬化,包括乙型病毒性肝炎肝硬化62 例、丙型病毒性肝炎肝硬化12 例、不明原因肝硬化6 例;55 例为单发HCC,15 例存在2 个HCC 病灶、10 例存在3 个HCC 病灶,共115 个HCC 病灶。纳入标准:①符合2022 年原发性肝癌诊疗指南[4]诊断HCC 标准;②HCC 直径≤5 cm;③分别于治疗前10 天、治疗后20、60 及90 天接受腹部DWI 及动态增强MR 检查;④于治疗后20 天接受数字减影血管造影(digital subtraction angiography,DSA)复查;⑤肝功能Child-Pugh A 或B 级。排除标准:①合并严重心、肝、肾功能障碍或其他恶性肿瘤;②肿瘤浸润血管或远处转移;③瘤灶数目>5 个;④凝血功能障碍;⑤资料不完整。本研究经医院伦理委员会批准[(2017)伦审第(053)号];治疗前患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Avanto MR 仪、腹部相控阵体线圈,嘱患者仰卧,行腹部扫描,范围自膈顶至肝下缘水平;采用腹部呼吸导航采集反相位三维梯度回波T1WI 及快速自旋回波脂肪抑制T2WI;后采用回波平面成像序列采集DWI,参数:TR 5 500 ms,TE 76 ms,FOV 309 mm×380 mm,矩阵154×192,层厚6 mm,层间距1.8 mm,b 值=0、200、800 s/mm2。之后经肘静脉以流率2.5 ml/s 注射钆喷酸葡胺0.1 mmol/kg 体质量并跟注20 ml 生理盐水,延迟20~25 s、50~70 s、180 s 分别采集动脉期、门静脉期及延迟期图像。
由2 名高年资影像科医师采用Siemens Syngo 后处理软件于DWI所示病灶范围内手动勾画3个直径3~5 mm 圆形ROI 并获得表观弥散系数(apparent diffusion coefficient,ADC),取平均值作为结果。
1.3 观察指标 治疗后20 天根据改良实体瘤疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)[5]评估TACE 联合射频消融治疗HCC 效果:以靶病灶动脉期无强化为完全缓解(complete response,CR),靶病灶动脉期强化面积减少≥30%为部分缓解(partial response,PR),靶病灶动脉期强化面积减少<30%或增加<20%为疾病稳定(stable disease,SD),靶病灶动脉期强化面积增加≥20%为疾病进展(progressive disease,PD)。对存在多发病灶患者选择最大病灶进行评估。以CR、PR 及SD为疾病稳定,将患者归为稳定组;以PD 为疾病进展,将患者纳入进展组。
1.4 统计学分析 采用SPSS 19.0 统计分析软件。以表示正态分布计量资料,行t检验;以频数表示计数资料,行χ2检验。以DSA 为标准,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评估DWI 联合动态增强MRI预测HCC经TACE联合射频消融治疗后复发的效能。P<0.05为差异有统计学意义。
2 结果
2.1 DWI 及 动 态 增 强MRI 表现 80例共115个HCC病灶,治疗前多呈DWI 高/不均匀信号、ADC图呈低信号,增强后不均匀强化。
将31 例CR、9 例PR 及7 例SD 纳入稳定组(n=47),33 例PD纳入进展组(n=33)。TACE 联合射频消融治疗后20 天,稳定组HCC 病灶DWI 多呈不均匀信号、ADC 图多呈高信号、增强后未见强化;进展组HCC 病灶DWI 多呈高信号、ADC 图多呈低信号,增强后轻度强化。见图1、2。

图1 稳定组患者,女,43 岁,肝右后叶HCC A~D.TACE 联合射频消融治疗后20 天,肝右后叶病灶呈T1WI 稍低信号(A)、DWI 稍高信号(B)、ADC 图高信号(C),增强T1WI 未见强化(D)

图2 进展组患者,女,65 岁,肝右后叶HCC A~D.TACE 联合射频消融治疗后20 天,肝右后叶病灶呈T1WI 稍低信号(A)、DWI 稍高信号(B)、ADC 图低信号(C),增强T1WI 可见轻度强化(D)
以DSA 为金标准,DWI 联合动态增强MRI 预测TACE 联合射频消融治疗后20 天HCC 复发的敏感度、特异度及准确率分别为97.75%(87/89)、92.31%(24/26)及96.52%(111/115)。
2.2 组间ADC 值比较 2 组治疗前ADC 值差异无统计学意义(P>0.05);治疗后20、60 及90天,稳定组ADC 值均高于治疗前(t=10.91、10.97、12.58,P均<0.05),而进展组ADC 值与治疗前差异均无统计学意义(t=10.88、10.30、11.94,P均>0.05)。见表1。
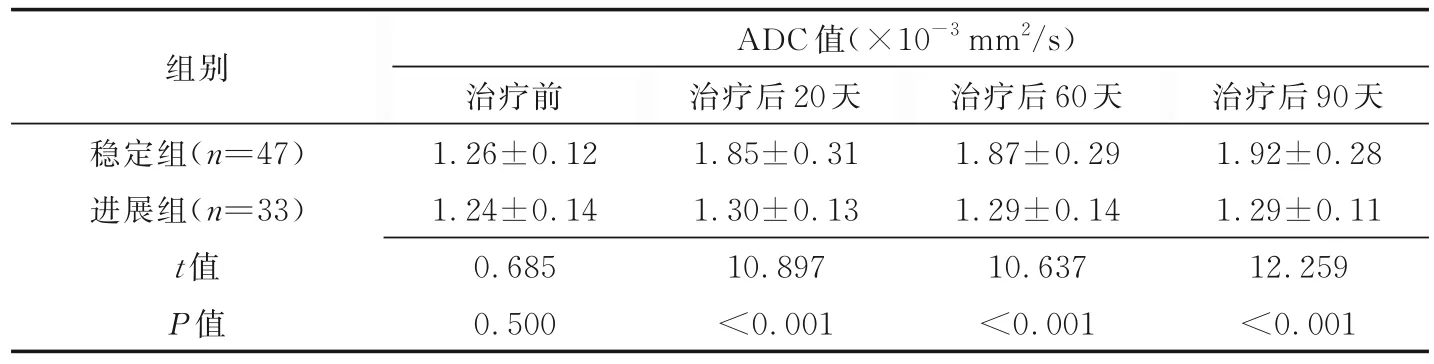
表1 80 例HCC 患者接受TACE 联合射频消融治疗前、后ADC 值比较
2.3 ADC 值用于预测HCC 复发的效能 ADC 值预测TACE 联合射频消融治疗后20 天HCC 复发的曲线下面积(area under the curve,AUC)为0.82;以ADC=1.42×10-3mm2/s 为截断值,其敏感度及特异度分别为72.13%及82.25%。见图3。
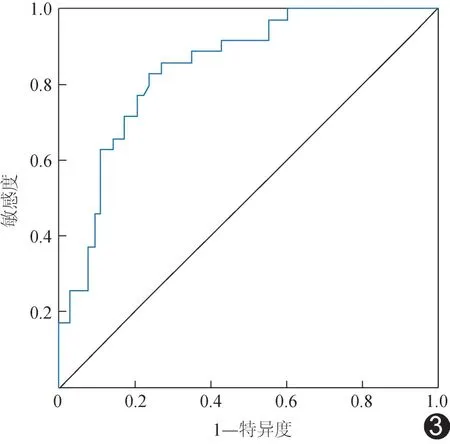
图3 以ADC 值预测TACE 联合射频消融治疗后HCC复发的ROC 曲线
3 讨论
HCC 进展较快,手术切除后复发率超过50%[6]。TACE 为治疗无法手术切除HCC 的常用方法,但杀伤肿瘤细胞效果有限,临床常联合消融等微创方法进行治疗[7-8]。
超声、CT、MRI 或DSA 均可用于观察介入治疗HCC 效果。超声对于缺血性HCC 的漏诊率较高。TACE 后,高密度碘化油沉积于病灶内,易在增强CT中产生伪影,且CT 扫描存在辐射。DSA 有创,不宜作为常规随访方案[9-10]。MRI 无辐射、分辨率高且具有可定量分析病灶等优点,利用DWI 和ADC 图还能在分子水平反映组织结构及功能[11-12]。侯毅斌等[13]采用DWI 联合动态增强MRI 对经TACE 治疗后的肝癌患者进行随访,其对残留病灶的检出率明显高于单独DWI 或动态增强MRI(P均<0.05)。既往研究[14]提出,肿瘤组织往往细胞排列密集,使水分子运动受限,故ADC 值较低;经介入治疗后,坏死肿瘤细胞分解,肿瘤组织密度减低,ADC 值随之升高。目前已有学者[15-16]基于DWI 联合动态增强MRI 评估乳腺癌、宫颈癌及直肠癌疗效,发现效能较好。
本研究结果显示,DWI 联合动态增强MRI 预测TACE 联合射频消融治疗后20天HCC 复发的敏感度、特异度及准确率分别为97.75%(87/89)、92.31%(24/26)及96.52%(111/115),提示其能较准确地区分残留肿瘤组织及坏死组织;治疗后20 天,稳定组与进展组HCC 病灶DWI 及动态增强MRI 表现存在一定差异,稳定组ADC 图多呈高信号、增强后无强化,而进展组ADC 图多呈低信号、增强后轻度强化;且治疗后20、60 及90天,稳定组病灶ADC 值均高于进展组,提示ADC 值可作为治疗后HCC 复发的有效预测指标。
本研究进一步以ROC 曲线评估ADC 值预测TACE 联合射频消融治疗后20 天HCC 复发的效能,发现以ADC 值=1.42×10-3mm2/s 为阈值的预测效能较好,AUC 达0.82,提示利用ADC 值可于介入治疗HCC 后早期判断靶病灶的活性,为预测预后、指导后续治疗及决定随访频次等提供参考。
综上所述,DWI 联合动态增强MRI 预测TACE 联合射频消融治疗后HCC 复发具有一定价值;ADC 值可作为有效预测指标。但本研究为单中心回顾性分析,样本量有限,且未涉及HCC 远期复发,有待后续加以完善。
利益冲突:全体作者声明无利益冲突。
作者贡献:胡舟朝研究设计和实施、撰写文章;张晓东研究实施、撰写文章;俞南南查阅文献;陈本宝统计分析、修改文章。