新生儿低血糖风险预测模型的构建及效果验证
2024-02-12刘颖朱珠单春剑蒲丛珊王义婷丁磊
刘颖 朱珠 单春剑 蒲丛珊 王义婷 丁磊
南京医科大学附属妇产医院/南京市妇幼保健院(江苏省南京市,210004)
新生儿低血糖症(Neonatal hypoglycemia,NH)是新生儿常见代谢性疾病,以血糖值低于2.2 mmol/L为其诊断标准,而临床中通常血糖值低于2.6 mmol/L时就需要干预。新生儿低血糖临床表现通常为新生儿反应迟缓、肌张力异常、喂养困难、呼吸急促、低体温、发绀、抽搐等,但多起病隐匿,约75.23%无明显表现[1-2]。研究指出[3],有6%~19%的新生儿会在出生后48 h 内发生低血糖,存在高危因素的新生儿中发病率可达50%。由于其起病隐匿且症状缺乏特异性,新生儿低血糖往往不易被发现和重视,而新生儿持续低血糖极易造成新生儿的永久性脑损伤,引发癫痫、神经发育不良等疾病,影响新生儿近期的生长发育,且对其远期的行为气质产生深远影响,相关的治疗和康复会给其家庭带来沉重的经济负担[4-5]。因此对新生儿低血糖危险因素的早期预测和识别对改善或逆转低血糖对新生儿的不良影响具有重要意义。目前对于新生儿低血糖发生的危险因素研究较多,但多集中在妊娠期糖尿病等存在高危母亲因素的新生儿人群中,且因纳入人群和诊断阈值的异质性,致使其危险因素尚未达成准确的定论,相关预测模型和预防脑损伤的阈值也尚不完善。因此,本文通过回顾性分析,探索新生儿低血糖发生的危险因素,构建个体化预测模型并验证,为临床孕妇保健及新生儿低血糖管理提供参考。
1 对象与方法
1.1 调查对象
本研究为回顾性研究,利用医院信息系统,回顾性收集2020 年1 月—2022 年1 月我院产科收治的1330 例产妇分娩后新生儿人口学特征、临床特征及低血糖相关特征资料。研究对象纳入条件:自然受孕;单胎活产;孕期资料完整;母婴同室;无喂养禁忌。排除条件:新生儿存在先天畸形或者重要器质性疾病;产妇合并严重呼吸系统、循环系统等原发疾病;产妇精神障碍或严重心理疾病;新生儿因病情变化需转入新生儿科治疗;资料不全。根据纳入条件按7:3的比例随机分为建模组931 例和验证组399 例。伦理编号(宁妇伦字[ 2018] 54 号)。
1.2 新生儿低血糖的诊断标准
参照人民卫生出版社第4 版《实用新生儿学》、人民卫生出版社第8 版《妇产科学》、美国儿科学会《新生儿低血糖管理指南》统一新生儿低血糖的判断标准:不论胎龄、日龄,血糖≤2.2 mmol/L 即诊断低血糖[6]。
1.3 调查工具及资料收集方法
在前期文献回顾的基础上和对1 名新生儿科主任医师及2 名产科主任医师、2 名产科副主任护师进行咨询,自行设计新生儿低血糖调查表,包括2个部分,共23 项指标。①产妇一般资料。母亲年龄、母亲是否肥胖、母亲合并糖尿病、母亲合并高血压、母亲合并甲状腺功能减退症、胎膜早破、孕期及哺乳期服用β 受体阻阻滞剂类药物、产前使用皮质类固醇(Antenatal Corticosteroids, ACS) 药物、是否存在羊水污染、分娩方式。②新生儿一般资料。是否早产、是否小于胎龄、是否低体温、新生儿体长、新生儿头围、是否低体质量、阿普加评分(Apgar)、是否存在窒息或复苏、纯母乳喂养、新生儿合并高胆红素血症、是否喂养不佳、血糖检测方式、血糖测量间隔。资料由2 名经过同质化培训的研究者分别通过医院的电子病历信息系统收集。
1.4 数据分析方法
采用SPSS 21.0 统计学软件对数据进行处理,计量资料采用“均数±标准差”表示,计数资料计算百分率,组间率的比较采用χ2检验。将单因素分析中P<0.05的分析因素纳入多因素Logistic回归分析中,并以多因素Logistic 回归模型作为最终预测模型并对其进行赋分。绘制受试者操作特征曲线检验预测模型的拟合效果,以灵敏度、特异度和正确率验证预测模型的检验效能。
2 结果
2.1 新生儿一般资料比较
回顾性收集2020 年1 月—2022 年1 月我院收治的1330 例新生儿临床资料,其中,男719 例,女611 例。共发生新生儿低血糖161 例,其中建模组发生新生儿低血糖117 例,验证组发生新生儿低血糖44 例。其余新生儿基本资料见表1。
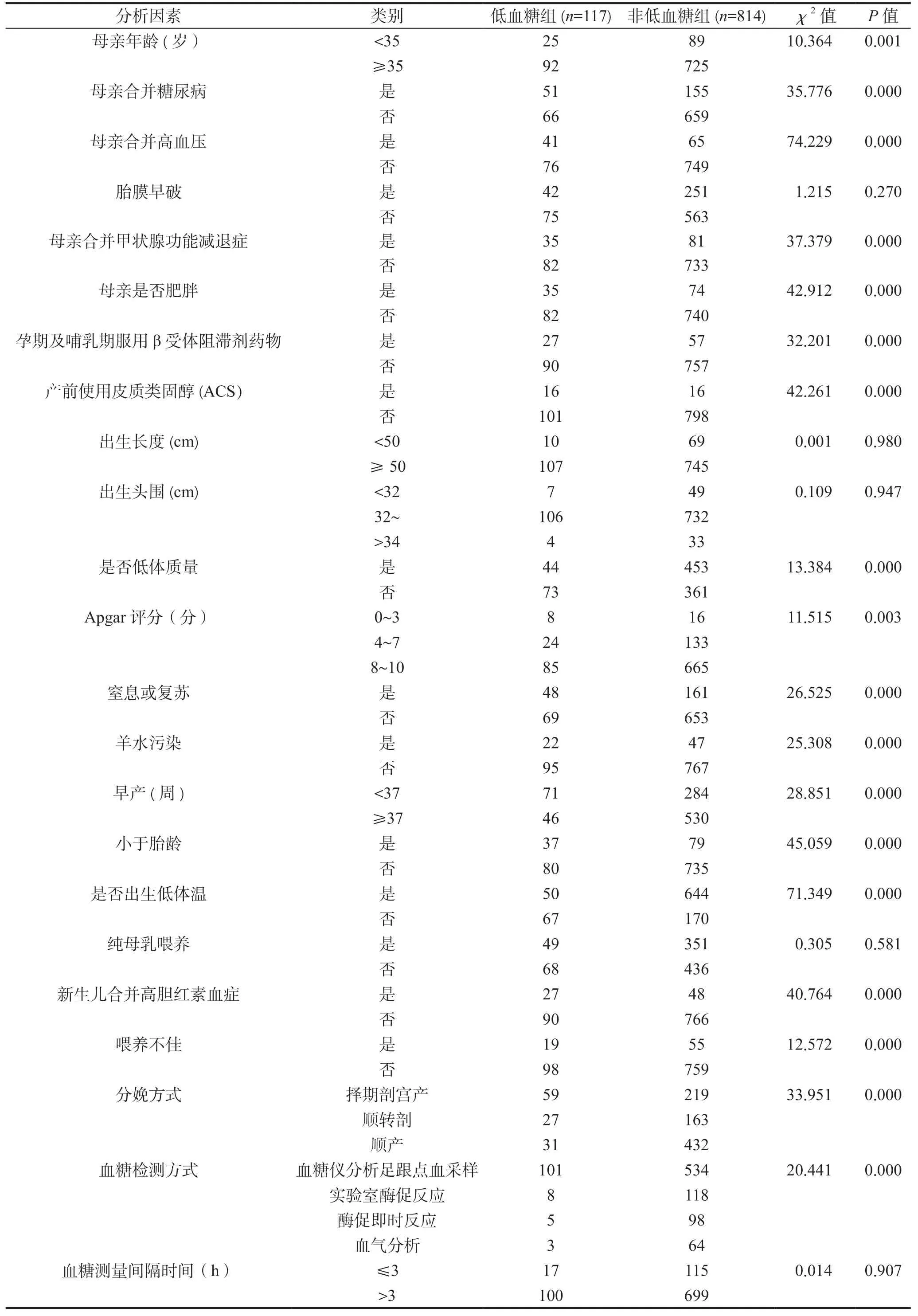
表1 新生儿低血糖发生的单因素分析(建模组)Table 1 Univariate analysis of neonatal hypoglycemia (modeling group)
2.2 新生儿低血糖发生的单因素分析
将建模组的931 例新生儿根据是否发生低血糖分为低血糖组、非低血糖组,进行单因素分析,结果表明,母亲年龄、母亲合并糖尿病、母亲合并高血压、母亲合并甲状腺功能减退症、母亲肥胖、孕期及哺乳期服用β 受体阻滞剂药物、产前使用皮质类固醇、低体质量、Apgar 评分 、是否存在窒息或复苏、羊水污染、早产、小于胎龄、低体温、喂养不佳、新生儿合并高胆红素血症、分娩方式、血糖检测方式共18个变量与新生儿低血糖有关(P<0.05),见表1。
2.3 新生儿低血糖发生的多因素Logistic 回归分析
将单因素分析中有统计学意义的母亲年龄、母亲合并糖尿病、母亲合并高血压、母亲合并甲状腺功能减退症、母亲肥胖、孕期及哺乳期服用β 受体阻滞剂药物、产前使用皮质类固醇、低体质量、Apgar 评分 、是否存在窒息或复苏、羊水污染、早产、小于胎龄、是否出生低体温、喂养不佳、新生儿合并高胆红素血症、分娩方式、血糖检测方式(以血气分析为参考类别)纳入多因素Logistic 回归模型中,以Back-Wald 法筛选变量,最终确定变量母亲合并糖尿病、母亲肥胖、孕期及哺乳期服用β 受体阻滞剂药物、产前使用ACS、小于胎龄、血糖检测方式共6 个变量:母亲合并糖尿病(95%CI:1.159~2.907)、母亲肥胖(95%CI:1.757~2.848)、孕期及哺乳期服用β 受体阻滞剂(95%CI:1.421~2.592)、产前使用皮质类固醇(95%CI:2.127~4.963)、小于胎龄(95%CI:1.881~2.299)、血糖检测方式(95%CI:1.021~3.824),见表2。
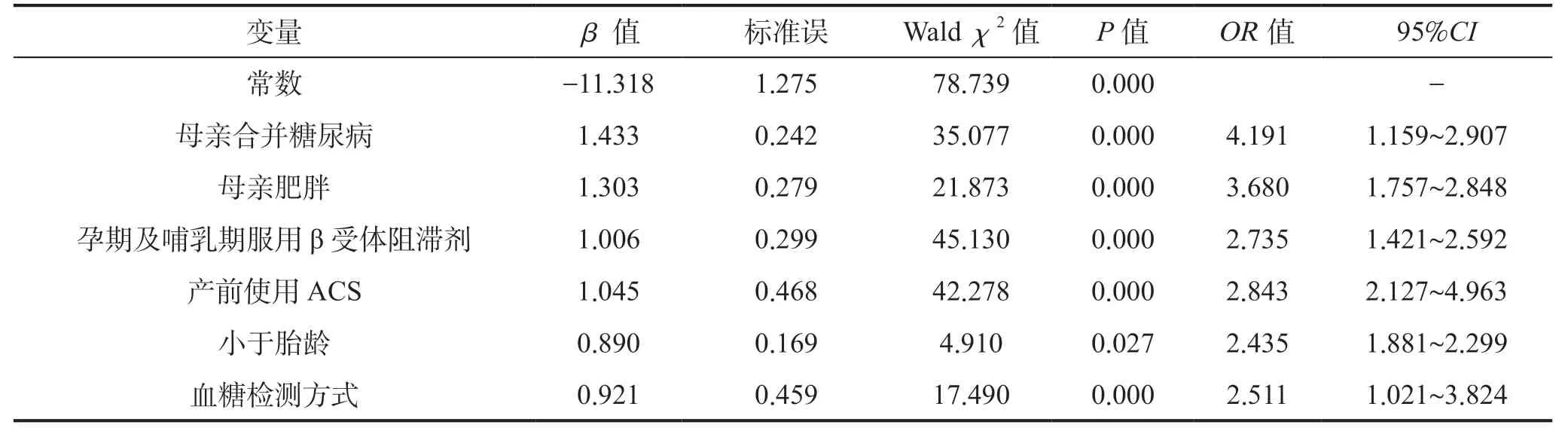
表2 新生儿低血糖发生的Logistic 回归分析(建模组)Table 2 Logistic regression analysis of neonatal hypoglycemia (modeling group)
2.4 风险预测评分模型的构建
依据β*4 构建风险预测模型评分体系,将母亲合并糖尿病赋分6 分、母亲肥胖赋分5 分、孕期及哺乳期服用β 受体阻滞剂赋分4 分、产前使用ACS4 分、小于胎龄4 分、血糖检测方式4 分(血糖仪分析足跟点血采样赋4 分、实验室酶促反应3 分、酶促即时反应2 分、血气分析1 分),总分0~27 分。见表3。根据构建的风险预测评分来对建模组评分,对风险评分排序可知,随着风险评分的增加,新生儿低血糖发生率也呈上升趋势。依据低血糖发生率,采用四分位法对低血糖风险等级进行划分,即低风险(P<25.0%)、中风险(25.0%≤P<75.0%)和高风险(P≥75.0%),最终确定0~9 分为低风险,10~17 分中风险,18~27分为高风险,各风险等级间两两比较均有统计学意义(P<0.05),见表4。高风险对新生儿低血糖预测的灵敏度为67.92%,特异度为90.80%;中风险对新生儿低血糖预测的灵敏度为25.50%,特异度为92.23%;低风险对新生儿低血糖预测的灵敏度为2.70%,特异度为67.11%。
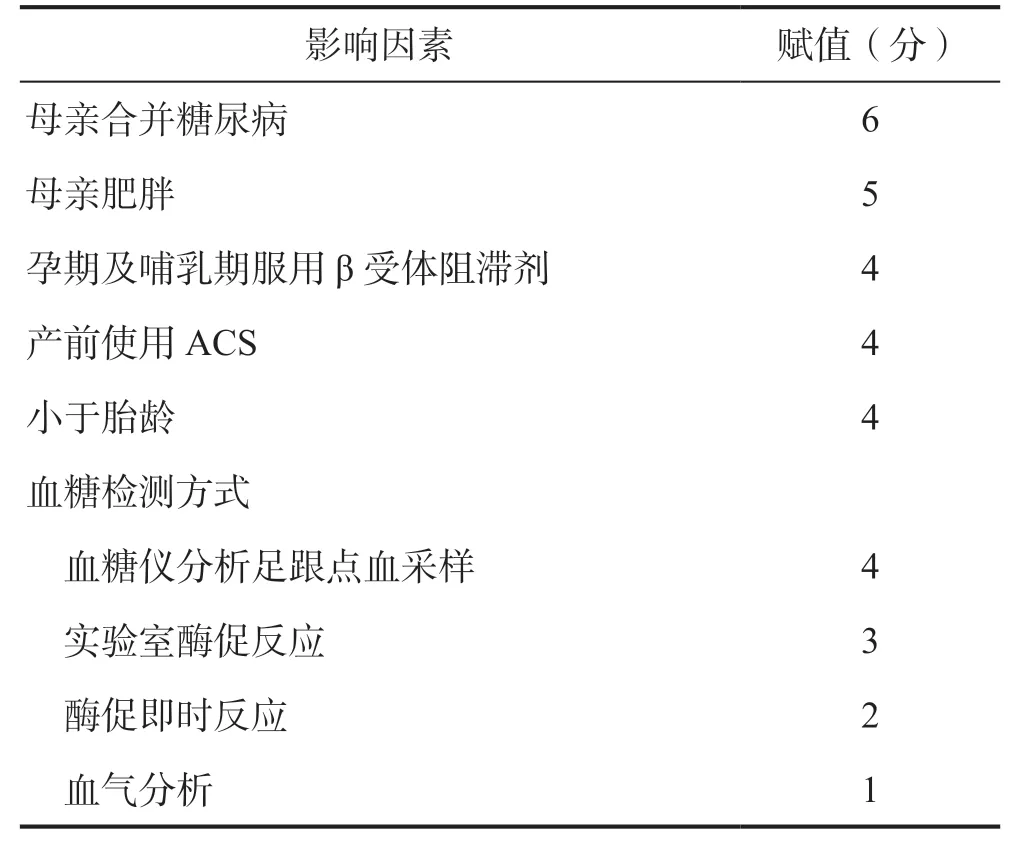
表3 新生儿低血糖风险评分模型Table 3 Neonatal hypoglycemia risk score model

表4 新生儿低血糖风险分层Table 4 Risk stratification of neonatal hypoglycemia
2.5 风险预测评分模型验证
在建模组的931 例新生儿中,通过实验室确诊为低血糖117 例,非低血糖814 例。利用风险评分模型对新生儿评分,以标准诊断结果为状态变量、风险评分值作为检验变量绘制ROC 曲线图。结果表明,预测建模组模型ROC 曲线下面积0.893(95%CI:0.855~0.931,P=0.000),H-L 检验结果为P=0.155,该模型在建模组中校准度、区分度良好。按照上述方法绘制验证组数据,结果表明曲线下面积占比0.847(95%CI:0.828~0.9876,P=0.000),H-L检验结果P=0.401,可见模型组在验证组中区分度、校准度有意义。
利用建立的风险评分预测模型评价验证组数据,计算各风险层新生儿低血糖发生率,结果表明高风险对新生儿低血糖预测的灵敏度为59.09%,特异度为91.78%;中风险对新生儿低血糖预测的灵敏度为27.54%,特异度为92.42%;低风险对新生儿低血糖预测的灵敏度为3.90%,特异度为64.84%,且各风险等级间两两比较均有统计学意义(P<0.05),见表5。

图1 建模组Figure 1 Modeling group
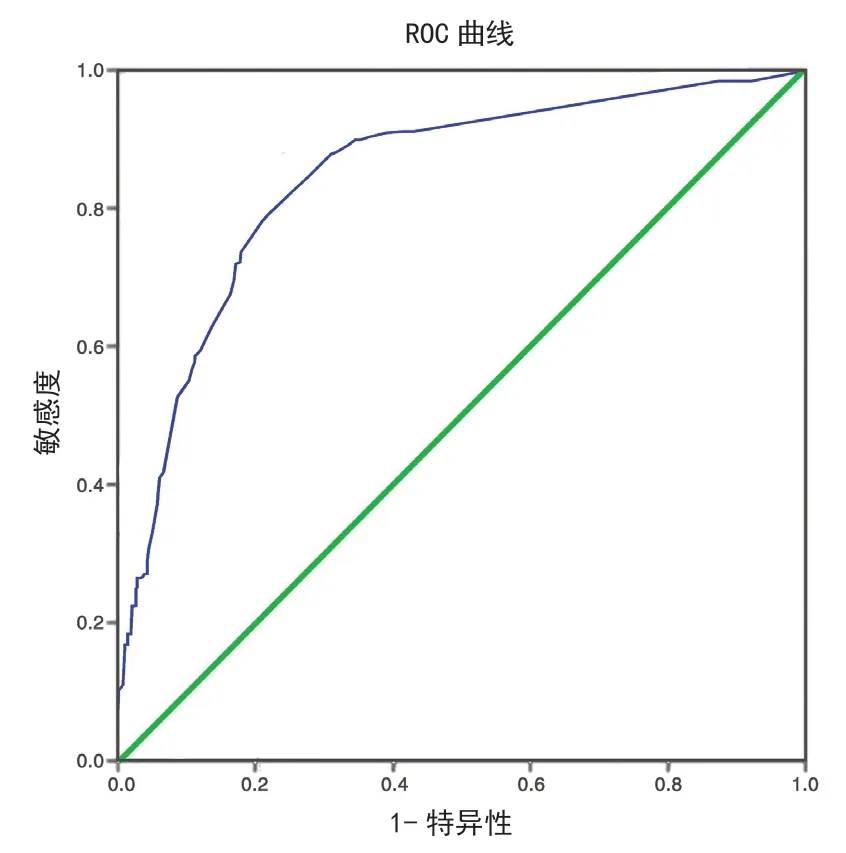
图2 验证组Figure 2 Validation group

表5 验证组新生儿风险等级与低血糖发生率比较Table 5 Comparison of neonatal risk levels and incidence of hypoglycemia in the validation group
3 讨论
3.1 新生儿低血糖情况分析
本研究多元逐步回归分析显示,新生儿低血糖发生率为12.11%,通常早期无症状,与Shah 等[7]调查结果15%的新生儿在12~36 h 内出现低血糖一致,说明健康婴儿经历短暂性低血糖是正常适应宫外生活的一部分。临床观察新生儿体征对检测低血糖既不敏感也不特异,且持续低血糖会增加婴儿神经发育障碍风险[8]。已有研究指出,54.54%低血糖婴儿磁共振成像异常,主要位于大脑的顶叶和枕叶,低血糖持续的天数与磁共振成像异常的显著相关,其可作为区分低血糖性脑损伤诊断和预后的重要工具[9]。
3.2 新生儿低血糖影响因素分析
3.2.1 产前糖尿病 本研究发现,母亲合并糖尿病是影响新生儿低血糖的重要因素,与Peters 等[10]、Hubbard 等[11]研究结果一致。分析原因:母亲合并糖尿病会影响宫腔内胎儿胰岛细胞分泌胰岛素,断脐后中断对胎儿的葡萄糖供氧,继而血糖骤降,导致过渡性低血糖或症状性低血糖。于玲玲等[12]Meta分析显示母亲妊娠期糖尿病、妊娠期高血压、剖宫产新生儿低血糖风险分别是正常新生儿的4.83 倍、5.25 倍、3.6 倍。因此,医护人员对于糖尿病母亲在建档后需加强随访,宣教讲解时强调血糖控制的“五驾马车”,使用连续血糖监测是糖尿病母亲有效的管理办法,能使临床医生更好调整治疗方案,实现最佳血糖控制改变妊娠结局[13]。
3.2.2 血糖检测方式 本研究发现,血糖检测方式是新生儿低血糖的主要影响因素。迄今为止,对检测低血糖的特定体征的可靠性知之甚少,对于不建议常规血糖筛查的足月出生新生儿,体征是怀疑低血糖和开始血糖测量的唯一办法,但体征中只有频繁的呼吸急促才被医护人员识别,出汗或触觉刺激反应都难以评估[14]。临床认为,新生儿出生后1~2 h使用准确的葡萄糖氧化酶法筛查高危新生儿,然后前24 h 每3 h 筛查1 次,此后可适当延长筛查间隔时间,但间隔时间不宜超过8 h。但实际操作中,常用测量葡萄糖浓度方法为床旁非酶血糖仪分析足跟点血采样,干预更具有侵入性,且在低葡萄糖下假阳性和假阴性率高达30%,使用实验室方法酶促反应(葡萄糖氧化酶、己糖激酶或脱氢酶)成本较高且耗时长,最佳方式使用血气分析仪或酶促即时分析仪[15-16]。因此,临床实践中,应加强医护人员以及产妇、新生儿主要照顾者的训练,来增加敏感性。
3.2.3 母亲肥胖 本研究多元逐步回归分析显示,母亲肥胖是影响新生儿低血糖的因素,这与Alfadhli[17]研究一致。孕期肥胖和糖尿病是相当普遍的现象,不良结局不仅限于肥胖孕妇,对后代自身代谢也有影响。分析原因:孕期女性有50%超重,10.9%肥胖,而肥胖者餐后产热作用减少,从而导致胰岛素抵抗增加[18],用时腹部内脏肥胖会导致促炎状态,不利于胎盘功能发展,从而导致新生儿低血糖[19]。较高的孕产妇体质量指数(BMI)与新生儿低血糖密切相关,III 类肥胖母亲所生的婴儿低血糖几率更高,OR=1.3[20]。还有学者研究发现BMI ≥30 更易发生新生儿低血糖,同时增加缺氧缺血性脑病发病率[21]。因此,孕产妇需要改变生活方式,合理管理膳食,加强身体活动,注重体质量监测,对于育龄肥胖女性还应接受有关妊娠期肥胖风险的实施和建议,并建议妊娠前和妊娠间减肥,才能有效降低新生儿低血糖风险。
3.2.4 孕期及哺乳期服用β 受体阻滞剂 本研究结果显示,孕期及哺乳期服用β 受体阻滞剂是新生儿低血糖的影响因素,与Liu 等[22]研究结果类似。β 受体阻滞剂是治疗患心血管疾病的主要药物,暴露在β 受体阻滞剂环境中足月新生儿低血糖风险是未暴露新生儿的3 倍[23]。分析原因:①孕妇循环血容量在妊娠第5 周开始增加,在28~32 周达到最大值,心输出量在16~24 周达到峰值,一氧化碳增加刺激血管内皮细胞中前列环素、松弛素和硝酸的产生,并降低全身血管阻力,继而会影响孕妇的心脏和血管,增加新生儿出现低血糖风险[24]。②β 受体阻滞剂可引起胎盘血管选择性收缩,导致内在的拟交感神经活性,这种对胎盘血流动力学的影响重新分配胎儿血流,出现糖酵解,继而诱发新生儿低血糖。Rosaliede 等[25]Meta 分析结果显示,孕期或哺乳期的孕妇使用受体阻滞剂的副作用是低血糖和心动过缓,建议新生儿葡萄糖在出生后24 h 持续监测,尤其阿替洛尔发生低血糖风险最高,拉贝洛尔发生低血糖风险最低。因此,建议孕产妇如实告知医护人员自身的用药史,对本身合并心衰、冠心病、高血压等基础病者,除使用尽量较低副作用的必需药物外,还应考虑治疗效果,医务人员进行个体化选择和监测,评估母亲和胎儿风险确保安全性[26]。
3.2.5 产前使用ACS 调查结果发现,产前使用ACS、小于胎龄是影响新生儿低血糖的重要因素,这与Uquillas 等[27]研究结果一致。单疗程的ACS通常认为对胎儿是安全的,最近证实了分娩前暴露于ACS 的新生儿也是影响因素之一,多因素调整体质量、胎龄后,ACS 类药物给药后24~48 h 时内分娩是与新生儿低血糖相关的唯一独立影响因素[28]。分析原因:ACS 给药可引起母亲短暂的高血糖症,母亲葡萄糖循环通过胎盘转移,诱发胎儿胰岛素血症,导致新生儿出生时脐带血中皮质醇浓度降低,胎儿下丘脑-垂体-肾上腺功能受到抑制,脐带血糖和C 肽水平较高,出现新生儿低血糖[29]。经过对24~37+6周有自然或医源性早产风险的女性调查结果显示,新生儿出生的前48 h,低血糖发生大部分暴露于ACS 胎儿中,超过1/3 的新生儿血糖低于45 mg/dL,平均血糖值52.24±32.17 mg/dL,低血糖发生率38.4%[30]。因此,对于生长受限的孕妇,早产前应用ACS 可以减少新生儿呼吸系统并发症,但增加低血糖发生率,启动ACS 给药后,科内需完善相关预案,做好充分应对[31]。
3.2.6 新生儿小于胎龄 本研究结果显示,新生儿小于胎龄是低血糖的影响因素,这与Wang[32]结果类似。在世界范围内,多数早产儿、小胎龄儿、大于胎龄儿、母亲糖尿病的新生儿都要接受低血糖筛查以预防脑损伤,但无法根据血糖浓度、低血糖持续时间和相关体征预测哪些新生儿出现脑损伤,使管理复杂化,增加新生儿低血糖风险的相同特征也会增加与低血糖无关的不良结局风险[16]。新生儿小于胎龄者糖原储存能力差,出生后糖原代谢加快,供需不匹配,导致低血糖风险增加。除了胎儿生长受限、高血压疾病等导致医源性出生属于小于胎龄,在自发性早产中也观察到很高比例,表明小于胎龄者分娩中存在胎盘受损情况[17]。尽管足月妊娠减少了新生儿低血糖风险,但小于胎龄,甚至足月儿40~42 周,会增加新生低血糖发生率,这可能与经济原因导致孕期不同营养成分摄入有关[18]。因此,对于小于胎龄的孕妇,哪怕是足月分娩也要重视新生儿低血糖的筛查做好应对措施。
本研究构建的风险预测模型具有一定的可行性和实用性。本研究中采用受试者操作特征曲线即ROC 曲线及Hosmer-Lemeshow 拟合优度检验进行验证,结果显示,该模型的预测结果与实际发生率的吻合度较高。当ROC 曲线下面积>0.7 时,约登指数0.675,灵敏度为77.2%,特异度90.4%,表明本模型预测效果较佳,风险分层具有指导作用[21]。同时验证组中结果校准线高度吻合,拟合优度高。医护人员可借助该模型分析并识别新生儿发生低血糖的危险因素,提高对新生儿低血糖的认识,并针对高危因素的新生儿实施预见性的护理干预,降低新生儿低血糖的发生率,为新生儿低血糖干预方案的制订提供参考和依据。
本研究建立了新生儿发生低血糖的风险预测模型,并进行风险分层,模型有良好拟合优度、预测效果,能为产科、新生儿科早期筛查高危低血糖新生儿提供理论支持。但本研究局限于单胎妊娠产妇且仅为单中心的回顾性研究,对于基层医院、社区医院等尚未验证,后期还需要扩大研究对象范围,开展多中心、大样本研究,从而让风险预测模型切实筛查新生儿低血糖风险,得到更广泛的临床应用,及早干预,避免影响新生儿运动、语言、神经等功能发展。
