镍铁锰酸钠层状氧化物的制备及性能研究
2024-02-11王亿周胡晓梅王永详张维民
王亿周,胡晓梅,王永详,张维民
(山东理工大学化学化工学院,山东淄博 255000)
近年来,锂离子电池在储能领域得到了广泛应用,但由于全球锂资源匮乏、成本高,制约了锂离子电池的可持续发展[1-2]。由于钠离子电池的工作原理与锂离子电池类似,其材料和电芯产线几乎可以通用,这引起了研究者们广泛关注。相比之下,钠比锂的储量更为丰富且价格低廉,同时集流体可以使用铝箔代替价格更贵的铜箔,大幅降低使用成本,因此近年来钠离子电池的发展得到了前所未有的推动[3-4]。
在高性能钠离子电池正极材料的研究中,许多正极材料相继开发出来,且多种材料已成功实现商业化应用,例如层状过渡金属氧化物[5-7]、聚阴离子化合物[8-9]、普鲁士蓝[10-12]等。其中,层状过渡金属氧化物NaxTMO2(TM代表过渡金属)具有成本低、容量高、合成方法简单等特点,非常适用于工业化生产。常见的层状过渡金属氧化物分为O3型(O代表三棱柱)和P2型(P代表八面体),区别在于Na+的配位环境不同,其中“2”和“3”代表氧原子堆积形成周期序列的最小层数,只有在Na+含量不足时才会形成P2型氧化物NaxTMO2(x<1)[13]。NaxTMO2中TM包括单金属、二元金属及多金属。近年来,含有多金属的层状过渡金属氧化物因其可提供更高的电压、更高的可逆容量及减少相变的发生而备受关注。其中,Mn、Fe 金属因其成本低廉、无毒无害等特性,具有很好的应用前景,尤其是采用Mn、Fe金属的O3型Nax(Ni,Fe,Mn)O2层状过渡金属氧化物得到了广泛而深入的研究。
O3 型NaNi1/3Fe1/3Mn1/3O2由KIM 等[14]于2012 年首次采用共沉淀法制备,该材料平均电压为2.75 V,在0.1C 下首次放电比容量为122 mA·h/g,首次库伦效率为81.3%,以硬碳为负极材料组装全电池,循环150 次后可逆比容量保持在100 mA·h/g。之后,WANG等[15]使用NaOH作为共沉淀剂制备出相同材料,在优化条件下所制得材料在0.1C时首次放电比容量为136 mA·h/g,在1C 下循环100次后可逆比容量衰减为99 mA·h/g。DING 等[16]通过制备一系列富Ni 正极材料,研究截止电压分别为4.2 V 和4.0 V下的电化学性能稳定性,探究材料在高压下的相变情况及劣化机制,通过对比发现截止电压为4.0 V时容量保持率较高。为了克服NaNi1/3Fe1/3Mn1/3O2正极材料空气稳定性差(可与空气中的水发生反应造成钠离子流失)的问题,SUN 等[17]通过复烧法恢复NaNi1/3Fe1/3Mn1/3O2材料的结构和性能。然而,在总结相关文献后发现,关于探讨制备材料详细参数的报道非常缺乏,特别是pH对合成钠离子层状正极材料的影响。
本文采用共沉淀法制备了NaNi0.4Fe0.2Mn0.4O2(简写为NFM)正极材料,重点研究pH 对前驱体结构、形貌、循环稳定性和倍率性能的影响,以及材料在-40~40 ℃下的高低温性能。对制备材料的XRD 曲线进行Rietveld细化,并通过循环伏安法(CV)、电化学阻抗测试法(EIS)和恒电流间歇滴定技术(GITT)计算钠离子扩散系数,以探索充放电过程中的电极过程动力学,同时通过赝电容贡献率确定其充放电控制过程。
1 实验部分
1.1 实验试剂与仪器
实验试剂:NiSO4·6H2O、FeSO4·7H2O、MnSO4·H2O、NaPF6、氨水、氢氧化钠、无水碳酸钠、导电碳、聚偏二氟乙烯、碳酸亚乙酯、碳酸二乙酯、氟代碳酸乙烯酯,均为分析纯;N-甲基吡咯烷酮,电子级。
实验仪器:共沉淀反应釜、pH计、蠕动泵、烧杯、磁力搅拌器、循环水浴锅、研钵、卧式快速球磨机、抽滤漏斗、循环水真空泵、新威充放电测试仪、电化学工作站、手套箱、马弗炉、脱泡搅拌机、鼓风干燥箱、真空干燥箱;X射线衍射仪、电感耦合等离子体发射光谱仪、扫描电子显微镜、热重分析仪。
1.2 Ni0.4Fe0.2Mn0.4(OH)2前驱体及NaNi0.4Fe0.2Mn0.4O2正极材料合成
采用共沉淀法制备三元前驱体,具体步骤如下:将NiSO4·6H2O、FeSO4·7H2O和MnSO4·H2O溶于去离子水中配制混合溶液,控制n(Ni)∶n(Fe)∶n(Mn)=4∶2∶4,阳离子总浓度为2 mol/L,另外配制1 mol/L 氨水溶液及2 mol/L氢氧化钠溶液;采用共沉淀反应釜作为反应容器,通入氮气作为保护气,其中氮气流速为0.8 L/h,反应温度为50 ℃,反应过程中精准控制pH分别为10.5、11、11.5、12,将盐、碱及氨水按照一定的流速通入反应釜,加料结束后保持温度为50 ℃陈化4 h;经抽滤、洗涤、干燥后将前驱体置于100 ℃鼓风干燥箱中干燥12 h,再转移至真空干燥箱中100 ℃下干燥6 h,得到Ni0.4Fe0.2Mn0.4(OH)2前驱体。
将制得的Ni0.4Fe0.2Mn0.4(OH)2前驱体与一定量的无水碳酸钠混合,其中钠与金属离子物质的量比为1.05∶1,以保证钠足量;取以上混合样品置于马弗炉中进行两步煅烧,首先在550 ℃下煅烧5 h,再升温至850 ℃保温20 h,升温速率均为5 ℃/min;结束后,对样品进行研磨破碎、过筛,得到NaNi0.4Fe0.2Mn0.4O2正极材料。
1.3 表征方法
采用D8 Advance 型X 射线衍射仪(XRD)分析样品的物相组成,测试采用铜靶,射线波长λ为0.154 06 nm,电压为40 kV,电流为40 mA,扫描范围为10°~80°,扫描速率为10 (°)/min;采用TGA 5500型热重分析仪测定样品在升温过程中的失重情况;采用Quanta 250 型场发射环境扫描电子显微镜(SEM)分析材料的形貌及结构;使用CHI760E 型电化学工作站对电化学性能进行研究;采用CT-4008型测试仪进行电化学性能测试;采用Agilent 5110(OES)型电感耦合等离子体发射光谱仪(ICP-OES)分析测试样品组成及含量。
1.4 电极制备和电池组装测试
将NaNi0.4Fe0.2Mn0.4O2(NFM)正极材料、导电碳(Super P)和聚偏二氟乙烯(PVDF)黏结剂以8∶1∶1的质量比加入到调浆盒中,随后加入适量的N-甲基吡咯烷酮(NMP),并转移至THINKY ARE-310 型脱泡搅拌机中进行搅拌。用刮刀将浆料涂覆于铝箔表面后,置于60 ℃鼓风干燥箱中干燥6 h,再转移至真空干燥箱中110 ℃下干燥12 h,最后裁成直径为12 mm的圆形极片。
CR2032 扣式电池的组装在充满氩气的手套箱中进行,负极采用金属钠片。将NaPF6溶解于体积比为1∶1的碳酸亚乙酯(EC)和碳酸二乙酯(DEC)中配制成1 mol/L 的混合溶液,随后添加5%(质量分数)的氟代碳酸乙烯酯(FEC)配制成电解液。电池测试电压范围为2~4 V。
2 结果与讨论
2.1 表征结果与分析
2.1.1 SEM分析
图1 为不同pH 下所制得NFM 材料的SEM 图。从图1可以看出,4种材料均呈现为由许多片状结构体组成的球形颗粒,且随着pH 的升高,球形颗粒尺寸呈减小趋势。当pH 为10.5 时,颗粒尺寸约为5 μm;当pH 为11 时,颗粒尺寸约为3 μm,尺寸适中;当pH为11.5时,颗粒尺寸约为2.5 μm,颗粒团聚较严重;当pH 为12 时,颗粒尺寸约为1 μm,尺寸最小,且球形颗粒不均匀。这主要是因为随着pH的升高,体系中溶液的过饱和度不断升高,结晶过程中成核速率不断增大,晶体生长速率不断减小,使得材料的小晶核得不到充分生长[18],因此pH 过高时颗粒尺寸锐减。综合来看,当pH 为11 时材料颗粒形貌较为规整。

图1 不同pH条件下所制得材料的SEM图Fig.1 SEM images of materials prepared under different pH conditions
2.1.2 热重分析
对NFM 材料的前驱体进行热重(TG)-微商热重(DTG)分析,结果见图2。由图2 可知,第一阶段为30~200 ℃,质量损失率为3.55%,对应于前驱体中自由水和结合水的挥发;第二阶段为200~470 ℃,质量损失率为6.89%,该过程为Ni0.4Fe0.2Mn0.4(OH)2热分解生成羟基氧化物;第三阶段为470~690 ℃,质量损失率为5.09%,归因于碳酸钠熔融分解并逐渐与羟基氧化物反应形成中间体钠过渡金属氧化物;第四阶段为690~1 000 ℃,质量损失率为7.09%,该过程为NaNi0.4Fe0.2Mn0.4O2的形成过程,其初步形成温度为740 ℃[19],形成结束温度为850 ℃。由以上结果可知,形成NFM 材料的相变过程缓慢,应采取多步煅烧法。因此,本文设计两步煅烧法,首先在550 ℃下煅烧5 h,再于850 ℃煅烧20 h,即整个锻烧过程大体分为分解和相变两步,目的是稳定其晶体形成过程。

图2 NFM前驱体材料的TG-DTG曲线Fig.2 TG-DTG curves of NFM precursor materials
2.1.3 产物成分分析
通过ICP-OES 测试NFM 材料中各金属离子比例,结果如表1 所示。由表1 可以看出,设计比例n(Ni)∶n(Fe)∶n(Mn)=4∶2∶4,实际测试比例n(Ni)∶n(Fe)∶n(Mn)=4.1∶2.0∶3.9,测试值与设计值基本吻合。

表1 NFM材料的ICP-OES测试数据Table 1 ICP-OES test data of NFM materials
2.1.4 XRD分析
图3 为不同pH 条件下所制得NFM 材料的XRD谱图。由图3 可知,所制得NFM 材料的衍射峰均与标准卡片JCPDS#25-0819 相匹配,表明合成了纯相的NFM 材料。其中,NFM(pH=10.5)、NFM(pH=11)与NFM(pH=11.5)材料结晶度较好,而NFM(pH=12)材料的结晶度较差,表明过高的pH 对材料的晶体结构产生不良影响[20]。

图3 不同pH条件下所制得材料的XRD谱图Fig.3 XRD patterns of materials prepared under different pH conditions
为了获得晶体的晶胞参数和结构信息,使用GSASⅡ软件对不同材料的XRD 谱图进行Rietveld精修[21-22],结果如图4 所示。由图4 可知,测试谱图与精修谱图具有较高的吻合度,权重分布因子Rwp和置信度Rp 均较小,表明在误差允许范围内,精修后结果可靠。4 种材料精修后的晶格参数如表2所示。由表2可知,参数c随着pH升高呈减小趋势,4 种材料的c/a值均大于4.94,表明4 种材料晶体均为R3ˉm空间群,属于α-NaFeO2层状结构。其中,NFM(pH=11)材料的c/a值最大,表明该材料具有最佳的层状结构,通常认为这是具备良好倍率性能的前提条件[23]。NFM(pH=10.5)、NFM(pH=11)、NFM(pH=11.5)及NFM(pH=12)材料对应于(003)晶面的层间距分别为5.383、5.357、5.335、5.324 Å,即随着pH的升高,层间距整体呈减小趋势。NFM(pH=11)材料的TM—O键长较短,键能较高,使得NFM(pH=11)材料结构更加稳定。
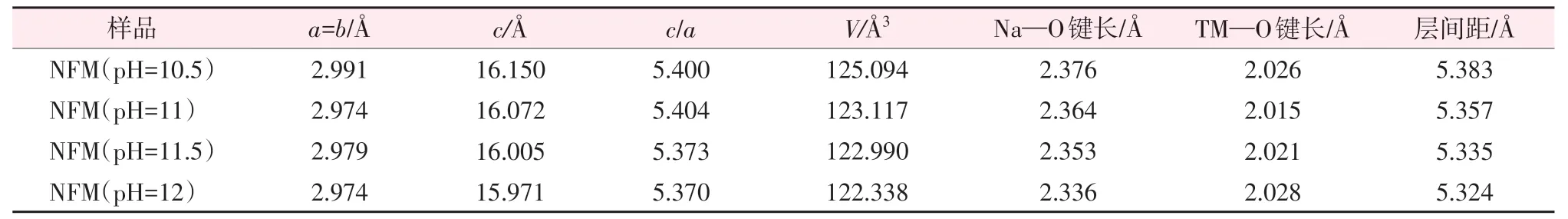
表2 NFM(pH=10)、NFM(pH=10.5)、NFM(pH=11)及NFM(pH=12)材料的晶格参数Table 2 Lattice parameters of NFM(pH=10),NFM(pH=10.5),NFM(pH=11)and NFM(pH=12)

图4 不同pH条件下所制得材料的XRD精修图Fig.4 Rietveld refinement results of materials prepared under different pH conditions
2.2 电化学性能测试
2.2.1 充放电测试
图5a 为4 种NFM 材料的充/放电比容量及电压曲线。由图5a可知,NFM(pH=10.5)、NFM(pH=11)、NFM(pH=11.5)及NFM(pH=12)4 种材料在0.2C下的首次放电比容量分别为133.2、142.3、140.1、135.8 mA·h/g,首次库伦效率分别为94.7%、92.6%、85.5%、93.0%。相比之下,NFM(pH=11.5)材料的首次库伦效率较低,可能与样品团聚严重有关。随着pH 的升高,材料的放电比容量明显提升,其中NFM(pH=11)具有最大的放电比容量,这归因于其粒径大小均匀;但当pH 进一步升高时,放电比容量呈减小趋势,其中NFM(pH=12)材料首次放电比容量最低,这可能是因为其结晶度较差的缘故[20]。
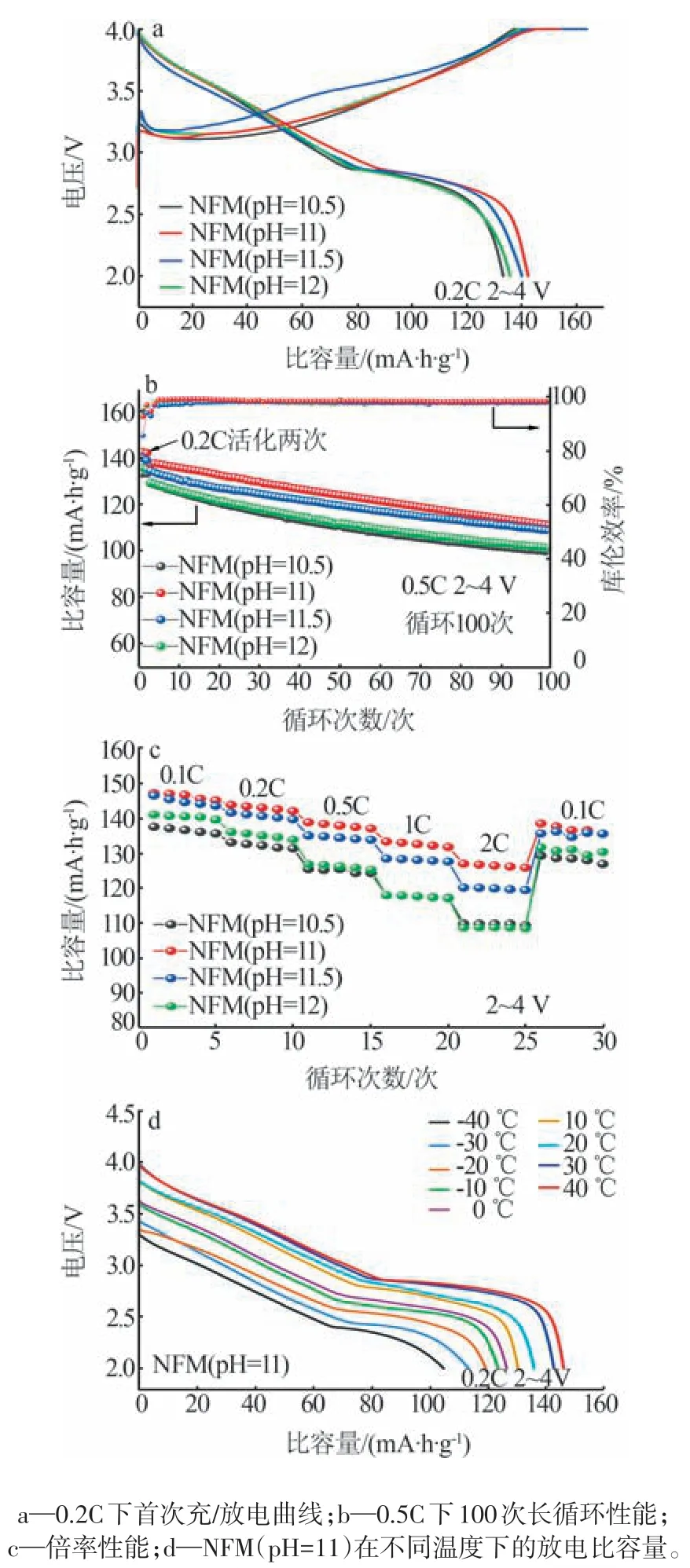
图5 不同pH条件下所制得材料的电化学性能Fig.5 Electrochemical properties of materials prepared under different pH conditions
图5b为4种材料在0.5C下100次长循环性能图(起始两次为活化过程)。由图5b 可以看出,NFM(pH=10.5)、NFM(pH=11)、NFM(pH=11.5)及NFM(pH=12)4 种材料循环100 次后的放电比容量分别为99.6、111.2、108.8、101.4 mA·h/g,放电比容量保持率(初始放电比容量分别为129.0、137.2、134.4、129.5 mA·h/g)分别为77.2%、81.0%、80.9%、78.3%,其中NFM(pH=11)材料放电比容量及容量保持率均最佳,这归因于其形貌良好、粒径均匀、层状结构良好。
图5c 为4 种材料的倍率性能曲线。由图5c 可知,4 种材料在高倍率2C(较0.1C)下容量保持率分别为79.8%、86.2、82.0%、77.0%,其中NFM(pH=11)材料具有优异的倍率性能,这与其较大的(003)晶面层间距相关,该材料在0.1C、0.2C、0.5C、1C、2C 倍率下的放电比容量分别为147.4、144.0、139.0、133.5、127.1 mA·h/g。NFM(pH=10.5)材料的放电比容量低,且倍率性能不佳,这可能是因为低pH 下合成的球形颗粒较大,比表面积较小,导致电解质溶液与活性物质之间的接触几率较小,钠离子嵌入/脱出通道受限,进而影响了材料的倍率性能[20]。然而,并非高pH对应高性能,如NFM(pH=12)。这可能是因为NFM(pH=12)材料的球形颗粒较小,比表面积较大,使得活性材料与电解液的接触几率大幅增加,导致副反应剧增[24];此外,由于NFM(pH=12)材料层间距较小,影响了钠离子嵌入/脱出,且其晶胞参数c/a值最小,层状结构较差,诸多因素导致材料倍率性能较差[23]。综合材料的形貌、晶胞参数及电化学性能可知,NFM(pH=11)的首次充放电性能及容量保持率最好,倍率性能良好,故确定最佳合成pH为11。
为了进一步测试NFM(pH=11)材料在不同温度下的放电性能,首先将电池充电到4 V,之后进行高低温放电实验,结果如图5d 所示。由图5d 可以看出,NFM(pH=11)材料在-40、-30、-20、-10、0、10、20、30、40 ℃下的放电比容量分别为104.7、113.3、119.2、123.5、126.5、130.4、135.9、142.8、146.1 mA·h/g,表明NFM(pH=11)材料具有良好的高低温性能。
2.2.2 交流阻抗测试
为了量化各动力学参数,对材料进行了电化学阻抗测试(EIS)及数据拟合,结果见图6。由图6 可知,交流阻抗分为高频区半圆和低频区直线两部分,其中高频区与X轴Z'的截距为电解液电阻Rs,高中频区半圆为电荷转移电阻Rct,对应于电化学反应过程,低频区直线为Warburg阻抗Zw,对应于钠离子扩散过程。通过Zview 软件进行阻抗拟合,结果见表3。从表3看出,4种材料的电解液阻抗Rs差异不大,NFM(pH=10.5)材料所对应的电荷转移电阻Rct最大,为175.4 Ω,这与其长循环的结果相一致;NFM(pH=11)材料的Rct最小,为124.8 Ω,这归因于其良好的层状结构及更快速的离子通道,表现为较高的长循环容量保持率。通过公式(1)~(2)计算得到4 种材料的钠离子扩散系数DNa+[25]。其中,NFM(pH=11)的钠离子扩散系数DNa+最大(7.6×10-12cm2/s),这有利于钠离子的嵌入/脱出,使其具有良好的倍率性能。
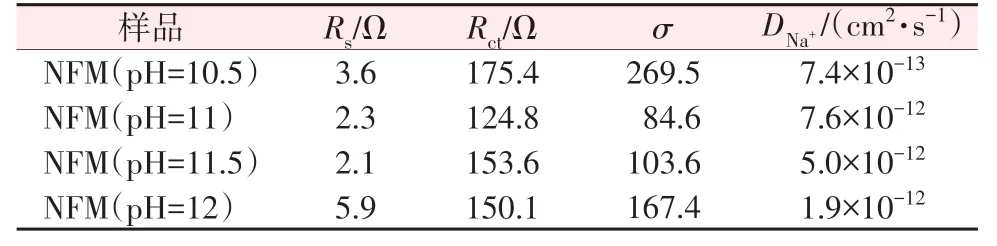
表3 4种材料的阻抗拟合值Rs、Rct和DNa+数据Table 3 Rs,Rct,and DNa+ values from EIS date of four materials

图6 不同pH条件下所制得材料的电化学交流阻抗谱图(a)及Zʹ和频率ω-1/2的线性图(b)Fig.6 EIS curves(a),and relationship of Zʹ and frequency ω-1/2(b)of materials prepared under different pH conditions
式中:σ 为Warburg 系数,Ω·cm2·mol-1;ω为角频率,rad/s;R为气体常数,J/(mol·K);T为绝对温度,K;A为电极面积,cm2;n为转移电子数;F为法拉第常数,C/mol;C为钠离子浓度,mol/L。
2.2.3 GITT测试
为了进一步测试NFM(pH=11)材料的钠离子扩散速率,对其进行了恒电流间歇滴定技术(GITT)测试[26],GITT 曲线及钠离子扩散系数如图7所示。通过公式(3)计算得到,NFM(pH=11)材料的扩散系数DNa+在1×10-11~1×10-10cm2/s波动,与表3通过阻抗计算得到的钠离子扩散系数接近。
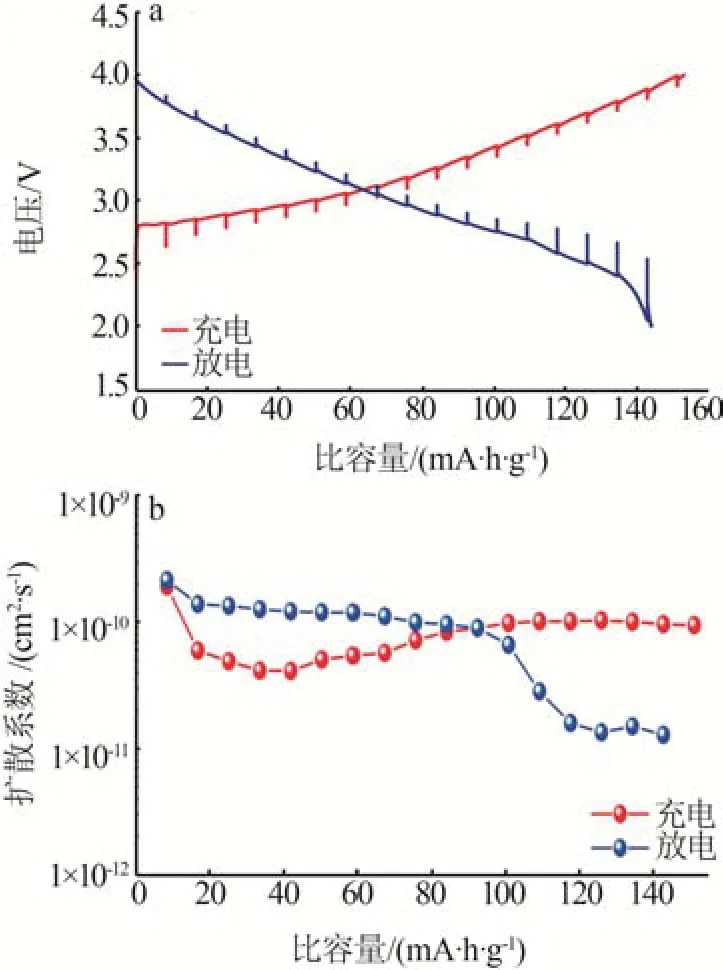
图7 NFM(pH=11)材料的GITT曲线(a)及从GITT曲线中得到的钠离子扩散系数DNa+(b)Fig.7 GITT curves of NFM(pH=11)material(a),and DNa+ extracted from GITT curves(b)
式中:τ为驰豫时间,s;mB为电极物质的质量,g;VM为电极材料的物质的量体积,cm3/mol;MB为电极物质的相对分子质量,g/mol;S为极片的面积,cm2;ΔES为脉冲引起的电压变化,V;ΔEt为恒电流充(放)电的电压变化,V。
2.2.4 循环伏安测试
为了进一步探究NFM(pH=11)材料的电极反应过程,对其进行了循环伏安测试,前3次测试结果如图8a所示。由图8a可知,首次曲线为电极材料与电解液之间发生反应生成SEI 膜,后两次曲线几乎重合,说明材料具有良好的稳定性;循环伏安曲线中存在一对氧化还原峰,分别为3.0 V 的氧化峰及2.5 V的还原峰,对应于Ni2+/Ni4+的氧化还原反应,即O3和P2 相之间的可逆相变[27];电位差为0.5 V,表明材料极化作用较小,具有良好的可逆性能、快速反应动力学及循环性能。此外,在不同扫描速率下对NFM(pH=11)材料进行循环伏安测试,结果如图8b 所示。由图8b可知,随着扫描速率的增加,峰值电流不断增大。使用Randles-Sevcik公式(4)计算得到氧化及还原钠离子扩散系数DNa+分别为1.27×10-11、2.30×10-11cm2/s,与GITT 测试结果接近。根据公式(5)判断电池充放电过程的控制机制[28],结果如图8d 所示。由图8d可知,氧化过程、还原过程的b值分别为0.521 和0.705,位于0.5~1,表明材料由扩散控制与赝电容协同作用,从而使得NFM(pH=11)材料具有快速反应动力学。根据公式(6)计算不同扫描速率下的赝电容贡献率,结果如图8e 所示。由图8e 可知,在0.2、0.4、0.6、0.8、1.0 mV/s 下的赝电容贡献率分别为52%、67%、76%、77%、86%。图8f 为扫描速率为0.8 mV/s时的赝电容贡献率图。
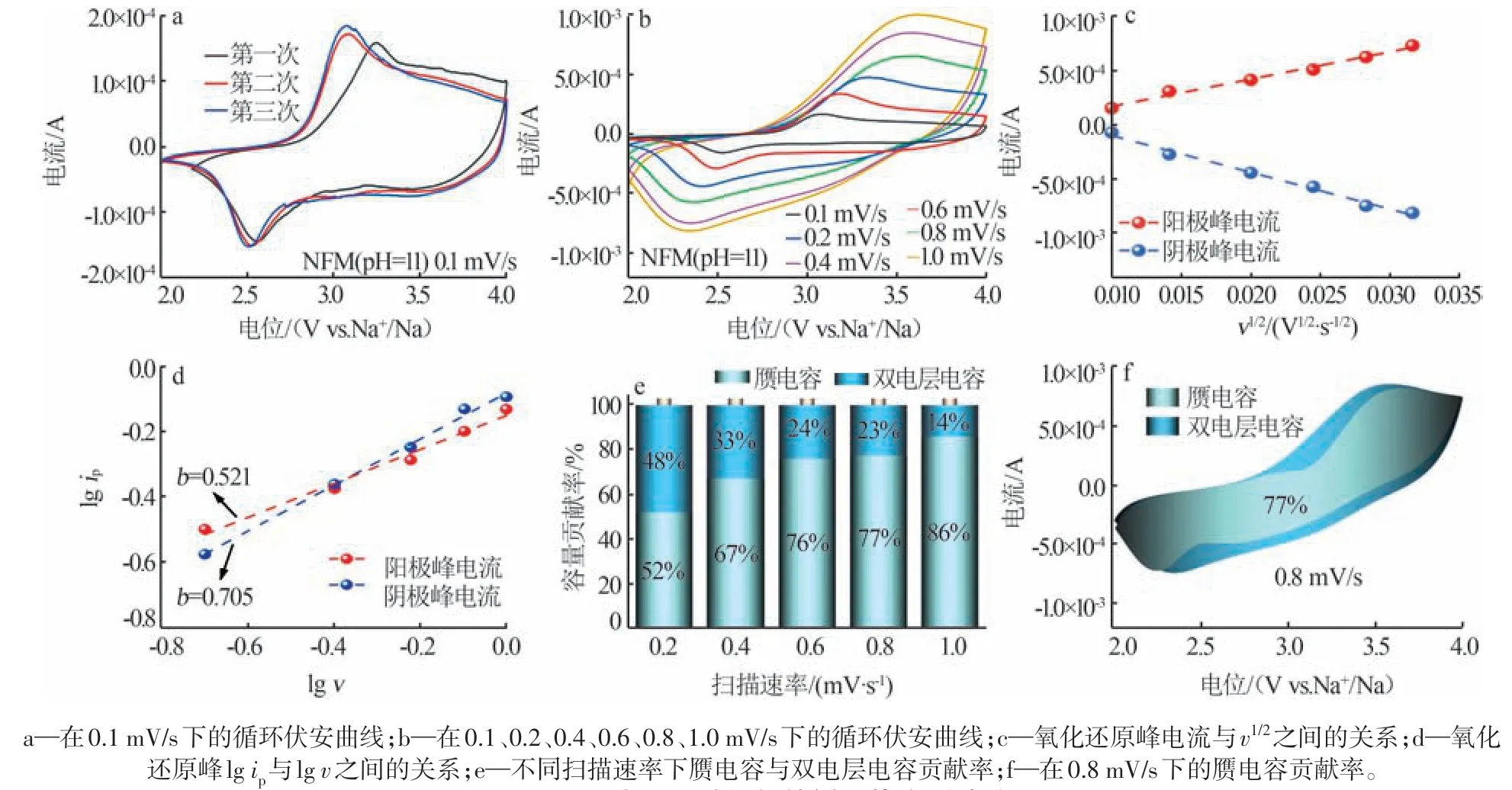
图8 NFM(pH=11)材料的循环伏安测试结果Fig.8 Cyclic voltammetry test results of NFM(pH=11)
式中:ip为峰电流,A;n为转移电子数;A为电极面积,cm2;DNa+为钠离子扩散系数,cm2/s;CNa+为钠离子浓度,mol/L;v为循环伏安测试的扫描速率,mV/s;a、b为可变常数;k1v为赝电容电流,A;k2v1/2为扩散控制电流,A。
3 结论
本工作重点探讨了共沉淀法制备阳极材料前驱体过程中不同pH 条件对钠离子层状氧化物正极材料形貌和电化学性能的影响。实验结果表明:在高pH 条件下制备的产物具有较小的粒径;当pH 为11时所得材料在比容量、首次库伦效率、倍率、电化学阻抗、扩散系数等方面均具有显著优势,即pH=11为最佳条件。材料在0.2C 下的放电比容量为142.3 mA·h/g,首次库伦效率为92.6%,低温-40 ℃下的放电比容量为常温下的82%,综合性能良好。该研究为钠离子电池的大规模生产及实际应用提供了一定的价值参考。
