Surfactin的结构、生物合成及其在生物防治中的作用
2024-02-05王俊芳黄秋斌张飘丹张彭湃
王俊芳 黄秋斌 张飘丹 张彭湃
(河南大学生命科学学院,开封 475004)
脂肽是由微生物产生的一类低分子量生物表面活性剂,这类活性物质具有独特的两亲性分子结构,由氨基酸结合形成极性亲水肽键与由脂肪酸烃链组成的非极性疏水基构成[1]。因此,脂肽类表现出多样的生物活性,如抗菌、抗炎和环境修复等生物活性,其在医药、化工、农业、食品和环境治理等领域都有广泛应用[2-3]。依据肽链拓扑结构的不同,微生物所产脂肽可以分为线性脂肽和环状脂肽。线性脂肽是由氨基酸肽链与脂肪酸链结合形成链状的脂肽化合物。环脂肽是由氨基酸肽链连接成环或肽链氨基酸上的羧基与部分脂肪酸链上的羟基或氨基结合形成内脂键或酰胺键,成为环状的脂肽化合物。根据合成脂肽的基因簇和化学结构的差异,芽孢杆菌(Bacillus spp.)所产脂肽主要有表面活性素(surfactin)、伊枯草菌素(iturin)、泛革素(fengycin)3大家族[4],其结构如图1所示,多为环脂肽形式,它们的脂质部分都是由异构或长度和饱和状态不同的β-羟基脂肪酸(fatty acid, FA)链组成,肽段由7个(surfactins, iturin)或10个(fengycin)L或D型的氨基酸残基组成[5]。本文主要介绍芽孢杆菌分泌的surfactin的结构、生物合成机制、结构多样性及其在农业中的生防作用等。
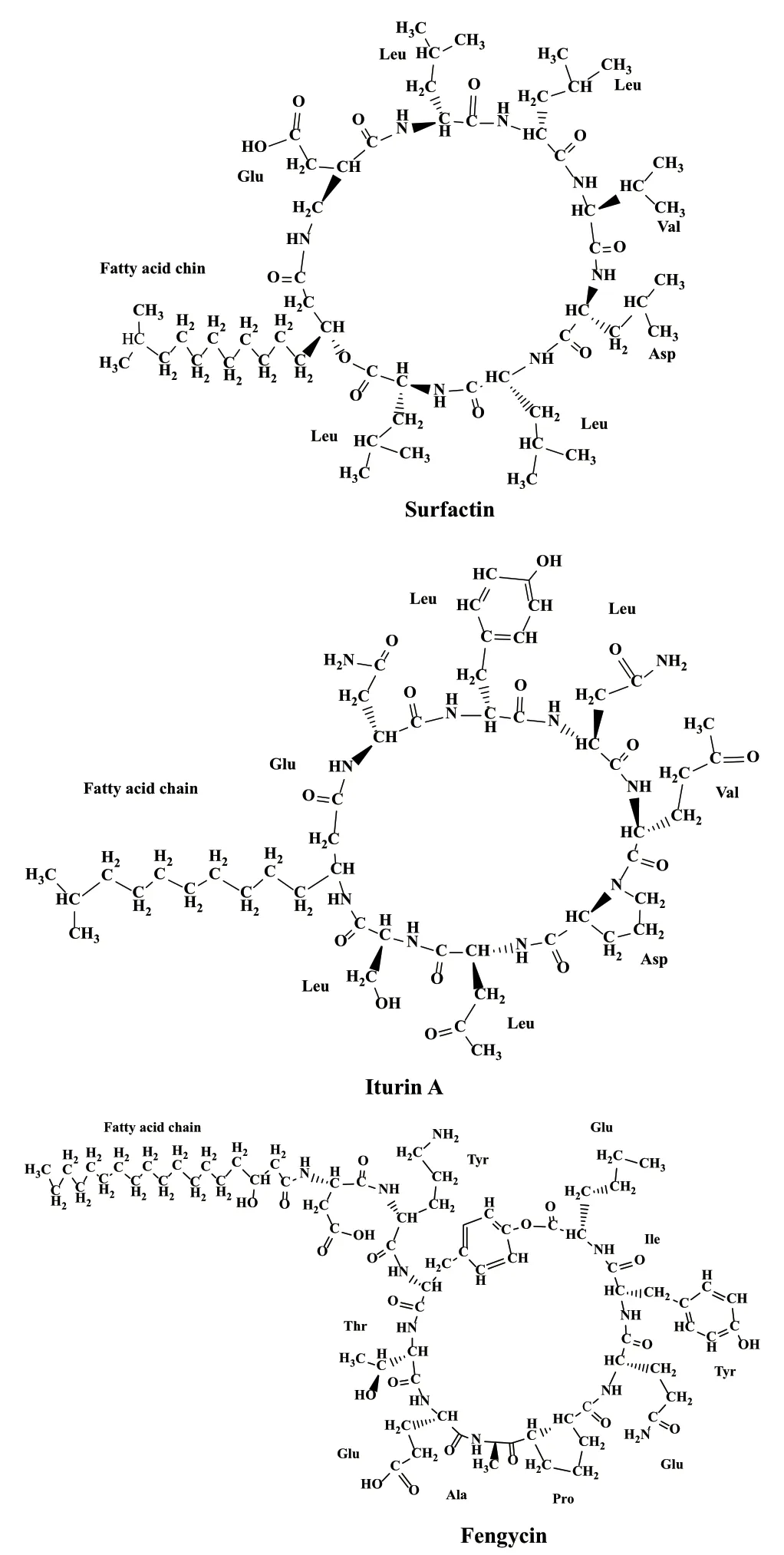
图1 Surfactin、fengycin和iturin A的结构Fig. 1 Structures of surfactin, fengycin and iturin A
1 Surfactin的结构及生物合成
1.1 Surfactin的结构
Surfactin是被研究的最多的生物表面活性剂。1968年,Arima等[6]在研究微生物代谢产物对纤溶系统和凝血系统的影响时发现,了几株枯草芽孢杆菌(Bacillus subtilis)菌株分泌到发酵液中的一种强效凝血抑制剂,经分离纯化凝血抑制剂为浅黄色针状物,由于它的高表面活性超过了十二烷基磺酸钠,因此被命名为“表面活性素(surfactin)”。Kakinuma等[7-8]通过对surfactin氨基酸序列和脂肪酸链分析阐明了其结构,surfactin具有亲水性肽段和亲脂性脂肪酸链的两亲性,有特殊的表面活性。Surfactin是具有共同结构特征的一个脂肽家族,该家族的肽链为七元肽,结构特点是由7个α-氨基酸残基的短肽与链长12-17个碳原子的β-羟基脂肪酸通过内酯键交联组成的环状物质。Surfactin家族典型的氨基酸顺序为:L-Glu1-L-Leu2-D-Leu3-L-Val4-L-Asp5-D-Leu6-L-Leu7,它们具有手性序列[9],位置3和6含有D型氨基酸残基,两个带负电荷的氨基酸残基Glu和Asp组成surfactin的极性部分(在天然surfactin分子中),其分子形成马鞍形构象,导致两个氨基酸残基形成一个极性带负电荷的爪状结构,电离时具有螯合能力(pKa = 5.8),因此,surfactin具有可以通过pH值来控制的螯合和吸附性能。
利用核磁共振氢谱(nuclear magnetic resonance,H NMR)技术检测surfactin的三维结构,研究表明,surfactin存在一个亲水结构域和一个疏水结构域。亲水结构域由环肽的主链及其两个带负电荷的Glu1和Asp5氨基酸残基形成。疏水结构域由脂肪酸链和Leu2、Leu3、Val4、Leu6和Leu7氨基酸残基形成[10],这种双结构域结构使surfactin具有两亲性,因此决定了其具有高的表面活性。浓度为20 μmol/L的surfactin可以将水的表面张力从72 mN/(mol·L)降低到27 mN/(mol·L),这大大低于文献中大多数生物表面活性剂的表面张力[11]。Surfactin在细胞中利用蛋白质在水介质中的β-片层结构形成的特殊构象,从而赋予surfactin分子广泛的生物活性,它们通过几种干扰机制破坏细胞膜结构,具有抗菌活性,如通过类洗涤剂机制使细胞膜溶解、包裹磷脂双分子层,通过离子扩散穿过膜屏障或形成孔状通道等而改变膜的渗透性等生物活性[12-13]。由于不同菌株产生的surfactins的氨基酸残基和脂肪酸链组成不同,变异性大,导致surfactin的生物活性具有多样性。Surfactin具有抗细菌、抗真菌、抗炎、溶栓、环境修复、抗支原体、抗高胆固醇、抗病毒、抗癌活性和对胰岛素抵抗的改善等生物活性[14-22]。
1.2 Surfactins的生物合成
Surfactins的生物合成包括脂肪酸的合成及活化、氨基酸的合成、肽段的合成和释放几部分组成,下面主要介绍其肽部分和脂肪酸的合成。
1.2.1 Surfactins肽部分的生物合成 通过对surfactin脂肽合成相关基因鉴定分析,证明surfactin的肽部分是由非核糖体肽合成酶(nonribosomal peptide synthetases, NRPSs)催化合成[23],这种机制赋予surfactin家族成员的脂肽结构及活性多样化。非核糖体脂肽的生物合成主要分为两部分进行:(1)单体物质(脂肪酸和氨基酸)的生物合成,属于初级代谢;(2)组装和释放,属于次级代谢(非核糖体肽的合成过程见图2)。NRPS是一种由重复模块组成的多模块巨型酶复合体,模块被定义为NRPS的一部分,其功能是将一个特定的氨基酸结合到肽骨架中。模块的顺序通常与产物肽序列共线性,每个模块又可以分解为以下3个主要结构域:腺苷酸(adenylation, A)结构域、巯基化(thiolation, T)结构域(又称肽基载体蛋白(peptidyl carrier protein,PCP-))和缩合(condensation, C)结构域[24]。A结构域识别、选择并激活特定氨基酸,通过与ATP的反应催化特定氨基酸转化为氨基酰基腺苷酸。一些特异性低的A结构域,可以激活结构相似的氨基酸残基,如Val、Leu和Ile等氨基酸,这种低特异性增加了同一NRPS合成的脂肽的结构及活性多样化。活化的氨基酸以硫酯的形式共价结合到T结构域的柔性辅基4'-磷酸泛酰巯基乙胺基(4'-Ppant)臂上,形成氨酰基-S-载体复合物;4'-Ppant辅基的长度为20 Å,可以在相邻的催化中心之间摆动,正是这种灵活性使活化的氨基酸底物能够转移到C结构域[25]。C结构域负责催化(i)新生肽和相邻模块携带的氨基酸之间形成肽键,并允许随后(ii)延伸链易位到下一个模块。C结构域分为几种功能亚型,如LCL结构域催化两个L -氨基酸之间的肽键形成,而DCL结构域则催化L -氨基酸与以D -氨基酸结尾的延伸肽之间的肽键形成。A-T模块被认为是起始模块,C-A-T模块被定义为延伸模块,在几个模块介导的肽延伸循环之后,末端硫酯酶(thioesterase, TE)结构域负责释放完整的线性中间肽,并催化其内部环化[26]。除了上述结构域,NRPS装配线还进一步包括其他修饰结构域,如催化修饰氨基酸结构的差向异构化(epimerization, E)结构域[27]。
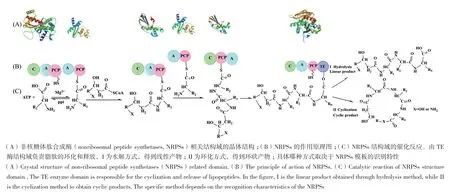
图2 非核糖体肽生物合成的原理Fig. 2 Principle of non-ribosomal peptide(NRP)biosynthesis
Surfactin的生物合成启动模块采用C-A-T结构,而不是经典的A-T结构,该模块包含一个特殊的N-末端C-结构域[28],称为C-起始(CS)结构域,负责已活化β-羟基脂肪酸与第一个氨基酸残基的连接,活性脂肪酸主要来源于初级代谢[29]。对于surfactins家族,催化合成surfactins的酶由srfA操纵子转录,有srfAA、srfAB、srfAC和srfAD四个结构基因编码7模块NRPSs装配线(图3),通过这些基因获得的7模块NRPS装配线中,srfAA编码前3个模块,其包含有CLP生物合成基因簇(biosynthetic gene clusters,BGCs)的N末端典型CS结构域,将第一个氨基酸Glu1与初级代谢产生的β-羟基脂肪酸酰化连接;srfAB编码4、5和6三个模块、srfAC编码第7个模块和末端TE;起始肽随后通过SrfAA、SrfAB和SrfAC的延伸模块以共线性方式延伸,产生线性七肽(FA-L-Glu1-L-Leu2-D-Leu3-L-Val4-L-Asp5-D-Leu6-L-Leu7),立体化学结构可以很容易地分析出模块M3和M6中存在E结构域以及模块M4和M7中存在DCL结构域。SrfAA催化前3位氨基酸的组装,SrfAB催化肽链4-6位氨基酸的组装;SrfAC催化肽链第7位氨基酸的组装,最后,SrfAC的TE结构域催化释放脂肽,并催化在Leu7与β-羟基脂肪酸的羟基之间形成内脂键进行大环化[30-31]。值得注意的是,srfAD编码刺激surfactin生物合成起始的IITE/酰基转移酶,属于水解酶家族成员,该结构域相当于一种支持性修复酶,能够在NRPS组装过程中再生定位错误的T结构域[32-33]。
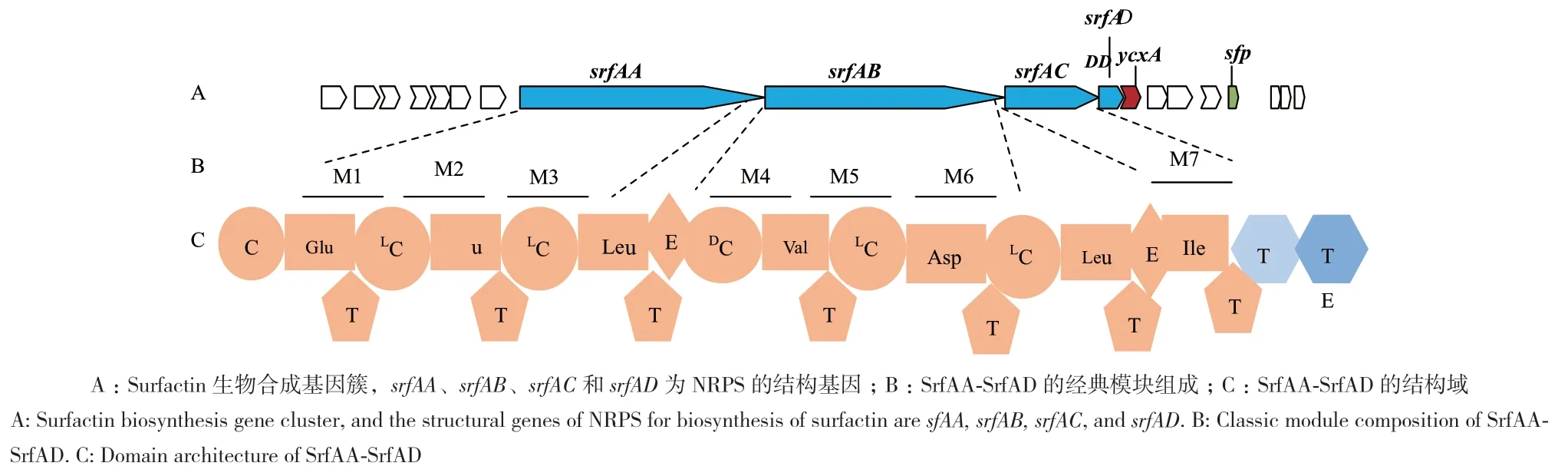
图3 Surfactin合成基因簇组成Fig. 3 Composition of gene cluster of surfactin biosynthesis
除以上结构基因外,surfactin生物合成基因簇(BGCs)还包括一些辅助基因,如编码转运蛋白和调控蛋白的基因ycxA、 krsE和yerP基因,以及与surfactin合成特别相关的基因或调控系统,如sfp、degU、codY基因及感受态调控系统ComQXPA等。
在B. subtilis中surfactin的生物合成受到感受态调控系统ComQXPA(Com是compotence的缩写)的调控,该系统由comX、comQ、comP和comA等4个结构基因组成。相应编码产物为ComX信息素、群体信号传感器ComP一种组氨酸激酶(histidine sensor kinase)和应答调节因子(response regulor)ComA[34-35]。srfA-A与comA基因相隔,磷酸化的ComA(ComA-P)能促进RNA聚合酶与srfA启动子的结合,激活srfA RNA聚合酶的起始转录[36]。全局调控因子CodY和天冬氨酰基磷酸酶Rap负调控surfactin的生物合成,天冬氨酰基磷酸酶Rap 使ComA-P脱磷酸化,阻止操纵子srfA转录[37];过量CodY直接作用于srfA启动子,抑制其转录进行;而全局调控因子DegU正调控surfactin的生物合成[38]。
芽孢杆菌sfp基因位于srfA下游约4 kb处(图3-A),其转录产物Sfp为磷酸泛乙烯基转移酶(PPTase)。NRPS的T结构域是以无活性功能的apo形式新生存在,需在Sfp酶催化下T结构域的柔性辅基4'-Ppant产生一个可与氨基酰-腺苷酸反应的巯基,将T结构域激活为其全活性holo形式,从而在T结构域和氨基酸残基的羧酸基团之间形成硫酯键,氨酰基-S-载体复合物形成。如在B. subtilis 168菌株中剪切部分sfp基因,导致其功能丧失,突变株不能合成surfactin;然而,通过转移一个完整的sfp位点,其互补菌株恢复了合成surfactin的能力,这也证明Sfp对于surfactin的合成必不可少[39]。
在合成surfactin的背景下,编码转运蛋白的基因(如ycxA,位点见图3-A)也是其生物合成的重要基因,这些转运蛋白类似外排泵,从生理学角度来看,外排泵可避免细胞内surfactin的大量积聚,并构成一种基本的自我保护机制[40],特别是由于surfactin具有插入生物膜和在较高浓度导致膜破坏的能力,转运蛋白的生态学原理是使surfactin处于细胞外可能是其正确的位置,在胞外它可以发挥有益的生物活性。到目前为止,已在芽孢杆菌中鉴定出3种参与surfactin外排的转运蛋白,即YcxA、KrsE和YerP。已经证明,相应基因的单独过表达分别使surfactin的外排释放率提高了89%、52%和145%[41]。
1.2.2 Surfactins脂肪酸链的生物合成 由于脂肪酸生物合成在surfactin生产中起着关键作用,并强烈决定了其生物活性和性质,因此对这一中心代谢途径以及导致脂酰-CoA前体修饰和激活的后续步骤进行总结。脂肪酸的合成在细胞溶胶中进行,包括脂肪酸链自乙酰-CoA获得两个碳原子单元,从而增长链长的若干步骤。第一轮回的产物是丁酰-ACP,丁酰-ACP可以进入第二轮回的碳链延伸。如此下去,每一循环碳链即延伸两个碳原子单元[42]。乙酰-CoA被用作合成直链脂肪酸的底物,而支链脂肪酸(branch chain fatty acid, BCFA)的合成由异丁酰基-CoA、异戊酰基-CoA和甲基丁酰基-CoA作为底物,这些前体分别来源于Val、Leu和Ile等支链氨基酸的分解代谢。碳链延伸至终产物形成,终产物脂酰-ACP在脂酰-ACP硫酯酶催化作用下FA被释放,游离出来。
长链FA被合成后,surfactin生物合成所需的下一个步骤是对底物长链FA的活化,即β-羟基酰基-CoA的生成。Youssef等[43]基于体外测定,研究表明酰基羟基化发生在与辅酶A(CoA)连接之前,催化FA前体羟基化的YbdT是一种细胞色素P450酶。枯草芽孢杆菌基因组包含8个编码细胞色素P450酶的基因,B. subtilis OKB105菌株的ybdT突变菌株产生的surfactin中只有2.2%的β-羟基化C14的FA,而菌株的97.8% surfactin为含有链长C12和C14-C18的非羟基化FA[44]。羟基化FA和CoA通过脂酰-CoA连接酶(FACS)催化,生成相应的β-羟基酰基-CoA衍生物,至此FA被活化完成。在B.subtilis基因组同源性搜索中确定4个FACS(LcfA、YhfL、YhfT和YngI),其中LcfA和YhfL在体外鉴定中参与了surfactin的合成,利用液质联用技术(high performance liquid chromatography- mass spectrometry,HPLC-MS)对FACS的活性分析表明,LcfA和YhfL可催化CoA和各种羟基化FA底物(β-OH C8、β-OH C10、C12和C14)形成β-羟基酰基-CoA。最后,surfactin合成酶NRPSs装配线可以在β-羟基酰基-CoA衍生物存在的情况下启动,在由N-末端缩合(CS)结构域进行催化的反应中,活化的FA最终转移到surfactin合成酶NRPSs装配线上,并与第一个氨基酸相连接。如上所述,该反应负责启动脂肽的初始合成[45]。
2 Surfactin家族结构多样性
枯草芽孢杆菌(B. subtilis)、贝莱斯芽孢杆菌(B.velezensi)、解淀粉芽孢杆菌(B. amyloliquefaciens)、地衣芽孢杆菌(B. licheniformis)和短小芽孢杆菌(B.pumillus)等多种芽孢杆菌能合成surfactin(美国国家生物技术信息中心)。Surfactin是由多种结构相似同系物组成的混合物,统称为surfactin家族,其结构上的差别主要在于脂肪酸链的长度以及肽环特定氨基酸种类的不同。根据多肽第7位氨基酸的不同,将surfactin的同系物分为A、B、C三类:Surfactin A类的第7位氨基酸为L-Leu7,其结构是由一个手性序列七肽(L-Glu1-L-Leu2-D-Leu3-L-Val4-L-Asp5-DLeu6-L-Leu7)与一个有12-17个碳原子的β-羟基脂肪酸相连[46-48]。Surfactin B类肽链上第7位氨基酸为L-Val7,其同系物与标准surfactin A的结构不同,命名为Val7 surfactin同系物[49]。Surfactin C类肽链的第7位氨基酸为L-Ile7,被命名为Ile7 surfactin同系物[50]。此外,由 B. licheniformis菌生物合成的脂肽地衣素(lichenysin)也隶属surfactins家族,理化性质与surfactin极为相似的脂肽类表面活性剂。然而,lichenysin与 surfactin A不同在于,前者第一位氨基酸残基是Gln而不是Glu,该类脂肽表面活性更高,还是很好的螯合剂[51]。由B. pumillus生物合成的脂肽短小酸素(pumilacidins)也隶属surfactins家族,Pumilacidins与surfactins A的不同之处在于第4位的Leu4取代Val4,第7位的Val或Ile取代Leu[52]。此外,还观察到surfactins不同程度的其他结构多样性,如对于同一菌株,所产生脂肽的一个氨基酸残基发生变化,从而形成不同的肽链,这种变化的起源是由于NRPS中A结构域的低特异性,对于2、4和7位置的氨基酸存在更大的可变性,接受的氨基酸属于脂肪族氨基酸(Leu、Val、Ile和Ala);对于其他位置1、3、5和6的氨基酸缺乏可变性,可能是由于氨基酸的类型(Glu1和Asp5带负电荷)和差向异构(位置3和6处为D-Leu)原因。但是,位置5的亲水性残基Asp5可以被修饰,它被甲基化并转化为相对疏水的Asp-4-甲基酯[53]。
对于surfactins家族,除了肽链的变化外,FA链的结构也会发生变化,如FA链会发生长度、饱和度和异构等结构变化。FA链的长度从C12-C17个碳原子不等,主要是具有14和15个碳原子长度的异构体。并且有直链、支链、异构(Iso)链或反异构(anteiso)链等结构形式,从而增加surfactin类生物分子的数量[54]。脂肪酸的Iso形式存在于所有碳链长度中,而anteiso形式存在于不均匀碳链长度中。在研究中还发现生物合成酯化的surfactin,如由B. subtilis HSO121菌株产生的单甲基酯-surfactin和B. licheniformis HSN221菌株可产生两种单甲基酯-surfactin和一种单甲基酯-lichenysin,具有抗癌细胞活性[55-56]。
3 基因工程提高surfactin产量及其衍生物开发
3.1 提高surfactin产量
利用基因工程技术开发基因修饰的突变菌株,以解除surfactins生物合成中的反馈调节作用,提高surfactin产量,如对非核糖体肽合成酶(NRPS)的调控基因进行修饰,促进信号肽、转运蛋白或辅助蛋白的过表达等作用。刘皓等[57]通过转录组分析鉴定B. subtilis THY-7菌株中surfactin合成酶原启动子PsrfA的局限性,设计人工强诱导型启动子Pg3替换基因组中原启动子PsrfA,增强surfactin合成酶表达;又通过强化脂肪酸生物合成关键基因,并优化surfactin发酵条件,使突变菌株surfactin产量比野生型提高了75%。Wang等[58]在B. subtilis菌株中发现bkd操纵子的bkdAA和bkdAB基因负调控surfactin的生物合成,利用CRISPR(clustered regularly interspacedshort palindromic repeats)干扰技术抑制该操纵子的bkdAA和bkdAB基因表达,使surfactin产量增加5.8倍。周泽宇等[59]利用基因工程方法,切断支路代谢途径策略,敲除B. amyloliquefaciens NK-△LP 菌株中Iturin和Fengycin合成酶基因簇,强化合成surfactin的脂肪酸前体供应,并分别过表达了与swarming相关的SwrC蛋白、跨膜转运蛋白YbfB和4'-磷酸泛酰巯基乙胺基转移酶Sfp等酶,使surfactin产量显著提高到50.17 mg/L。Klausmann等[60]对不产surfactin的B. subtilis 168菌株进行基因突变,得到sfp+突变菌株JABs32,该菌株spo0A位点和abrB(其基因产物从96个氨基酸延长到107个氨基酸)位点的突变与高细胞密度补料间歇工艺相结合,致使surfactin的产量提高21倍。
3.2 Surfactin新衍生物开发
Hu等[61]研究发现随着Arg、Gln或Val的添加,增加了B. subtilisTD7中偶数β-羟基脂肪酸组分的C14和C16的surfactin的比例增加,而Cys、His、Ile、Leu、Met和Ser的添加增加了B. subtilis TD7中奇数β-羟基脂酸的比例;通过敲除位于bkd操纵子(包括lpdV、bkdAA、bkdAB和bkdB基因)的lpdV基因,nC14surfactin的比例增加了2.5倍,该基因负责acyl-CoA中支链氨基酸(branch chain amino acid,BCAA)降解的最后一步,脂肪酸前体供应对修饰surfactin的脂酰部分的重要性被证明。B. subtilis PB2-L1为产生surfactin菌株,Jiang等[62]采用同源重组方法成功敲除了B. subtilis BP2-L1菌株中NRPSs合成酶的SrfA-A-Leu、SrfA-B-Asp和SrfA-B-Leu模块,结果产生了3种新的surfactin脂肽产品,分别缺乏氨基酸Leu-3、Asp-5或Leu-6;与野生菌株产的天然surfactin相比,ΔLeu-3和ΔLeu-6 surfactin表现出毒性变低,而ΔAsp-5 surfactin对短小芽孢杆菌(B.pumilus)和黄体微球菌(Micrococcus luteus)的抑制作用强于天然surfactin。Eppelmann等[63]开发非核糖体肽合成酶选择性编码,为合理设计新型脂肽抗生素提供可能。Mootz等[64]利用一种新的基因工程技术,通过交换催化亚基来重新编辑NRPS的模块化结构,得到杂交的NRPS,在NRPS装配线中删除整个模块,获得了预测的环尺寸减小的脂肽抗生素变体。
4 Surfactins对植物病害的生防特性及作用机制
4.1 Surfactins对植物病害的生防特性
4.1.1 抑制病原体 Surfactin的生物活性与其特定的化学键和亲水亲油基团独特的性质相关,在农业生产中,surfactin对细菌、真菌及病毒都有一定抑制作用,可以作为生防制剂,其在菌体生物膜形成、叶面或根际定殖和抑制或杀死病原菌等生防方面都发挥重要作用(图4)。如生防菌株B. subtilis VD18R19产生的surfactin类产物对胡椒花叶病具有显著的生防效果,防效达87.18%[65];不产生surfactin的B. subtilis 168菌株,其重组菌株B168S具有产surfactin能力;利用两菌株处理黄瓜种子,重组菌株在黄瓜根部的定殖量相对提高,同时,对尖孢镰刀菌(Fusarium oxysporumf. sp. cucumerinum,Foc)侵染引起的黄瓜枯萎病防效相对增强。研究结果说明surfactin可明显促进菌体在黄瓜根部的定殖,并通过抑制Foc的侵染增强对黄瓜枯萎病的防治效果[66]。香蕉内生细菌B. amyloliquefaciens G9R-3菌株对香蕉枯萎病菌(Fusarium oxysporum f. sp. cubense race 4, Foc4)具有较强抑制活性,体外检测其产生的surfactin类化合物能抑制病原菌Foc4菌丝的生长和孢子的萌发[67]。生防芽孢杆菌SPB菌株产生的surfactin A对Fusarium oxysporum、F. moniliforme、F.solani、Trichoderma atroviride和T. reesei均有较强的抑制活性,surfactin A能显著降低水稻恶苗病发病率达80%[68]。Laird等[69]研究发现番茄细菌性溃疡病生防菌株B. velezensis 1B-23和Bacillus spp. 1D-12产生的脂肽C13-surfactins A、C14-surfactins A和C15-surfactins A均能抑制病原菌Clavibactermichigan sub(Cmm98-1)的生长。生防菌株B. subtilis 9407对果斑病菌(Acidovoraxcitrulli)的体外抑菌活性较强,活体检测对甜瓜幼苗果斑病的生防效果达61.7%,经检测该菌株的主要抗菌物质是C13-C16的surfactins,其在菌体生物膜形成、聚集运动、叶面定殖和抑制A. citrulli生长等方面都发挥重要作用[70]。
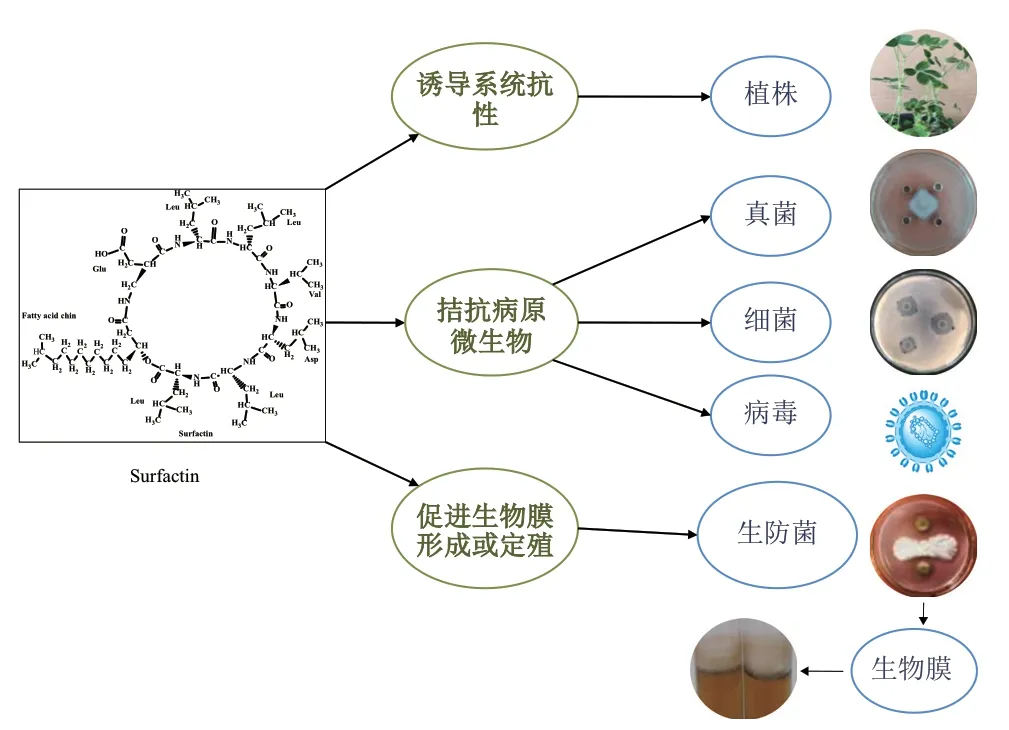
图4 Surfactin的生防作用示意图Fig. 4 Schematic representation of biocontrol effects of surfactin
4.1.2 诱导植株产生系统抗性 Surfactin还具有能够刺激宿主组织产生免疫相关反应的生物学功能,这有助于增强植株对病原体的抵抗作用(图4)。B.subtilis GLB191是一株防治葡萄霜霉病的有效生防菌,其产生的脂肽surfactin和fengycin对葡萄霜霉病都具有显著的防效,经检测脂肽的这种生防作用既来自对病原菌的直接抑制作用,也来自对植株的防御刺激(诱导植株防御基因表达),即诱导植株产生系统抗性(induced systemic resistance, ISR)[71]。任鹏举等[72]将生防菌株B. subtilis OKB105产生的脂肽surfactin配成溶液,处理感染烟草花叶病毒(tobacco mosaic virus,TMV)的烟草,结果显示surfactin对TMV病防治效果显著,并诱导烟草植株的系统抗性。B. velezensisMS20菌株产生的surfactin具有抑制立枯丝核菌(Rhizoctonia solani)菌丝生长的特性,用surfactin处理感染了R. solani的玉米植株,能有效降低玉米纹枯病的发病率,经检测抗性玉米植株细胞产生的防御酶量相对提高,说明surfactin诱导了玉米植株的系统性抗性[73]。生防菌B. amyloliquefaciens S499产生的surfactin,温室试验其对小麦叶枯病的防效达70%;体外抑菌试验表明,surfactin对小麦叶枯病原菌Zymoseptoriatritici无抑制作用,而surfactin通过刺激小麦细胞水杨酸和茉莉酸依赖的信号通路,诱导小麦植株系统抗性防御小麦叶枯病[74]。Rodrguez等[75]研究显示,施用由B.subtilis菌株产生的surfactin处理花生植株,显著降低了齐整小核菌(Sclerotium rolfsii)感染引起的花生白绢病的发病率,受感染植株的过氧化物酶活性和酚类化合物在真菌感染区下方的沉积量明显增加,证明surfactin诱导了花生植株对S. rolfsii的系统抗性的能力。Cawoy等[76]通过对特定菌株的研究,建立了一项涉及一系列天然菌株的比较研究。首先测试它们的分泌物用于诱导在培养烟草细胞的早期防御情况,确定surfactin是刺激植物免疫相关反应的主要化合物。基于宏观的病情减轻和作为防御机制的Oxylipin途径的刺激,评估了6个野生分离株对植株系统抗性的诱导能力。研究发现,菌株的防御诱导活性与其产生的surfactin的量有较强的正相关性。
4.2 Surfactin对植物病害的生防机制
Surfactin在作物生防中的抑菌或杀菌作用机制较复杂,目前的研究发现主要有以下几种生防作用机制:(1)阻碍DNA复制,抑制蛋白质合成,阻止病原菌繁殖。如从B. brevis KN8菌株中提取的surfactin可防治病原菌F. moniliformme对玉米籽粒的感染,经体外检测显示,该surfactin对F.moniliformme菌丝生长有抑制和损伤作用,生化分析结果显示,其破坏了病原菌F. moniliformme的DNA和部分蛋白质,谷胱甘肽(glutathione, GSH)含量下降[77]。(2)诱导植株系统抗性,产生防御酶来抵御病原菌侵染。从B. pumilus W-7菌株发酵液提取的surfactins和fengycin B脂肽,通过协同作用可有效降低马铃薯晚疫病的发病率。Fengycin B通过诱导菌丝变形、氧化损伤和线粒体功能障碍抑制P. infestans菌丝体菌丝生长;Surfactin通过加强植株防御基因(pod、pal和cat)表达,提高了(POD、PAL和CAT)酶活,诱导马铃薯的植株防御反应以抵抗晚疫病的发生[78]。Henry等[79]研究植物细胞表面感知surfactin的机制,结合烟草细胞中的氧化诱导、结构/活性关系、竞争抑制、植物膜内动力学以及模型质膜参数的热力学测定数据表明,烟草细胞对surfactin的感知依赖于烟草细胞质膜水平的脂质驱动过程,即脂质双分子层的传感器作用。(3)损伤病原菌细胞膜,引起细胞膜裂解或渗透压失衡。Carrillo等[80-81]利用傅里叶变换红外光谱(fourier translation infrared spectroscopy, FTIR)跟踪surfactin对细胞膜磷脂双分子层不同组分的影响,对棕榈酰油酰基磷脂酰胆碱(palmitoyl oleoyl phosphatidylcholine, POPC)振动的CO拉伸模式的影响表明,surfactin脂肽引起了膜强烈的脱水;另一方面,CH拉伸带表明surfactin与磷脂酰链相互作用,导致膜流态化;以上的试验发现有助于解释surfactin诱导形成膜孔隙,最终导致细胞内容物泄漏,菌体死亡。(4)促进生防菌株的定殖或生物膜的形成,增强生防能力。如不合成surfactin的B. subtilis168菌株,其重组菌株B168S具有合成surfactin能力,利用两菌株处理黄瓜种子,结果表明surfactin可促进重组菌株B168S在黄瓜植株根部的定殖作用[66]。Surfactin在生防菌株B. subtilis 9407生物膜形成、聚集运动和叶面定殖等方面都发挥重要作用[70]。
5 总结与展望
通过对surfactin的生防特性及作用机制总结,在植物病害防治上,surfactin对黄瓜枯萎病、小麦纹枯病、水稻恶苗病、葡萄霜霉病、烟草花叶病毒病和花生白绢病等多种作物病害都有较好生防作用[66-71]。但是,surfactin的生防作用机制较复杂,对于surfactin抑制植物病原菌生长的作用机制尚未完全阐明,其既有细胞膜靶点作用机制,如形成膜离子通道、跨膜孔隙或广泛的膜破裂等方式导致微生物细胞的裂解;也有细胞内非膜靶点作用机制,如DNA、RNA、蛋白质或酶等;还有诱导植物系统抗性、促进生防菌的定殖和生物膜的形成等特性。Surfactin的抑菌活性可能是以上这些特性共同作用的结果,这表明surfactin的抑菌机理有待进一步研究分析。
基于surfactin对多种作物病害有较好的生防效果,抑菌普广泛,对多种作物有诱导系统抗性作用,surfactin可作为生防制剂或植物生长促进剂进行开发利用。Surfactin作为天然的生防制剂与化学农药相比有以下优点:毒性相对低[82]、生物降解性高、更环保、极端条件(温度、酸碱度和盐离子浓度)比活性高,以及可以利用可再生原料生产的特性等[83-87]。因此,surfactin在农业上可作为生防制剂或植物生长促进剂进行重点研发应用。
鉴于surfactin的抑菌杀菌方面的生防潜力及其多样的生物活性,可以利用基因工程技术的优势,探索和生产更多样化碳骨架的surfactin。开发新型的surfactin及其衍生物,不仅有重要应用价值,而且有利于从分子水平上深入研究和阐明不同亚型surfactin的结构、功能及作用机制等,对改进surfactin的表面活性、稳定性、抑菌谱和可溶性等具有理论意义。