三种主要真菌毒素及其毒素降解酶的研究进展
2024-02-05向霞朱恩恒韩楠玉
向霞 朱恩恒 韩楠玉,
(1. 云南师范大学生命科学学院,昆明 650500;2. 生物能源持续开发利用教育部工程研究中心,昆明 650500)
真菌毒素是由来自青霉属、曲霉属和镰刀菌属的真菌在谷物的生长、收获、储存和加工等过程中产生的有毒次级代谢物[1-2]。据报道,已发现来自100多种真菌产生的400多种真菌毒素会对人和畜禽的健康造成不同程度的影响[3]。真菌毒素对畜禽和人类的威胁主要包括三个方面:(1)受真菌毒素污染饲料喂养的动物会出现多种问题,如生产性能变差、繁殖率降低、免疫抑制、组织器官损伤和病变等[4-5];(2)在严重的情况下,动物会面临致癌、致畸甚至死亡的风险,同时,受真菌毒素污染的饲料会降低或完全失去营养和饲用价值,导致农户经济的巨大损失[6];(3)人类食用含有霉菌毒素残留的农产品会对健康产生不良影响[3]。
全球动物生产中,饲料谷物中真菌毒素污染作为一个经济问题一直受到各国的重视。联合国粮食及农业组织的研究表明,全球超过25%的粮食作物受到真菌毒素污染[7-8]。我国饲料中普遍存在真菌毒素污染问题,其中以黄曲霉毒素(aflatoxins,AFs)、玉米赤霉烯酮(zearalenone, ZEN)和脱氧雪腐镰刀菌烯醇(呕吐毒素,deoxynivalenol, DON)最为严重[9]。针对这种情况,我国在2017年《饲料卫生标准》中新增了对黄曲霉毒素、玉米赤霉烯酮及呕吐毒素在“泌乳期精料补充料” “犊牛、羔羊精料补充料”及其他精料补充料的限制含量[10]。然而,这三种毒素在饲料中共存率较高,并且共存具有叠加毒性[11-13],即使每种真菌毒素的含量都未超标,叠加的毒性累积仍会对人畜产生极大危害。因此,有必要采用脱毒或解毒等方法处理饲料中的这三种真菌毒素。本文详细阐述了黄曲霉毒素、玉米赤霉烯酮和呕吐毒素这三种毒素的分子构象、危害机制、降解途径以及相关的毒素降解酶。这些内容为保护畜禽健康、确保饲料安全以及应用酶法降解真菌毒素提供了参考素材。
1 真菌毒素分子构象及危害机制
1.1 黄曲霉毒素
黄曲霉毒素(aflatoxins, AFs)是由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)等霉菌产生的一类化学结构相似的双呋喃香豆素衍生物[14]。已知约20种AFs衍生物,包括AFB1、AFB2、AFG1、AFG2和AFM1等(图1)。其中,AFB1毒性最强而被归类为一级致癌物[15-16]。AFM1被列为二级致癌物[17]。Matumba等[18]研究发现,玉米和花生中黄曲霉毒素G1含量通常与B1黄曲霉毒素相等或更高。
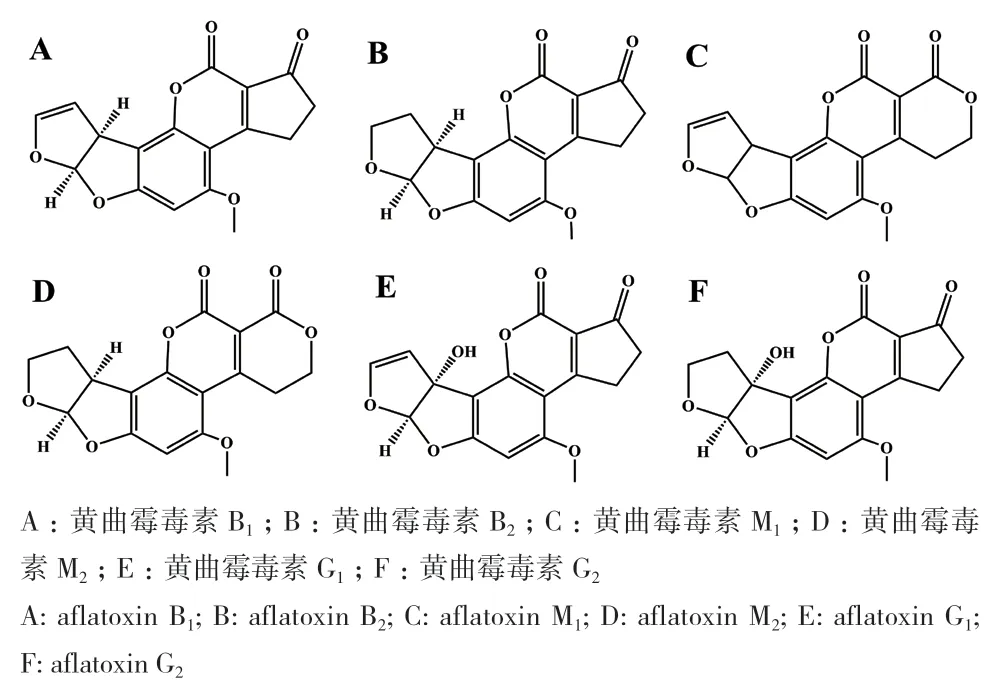
图1 AFs毒素衍生物Fig. 1 AFs toxin derivatives
AFB1是AFs中强毒成分。食用超标食物或饲料会损害肝脏,甚至导致肝癌。随着AFB1浓度增加超过10 μmol/L时,会加速细胞氧化,引发DNA损伤、染色体异常分裂及细胞凋亡[19]。AFB1代谢成AFB1-8,9-环氧化物会与肝细胞DNA分子结合进而导致肝癌[20]。人类和哺乳动物摄入过量AFB1,肝脏部分羟基化形成致毒的四羟基化代谢物(AFM1)积累在母乳中,在哺乳过程中危害幼体[21-22]。
1.2 玉米赤霉烯酮
玉米赤霉烯酮(zearalenone, ZEN)是真菌毒素中的一种有机化合物,主要由禾谷镰刀菌(Fusarium graminearum)、枯草镰刀菌(F. culmorum)等所产的类雌激素样真菌毒素(图2-A)[23-24]。
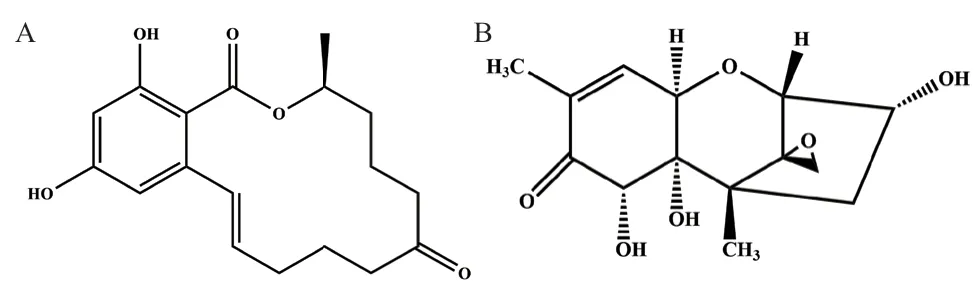
图2 ZEN(A)和DON(B)结构图Fig. 2 ZEN (A) and DON (B) structure diagram
研究表明,ZEN会干扰细胞的早期分化过程[25],对畜禽的生殖功能造成不良影响。其主要通过扰乱睾丸间质细胞(LCs)的合成和影响睾酮的分泌,其作用机制包括以下几个方面:(1)干扰LCs的功能,降低睾酮水平,从而对生殖能力产生不良影响[26];(2)激活Wnt/β-catenin信号通路:ZEN能够通过上调WNT1和β-catenin的表达来激活Wnt/βcatenin信号通路,促进猪子宫内膜上皮细胞的增殖和发育,导致猪的子宫肥大和生殖障碍[27]。
1.3 呕吐毒素
呕吐毒素(deoxynivalenol, DON)是一种水溶性三烯真菌毒素,主要由镰刀菌属(Fusarium)中的禾谷镰刀菌(F. graminearum)和黄色镰刀菌(F.culmorum)产生。它能够污染玉米、大麦、小麦、大米和其他谷物农产品(图2-B)。
DON因其会引起动物呕吐的特性而得名。动物食用被DON污染的饲料会出现呕吐、食欲下降等症状。大量研究表明,长期暴露于高浓度的DON可能导致动物免疫抑制、生长发育受损、生殖问题和器官损害等健康问题; 并且DON具有致癌、致畸和致突变作用[28]。其通过影响转录、翻译和细胞凋亡等过程,引发细胞功能异常和损伤,导致畜禽呕吐增加其死亡率,因此,世界卫生组织和联合国粮食农业组织将呕吐毒素列为最危险的自然污染物之一。研究表明,在猪的小肠细胞中,DON促进与炎症和细胞凋零相关的基因表达,产生活性氧对细胞造成损伤[29-30]。
2 真菌毒素降解途径
除了化学或物理方法去除毒素外,生物酶解法具有环保、高效降解毒素的特点,被认为是减少真菌毒素积累最有希望的方法[31]。除了文献中介绍的能够降解真菌毒素的酶,本文还利用计算方法对从PDB(protein data bank, https://www.rcsb.org)数据库中下载的蛋白结构和从Pubchem(https://pubchem.ncbi.nlm.nih.gov)数据库中下载的霉菌毒素小分子结构进行了分析。使用AutoDock Tools[32]和AutoDock vina[33]软件将毒素分子与蛋白进行对接,并使用Discovery Studio Visualizer和Pymol(Schrodinger, LLC 4.60)[34]软件进行可视化分析。然而,对于一些蛋白在PDB数据库中没有共结晶结构的情况,无法参照其活性口袋进行对接分析,对于这部分结构,进一步利用Proteins Plus[35]进行后续分析。
结合实验和计算方法,可以更深入地了解到酶对真菌毒素的降解机制,并为开发具有高效降解能力的生物转化方法提供理论指导。这种综合的研究方法有助于挖掘和优化潜在的酶类分子,为毒素降解提供新的解决方案,并为畜禽的健康和饲料安全作贡献。
2.1 物理和化学途径降解真菌毒素
黄曲霉毒素结合剂Toxeat®被证明能够改善肉鸡肠道菌群,降低大肠杆菌数量,并显著提高乳酸菌数量,同时,它还能提高肠道的吸收能力,对肉鸡的功能指标、免疫反应、肠道菌群和肠道形态产生显著良好影响[36]。研究还发现,硒是一种有效的抗氧化剂。添加有机和无机硒元素到动物饲料中已被证明可以降低AFB1的毒性,并预防黄曲霉毒素引起的氧化性肝损伤,同时还能抑制促凋亡蛋白的表达[37]。此外,姜黄素具有强大的抗氧化性,在含有AFB1的饲料中添加0.2%的姜黄素或0.3%的纤维类高蛋白能够显著减轻AFB1对家禽生殖、发育造成的不良影响,并对家禽的肝脏起到保护作用[38]。另外,普通的物理吸附剂MIL-101(Fe)具有较高的吸附能力,其对AFB1的饱和负载能力为30.58 mg/g。而经过优化的TMCS-MIL101(Fe)则具有更好的疏水性,相比普通MIL-101(Fe)对AFB1的吸附性提高了25%以上[39],这些吸附剂在降低饲料中AFB1的毒性方面具有一定的应用价值。
DON及其乙酰化衍生物3-乙酰脱氧雪腐镰刀菌烯醇(3A-DON)和15-乙酰脱氧雪腐镰刀菌烯醇(15A-DON)是镰刀菌污染谷物产生的高毒性真菌毒素[40-42]。这些化合物的主要毒性结构是C3位羟基和C16位甲基。通过对C3位羟基进行乙酰化、异构化、糖基化以及氧化,以及对C16位羟基化,可生成不同类型的 DON 衍生物,从而减轻其毒性[43-44]。例如,C3糖基化可产生3-葡萄糖苷-DON;乙酰化可生成3-乙酰-DON,C16位羟基化可产生16-羟基DON,图3展示了DON的代谢途径和降解产物[45]。
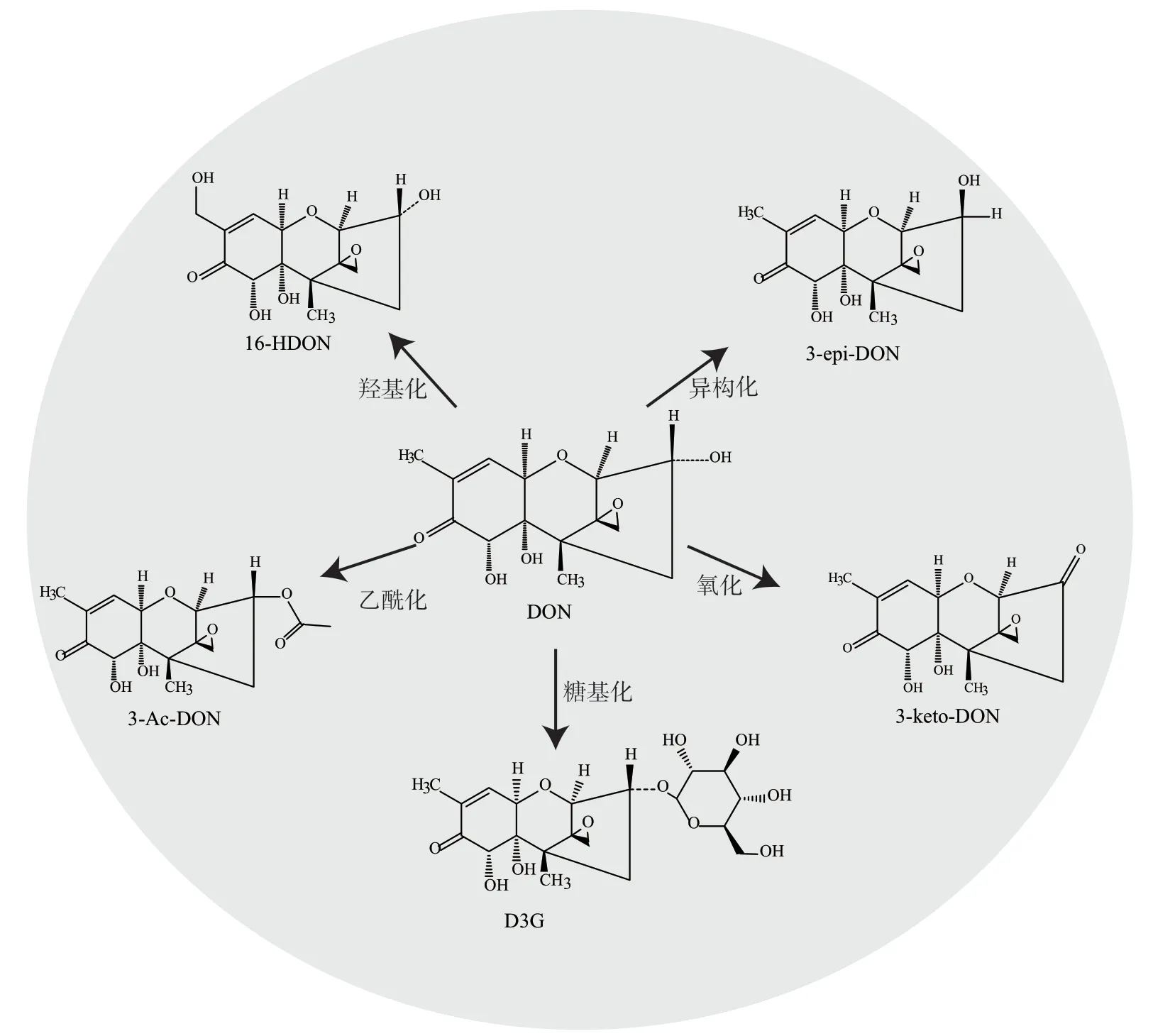
图3 DON代谢途径及降解产物Fig. 3 DON metabolic pathway and degradation products
除了糖基化、乙酰化等降解途径外,长链n-3多不饱和脂肪酸如二十碳五烯酸和二十二碳六烯酸也具有降低DON对肠道细胞损伤并具有增强肠道屏障的功能。这些脂肪酸通过抑制caspase-3和caspase-8蛋白的表达来发挥其防护效果[29,46]。
2.2 生物法降解毒素
2.2.1 微生物法降解真菌毒素 传统的物理化学策略通过使用紫外线照射、添加酸、碱、氧化剂和醛等方法来改变真菌毒素的结构,以期降解真菌毒素。然而,这些方法会对粮食的营养等方面造成不同程度的影响,并引起公众对食品和饲料中化学残留物含量的担忧。与传统方法相比,生物酶解法具有特异性,能够产生无害的降解产物,甚至能够在特定条件下完全降解真菌毒素,因此在降解真菌毒素的研究中广受青睐[47]。生物酶解法是利用微生物发酵产生的酶来降解真菌毒素,具有脱毒效率高、特异性强、无二次污染等优势。例如,迟缓芽孢杆菌作为添加剂添加在饲料中,通过发酵作用能够高效降解真菌毒素ZEN和DON,其降解率分别为79.59%和46.93%[48]。此外,乳酸杆菌和酿酒酵母菌株组成的益生菌降解真菌毒素也显现出了很大潜力。研究表明,乳酸杆菌和酿酒酵母在6 h内就显著降低了真菌毒素AFB1、DON和ZEN的浓度,因此可以作为食品和饲料添加剂来去除毒素[49]。这些微生物降解真菌毒素的研究为开发高效、可行的生物降解方法提供了有益的参考。
综上所述,生物酶解法不仅能够有效降解毒素,而且能够产生无害的降解产物,具有良好的应用前景。随着对微生物降解机制的深入研究,需要进一步优化和开发生物降解方法,为食品安全和畜禽养殖提供更可靠的保障。
2.2.2 酶法降解真菌毒素
2.2.2.1 降解AFs的相关酶 用于脱除AFB1的菌株有芽孢杆菌、假单胞菌、乳酸菌、非产毒曲霉等,可采用单菌种发酵、多菌种协同发酵和菌酶协同作用脱除AFB1,枯草芽孢杆菌WTX1的胞外酶Ea可作用于AFB1的呋喃环双键、香兰素内脂环、戊烯酮环以达到降解AFB1的效果,该酶在50℃,pH 5的条件下,对AFB1的降解率高达88.4%[50]。黄曲霉毒素氧化酶(AFO)能够作用于AFB1双呋喃环上的烯醚键,是首次发现能够完全降解AFB1的酶(图4)[51]。

图4 AFB1的主要代谢途径Fig. 4 Main metabolic pathways of AFB1
为了进一步研究AFO与AFB1的相互作用,通过数据库下载AFO的结晶结构(PDB ID: 5yfd)以及AFB1的三维结构(PubChem CID: 186907)。使用AFO的复合物结晶结构作为参考,通过分子对接方法,利用AutoDock和AutoDock Vina软件进行了AFO和AFB1的对接,并选择了最优模型进行进一步分析。最终的结果通过Discovery Studio Visualizer和Pymol进行可视化展示,见表1和图5。
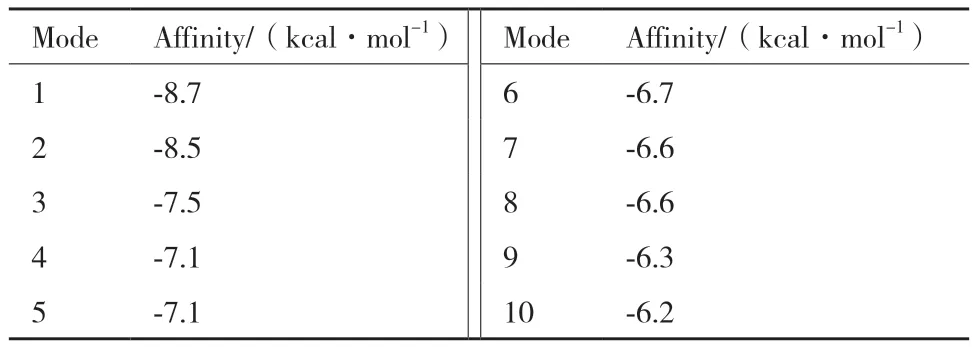
表1 黄曲霉毒素氧化酶与小分子对接最优模型结果Table 1 Results of optimal model of aflatoxin oxidase docking with small molecules
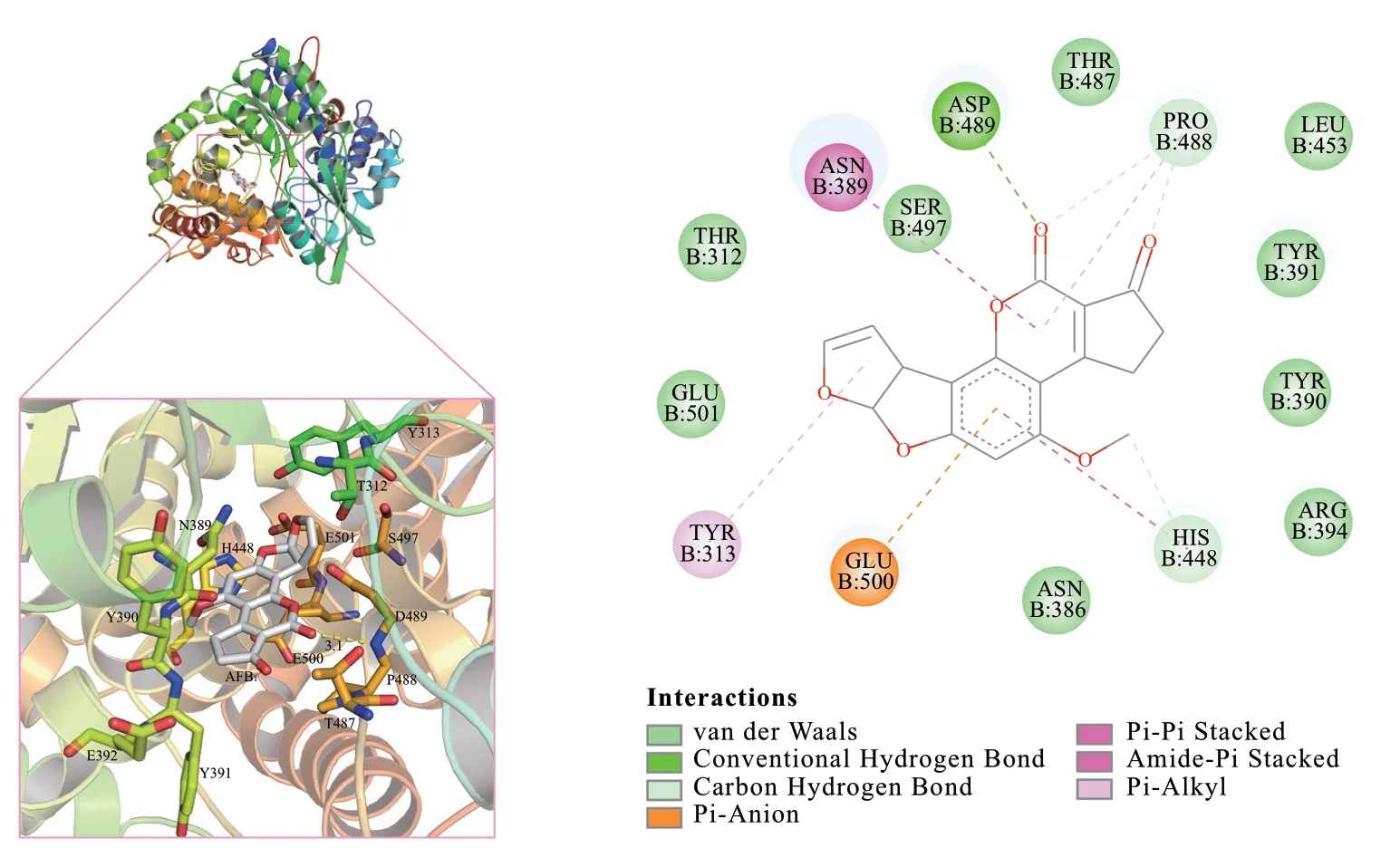
图5 黄曲霉毒素氧化酶与AFB1形成的相互作用Fig. 5 Interaction formed between aflatoxin oxidase and AFB1 formation
分子对接结果显示黄曲霉毒素氧化酶与AFB1之间存在氢键、π-烷基、范德华力等相互作用。AFB1和黄曲霉毒素氧化酶的D489残基之间存在氢键相互作用,而氨基酸残基Y313、N389、H448、P488、和E500与AFB1的五元环则形成π-烷基的分子间作用力。这些相互作用力的存在能够稳定蛋白与小分子之间的结合,为进一步降解毒素提供了有益条件。以上研究结果揭示了黄曲霉毒素氧化酶与AFB1之间的相互作用机制,为深入理解AFB1的降解过程以及开发有效的生物降解法提供了重要的信息。
2.2.2.2 降解ZEN的相关酶 鲁氏不动杆菌(Acinetobacter lwoffii)菌株的胞外酶对ZEN的降解率高达82.31%[52]。此外,研究人员采用盐沉淀和柱层析相结合的方法,从真菌中纯化出一种具有解毒能力的碱性水解酶,纯化出的酶为同源二聚体,亚单位分子量为30 kD,并含有亚单位内的二硫键。根据纯化蛋白的内部肽序列,克隆了该酶的整个编码区并将其命名为zhd101[53]。内酯水解酶zhd101显示出高效降解ZEN的能力,可用于易受ZEN侵染的重要谷物,如小麦和玉米污染(图6)[54-55]。

图6 ZHD101水解ZEN的降解产物Fig. 6 Degraded product of ZHD101 hydrolyzing ZEN
利用蛋白数据库PDB下载内酯水解酶zhd101的3D结构(ID: 5XMW),并从Pubchem获取了真菌毒素ZEN(CID: 5281576)的3D结构。随后,使用Proteins Plus对zhd101进行了活性口袋预测,并获得了预测及计算结果,具体数据可见图7和表2。为了进一步研究酶与小分子的相互作用,我们从计算结果中选取了与小分子结合的最优模型,并进行了后续分析。

表2 玉米赤酶烯酮降解酶与ZEN对接最优模型结果Table 2 Optimal model results for maize erythrene ketone degradation enzyme docking with ZEN
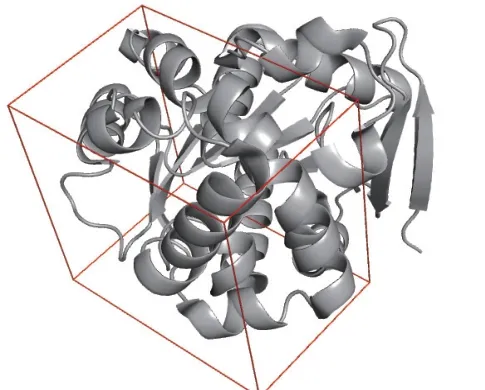
图7 玉米赤霉烯酮降解酶活性口袋位置预测结果Fig. 7 Prediction of the position of the active pocket of zearalenone degradation enzyme
通过将蛋白与小分子结合的最优结果进行可视化,得到了图8所示的结果。在这个模型中,毒素小分子ZEN与zhd101的H242形成了氢键,这一相互作用以绿色虚线在Discovery Studio Visualizer中表示,在Pymol中以黄色虚线呈现。除了氢键之外,ZEN降解酶和蛋白之间还存在Pi-烷基、范德华力等作用力。特别值得注意的是,氨基酸残基L132、V158、F221和H242能够稳定蛋白与小分子之间的相互作用。其将毒素牢固地耦合在蛋白的催化口袋中,为真菌毒素降解酶能够有效降解毒素小分子发挥了关键性的作用。
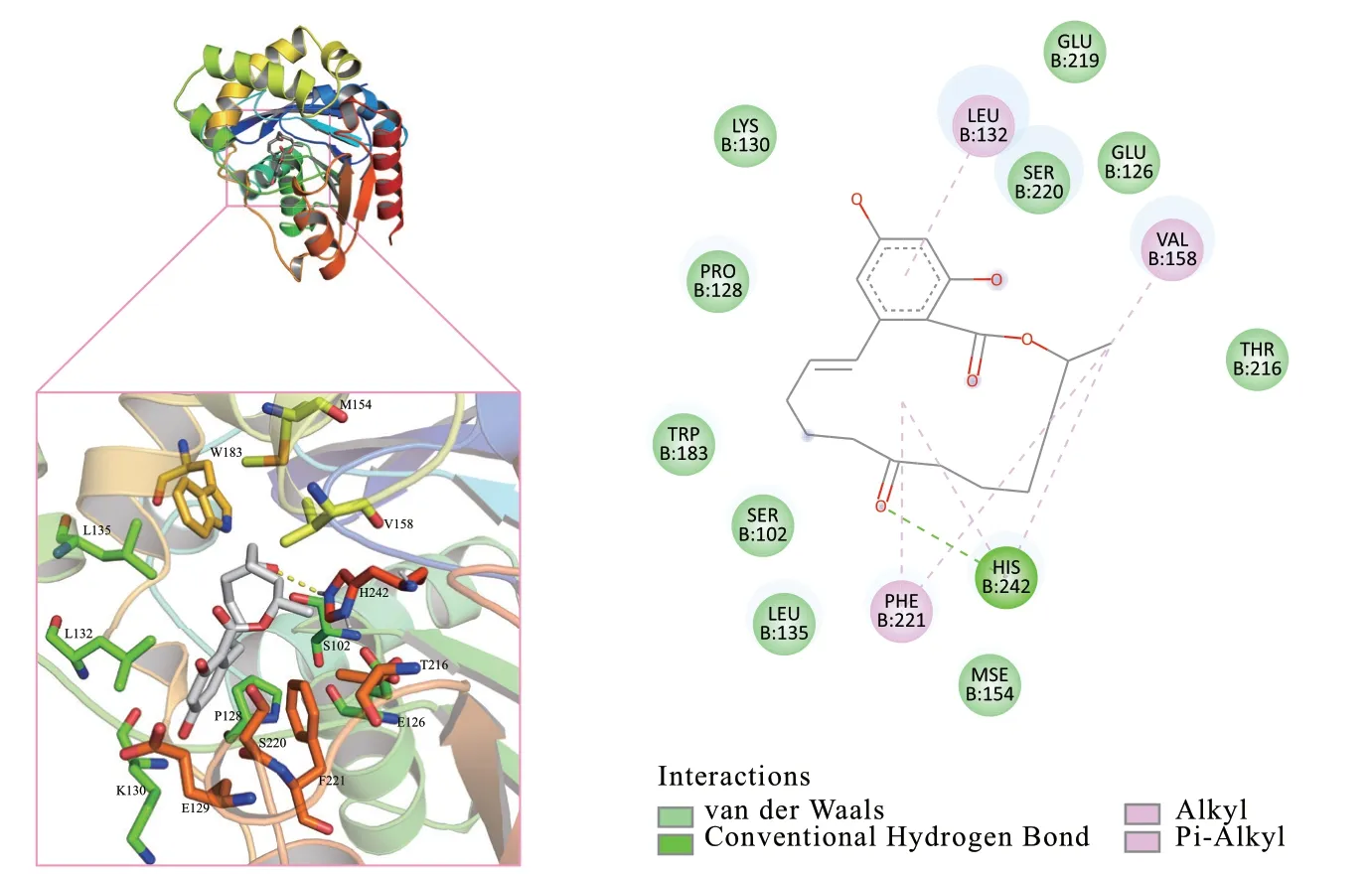
图8 内酯水解酶zhd101与ZEN形成的相互作用,参与底物结合的氨基酸显示为棒状Fig. 8 Interaction formed by lactone hydrolase zhd101 and ZEN, and the amino acids involved in substrate binding are shown as rods
上述研究揭示了内酯水解酶zhd101与真菌毒素ZEN之间的相互作用机制。这些相互作用力,如氢键、Pi-烷基和范德华力等,促使ZEN与酶发生结合,并将其稳定地固定在催化口袋中,为降解真菌毒素提供了重要的贡献。这一发现有助于深入了解真菌毒素降解酶的工作原理,为开发更有效的毒素解毒方法提供思路。
2.2.2.3 降解DON的相关酶 从德沃斯氏菌属(Devosia mutans)分离出的两种蛋白酶DepA和DepB被发现可以降解DON。DepA能将DON转化为3-酮基-DON,而DepB则进一步将3-酮基-DON转化为3-异构化-DON(图9)[56]。

图9 DepA和DepB降解DON机制Fig. 9 Mechanism of DepA and DepB degrading DON
此外,来自陆地棉(Gossypium hirsutum)的特异乙醛化酶(SPG)也展现出异构化能力,其使3A-DON的C8羰基转移到C7,并将双键从C9-C10转移到C8-C9,因此,降低了DON的毒性。研究还发现,SPG的活性中心可以对15A-DON和DON起降解作用,其作用机制与3A-DON的异构化机制相同(图10)[57]。
在DON衍生物与SPG结合时,DON衍生物的C7羟基和C8羰基部分取代两个水分子以配位金属离子。随后,E167从C7原子中提取一个质子,并将其传递给DON衍生物的C8原子,以形成具有活性的中间体烯二醇。烯二醇的C3通过将C8羰基转移至C7,并将双键从C9-C10转移到C8-C9来进行自发异构化,生成异构化产物如图11[57]。
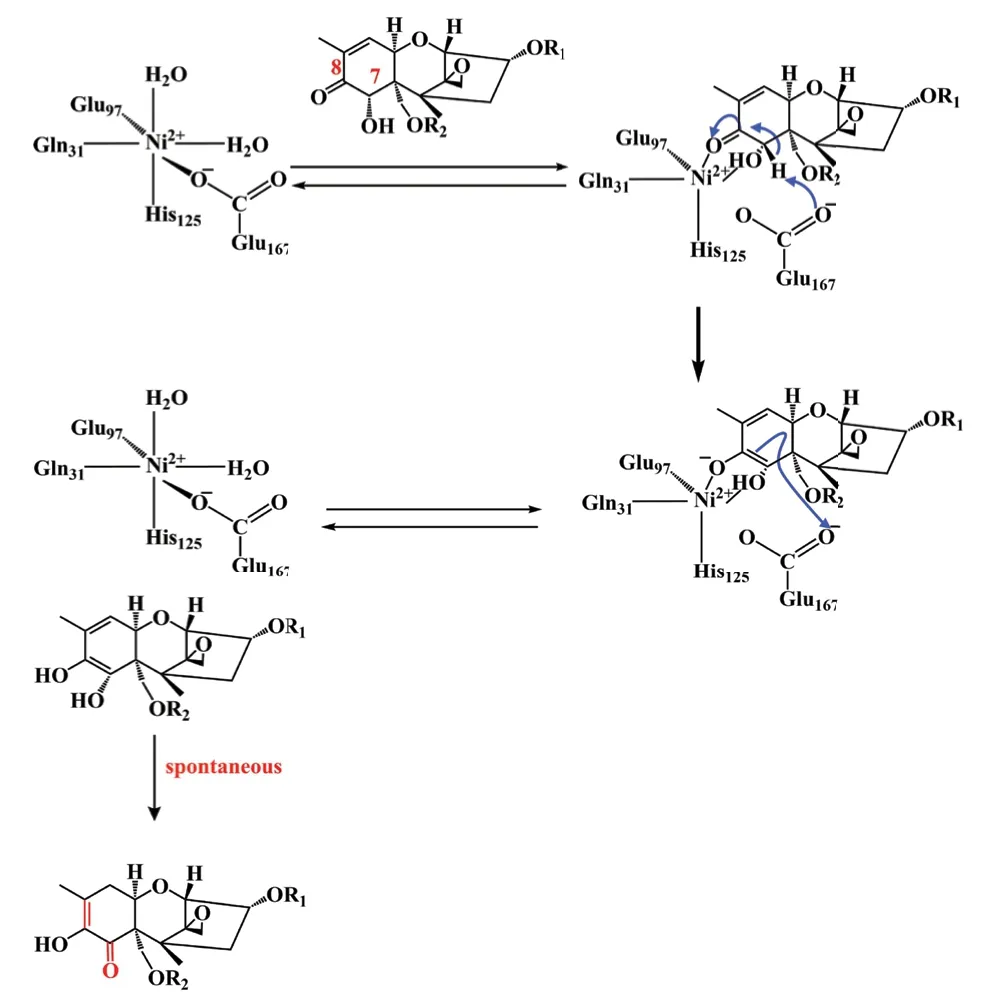
图11 SPG的催化机理Fig. 11 Catalytic mechanism of SPG
尽管研究人员尝试了将DON、3A-DON或15A-DON与SPG结晶或浸泡来获得二元配合物,但这些尝试并没有成功。在文中,只对SPG/3A-DON复合物进行了建模分析,而未对DON进行分析。通过蛋白数据库和PubChem获取的特异乙醛化酶(ID:7VQ6)和DON(CID: 40024)的3D结构被用于进一步分析,计算结果及可视化结果如表3和图12所示。
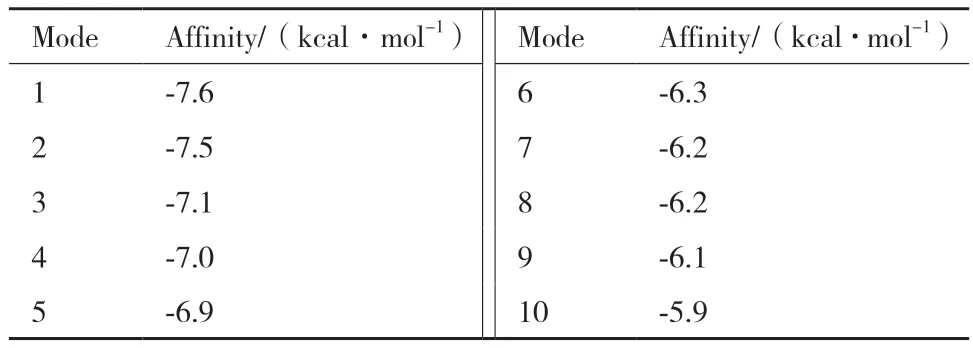
表3 特异乙醛化酶与DON对接最优模型结果Table 3 Results of the optimal model for the docking of specific glyoxylase with DON
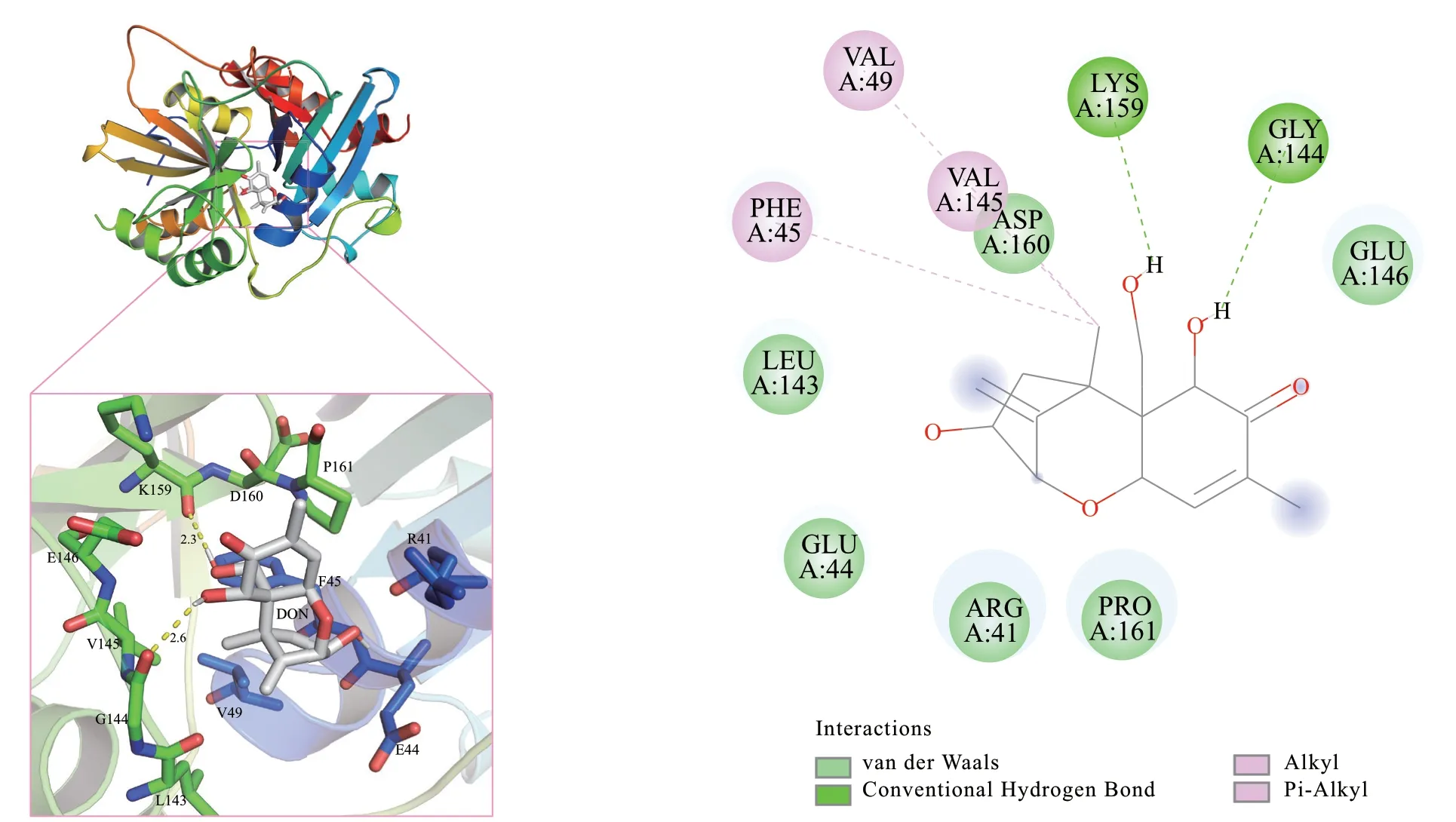
图12 特异乙醛化酶SPG与DON形成的相互作用,参与底物结合的氨基酸显示为棒状Fig. 12 Interaction of specific glyoxylase SPG with DON formation, amino acids involved in substrate binding shown as rods
特异乙醛化酶SPG与DON之间存在包括范德华力、氢键和Pi-烷基多种相互作用力,底物结合口袋由多个氨基酸残基组成,包括R41、E44、F45、V49、L143、G144、V145、E146、K159、D160和P161。其中,G144和K159与DON形成了氢键。具体的氨基酸残基与小分子之间的相互作用力可以参考图12-B。
虽然目前尚未成功获得SPG与DON的二元配合物的结晶结构,但通过计算和分析SPG与3A-DON的复合物,可以初步了解SPG与DON之间的相互作用模式。这有助于揭示SPG对DON的识别和降解机制,为进一步研究和应用相关生物技术提供了新思路。
3 总结与展望
研究表明,真菌毒素对人类和动物的健康构成严重威胁,因其化学和热稳定性以及对食品加工条件的耐受性,能够通过生产链传播至最终产品,对人类和动物的健康造成危害。研究人员发现,真菌毒素代谢产物不仅导致动物白细胞和血清免疫球蛋白水平的改变,还会引起动物器官(如肾上腺、胸腺、胃、肝脏、脾脏和结肠)的病变,在饲料农业中,全球超过25%的粮食和饲料受到真菌毒素污染,造成高达10亿美元的经济损失[58]。
物理和化学降解方法虽能降解真菌毒素,但对粮食营养和质量有不利影响,并且难以在普通的加热和食品加工条件下有效破坏其分子结构和降低毒性[28,59]。相比之下,酶解法作为一种可行且有效的解毒方法具有环保、高效去除毒素等优势[60]。然而,目前酶解法在真菌毒素降解领域仍面临挑战。尽管已取得一定进展,但降解毒素的基因研究较少,主要是因为产真菌毒素降解酶的菌株存在生物安全隐患。因此,需要进一步研究和寻找更多安全可靠的菌株和降解酶基因。另外,不同真菌毒素需要不同的降解酶,单一的菌株或降解酶通常不能同时对多种毒素起到较好的降解效果。基因工程技术可用于将多个降解酶基因融合表达,以增强降解效果。
酶解法相对于传统的化学和物理降解法具有环保、高效去除真菌毒素的优点,并且不会破坏饲料营养成分。因此,本文着重对产毒素降解酶的菌株以及对毒素降解酶进行了分析,得到其活性口袋氨基酸残基,真菌毒素降解酶与毒素小分子之间的相互作用类型的结果。以上理论结果可通过实验改造,如定点突变相关氨基酸残基进行验证。本文所得到的结果可通过理性设计指导改造真菌毒素降解酶氨基酸位点,以期增强毒素降解酶与毒素小分子的结合,达到更高的毒素降解效率。如Hu等[57]基于结构的蛋白质工程构建的变体SPG-Y62A对DON、3A-DON和15A-DON的催化活性提高了70%以上。同时文献调研发现,在饲料谷物中存在被不同真菌毒素污染的情况[61]。未来的研究应加强对真菌毒素降解的酶解法的应用探索。首先,需加强对降解酶基因的研究,包括寻找更多高效降解能力和生物安全性的菌株,以及深入了解降解酶的降解机制。这将有助于提高降解效率和扩大适用范围。其次,应进一步优化酶解法的条件和工艺,确保在实际应用中高效、经济地去除真菌毒素。这可能涉及提高降解酶的产量、改善酶的稳定性以及优化反应条件等方面的研究。
综上所述,酶解法在真菌毒素降解中具有巨大潜力,但仍需要进一步研究和开发,以提高降解效率、降低成本,并确保其安全和可行性。这将有助于保障食品安全和动物健康,并减少与真菌毒素相关的经济损失。本文综述了AFB1、ZEN、DON三种毒素危害机制,并详细介绍了三种毒素的降解方法及降解产物,期望对后续改造、提高毒素降解酶降解毒素的效率提供参考。