绿原酸生物合成调控及其应用研究进展
2024-02-05陈治民李翠韦继天李昕然刘峄郭强
陈治民 李翠 韦继天 李昕然 刘峄 郭强
(1. 北京市农林科学院草业花卉与景观生态研究所,北京100097; 2. 天津农学院园艺园林学院,天津 300392)
绿原酸(chlorogenic acid, CGA)作为植物苯丙烷类重要的次生代谢产物之一,广泛存在于蕨类植物和双子叶植物中。1947年,Rudkin和Nelson首次确定了绿原酸的化学结构,其分子结构中有多元酚、不饱和双键和酯键等,与植物的生物与非生物抗性密切相关[1-2]。目前发现富含绿原酸的植物主要有咖啡树(Coffea)、杜仲(Eucommia ulmoi)、金银花(Lonicera japonica Thunb.)和番茄(Solanum lycopersicum)等[3]。近年来,因绿原酸具有抗氧化、抗衰老等功效,被制成药品、保健品等用以提高人体免疫力。此外,绿原酸还作为食品添加剂起增香和保色作用[4]。可见,绿原酸对人体健康具有诸多益处,但植物的绿原酸含量并不高,难以满足市场的需求。因此,如何提高绿原酸产量显得尤为重要。
随着现代生物技术和酶化学的发展,绿原酸的生物合成途径逐渐被破解。在合成绿原酸时,也会受不同转录因子的调控,进而影响绿原酸的含量。同时,生物胁迫、非生物胁迫、植物激素和环境因素也会影响绿原酸的含量。鉴于此,本文将从绿原酸的结构、功能、生物合成途径以及转录因子和外源诱导影响绿原酸含量方面进行综述,以期为绿原酸开发利用以及提高作物抗逆性提供新的思路。
1 绿原酸的结构和作用
1.1 绿原酸的结构
绿原酸是由咖啡酸的1位羧基和奎尼酸的3位羟基缩合而成的酯类物质,由于咖啡酸与奎宁酸酯化的部位不同使得绿原酸类物质存在多种类型化合物,主要包括单咖啡酰奎宁酸(3-咖啡酰奎宁酸、4-咖啡酰奎宁酸、5-咖啡酰奎宁酸)、双咖啡酰奎宁酸(1,3-二咖啡酰奎宁酸、3,4-二咖啡酰奎宁酸、3,5-二咖啡酰奎宁酸等)、三咖啡酰奎宁酸以及阿魏酰奎宁酸等。它们因结构的不同,存在的药理活性亦呈现出多样化(表1)。
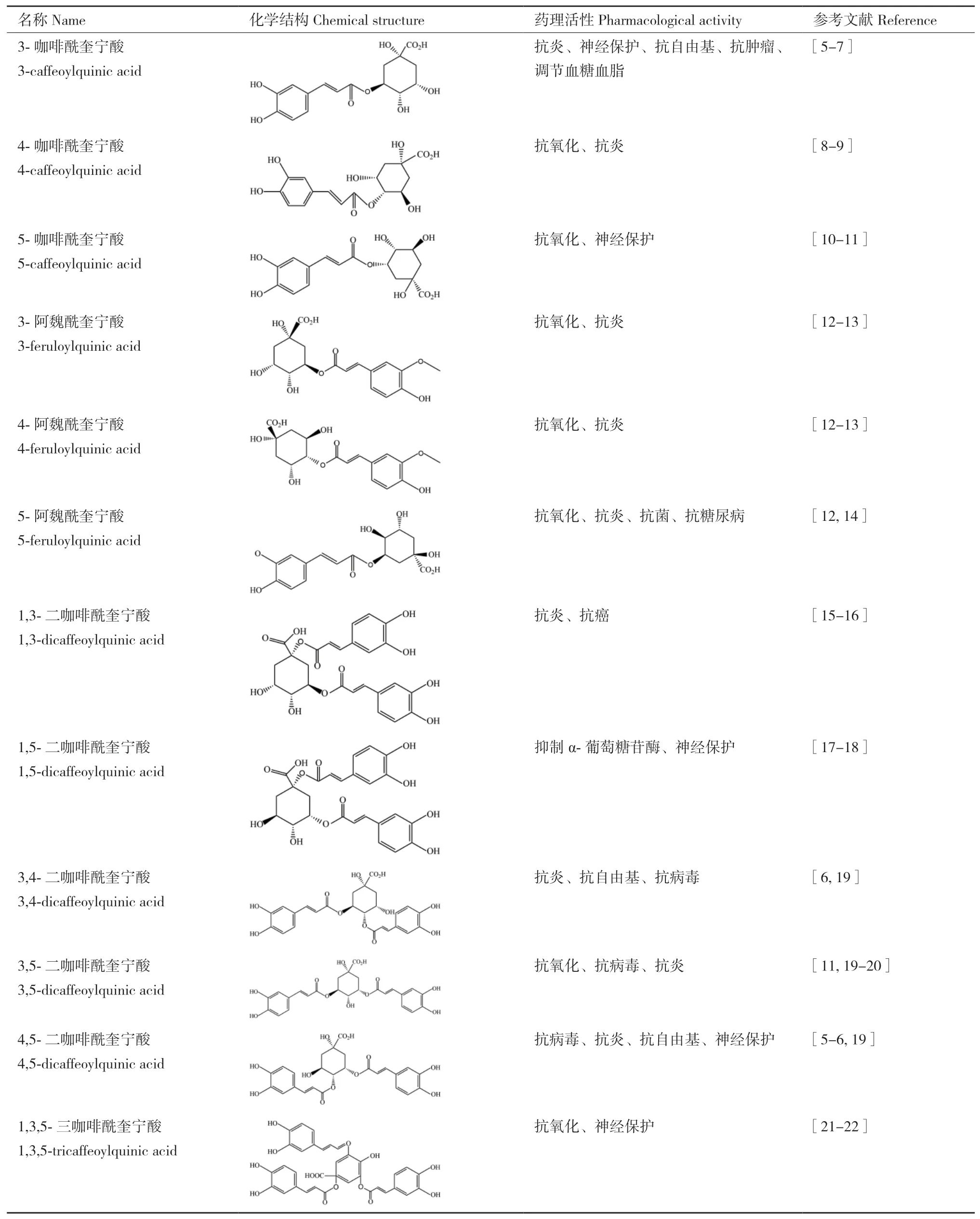
表1 绿原酸类物质的分子结构与生物活性Table 1 Molecular structure and bioactivities of chlorogenic acids
1.2 绿原酸的作用
1.2.1 绿原酸在植物抗逆生理中的作用 作为天然酚酸类化合物,绿原酸在提高植物抗逆性中发挥重要作用。研究表明,外源施加绿原酸,对樱桃番茄(Lycopersicon Esculentum var. cerasiforme A. Gray)中黑曲霉分生孢子萌发、芽管伸长、细胞活力和菌丝生长均有明显的抑制作用,显著抑制了樱桃番茄腐烂病的发生[27]。类似地,在烟草(Nicotiana tobacum)中施加绿原酸能显著抑制其疫霉病的生长,且抑制作用随着绿原酸施加浓度的递增而增强[28]。可见,绿原酸在增强植物抗病性方面发挥着重要的作用。此外,绿原酸还具抗虫功能。研究发现,对美国白蛾(Hyphantria cunea)幼虫饲喂一定浓度的绿原酸后,会破坏它的解毒系统,美国白蛾的生长发育、繁殖等活动因此受到抑制[29-30]。其原因是施加绿原酸后能够提高过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)等相关抗氧化酶活性,从而提高植物抵御病菌侵害以及环境胁迫的能力[28]。而随着绿原酸处理时间延长会引起内质网应激,导致内质网中的Ca2+释放到细胞质,随后进入线粒体,导致Ca2+在线粒体中过量积累并破坏体内Ca2+稳态,致使线粒体结构受损,致病菌活力下降[31]。同时,绿原酸的积累也有助于提高植物的抗寒性、抗旱性、耐盐性以及抵御强光照射或紫外辐射[32-34]。由此可见,绿原酸在植物的生长发育、抗病、抗虫以及抵御外界胁迫环境中扮演重要角色。
1.2.2 绿原酸在动物健康中的作用 在动物的饲料中添加一定量的绿原酸对动物的生长和品质等有着积极的影响。研究发现,在鱼饲料中添加绿原酸可以提高鲫鱼(Carassius auratus)肠道、肌肉和肝脏组织的抗氧化能力,促进其健康生长[35]。同时,绿原酸具有使肌原纤维蛋白的二级结构和三级结构变松散的功能,以提高肌原纤维蛋白的热稳定性和凝胶特性,从而改善鱼肉品质[36]。一般而言,高密度饲养会显著降低鸡(Gallus gallus)的生长、体重和空肠绒毛长度,但在添加含有绿原酸的饲料后,能显著增加鸡肠道有益微生物种群,改善其肠道屏障的完整性,从而改善鸡在高密度饲养环境中的健康生长[37]。在饲料中添加低浓度的绿原酸可以诱导背部最长肌肌肉向更多氧化性肌纤维转化,进而改善猪肉品质[38]。另外,绿原酸亦能改善动物抗病性。添加绿原酸可抑制猪(Sus scrofa domesticus)的呼吸综合征病毒活性和抑制鸡的传染性支气管炎病活性[39-40]。有趣的是,奶牛(Bos taurus)饲料中添加绿原酸能显著抑制奶牛乳腺上皮细胞促炎因子的表达,从而减轻炎症反应[41]。其作用机理为绿原酸通过抑制免疫细胞和活化抑制因子来激活宿主的免疫系统,进而增强动物机体免疫保护功能,提高机体免疫防御作用[42]。因此,绿原酸在动物的生长发育和抗病中起重要作用,可通过在饲料中添加一定浓度的绿原酸改善动物的健康生长。
1.2.3 绿原酸对改善人体健康的作用 绿原酸具有较强的生物活性,是重要的治疗性药物,对改善人体健康具有积极的作用。研究表明,服用绿原酸可以显著增强睡眠中的脂肪氧化,最大限度地减少睡眠延迟,且不会对睡眠质量产生任何不利影响[43]。同时,持续服用绿原酸6个月可以明显改善老年人的注意力、执行和记忆功能[44]。其作用机制是绿原酸通过对成纤维生长因子21(fibroblast growth factor 21, FGF21)信号通路的激活降低微管相关蛋白(microtubule associated protein τ, tau)的活性,减少过度磷酸化的tau蛋白的产生,从而延缓衰老相关神经退行性疾病的发生[45]。除此之外,绿原酸还有降脂、抗肿瘤、抗癌等多种功效[46-47]。降脂可以通过激活腺苷酸活化蛋白激酶(adenosine 5'-monophosphate-activated protein kinase, AMPK),抑制3-羟基-3-甲基戊二酰辅酶A还原的活性来调控脂质代谢[48]。抗肿瘤和抗癌则可以通过绿原酸阻滞细胞生长周期,抑制细胞增殖和诱导细胞凋亡等多种机制得到缓解[47-48]。可见,绿原酸对改善人体健康至关重要,未来,也应多挖掘绿原酸保健品和绿原酸功能性食品。
2 绿原酸的生物合成途径及关键酶基因
2.1 绿原酸的生物合成途径
绿原酸的合成来源于复杂的苯丙烷途径,根据现有文献分析,总结出4条绿原酸的合成途径(图1)。首先,植物中的葡萄糖经过相关酶的催化转化成莽草酸,再由莽草酸转化成苯丙氨酸,而后在苯丙氨酸解氨酶、肉桂酸4-羟化酶和4-香豆酸-辅酶A连接酶的连续催化下转化为对香豆酰辅酶A。对香豆酰辅酶A是类黄酮与木质素生物合成的前体,同时也是绿原酸的合成路线的重要起点。(1)路线1为奎宁酸羟基肉桂酰转移酶与对香豆酰辅酶A发生酯化反应形成对香豆酰奎宁酸,然后通过羟基化反应生成绿原酸[49](图1,路线1)。(2)路线2是对香豆酰辅酶A在莽草酸和对-香豆酸3-羟化酶的催化下生成咖啡酰辅酶A,咖啡酰辅酶A和奎宁酸在羟基肉桂酰辅酶A奎宁酸羟基肉桂酰转移酶催化下生成绿原酸[50-51](图1,路线2)。(3)路线3是对香豆酸能在对-香豆酸3-羟化酶和肉桂酸-4-羟化酶催化下转化为咖啡酸,然后在4-香豆酸-辅酶A连接酶与羟基肉桂酰辅酶A奎宁酸羟基肉桂酰转移酶连续作用下生成绿原酸[49,52](图1,路线3)。(4)路线4是通过奎宁酸羟基肉桂酰基转移酶将咖啡酰基葡萄糖苷转化为绿原酸[50-51](图1,路线4)。
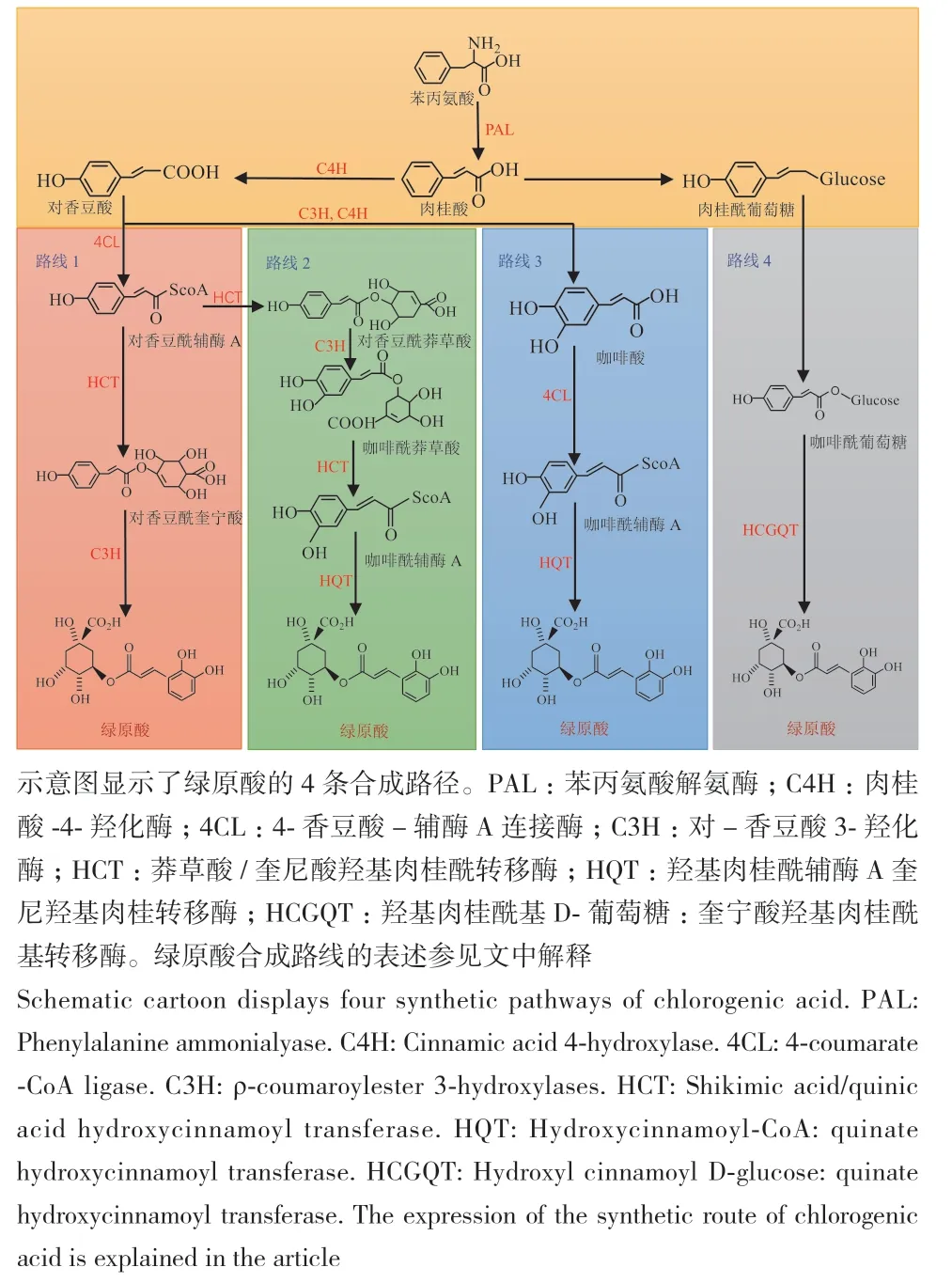
图1 绿原酸的生物合成途径Fig. 1 Biosynthesis pathway of chlorogenic acid
2.2 绿原酸合成途径中的关键限速酶基因功能
在绿原酸的4条生物合成途径中,其中苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酸-辅酶A连接酶(4CL)、对-香豆酸3-羟化酶(C3H)、莽草酸/奎尼酸羟基肉桂酰转移酶(HCT)、羟基肉桂酰辅酶A奎尼羟基肉桂转移酶(HQT)是绿原酸生物合成的关键酶,诱导其表达有助于提高植物中绿原酸的含量。
2.2.1 苯丙氨酸解氨酶 PAL是连接初生代谢和次生代谢的关键桥梁,能将苯丙氨酸催化转化为肉桂酸,是控制前体进入苯酚途径的代谢通量,也是影响累积的酚类化合物的总体水平重要组成部分[53]。因此,PAL在植物的生长发育、响应植物的生物与非生物应激防御,如机械损伤、紫外线等中起关键作用[54]。研究表明,绿原酸的积累与PAL的表达相关。在甘薯中,过量表达IbPAL1提高苯丙烷通量,促进了绿原酸在叶片中的积累[55]。同时,PAL基因在其他植物中也具有不同的功能。例如,在毛果杨(Populus trichocarpa)中,PtPAL1和PtPAL3可能负责单宁的产生,而PtPAL2、PtPAL4和PtPAL5可能在木质素生物合成中发挥作用[56]。可见,PAL不仅能促进绿原酸的生物合成,也会调控苯丙烷途径中其他次生代谢物质的合成。
2.2.2 肉桂酸-4-羟化酶 C4H是催化苯丙烷途径的第2个关键限速酶,定位于植物细胞的内质网,是细胞色素P450酶CYP73蛋白家族的成员[57]。作为P450蛋白,C4H催化不可逆反应,在氧和还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)的存在下,该酶以NADPH作为电子供体,将反式肉桂酸催化生成对香豆酸[57-58](图2)。在烟草中,NtC4H基因沉默上调了Nt4CL的表达,增加了绿原酸的含量[59]。因此,可通过C4H的沉默来诱导其他基因的表达,促进绿原酸的生物合成。
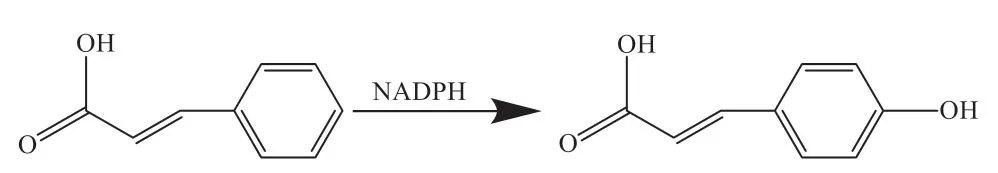
图2 C4H催化原理Fig. 2 Catalytic mechanism of C4H
2.2.3 4-香豆酸-辅酶A连接酶 4CL是肉桂酸的主要分支点,可以将肉桂酸的衍生物,包括对香豆酸、咖啡酸、阿魏酸和肉桂酸,转化为不同类型的辅酶A,这些中间体是合成苯丙烷类化合物的基础,如木质素、绿原酸和类黄酮类。在陆地棉(Gossypium hirsutum)中,过表达Gh4CL3提高了4CL活性,增强了肉桂酸、对香豆酸等酚类化合物前体,促进绿原酸的合成[60]。系统发育树表明,4CL基因家族被分为class I和class II,表现出不同的功能,其中class I参与木质素的生物合成和创伤反应,class II参与类黄酮的合成[61]。4CL具有两个保守的多肽基序:AMP结合结构域Box I(SSGTTGLPKGV)和Box II(GEICIRG),Box I在4CL蛋白家族和乙酰CoA合成酶等酰基活化酶中高度保守,是4CL蛋白直接催化底物的活性中心,Box II是4CL的绝对保守结构域但不直接参与催化,这可能与酶的空间构象有关[62-63]。由此可见,4CL在绿原酸、木质素和类黄酮的生物合成中扮演着重要角色。
2.2.4 对-香豆酸3-羟化酶 C3H是绿原酸合成途径的另一个关键酶,也是脂肪酸、咖啡酸等酚酸生物合成途径中的第2个羟化酶,属于细胞色素P450单加氧酶中的CYP98A家族[64]。C3H可以决定木质素单体的碳源流向,并调控植物体内H单体向G单体和S单体转换[65]。同时,C3H的表达也可以控制类黄酮和绿原酸等次生代谢物质的合成。在烟草中,过量表达NtC3H使烟草叶片中绿原酸和芦丁的含量分别提高了3.6倍和6.1倍[66]。可见,C3H正向调控绿原酸的生物合成。
2.2.5 莽草酸/奎尼酸羟基肉桂酰转移酶 HCT属于BAHD酰基转移酶家族,存在两个共同的保守结构域,包括HXXXD和DFGWG,在所有陆生植物中都是保守的[67]。在参与的苯丙烷代谢途径中,由于其位于C3H催化的羟基化过程的上游与下游结合处,能同时调控上下游的靶基因,既能生成对香豆酰草莽酸/奎宁酸来作为C3H酶作用的底物,又能将C3H催化生成的产物咖啡酰草莽酸/奎宁酸转变为咖啡酰辅酶A,因此认为HCT在苯丙烷羟基化途径中具有双重作用[68]。HCT具有底物普适性,以咖啡酰辅酶A、对香豆酰辅酶A和阿魏酰辅酶A等多种酰基辅酶作为酰基供体。对烟草中纯化得到的HCT活性进行分析表明,对香豆酰辅酶A和咖啡酰辅酶A是HCT最匹配的酰基供体,且酰基转移到莽草酸酯比奎尼酸酯更为有效,说明该酶对莽草酸的亲和力更高[69]。HCT是绿原酸合成途径中的关键酶。在烟草中过量表达NtHCT,转基因烟草叶片中的绿原酸提高了2.0-6.3倍,而将本式烟草(Nicotiana benthamiana)NbHCT基因沉默表达后,烟草叶片中绿原酸含量降低,表明HCT可正向调控绿原酸的合成[70]。同时,HCT也是木质素单体合成途径中的关键酶。烟草中HCT基因表达下调会导致木质素中H单元增加,G单元和S单元降低,使木质素含量降低,植株多茎矮小,但在二穗短柄草(Brachypodium distachyon)中HCT基因表达的下调对木质素的组成影响不大[71-72]。可见,HCT具有双重功能,在合成绿原酸与木质素发挥重要作用,但二者之间是否存在叠加影响有待继续研究。
2.2.6 羟基肉桂酰辅酶A奎尼羟基肉桂转移酶HQT也属于BAHD酰基转移酶家族,亦包含HXXXD和DFGWG两个基因序列[67]。而在三叶鬼针草(Bidens pilosa)、紫锥菊(Echinacea purpurea)、灰毡毛忍冬(Lonicera macranthoides)和白掌(Spathiphyllum floribundum ‘Clevelandii’)等植物中还检测出HQT的HTLSD基序[73]。HQT基因有3种异构型,即HQT1、HQT2和HQT3[73]。3种异构型表现出组织特异性,例如,在朝鲜蓟(Cynara scolymus)中,HQT1在苞片中的表达水平较高,是叶组织的4.3倍,HQT2在茎和6周龄的叶组织中表达最强,HQT3在茎组织中的表达水平非常高,是叶组织的17倍[74]。研究发现,HQT与HCT是紧密连锁的。不同于HCT的底物普适性,HQT具有底物特异性,是参与绿原酸生物合成的最后一步关键限速酶,可催化咖啡酰辅酶A和奎尼酸进行酯交换生成结构不同的绿原酸[75]。在丹东蒲公英(Taraxacum antungense)中,过量表达TaHQT使蒲公英叶片中绿原酸含量提高了82.49%[76]。朝鲜蓟中过量表达HQT1、HQT2和HQT3,显著增加了转基因朝鲜蓟叶片中绿原酸含量[74]。然而,沉默NtHQT基因表达,使烟草中的绿原酸含量显著降低[71]。因此,通过诱导HQT的表达是提高植株体内绿原酸生物合成的重要途径之一。
3 绿原酸生物合成调控
3.1 转录因子对绿原酸合成调控的影响
转录因子(transcription factor, TF)是一类重要的具有序列特异性的DNA结合蛋白,通过与靶基因启动子中的顺式作用元件特异性结合,调控参与众多植物代谢过程中的基因表达[77]。常见的转录因子包括WRKY、MYB(v-myb avian myeloblastosis viral oncogene homolog)和bHLH(basic helix-loop-helix)等,它们在绿原酸合成调控中扮演着不同的角色。
3.1.1 WRKY转录因子 WRKY是植物特有的锌指型转录调控因子,其可以与顺式作用元件W-box、WT-box、PRE和SURE特异性结合,从而调控目的基因的表达。植物WRKY基因家族在进化过程中主要被分为Group I、Group II和Group III三大类,在植物的生长发育、抵御生物与非生物胁迫中起重要作用。值得注意的是,WRKY亦参与苯丙烷途径调控。尤其在绿原酸生物合成途径中,WRKY能与绿原酸合成关键酶基因共表达。例如,共表达网络分析表明,WRKY在C4H中存在结合位点,表明WRKY参与绿原酸合成调控[78]。EMSA分析表明在桃树(Prunus persica)中PpWRKY70与Pp4CL启动子中的W-box特异结合,从而调控绿原酸、新绿原酸等苯丙烷类化合物的生物合成[79]。在蒲公英中过量表达TaWRKY14,可调控TaPAL1的表达,促使绿原酸含量得到提高[80]。杨树(Populus)原生质体瞬时表达系统中验证表明,PtHCT2受防御反应WRKY的调控,其叶片表达量与绿原酸含量显著相关[81]。
3.1.2 MYB转录因子 MYB广泛存在于植物中,根据结构域,将MYB分为1R、R2R3、3R、4R四种类型。MYB 转录因子被证实参与调控植物苯丙烷类化合物代谢。在烟草中过表达NtMYB59 基因可显著的提高烟草叶片中的绿原酸含量,说明NtMYB59能够正向调控烟草中的绿原酸合成[82]。通过酵母单杂交和双荧光素酶报告基因实验证实,灰毡毛忍冬中LmMYB15可调控4CL基因表达,促使其绿原酸的生物合成和苯丙素的代谢[50]。另外,MYB与苯丙烷途径中HQT基因也呈正相关关系,可上调HQT基因的表达来增加绿原酸的含量。研究表明,AtMYB12能使HQT基因上调表达,显著提高转基因马铃薯(Solanum tuberosum)体内绿原酸的含量[83]。然而,MYB也对苯丙烷合成途径起抑制作用。例如,在杨树中过表达MYB165和MYB194显著下调PAL1表达,导致苯丙烷类化合物含量降低[84]。类似地,茶树(Camellia sinensis)CsMYB4a基因的表达与酚酸的积累呈负相关性,并在烟草中过表达时,显著抑制苯丙烷类途径基因C4H和4CL表达,引起绿原酸含量的降低[85]。而同样是过表达MYB1,在茄子(Solanum melongena)中可促进绿原酸增加,在烟草中则会抑制绿原酸[86-87]。说明,转录因子MYB 在不同植物绿原酸合成调控中亦发挥不同的作用,具体的调控机理需进一步地研究探索。
3.1.3 其他转录因子 bHLH家族蛋白保守结构域约含60个氨基酸,能识别并特异性结合E-box(CATGTG)、G-box(CACGTG)等顺式作用元件来调控植物次生代谢物质的合成。双荧光素酶、酵母单杂交和凝胶迁移率改变分析表明,在丹东蒲公英中,过表达TabHLH1通过E-box基序直接与TaHQT2和Ta4CL启动子结合,显著上调TaHQT2和Ta4CL基因表达,从而调控绿原酸的合成与积累[88]。除此之外,ERF(ethylene responsive factor)、bZIP(basic region-leucine zipper)等转录因子也可以正向或负向调控绿原酸的合成。例如,在烟草中,过表达NtERF13a可通过直接结合NtHCT基因启动子中的GCC box和DRE元件,诱导NtHCT基因的mRNA丰度,促进烟草叶片中绿原酸的积累[89]。金银花中,LjbZIP8在转基因烟草中过表达时,则抑制了NtPAL1、NtPAL2和NtPAL4的表达,降低了新绿原酸、绿原酸和隐绿原酸的含量,表明LjbZIP8是一个转录抑制因子[90]。在灰毡毛忍冬中,LmHY5基因的沉默会导致转本氏烟草(Nicotiana benthamiana)叶片中绿原酸含量显著降低,表明HY5与绿原酸积累之间存在正调控关系[91]。另外,转录因子之间也可以协同表达。香蕉(Musa nana)中,过表达MusaMYC29协同激活WRKY和bHLH的表达,进而提高绿原酸的含量[92]。
3.2 外源诱导对绿原酸含量的影响
3.2.1 生物胁迫 生物胁迫如病菌侵害会在植物中引发与防御相关的反应,使抗菌化合物积累,而绿原酸作为植物中最重要的防御性酚类化合物之一,在病原体攻击时其含量会相应的增加或减少。葡萄(Vitis vinifera)在感染霜霉病和白粉病后,不同葡萄品种的绿原酸含量发生了不同程度的变化,如圆叶葡萄和美洲葡萄品种的绿原酸含量会增加,欧亚种葡萄绿原酸含量则减少[93]。同样,病菌侵害也可以通过增加绿原酸合成途径关键酶如PAL1、C4H、HQT和HCT等的转录水平来提高绿原酸的含量。例如,索邦(Sorbonne)在椭圆葡萄孢的侵染下,PAL与HCT会上调表达,促进绿原酸积累[94]。但关键酶的转录水平也会随病菌的类型以及侵染时间而发生变化。向日葵(Helianthus annuus)在立枯丝核菌或丛枝菌根真菌的侵染下,HCT的表达随侵染时间而增加,HQT和C3H的表达会随侵染时间的延长逐渐减少[95]。而同样是丛枝菌根真菌侵染,不同植物关键酶转录水平会出现相反情况,例如在向日葵中会上调C4H的表达,在番茄中却会下调C4H的表达[95-96]。可见,适当的生物胁迫可以促进绿原酸的积累,进而提高植物的防御系统。
3.2.2 非生物胁迫 非生物胁迫包括干旱、低温、盐、重金属等,植物对各种非生物胁迫会产生不同的生理性反应,通过调整由初生代谢转向次生代谢来构建防御体系,建立抵抗或适应环境胁迫的物理屏障和化学屏障。研究表明,非生物胁迫会导致氧化应激,是由于活性氧(reactive oxygen species, ROS)的产生和消除速率之间的平衡失调引起的[97]。而氧化应激诱导的自由基与植物代谢途径中的许多化学物质相互作用,导致产生绿原酸、类黄酮等植物次生代谢物质[98]。绿原酸则清除过量产生的ROS,减少细胞膜过氧化,从而保护细胞免受氧化应激的伤害,提高植物的抗逆性。
非生物胁迫可以使绿原酸生物合成途径相关酶活性和基因表达升高,从而使绿原酸积累。例如,低温、干旱以及盐胁迫可以诱导HCT的表达,重金属胁迫可使PAL和HCT的表达上调[99-100]。同时,绿原酸的含量还会受到胁迫程度的不同作出相应的变化。在香青兰(Dracocephalum moldavica)中,随着干旱程度的升高,呈现出先升高后下降的趋势,在中度干旱时绿原酸含量最高[101]。表明在一定胁迫程度范围内能促进绿原酸的合成。而不同植物对非生物胁迫的耐受性不同,同种胁迫会导致绿原酸含量的变化存在相反的结果。例如在玉米(Zea mays)中重金属胁迫会使绿原酸含量增加,而在番茄中则会使绿原酸含量下降[102-103]。因此,可以通过适当浓度的非生物胁迫提高绿原酸的含量,进而在提高植物抗逆性的同时还能促进植物的生长。
3.2.3 外源处理 植物激素在调节植物代谢中起重要作用。在甘薯中,脱落酸(abscisic acid, ABA)、水杨酸(salicylic acid, SA)和赤霉素(gibberellin,GA)处理72 h后,PAL、C4H、HCT和HQT得到相应表达,促进甘薯茎尖绿原酸含量增加[104]。草莓(Fragaria×ananassa Duch.)施加乙烯(ethylene,ET)后,诱导了ABA的积累,两种激素协同作用,促进了绿原酸的增加[105]。在猕猴桃(Actinidia chinensis Planch.)中外源施加茉莉酸甲酯(methyl jasmonate, MeJA)后,PAL、4CL和C4H基因及MYC转录因子均被上调表达,促进了绿原酸的积累[106]。除此外,外源施加油菜素甾醇(brassinosteroid, BRs)、多巴胺(dopamine, DA)、褪黑素(melatonin, MT)以及胰蛋白酶后,均能提高绿原酸的含量,并增强植物的抗逆性[107-110]。
值得注意的是,通过改变生长条件也可以调节绿原酸的合成。研究表明,光质、光周期、CO2浓度和空气温度通过调节相应生物合成途径关键酶基因如PAL、C4H及C3H等,对绿原酸含量产生影响[111]。光通过两种方式调控绿原酸的积累与合成,一方面,光作为物质基础调节碳水化合物和其他初级代谢产物的合成,另一方面,通过光信号调控关键酶及下游基因的转录表达,改变绿原酸含量。例如遮光后,HY5被诱导表达,从而积累绿原酸[91]。光质的不同会影响绿原酸的积累。例如,生菜(Lactuca sativa var. ramosa Hort.)培养条件中补充蓝光和红光,会显著增加绿原酸含量,而补充远红光则抑制绿原酸的合成[112]。而生菜中绿原酸含量在不同光周期条件下也发生变化,其中每100 g鲜重在光照24 h/黑暗0 h条件下比光照12 h/黑暗12 h时含量高出4倍,每100 g干重在光照24 h/黑暗0 h条件下比光照12 h/黑暗12 h时含量高出2倍,表明持续光照有利于绿原酸的积累[113]。同时,在高CO2浓度下,生菜中的绿原酸含量增加,但在连续光照、高光照强度和高CO2协调作用下,会抑制绿原酸的积累[113]。另外,空气温度也是影响绿原酸含量的重要因素。研究表明,生菜体内绿原酸含量随空气温度的降低而增加,空气温度在15℃时的含量是25℃时的1.6倍[111]。因此,可以通过施加植物生长激素以及优化外界生长环境来提高绿原酸的含量。
4 总结与展望
绿原酸作为一种重要的次生代谢物质,广泛存在于植物中,因其较强的生物活性和药理作用,在植物的生长发育和抗逆性、食品风味调节、预防和治疗人类疾病以及畜牧生产中发挥重大作用。绿原酸的合成来源于苯丙烷代谢途径,现发现绿原酸的合成途径有4条,在合成过程中会涉及到大量的酶。目前研究对涉及绿原酸生物合成途径的相关关键限速酶进行了酶活性分析,并对相应的关键限速酶基因进行了克隆、表达分析以及功能鉴定。然而,绿原酸的生物合成是一个十分复杂的基因互作网络,涉及的转录因子数量庞大,现阶段主要对MYB、WRKY和bHLH研究得较多,对于其他未知的并参与绿原酸生物合成途径的转录因子还有待挖掘。植物中绿原酸含量的高低不仅受基因表达水平的影响,同时也因环境条件的差异而不同,因此可以通过物理和化学等手段诱导相关酶的编码基因表达,如合理范围内增加光照时间、CO2浓度的增加以及适度的生物胁迫与非生物胁迫等,以提高植物中绿原酸的生物合成量。
目前对绿原酸的生物合成途径及调控途径研究日益增多并取得一定的成果,但仍存在以下问题需要突破:(1)天然绿原酸含量低,生产成本高且生物利用率低,而生物利用率是决定绿原酸生物活性的先决条件,需要在降低生产成本的同时确保提取高质量绿原酸并提高绿原酸生物利用率,例如优化提取工艺等。(2)随着对绿原酸研究的不断深入,绿原酸生物合成途径关键酶与转录因子相继被发现,但他们之间的调控关系还需进一步探讨。(3)苯丙烷代谢途径有很多分支,各分支的相互关系及调控机制研究较少,加强其他分支调控绿原酸途径的研究,将有助于通过其他代谢途径提高绿原酸的合成。(4)通过外源诱导可以影响绿原酸的积累,但不同胁迫之间和不同环境因子之间的拮抗或协同作用以及各关键基因节点对环境的响应研究不够全面,需进一步深入研究。
未来,应借助基因组学、多组学(蛋白质组、转录组、代谢组、表型组)以及酶化学等联合手段,进一步对绿原酸生物合成与调控机制进行深入探索,以期为绿原酸的合理开发利用以及作物或牧草抗逆遗传改良提供参考。