解脂耶氏酵母细胞工厂生产多不饱和脂肪酸的研究进展
2024-02-05何思成张紫瑗韩雨晴苗琳张翠英于爱群
何思成 张紫瑗 韩雨晴 苗琳 张翠英 于爱群
(天津科技大学生物工程学院 省部共建食品营养与安全国家重点实验室 工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室,天津 300457)
多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)是指含有2个或2个以上碳碳双键的长链脂肪酸,碳原子数目一般为18-22个[1]。根据距离甲基端第一个双键位置的不同,通常可将PUFA分为ω-3系列和ω-6系列。长期以来,市场上的绝大多数PUFA是从深海鱼类中直接提取获得的,而海洋微藻则是PUFA的次要来源。近年来,海洋环境污染和过度捕捞严重破坏了渔业资源,这也极大程度地限制了利用海洋鱼类提取PUFA产业的发展[2]。另外,鱼油中PUFA会随着鱼的种类、繁殖季节、地理环境等因素改变,这使得提取到的PUFA含量和组成不断发生变化,少数PUFA在鱼油中含量又是较低的。上述因素都造成了传统的PUFA制备方法难以满足与日俱增的市场需求,迫切需要开发稳定、高效、可持续、低成本的新型PUFA合成路线[3-4]。
“微生物细胞工厂”是通过对选定的微生物底盘细胞的代谢途径进行特定改造,创建出满足定制化需求的生产线,从而加工制造出人类所需的食品、药品、化学品、燃料、材料等各类型产品,它现已成为合成生物学领域最为典型的应用研究模式和最为重要的前沿发展方向[5-6]。其中,解脂耶氏酵母(Yarrowia lipolytica)具有多种独特的生理代谢特征,因此将其作为“微生物细胞工厂”来实现工业产品的合成和生产备受学术界和工业界的高度关注[7]。
总之,目前利用微生物细胞工厂发酵生产功能性PUFA对于解决PUFA资源匮乏问题具有深远意义,这也吸引了国内外研究人员的广泛关注[8]。解脂耶氏酵母是异源合成PUFA理想的微生物底盘细胞,近年来利用代谢工程及合成生物学技术在该微生物底盘中重构与优化PUFA的合成途径成为了领域内的一项研究热点和发展趋势。本文首先对PUFA的微生物来源和代谢途径、解脂耶氏酵母的分子遗传学操作技术进行了介绍;其次系统总结和梳理了以解脂耶氏酵母作为底盘细胞异源生产PUFA的有关代谢工程实例;最后对利用解脂耶氏酵母细胞工厂生产PUFA存在的主要问题和未来发展方向进行了分析和讨论,以期为从事相关研究的科研人员开辟新的思路提供借鉴与依据。
1 PUFA的微生物来源及其合成途径
PUFA是机体生物膜的关键结构组分,同时已有大量研究表明,它作为信号分子参与了对糖代谢、脂代谢、激素代谢等多种生理过程的调控[9-10]。此外,PUFA在机体中还直接或者间接地发挥着抗癌、抗衰老、抗动脉粥样硬化、降低胆固醇、促进发育、缓解炎症、提高免疫力等多种生理作用[11-12],因此其对于机体健康状态的维持起着十分重要的作用[13-15]。由于PUFA具有上述多种重要的生物学功能,这使其作为功能因子在食品、保健品、医药、饲料等多个领域均表现出了很好的开发前景和应用价值[16-18]。表1列举出了机体中存在的一些重要的PUFA及其生理功能。

表1 生物体中常见的多不饱和脂肪酸类型Table 1 The most common types of PUFA in organisms
目前PUFA的市场需求量巨大,利用细菌、真菌和微藻等微生物生产PUFA具有生长速率快、营养需求简单、培养条件可控等优势,因此微生物被认为是替代海洋生物资源生产PUFA的理想原料。与细菌相比,某些微藻和真菌具有较高的PUFA含量。藻类中,一些可进行光合作用的自养型微藻如单胞藻(Monodus subterraneus)、角核指藻(Phaeodactylum tricornutum)、微拟球藻(Nannochloropsis oculata)、金色奥杜藻(Odontella aurita)和紫球藻(Porphyridium cruentum)等都具备合成较高含量EPA的能力[19];一些无法进行光合作用的异养型微藻如破囊壶菌(Thraustochytrium spp.)和裂殖壶菌(Schizochytrium limacinum)等则可合成较高产量的DHA[20]。但利用微藻生产PUFA存在着一些明显的瓶颈和制约因素,如微藻生长缓慢、采收成本高、油脂含量较低等。目前已经证实的天然高产PUFA的油脂真菌主要有高山被孢霉(Mortierella alpina)、深黄被孢霉(Mortierella isabelina)、木霉(Trichoderma spp.)、黑曲霉(Aspergillus niger)、畸雌腐霉(Pythium irregulare)和樟疫霉(Phytophthora cinnamomi)等丝状霉菌,以及解脂耶氏酵母(Y. lipolytica)、圆红冬孢酵母(Rhodosporidium toruloides)、斯达氏油脂酵母(Lipomyces starkeyi)、胶红酵母(Rhodotorula mucilaginosa)、弯假丝酵母(Candida curvata)和曲隐球菌(Crytococcus curvatus)等酵母菌。与微藻相比,这些丝状霉菌和酵母菌能够积累较高产量的PUFA,且具有生长速度快、基质原料选择宽泛、发酵工艺简单、易于大规模生产等优势,因此,利用真菌发酵法生产PUFA展现出了更大的研发潜力。近十几年来,利用高山被孢霉(M. alpina)、深黄被孢霉(M.isabellina)等被孢霉属菌种发酵合成一种PUFA——ARA,已经成为了ARA的主要工业化生产方法[21],但被孢霉发酵过程存在生长缓慢、生物量低、易形成絮状或团块状菌球等缺陷。单细胞酵母发酵具有生长速度快、生产周期短、适合高密度培养、生物安全性高等优点,因此有望成为利用微生物发酵法生产PUFA的新的菌种来源[22]。
不同微生物物种所合成PUFA的链长以及不饱和程度是有所区别的。酵母菌通常生成的PUFA碳链长度大于18,酿酒酵母(Saccharomyces cerevisiae)等常规酵母产生的长链脂肪酸主要包括饱和脂肪酸(saturated fatty acids, SFA),即棕榈酸(C16:0)和硬脂酸(C18:0);单不饱和脂肪酸(monounsaturated fatty acids, MUFA),即棕榈油酸(C16:1n-7)和油酸(Cl8:1n-9);不产生任何PUFA[23];而解脂耶氏酵母等非常规酵母则具有相对完整的PUFA合成途径[24]。酵母菌生产PUFA主要依靠的是脂肪酸延长去饱和途径,该途径以棕榈酸为底物,并由脂肪酸去饱和酶(也称脂肪酸脱氢酶,fatty acid desaturase)和脂肪酸延长酶(fatty acid elongase)这两种酶所构成,去饱和酶和延长酶的种类和数量的差异将造成最终酵母菌合成PUFA种类的差异,去饱和酶的种类和数量则决定了PUFA的不饱和度,是整个合成途径的关键酶。在酵母菌中,PUFA从头合成途径始于线粒体中产生的柠檬酸:柠檬酸通过线粒体膜转运蛋白运输到细胞质中,一部分柠檬酸被胞质中的ATP柠檬酸裂解酶裂解为合成PUFA的基本二碳单位——乙酰辅酶A[25];柠檬酸裂解产生的乙酰辅酶A通过脂肪酸合成酶(fatty acid synthase, FAS)生成了棕榈酸,棕榈酸再经过一系列碳链的交替延长和去饱和作用生成了各类PUFA。图1展示了解脂耶氏酵母以葡萄糖为底物生产PUFA的内源性合成途径以及通过代谢工程改造已经在该酵母底盘中所构建的各种PUFA(如ARA、EPA和DHA)的异源合成途径[26]。

图1 解脂耶氏酵母中PUFA生物合成途径示意图Fig. 1 Schematic diagram of the PUFA synthetic pathway in Y. lipolytica
2 解脂耶氏酵母合成生物学工具的研究进展
解脂耶氏酵母的全基因组序列已经公布,其遗传转化体系经过近十几年的发展也逐渐成熟并完善。近年来,针对该酵母的合成生物学元件和基因编辑技术也有了蓬勃发展。再加上该酵母具有多种独特的生理代谢特征,因此解脂耶氏酵母已经成为了当今代谢工程及合成生物学领域中备受关注且极具发展潜力的工业微生物底盘细胞之一。本部分主要对解脂耶氏酵母底盘的合成生物学元件和基因编辑技术进行简要介绍。
2.1 启动子
启动子序列决定了微生物细胞内多数基因的表达水平,也是构建基因表达载体的基本功能组件,因此可以说是最为重要的合成生物学元件之一,选择并使用合适表达强度的启动子成为了合成生物学研究中对底盘中特定基因表达进行调控的最常用方法[27-28]。最早从解脂耶氏酵母中分离鉴定并广泛应用于调控外源基因表达的内源性启动子包括碱性胞外蛋白酶基因的启动子pXPR(诱导型强启动子)[29]和翻译延伸因子1-α基因的启动子pTEF1(组成型强启动子)[30]。诱导型启动子能够基于特定诱导物或阻遏物的浓度来调控目的基因的表达,因此在解脂耶氏酵母细胞工厂的构建中显示出了比组成型启动子更好的优势。目前解脂耶氏酵母底盘可用的诱导型启动子主要包括pLIP2、pPOX2、pPOT1、pXPR2、pICL1等[31-32]。近年来,更多的解脂耶氏酵母内源性启动子得到了序列克隆与活性初步鉴定,但其功能和应用仍有待于进一步验证和完善[33-34]。
许多研究表明,对于解脂耶氏酵母底盘来说,强启动子不一定是提高蛋白质表达水平的最佳选择[35]。因此,有必要对解脂耶氏酵母内源性启动子序列及其5'端侧翼序列进行分段功能分析,并通过定向或非定向改造开发出转录活性更强的人工合成启动子。例如,利用分段分析方法,研究人员证明了上游激活序列(upstream activating sequence,UAS1B)对pXPR2启动子活性影响最为显著。在此基础上,Madzak等[36]通过在pLEU2启动子上游添加UAS1B元件构建了人工合成的组成型强启动子pHP1d、pHP2d、pHP3d和pHP4d;启动子活性分析结果显示,人工合成启动子强度随UAS1B拷贝数的增加而增加。而pHP4d也是目前在解脂耶氏酵母底盘中得到最广泛应用的杂合启动子之一,能够表现出准组成型的高水平活性。进一步地,Blazeck等[37-38]在pLEU2和pTEF1启动子上游也分别添加了多个UAS1B元件,结果显示启动子活性同样大大提高,这就再一次证实了UAS1B元件的重要功能。此外,研究人员利用启动子截短和重排的方法对不同启动子元件(如核心启动子、TATA框、近端序列、UAS)进行了功能分析,结果表明了这些序列都是决定解脂耶氏酵母启动子强度的重要因素[39]。解脂耶氏酵母中天然脂肪酸诱导型酰基辅酶A氧化酶2(pPOX2)启动子由上游激活序列(A1、A2和A3)、调节序列(R1和R2)以及核心启动子序列组成,Lv等[40]研究表明pA1R1x2A3启动子(包括2个A1R1序列和1个pPOX2核心启动子序列)具有脂肪酸诱导的最广泛的表达范围。这些具有不同强度和不同诱导特性的启动子能够调控解脂耶氏酵母中PUFA的合成代谢网络。重要的是,诱导型启动子具有动态调节解脂耶氏酵母脂肪酸谱的能力,所以在生长阶段天然脂肪酸不会减少,反而能够在积累期快速合成。例如,pYAT1启动子已被用于调控解脂耶氏酵母PUFA合成途径中的关键基因[41]。表2列出了目前解脂耶氏酵母表达系统中可用的组成型和诱导型启动子类型。

表2 解脂耶氏酵母表达系统中常用的启动子Table 2 Most prominently used promoters for heterologous expression in Y. lipolytica
2.2 DNA重组
构建解脂耶氏酵母细胞工厂的首要步骤是需要将外源DNA片段以正确的顺序首尾相连,然后插入到目标载体中[48-52]。基于酶切或单元克隆的传统技术已不能满足构建具有复杂遗传功能的微生物细胞工厂的要求。近十几年来已经开发出了许多针对解脂耶氏酵母的DNA重组策略,如一步PCR法[49]、Gateway克隆[37]、BioBricks[50]、Gibson组装[51]和Golden Gate[52]等。一步PCR法是利用重叠延伸PCR(OE-PCR)技术,将重叠45或60个碱基的4个基因盒组装起来,然后将混合片段直接转化解脂耶氏酵母进行组装和插入rDNA位点。Gateway克隆允许通过att位点将特定基因从供体载体转移到多个目的载体中[35]。Wong等[50]研究发现具有4个可调节限制位点的载体(Avr II、Xba I、Spe I和Nhe I)在使用基于BioBrick的组装时能构建多个模块化元件。Gibson组装需要多个两端重叠约30个碱基片段,以便核酸外切酶生成单链悬挑结构,之后DNA聚合酶填充退火区域上的间隙,DNA连接酶密封缺口并将DNA片段共价连接在一起[51]。Engler等[52]研究发现可利用II型限制性内切酶构建标准化和可互换的DNA文库。值得注意的是,每一种DNA组装技术都有其优缺点,需要根据具体的基因改造需求来进行使用。OE-PCR和Gibson组装方法简单、快速,但每个组分依赖不同的引物,难以组装含有多个重复序列的DNA片段序列。相反,使用Gateway方法可以容易地重组和改变含有目标基因的重组载体,而BioBricks和Golden Gate更适合高通量文库的构建[50,53]。这些先进的DNA组装技术能够帮助快速组装需要在解脂耶氏酵母底盘中进行表达的多基因途径。此外,Golden Gate法已应用于启动子改组实验[54],该实验有助于筛选到控制不同PUFA合成途径中限速基因表达的最佳启动子。
2.3 基因编辑
目前,在解脂耶氏酵母底盘中已经建立了多种基因敲除和整合工具,这为在解脂耶氏酵母染色体上重新设计和构建合成途径提供了可能性。Cui等[55]开发出了外体质粒,实现了蛋白质简易表达或快速表征,但这种基因表达方法显示出了遗传不稳定性。对于酵母菌而言,传统的基因组编辑技术主要依赖于非同源末端连接(non-homologous endjoining, NHEJ)或同源定向修复(homologous-directed repair, HR)[56]。在解脂耶氏酵母中,利用NHEJ和营养缺陷型或抗生素抗性选择标记可以将外源基因随机整合到基因组中。修复DNA双链断裂(DNA double strand break, DSB)的主要方法是通过NHEJ而不是HR[54]。NHEJ过程的随机性阻碍了插入位点的精确控制,但这一特性反过来又可用于生成染色体突变文库。Cui等[55]通过NHEJ将多个大片段DNA引入解脂耶氏酵母基因组中,导致插入片段的染色体位置和基因拷贝数发生变化,自动生成了多样化的基因表达文库。与此同时,Bai等[57]建立了NHEJ介导的基因组文库技术,允许随机整合多个异源片段,从而产生了具有优异表型的不同菌株。Jang等[58]为了提高解脂耶氏酵母中HR的表达频率及效率,阻断了NHEJ通路中负责修复DSB的KU70基因,并使用羟基脲使细胞周期同步于S期。结果显示,解脂耶氏酵母中同源重组HR频率显著提高(超过46%)。此外,Ding等[54]通过增加同源臂长度、下调/删除KU70或KU80来抑制NHEJ以及异源表达来自酿酒酵母的ScRad52p,成功提高了解脂耶氏酵母的HR效率。Wagner等[59]使用26S rDNA或Zeta DNA位点和转座子突变的多拷贝基因整合法成功拓展了解脂耶氏酵母的基因编辑方法库。
重复的基因整合需要标记基因的循环使用。Gao等[60]通过回收两侧带有两个hisG位点的Ura3表达盒以及Cre-loxP系统能够在含有5-氟硼酸的平板上进行多轮基因操作。Lv等[61-63]将Cre-loxP系统与靶向存在于解脂耶氏酵母基因组中至少200个拷贝中的26S rDNA相结合,可以实现重复的基因整合,而无需构建具有不同位点同源臂的质粒。Zhu等[64]基于此建立了一种基因多拷贝方法,可以替代传统的多拷贝方法。通过增加基因整合到基因组的轮次来微调HpCrtW和HpCrtZ的转录表达,并同时应用HpCrtW和HpCrtZ的模块化酶组装。此外,Zhou等[65]基于Cre/loxP位点特异性重组系统开发出了一种新型高效的基因整合工具。其只需一个单一的选择标记,可以完全切除所有不必要的序列,从而实现了在相同整合位点重复完成基因的整合操作。近期,一个由自主复制序列(ARS)、一个着丝粒(CEN)和两个端粒元件(TEL)组成的解脂耶氏酵母人工染色体(ylAC)被开发出来,可用于多个基因表达盒的有效组装。基于此结果,Guo等[66]将一个含有8个基因表达盒长23 kb的重组ylAC成功整合到了解脂耶氏酵母基因组中,结果使解脂耶氏酵母工程菌株能够同时消耗利用木糖和纤维二糖。
2.4 CRISPR-Cas系统
2013年,CRISPR-Cas系统被首次成功应用于对酵母菌即酿酒酵母染色体基因组的修饰[67]。紧接着,该技术就在其他酵母底盘中如解脂耶氏酵母[68-69]、巴斯德毕赤酵母[70]、乳酸克鲁维酵母[71]和粟酒裂殖酵母[72]等中实现了成功应用。其中,Schwartz等[68]将由混合RNA聚合酶III启动子表达的gRNA和经密码子优化的Cas9蛋白共转化到解脂耶氏酵母宿主菌株中,结果显示目标基因的敲除率达到了90%。Gao等[73]将gRNA表达盒和Cas9表达盒插入到同一质粒中,然后将该质粒分别转化至解脂耶氏酵母野生型、ΔKU70菌株和ΔKU70/ΔKU80菌株中,结果显示野生型菌株和ΔKU70/ΔKU80菌株中的基因定向编辑效率分别为85.6%和94.1%。Holkenbrink等[74]又构建了针对解脂耶氏酵母底盘的EasyCloneYAL1系统,单基因敲除率为90%,双基因敲除率为6%-66%。Gao等[75]通过构建两个整合型载体(各含1个Cas9表达盒和1个sgRNA表达盒),其效率约为20%。紧接着,该课题组又构建了含有1个Cas9表达盒和2个sgRNA表达盒的质粒,并将其与含有待敲入基因的质粒进行共转化,基因同源重组整合效率为15%-37%。Larroude等[76]使用Golden Gate技术构建了一组用于编辑解脂耶氏酵母基因组的含有不同标记的CRISPR-Cas系统。此外,Schwartz等[77]开发出了一种可以对sgRNA在解脂耶氏酵母底盘中的切割效率进行定量的方法。
3 代谢工程改造解脂耶氏酵母合成PUFA的应用实例
解脂耶氏酵母作为代谢工程改造底盘细胞主要具有以下特征:(1)解脂耶氏酵母的安全级较高,能够用于食品和医药的生产[78]。(2)该酵母是一种产油酵母,具备天然积累高含量脂质的能力,其脂质积累量可达细胞干重(dry cell weight, DCW)的40%以上,因此是生产游离脂肪酸、甘油三酯、生物柴油等脂质相关物质的理想宿主菌株。(3)该酵母对油脂类物质具有较强的分解能力[79]。(4)该酵母能够在多种碳基质如亲水性和疏水性廉价碳源上生长[80-81],并通过特定代谢途径将其转化成各种高值化合物。(5)该酵母对各种不利生长条件的适应能力较强,例如可以在低pH和高渗透压条件下生长,从而有利于减少细菌污染[82]。(6)该酵母不受葡萄糖效应的影响,因此不会进行有氧酒精发酵[83]。(7)该酵母具有完全测序的基因组和相对成熟的遗传操作工具(如目前已开发了各种受体菌株和表达载体[81-84]),因此它已常被用作非模式微生物底盘/宿主菌来生产各种产品,成为了目前代谢工程和合成生物学方向使用最广泛的非常规酵母底盘之一[81, 85]。
近年来,研究者纷纷尝试利用代谢工程技术来改造解脂耶氏酵母底盘以生产PUFA。本文选择了部分代表性成果进行介绍,具体包括,ω-3 PUFA:ALA、EPA和DHA;ω-6 PUFA:LA、GLA和ARA。
3.1 ω-3系列脂肪酸
Damude等将来自串珠镰刀菌(Fusarium moniliformis)的Δ15-去饱和酶引入解脂耶氏酵母中进行表达,结果显示该酶具有将内源LA一步转化生成ALA的能力(图1),ALA的积累量达到了总脂肪酸(total fatty acids, TFA)的20%以上[86]。为了进一步提高ALA的产量,Cordova等[87]选择了高效积累油酸(占TFA 80%)的解脂耶氏酵母菌株作为出发底盘,并表达了圆红冬孢酵母(R. kratochvilovae)Δ15-去饱和酶;因为该出发底盘能够提供更多的前体物质——油酸,工程菌株中ALA含量得以提高。Tezaki等[88]通过验证解脂耶氏酵母细胞膜磷脂层的脂肪酸组成证明了PUFA合成量与细胞膜流动性之间具有一定的正关联性;而在低温条件下,解脂耶氏酵母细胞可通过提高其胞内脂肪酸的不饱和度来维持其细胞膜的流动性。因此,研究者将工程菌株在20℃下对该工程菌株进行培养,ALA含量显著增加,达到了TFA的近30%。通过补料分批发酵,解脂耶氏酵母工程菌株最终产生了1.4 g/L的ALA,这是目前酵母底盘生产ALA的最高产量。Li等[89]将可异源生产ALA的解脂耶氏酵母工程菌株与可利用木糖生长的解脂耶氏酵母工程菌株进行杂交,产生的子一代可以发酵木糖产生1.42 g/L的ALA。这一结果首次展示了利用菌株杂交的方式实现酵母发酵木糖生产PUFA的可能性。
迄今为止,由美国杜邦公司使用代谢工程策略改造解脂耶氏酵母生产EPA获得的产量是目前微生物细胞工厂里的最高值[24,90]。首先,研究者对所保存的40株解脂耶氏酵母菌株进行了筛选发现,最适产脂菌株ATCC 20362的油脂产量超过了100 g/L,脂质生产率超过1 g/L/h。其次,将三拷贝的Δ12-去饱和酶、两拷贝的Δ6-去饱和酶、四拷贝的C18/20-延长酶、五拷贝的Δ5-去饱和酶和三拷贝的Δ17-去饱和酶转化至该菌株中,使其能够通过Δ6途径成功产生了EPA(占TFA 3%)(图1)。紧接着,研究者又通过异源基因筛选、强启动子、多拷贝整合等策略实现了去饱和酶和延长酶活性的增加。最终,工程菌株共携带有19个过表达的异源基因,发酵后其EPA产量高达TFA的40%[91-93]。
Gemperlein等[94]在解脂耶氏酵母底盘中异源表达了原核来源的PUFA合成基因簇(biosynthetic gene clusters,BGC),并成功实现了DHA的异源合成。研究人员将来源于黏细菌的聚酮合酶(polyketide synthase, PKS)样PUFA合成酶以及来源于束状芽孢杆菌的DPA/DHA型PUFA合成酶转化至解脂耶氏酵母底盘中,由此得到的工程菌株所产生的DHA产量为86.5 mg/L,占TFA的10.5%。为了进一步提高DHA的产量,研究人员比较了不同培养基组成及培养条件对PUFA生产菌株DHA产量的影响情况。结果表明,甘油对DHA生产菌合成DHA的促进作用最为显著(例如,在甘油培养基中DHA产量可达到葡萄糖培养基的2倍)。此外,限制培养基中磷酸盐缓冲液的含量对DHA生产也具有一定的正向影响。在葡萄糖和甘油培养基中,当使用2-吗啉乙磺酸(4-morpholineethanesulfonic acid, MES)代替磷酸盐缓冲液时,可观察到DHA产量的显著提高,最终通过代谢工程和发酵优化的组合使用可使DHA合成量达到100 mg/L,占TFA的16.6%。
3.2 ω-6系列脂肪酸
Sun等[95]将来自高山被孢霉的Δ6-去饱和酶引入到解脂耶氏酵母中,构建了一株能够高产GLA的工程菌株(占TFA的4.6%)。同时,这项研究也证明了变温策略可提高解脂耶氏酵母生产GLA的能力。通过28℃预培养和20℃移温培养的策略对所获得的工程菌株进行发酵优化,所得GLA产量为71.6 mg/L。
Zhang等[96]在解脂耶氏酵母中以高拷贝数表达了来自痤疮丙酸杆菌的亚油酸异构酶,使其在能够发酵葡萄糖产生反式-10,顺式-12 CLA,产物含量达到了TFA的5.6%(DCW的0.23%),LA到CLA的底物转化率达到了80%。Zhang等[97]进一步使用组合代谢工程策略培育出的解脂耶氏酵母工程菌株能够产生高达TFA 10%(DCW 0.4%)的CLA,该菌株经发酵条件优化后能够发酵大豆油培养基产生4 g/L的CLA(TFA的44%,DCW的30%)。本研究中使用的代谢工程策略包括:(1)使用改良的pHP4d启动子(pHP4d启动子与另外12个拷贝的UAS1B融合)共过表达亚油酸异构酶和Δ12-去饱和酶;(2)通过多拷贝整合质粒进一步增强这两个异源基因的表达量,最终所构建的解脂耶氏酵母工程菌株是生产反式-10,顺式-12 CLA的理想菌株。
Liu等[98]首次采用一步PCR法将核糖体RNA(ribosomal DNA,rDNA)作为整合位点对解脂耶氏酵母细胞进行了工程化改造,并证明了同源整合效率与rDNA重叠区长度有关。使用该方法将高山被孢霉来源的ARA完整生物合成途径基因(近10 kb)快速组装到了解脂耶氏酵母的染色体上,效率高达23%。所构建的工程菌株具有较高的遗传稳定性,并能够合成高水平的ARA(TFA的0.4%)。
表3列举出了目前经代谢工程策略改造后的微生物底盘生产部分PUFA的最高产量及占总脂肪酸含量,也证明了经代谢工程改造的解脂耶氏酵母工程菌株具有高产PUFA的显著优势。
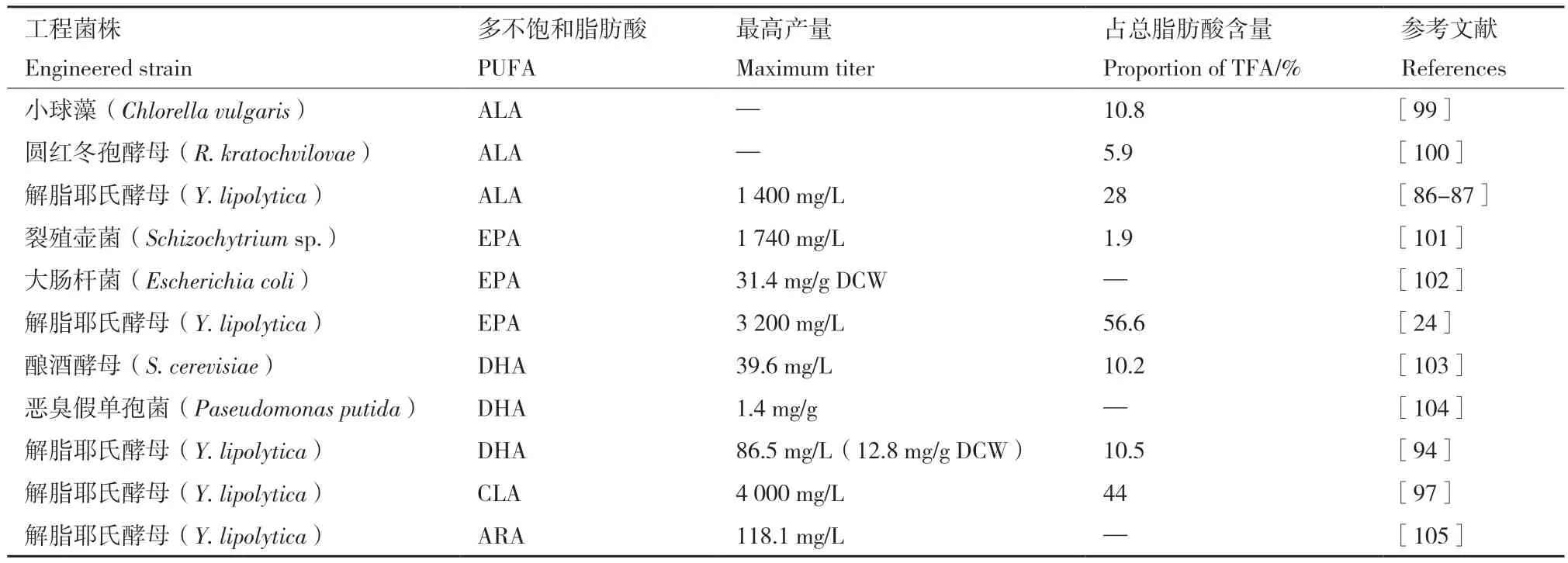
表3 代谢工程改造微生物底盘生产部分多不饱和脂肪酸的产量情况Table 3 Representative examples of PUFA production by metabolically engineered microorganisms
4 总结与展望
PUFA因其具有优良的生理功能及营养价值,现已被作为高附加值生物活性物质广泛添加到了功能性食品等各种产品中,近年来市场上对于PUFA的需求量和价格持续大幅度增加,因此急需解决现有生产瓶颈或发展新的生产路线。不论从生态环保、投产比,抑或是产业规模来看,利用微生物发酵生产PUFA的方法均具有很大优势,这是一条经济高效的PUFA绿色合成途径。解脂耶氏酵母作为一种天然高产油脂及脂肪酸的产油酵母,具备相对成熟的分子遗传体系和不断完善的合成生物学元件,因此成为了利用代谢工程策略改造微生物生产PUFA的首选底盘细胞之一。目前的研究结果也表明,经代谢工程改造后的解脂耶氏酵母细胞工厂已经实现了多种PUFA的合成,并展现出了优良的PUFA生产能力,因此其应用价值与发展前景是极为广阔的。
然而,由于对解脂耶氏酵母的基础及应用研究起步较晚,再加上该酵母存在的一些固有特性,在一定程度上限制了该酵母底盘在代谢工程及合成生物学方面的应用。目前所获得的PUFA产量还无法达到大规模工业化、效益化生产的要求,有以下几个主要问题亟待突破:
(1)该酵母本身不含有可自主复制的游离质粒,因此在该酵母底盘中进行外源基因表达时,需要首先构建人工整合载体,操作烦琐、工作量大。而且,虽然已经具有了多种解脂耶氏酵母表达系统可用的组成型和诱导型强启动子,但是在终止子元件方面的研究还相对落后。因此为解脂耶氏酵母构建能够稳定高效进行自主复制的游离型质粒,继续筛选更优的合成生物学组件(主要是终止子),开发序列更短、性能更强的人工启动子元件和人工终止子元件,都将是下一步工作的重点工作。
(2)目前仍然缺乏可对解脂耶氏酵母基因组中多个基因进行同时快速编辑的简便高效、特异性强的方法。未来需要研究者们开发出更多适用于解脂耶氏酵母基因组编辑的创新工具和技术。
(3)NHEJ是该酵母完成DNA双链断裂修复的主要形式,因此该酵母胞内的非同源重组效率极高,导致基因定点敲除和敲入非常困难。利用CRISPRCas9介导的基因整合技术虽然能够提高其同源重组的成功率,但现有技术仍未完全解决该酵母更倾向于进行非同源重组的问题。
(4)目前利用代谢工程技术在该底盘中所进行的遗传操作还相对较少,所用改造策略也并不完善,所以需要对该底盘进行更广泛的定向遗传改造(包括途径基因工程、启动子工程、辅助因子工程、蛋白质工程、前体工程、细胞器工程、细胞毒性工程、动态控制工程等),使代谢流更多地流向PUFA的合成途径,进而提高该非常规酵母细胞工厂生产PUFA的效率。
(5)我们推测PUFA在解脂耶氏酵母中可能发挥了某些重要功能,但目前有关这一问题的研究却相对较少;而且,解脂耶氏酵母不饱和脂肪酸合成和积累的分子调控机制尚不清晰,因此还需要深入研究PUFA的具体功能以及外界条件对解脂耶氏酵母合成PUFA的代谢影响及其调控机制。只有明确了这些关键核心问题,才能有的放矢,最终实现PUFA在解脂耶氏酵母底盘细胞中的进一步增产。
(6)该酵母是严格需氧的非发酵酵母,只有在氧气充足时才能达到最佳的生长和代谢状态,这可能是利用该酵母在工业上大规模发酵生产PUFA潜在的制约因素。