安徽甜瓜和栝楼蔓枯病的病原菌鉴定及其有效药剂筛选
2024-02-05夏智杰宋江华张立新
夏智杰,张 雷,宋江华,傅 敏,张立新,*
(1.安徽农业大学 植物保护学院,植物病虫害生物学与绿色防控安徽普通高校重点实验室,安徽 合肥 230036; 2.安徽农业大学 园艺学院,安徽 合肥 230036)
瓜类蔓枯病(gummy stem blight)是一种典型的世界性土传病害[1],可危害甜瓜、黄瓜等瓜类蔬菜茎蔓,致其产生褐色油渍状斑点,严重时造成茎蔓分叉处开裂枯死,植株死亡率高达60%~80%,减产30%以上[2-4]。该病害于1869年在德国首次被发现,随后在美国、瑞典、加拿大、日本、印度、中国新疆等地区相继报道了甜瓜、西瓜、黄瓜等瓜类作物的发生和危害[5]。目前引起瓜类蔓枯病的病原菌主要有Stagonosporopsiscitrull,Stagonosporopsiscucurbitacearum和Stagonosporopsiscaricae[6]。据报道,S.citrulli引起的黄瓜蔓枯病在美国北卡州是仅次于根结线虫的黄瓜第二大病害[7];在我国,S.cucurbitacearum引起广东省苦瓜蔓枯病暴发流行,部分设施大棚中苦瓜蔓枯病发病率超过80%[8];在吉林省S.citrulli引起西瓜主产区暴发蔓枯病,导致大面积失收,严重影响了西瓜生产[9]。该病害具有发病早、危害重、损失大等特点[10],对瓜类作物的安全生产造成了严重威胁。
蔓枯病在瓜类植株整个生育期均可发生,苗期蔓枯病的发病率较低,孕蕾期植株开始表现症状,生长中后期发病最为严重。叶片和茎蔓是最主要的发病部位,叶片发病初期可出现水渍状小斑点,后期逐渐发展为轮纹状的黄褐色斑点或呈“V”形病斑,严重时可在发病部位观察到黑色点状的分生孢子器。茎蔓部发病初期可出现水渍状褐色病斑,随着病情发展,病斑可沿茎蔓拓展几厘米到几十厘米,后期病斑上可出现散生黑色颗粒物[11-12]。近年来,随着安徽省瓜类蔬菜种植面积不断扩大,瓜类蔓枯病的发生也呈加重趋势。2021—2022年在舒城和巢湖地区的甜瓜和栝楼田间出现了严重的蔓枯病,为明确这些瓜类蔓枯病的病原菌类型,本研究对该地区的病样进行了采集、病原菌分离和鉴定,以及室内药剂筛选工作,以期为农业生产中瓜类蔓枯病防控提供科学依据。
1 材料与方法
1.1 供试材料
供试样品:2021—2022年分别从安徽舒城县、巢湖市的甜瓜和栝楼田块,采集蔓枯症状的茎蔓组织,放于自封袋内,带回实验室用于病原菌的分离;金香玉甜瓜种子(武汉金阳红种苗农业有限公司)、皖蒌9号栝楼种子(安徽有余跨越瓜蒌食品开发有限公司)催芽育苗后用于病原菌致病性测定。
培养基:马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基;燕麦培养基(oat meal agar, OA);诱导产孢培养基:原PDA培养基配方中加入酵母提取物2 g。
试剂及仪器:DL2000 DNA Marker、2×TaqMaster Mix,北京康为世纪生物科技有限公司;其他试剂均为国产分析纯。RLD-500C-4 人工气候箱,宁波乐电仪器制造有限公司;C1000 Touch PCR仪,美国Bio-Rad公司;CKX53倒置显微镜,日本Olympus株式会社。
供试药剂:98%啶酰菌胺原药,武汉曙欧科技有限公司;97%咪鲜胺原药,江苏辉丰生物农业股份有限公司;95%苯醚甲环唑原药,深圳诺普信农化股份有限公司;98%戊唑醇原药,97%多菌灵原药,98%吡唑醚菌酯原药,先正达作物保护有限公司;97%异菌脲原药,湖北成丰化工有限公司。
1.2 病原菌的分离和纯化
采用组织分离法[13]对病原菌进行分离和纯化。将采集得到的具有蔓枯症状的茎蔓用灭菌剪刀在病健交界处剪取2~3 mm的病组织,先后浸入0.1%HgCl290 s、75%乙醇45 s 进行表面消毒,无菌水冲洗3次后,用灭菌的滤纸吸干病组织表面水分,最后转移至PDA平板上,置于25 ℃黑暗条件下培养,待长出菌落后挑取菌落边缘的菌丝进行纯化培养。待长出菌落后转接到另一平板上纯化培养。在新鲜的PDA中进行单孢分离,获得纯化的后代,并对分离所得的菌株进行编号,于PDA斜面保存。
1.3 病原菌的形态学观察
将纯化后的菌株接种于PDA培养基上,26 ℃黑暗条件下培养7 d,观察并记录菌落形态特征;参照李英等[14]诱导蔓枯病菌产孢的方法, 将纯化后的菌株接种于诱导产孢培养基上,26 ℃黑暗条件下培养7 d后,在40 W紫外灯下(20 h黑暗/4 h紫外)下30 cm照射4 d,在倒置荧光显微镜下观察菌株的分生孢子形态,并测量分生孢子大小;同时将纯化后的菌株接种于燕麦培养基上,26 ℃黑暗条件培养7 d后,在40 W紫外灯下(20 h黑暗/4 h紫外)下30 cm照射4 d,在倒置荧光显微镜下观察菌株的子囊孢子形态,并测量子囊孢子大小。
1.4 目的位点的序列分析和构建系统发育树
根据分离地点及寄主植物的不同,随机选择5个代表性菌株,其中安徽舒城3株(SC1-1、SC2-1、SC3-1),巢湖市2株(CH1-1、CH2-1)进行分子鉴定。采用CTAB法提取各菌株的基因组DNA,利用3个目的位点的引物对测试菌株进行PCR扩增,包括ITS(ITS-1: 5′-TCCGTAGGTGAACCTGCGG-3′, ITS-4: 5′-TCCTCCGCTTATTGATA-3′)[15]、TUB2基因(T1: 5′-AACATGCGTGAGATTG-3′, Bt2b: 5′-ACCCTCAGTGTAGTGA-3′)[16]和LSU(LROR: 5′-GTACCCGCTGAACTTAAGC-3′, LR7: 5′-TACTACCACCAAGATCT-3′)[17], 以上引物均由南京擎科生物科技有限公司合成。
25 μL PCR扩增体系:10 μmol·L-1上下游引物各1.0 μL、2×TaqPCR Master Mix 12.5 μL、基因组DNA 1.0 μL,ddH2O补足至25.0 μL。ITS、TUB2基因扩增反应程序为94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃再次延伸5 min。LSU位点扩增程序为95 ℃预变性5 min;95 ℃变性45 s,48 ℃退火45 s,72 ℃延伸2 min,35个循环;72 ℃再延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,纯化后送至南京擎科生物科技有限公司进行测序。
将测序获得的序列在NCBI数据库中进行BLAST序列比对和校对后,将获得的测试菌株目的基因序列递交GenBank,各菌株目的片段的序列登录号见表1。同时下载Stagonosporopsis属内各近缘种模式菌株及参考菌株的目的序列,经Clustal X 1.83序列比对,并手动截齐两端,按LSU-ITS-TUB2顺序连接成多基因联合序列。基于最大似然法(maximum likelihood, ML),设置自展值(boot straps)为1 000,用MEGA 7.0软件构建系统发育树。

表1 菌株信息及目的位点序列
1.5 致病性测定
采用分生孢子悬浮液进行致病性测定。收集诱导产孢培养基上的分生孢子,无菌水漂洗后调节分生孢子悬浮液浓度约为107mL-1。将甜瓜及栝楼种子消毒、催芽,出苗后长至4片真叶时,取大小相近的健康幼苗,用75%乙醇擦拭消毒、无菌水清洗后,晾干。将配制好的孢子悬浮液喷洒幼苗叶片及茎部至有水滴流下,另设无菌水处理为对照组,每次处理重复3次,置于25 ℃人工气候箱内保湿培养(相对湿度85%,12 h光照/12 h黑暗),逐日观察记录幼苗发病情况。待接种的幼苗发病后,从病组织处再分离病原菌,经形态学和分子生物学方法鉴定后,验证是否与原接种病原菌相同,从而完成柯赫氏法则。
1.6 病原菌室内药剂筛选
采用生长速率法测定7种药剂对瓜类蔓枯病病原菌的毒力。供试药剂母液用无菌水溶解稀释,设置5个质量浓度梯度。97%异菌脲、95%苯醚甲环唑浓度梯度为5、1、0.5、0.1、0.05 μg·mL-1,98%啶酰菌胺、97%咪鲜胺浓度梯度为1、0.5、0.1、0.05、0.01 μg·mL-1,98%吡唑醚菌酯、98%戊唑醇浓度梯度为25、5、1、0.5、0.1 μg·mL-1,97%多菌灵浓度梯度为200、100、50、25、5 μg·mL-1。
无菌操作条件下,将不同浓度的药剂以1∶9等比例分别加入到灭菌的PDA培养基中,充分摇匀后等量倒入培养皿中,制成含有相应浓度药剂的平板,以加入等量无菌水的PDA培养基为对照。将供试菌株在PDA平板26 ℃培养5 d后,用打孔器在菌落边缘打取直径6 mm的菌碟,接种到含药培养基中央和对照PDA平板中,每个浓度为1组处理,每组处理重复3次。培养至对照组菌落直径为培养皿直径的2/3时,采用十字交叉法测量各处理的菌落直径,计算菌丝生长抑制率。菌丝生长抑制率=(对照菌落直径-药剂处理菌落直径)/(对照菌落直径-6 mm)×100%。按最小二乘法作毒力回归方程、EC50值。
2 结果与分析
2.1 甜瓜和栝楼蔓枯病田间症状
甜瓜和栝楼蔓枯病主要侵染其茎蔓,初期症状为在近节处产生褐色油浸状斑点,略凹陷(图1-a),严重时,茎蔓近节处开裂,同时伴有黄白色流胶,干燥后呈红褐色或黑色(图1-b);发病后期病节处干枯,凹陷,呈灰白色,表面散生黑色小点(图1-c)。

a, c, 甜瓜蔓枯病田间发病症状;b, 栝楼蔓枯病田间发病症状。a, c, Diseased symptoms of C. melo in the field; b, Diseased symptoms of T. kirilowii in the field.图1 甜瓜和栝楼蔓枯病田间发病症状Fig.1 Field sympthoms of gummy stem blight on Cucumis melo and Trichosanthes kirilowii
2.2 病原菌的形态学特征
对采集的6份甜瓜及4份栝楼病样进行组织分离,从甜瓜病样中分离得到22个纯化菌株,从栝楼病样中得到12个纯化菌株。从甜瓜和栝楼茎蔓处分离得到蔓枯病的病原菌菌株形态无明显差异。各分离菌株在PDA培养基培养7 d后呈现白色菌落,气生菌丝发达、棉絮状,中间稠密, 略隆起(图2-a),初白色, 老化后灰白色,菌落背面初白色, 后期变为墨绿色, 基生菌丝深褐色(图2-b);分生孢子短圆形至圆柱形,两端钝圆,无色,平均大小为5.6 μm×3.0 μm,单胞(图2-c);假囊壳内子囊呈棍棒状,无色透明,顶端钝圆,内含8个子囊孢子(图2-d);子囊孢子为无色透明双胞,椭圆形,孢子横向有一个分隔膜,隔膜处明显缢缩将孢子分为两部分细胞,上细胞较宽,顶端较钝,下细胞较窄,子囊孢子平均大小为12.85 μm×5.7 μm(图2-e)。
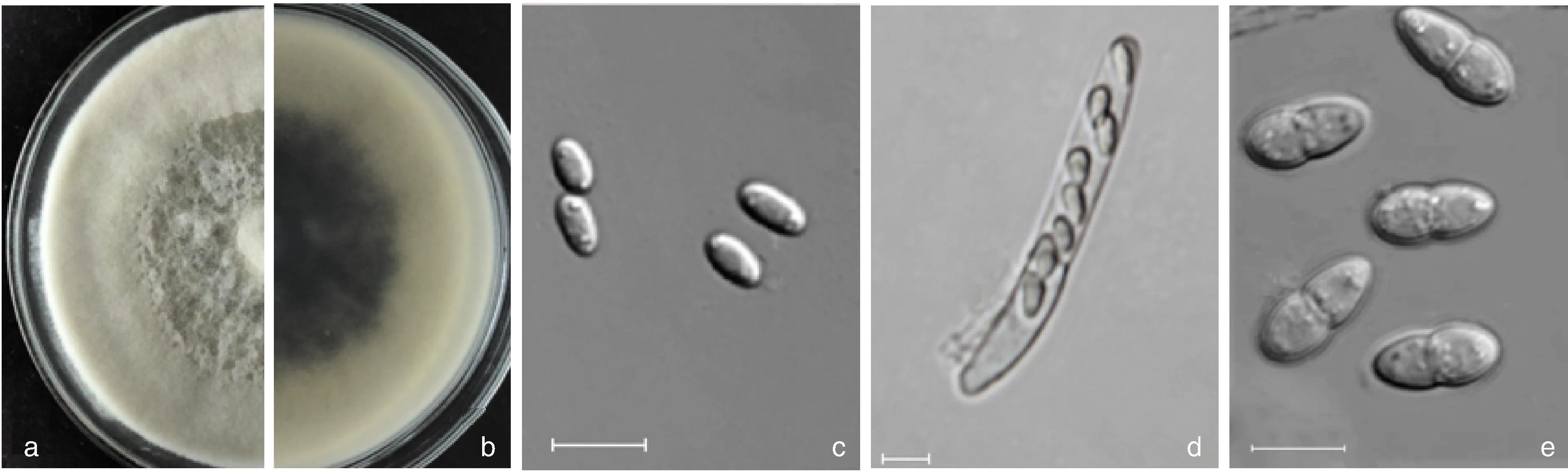
a, b,菌株在PDA培养基上培养7 d的菌落形态;c,分生孢子,标尺为10 μm;d,子囊,标尺为10 μm;e,子囊孢子,标尺为10 μm。a, b,Colony characters of isolates on PDA medium for 7 d; c,Conidia, scale bar=10 μm; d,Asci, scale bar=10 μm; e,Ascospores, scale bar=10 μm.图2 病菌分离物的形态学特征Fig.2 Morphological characteristics of the isolates
2.3 多位点序列分析
为明确甜瓜和栝楼蔓枯病的病原菌种类,根据分离地点、寄主植物以及分离频率,选取5个代表性菌株进行分子鉴定。对其3个位点 (ITS、TUB2、LSU) 进行PCR扩增,测序后进行序列同源性比对及多位点序列聚类分析。BLAST序列同源性搜索结果显示,菌株SC1-1、SC2-1、SC3-1、CH1-1、CH2-1的rDNA-ITS、rDNA-LSU序列与GenBank中参考菌株S.citrulli(MT040723和MN943656)的同源性为100%;测试菌株的β-tublin基因序列与参考菌株S.citrulli(MH853667)的同源性为99.06%。基于LSU、ITS、TUB2的多位点序列聚类分析结果,测试菌株与参考菌株S.citrulliCBS 214.65以90%的自举置信值紧密地聚在一起(图3)。结合形态学特征及多位点序列分析,确定引起安徽省甜瓜和栝楼蔓枯病的病原菌为S.citrulli。测试菌株目的位点序列的GenBank登录号见表1。

图3 基于LSU、ITS、TUB2的位点序列构建的系统发育树Fig.3 Phylogenetic tree inferred from concatenated sequences of partial LSU, ITS and TUB2
2.4 病原菌致病性测定
将代表性菌株的分生孢子悬浮液喷雾接种进行致病性测定,结果表明,供试菌株对甜瓜和栝楼幼苗均具有致病性。甜瓜幼苗接种2 d后,叶片失绿呈淡黄色,茎蔓处呈油浸状,整株猝倒,且从病斑上均能再次分离纯化出相同的病原菌;栝楼幼苗接种3 d后,栝楼叶片失绿干枯出现不规则黄褐色病斑,茎蔓干枯脱水变为黄褐色;5 d后栝楼叶片完全干枯,茎蔓表面分布大量黑色分散小点,与田间瓜类蔓枯病发病症状相似,对照组未发病。将发病组织重新进行病原菌的分离和鉴定,确定与原接种的菌株一致(图4)。

a,甜瓜幼苗对照;b,接种菌株S.citrulli SC1-1的甜瓜幼苗;c,栝楼幼苗对照;d,接种菌株S.citrulli CH1-1的栝楼幼苗。a, Control(C. melo seedlings); b, C. melo seedlings inoculated with S. citrulli SC1-1; c, Control (T. kirilowii seedlings); d, T. kirilowii seedlings inoculated with S. citrulli CH1-1.图4 蔓枯病菌在甜瓜(2 d)和栝楼(5 d)幼苗上的致病性Fig.4 Pathogenicity of S. citrulli isolates on C. melo(2 d) and T. kirilowii (5 d) seedlings
2.5 七种药剂对病原菌的室内毒力测定
通过菌丝生长速率法测定了7种药剂对甜瓜和栝楼蔓枯病的病原菌S.citrulli(SC1-1、SC2-1、SC3-1、CH1-1、CH2-1)的毒力(表2、表3)。结果表明,啶酰菌胺、咪鲜胺的EC50值在0.010 6~0.043 8 μg·mL-1,这2种杀菌剂抑菌效果最好;其次为异菌脲和苯醚甲环唑,EC50值在0.867 5~1.767 5 μg·mL-1;多菌灵的抑菌效果最差,其EC50值最高,为40.677 7 μg·mL-1。
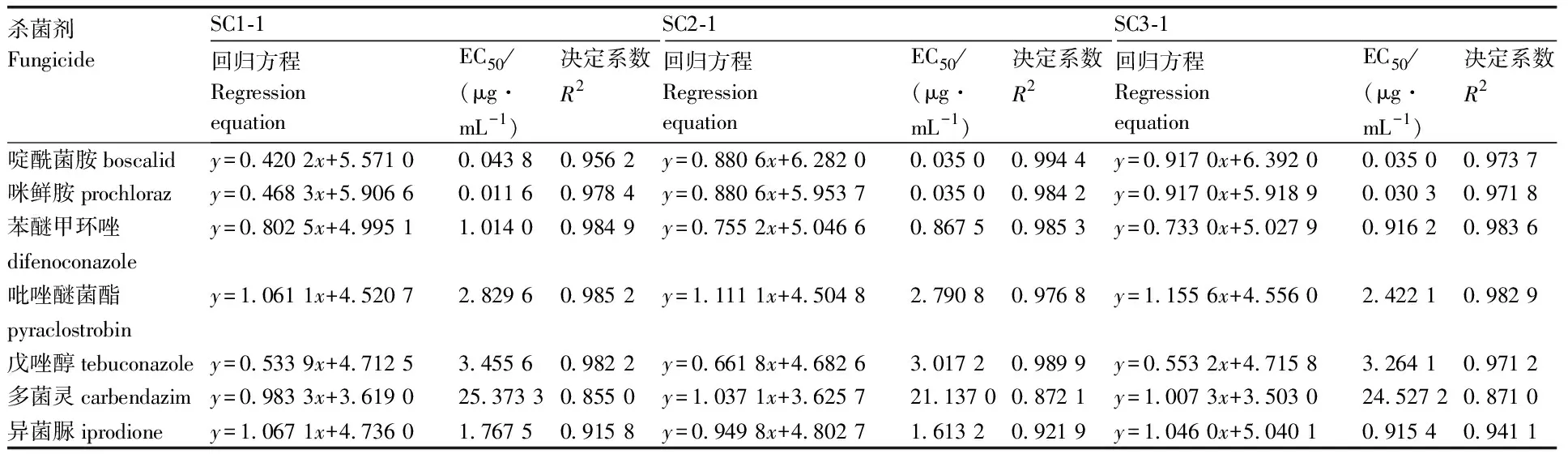
表2 七种杀菌剂对安徽舒城菌株的室内毒力测定
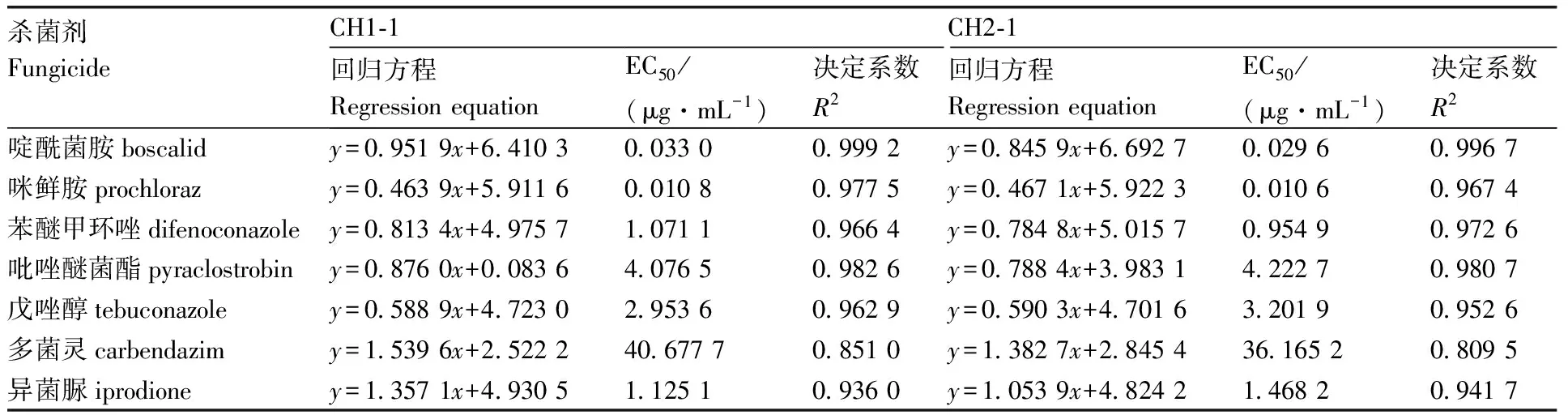
表3 七种杀菌剂对安徽巢湖菌株的室内毒力测定
3 讨论
蔓枯病是世界范围内葫芦科植物的主要病害,该病害于1823年在瑞典首次被报道[18]。S.caricae、S.citrulli和S.cucurbitacearum是引起蔓枯病的病原菌,3种病原菌具有相同的形态特征和重叠的地理、寄主范围[6,18-19]。瓜类蔓枯病病原菌以前的鉴定方法主要是基于形态学,以及部分大亚基(LSU)和小亚基(SSU)的核苷酸序列,但由于 LSU和 SSU 序列数据不能提供足够的系统发育信息,无法区分密切相关的属或种[20-22]。学者们利用LSU、ITS与TUB2多位点序列分析,为亚隔孢壳科的分类鉴定提供了强大的系统发育主干,可清楚区分该科中各属内的近缘种[23-25]。
本研究对安徽省引起甜瓜和栝楼蔓枯病的病原菌进行鉴定,通过组织分离法从病样组织中分离获得菌落形态一致的分离物,通过致病性测定、形态学特征和多位点序列分析,将获得的5株代表性菌株确定为S.citrulli。目前,在21个不同属 37种瓜类上发现蔓枯病[26],其中,甜瓜和西瓜是最为易感的品种[27]。Huang等[28]将采集于台湾地区的西瓜蔓枯病的病原菌鉴定为S.citrulli,但谭蕊[29]将来自于西南地区的西瓜蔓枯病的病原菌鉴定为S.cucurbitacearum和S.caricae;秦健等[8]鉴定广东省苦瓜蔓枯病的病原为S.cucurbitacearum。结合前人研究报道,笔者认为我国瓜类蔓枯病的病原菌存在3个种,且可侵染多种葫芦科作物,但不同地理区域瓜类作物蔓枯病的病原菌种类是否存在明显差异,这有待进一步开展广泛的调查和研究。
目前,化学防治仍为防治瓜类蔓枯病的主要手段。本研究测定了7种杀菌剂对蔓枯病病原菌的毒力,其中咪唑类杀菌剂咪鲜胺和烟酰胺类杀菌剂啶酰菌胺对瓜类蔓枯病菌S.citrulli的抑制效果最佳,这与前人报道的咪鲜胺和啶酰菌胺对瓜类蔓枯病病原菌的室内抑菌效果一致[30]。但烟酰胺类杀菌剂作用位点单一, 病原菌极易产生抗性。Thomas等[31]和Keinath等[32]报道美国部分地区西瓜蔓枯病菌S.citrulli已对啶酰菌胺产生抗药性。建议在农业生产中啶酰菌胺与其他杀菌剂混合使用或交替使用,以提高防治效果和避免产生抗药性。此外,有研究表明,播种感染的种子,即使是低水平的种传接种也会导致温室和大田蔓枯病的严重发生[33]。同时研究发现,在感染蔓枯病死亡植株附近11%~15%的幼苗可表现出蔓枯病症状[34]。因此,播种无菌种子和及时清理田间蔓枯病植株也十分必要。
