基于非靶向代谢组学技术探讨Yes 相关蛋白1 改善马兜铃酸I诱导小鼠肝损伤的机制
2024-02-04薛玉李彩格刘一玮杨佳丽张智琴纪敬敏于琨石新丽河北中医药大学河北石家庄050200
薛玉,李彩格,刘一玮,杨佳丽,张智琴,纪敬敏,于琨,石新丽(河北中医药大学,河北 石家庄 050200)
马兜铃酸(Aristolochic acid,AA)是一种植物次生代谢物,普遍存在于马兜铃属和细辛属植物中,而马兜铃酸I(Aristolochic acid I,AAI)被认为是马兜铃酸的主要毒性成分,被列为一级致癌物,可引起肾小管上皮细胞坏死、凋亡,触发肾间质纤维化,导致马兜铃酸肾病[5]。近年来研究发现,AAI 除了具有肾毒性外[5],其对肝脏[6-7]和代谢[8]也有一定影响。已有研究[9]表明,AAI 可抑制小鼠睾丸细胞氨基酸代谢,阻碍脂肪酸的摄取和氧化分解,抑制糖酵解和糖异生,影响睾丸细胞正常葡萄糖摄取。而肝脏作为主要的代谢器官,AAI能通过影响代谢对肝脏产生一定作用,进而导致肝损伤和代谢紊乱。
Yes 相关蛋白1(Yes-associated protein 1,YAP1)是Hippo 通路下游的一种关键效应蛋白,协同调控多个生物学过程[10]。YAP1 在脂肪肝、肝纤维化、肝脏肿瘤等肝脏病变的发生发展过程中发挥了重要作用[11]。临床研究[12]表明,肝癌患者肿瘤组织中YAP1高表达。YAP1 还能通过促进糖酵解、脂肪生成和谷氨酰胺分解而调节代谢,参与脂肪肝的发生发展[11]。故本研究拟探讨YAP1 对AAI 诱导肝损伤后代谢的影响及机制,以期为通过代谢治疗DILI 提供新的新靶点。
1 材料与方法
1.1 动物肝细胞特异性Yap1基因敲除小鼠(基因型为Yap1Flox/Flox,Albumin-Cre,简称Yap1LKO)、对照小鼠(基因型为Yap1Flox/Flox,简称Yap1Flox),由广州赛业生物有限公司构建并鉴定成功,实验动物生产许可证号:SCXK(粤)2018-0032,动物质量合格证号:44410400003059。动物在SPF 级环境中饲养,室温为23~25 ℃,12 h 明暗循环,自由饮水摄食。每笼小鼠按照雄性∶雌性=1∶2 的比例配成繁殖笼,挑选由其配繁出的子代雄性小鼠经鼠尾鉴定其基因型后进行实验研究。本实验经过河北中医药大学伦理委员会批准,伦理批文号:DWLL202203064。
1.2 主要仪器Tanon3500R 型全自动凝胶成像分析系统,上海天能科技公司;Varioskan LUX 型多功能微孔板读数仪、Q-Exactive 型四级杆-静电场轨道阱高分辨质谱仪、Ultimate 3000 型超高效液相色谱系统、Heraeus Fresco 17 型离心机,赛默飞世尔科技(中国)有限公司;ACQUITY UPLC BEH Amide色谱柱(1.7 μm,2.1 mm×100 mm),美国Waters公司。
1.3 主要试剂动物组织/细胞基因组DNA 提取试剂(货号:D1700),北京索莱宝科技有限公司;乙腈(货号:1499230-935)、乙酸铵(货号:70221),德国Merck 公司;甲醇(货号:144282),天津市大茂化学试剂厂;丙氨酸氨基转移酶(ALT)检测试剂盒(货号:C009-2-1)、天门冬氨酸氨基转移酶(AST)检测试剂盒(货号:C010-2-1)南京建成生物工程研究所;兔抗小鼠/人YAP(D8H1X)XP 抗体(货号:14074),美国Cell Signaling Technology 公司;生物素标记的山羊抗兔IgG(H+L,货号:D110058),上海生工生物工程股份有限公司。
1.4 分组及干预随机选取8 只体质量为(10±5)g 的3 周龄雄性Yap1LKO小鼠作为Yap1LKO+AAI 组,8 只Yap1Flox对照小鼠作为Yap1Flox+AAI组。2组小鼠均按照2.5 mg·kg-1·d-1剂量腹腔注射AAI,连续14 d。
1.5 鼠尾PCR 法鉴定基因型按照索莱宝动物组织/细胞基因组DNA 提取试剂盒说明书步骤操作,提取小鼠尾部DNA。PCR 样本包括基因组DNA、Taq主混合物、正向引物、反向引物和ddH2O。将目标样品放入热循环机中进行PCR 扩增反应,经历变性、退火、延伸和最终延伸。将PCR 产物置于2%琼脂糖凝胶上进行电泳,采用全自动凝胶成像分析系统分析最后结果。Cre引物序列:上游引物(Forward),5’-GAAGCAGAAGCTTAGGAAGATGG-3’;下游引物(Reverse),5’-TTGGCCCCTTACCATAACTG-3’;产物长度为390 bp。
第一个办法就是在饮食上做出改变。每一样食物在体内的消化速度是不一样的,有些食物很快被消化,短时间内就能为身体提供能量。像富含蛋白质和纤维的食物就有助于加快新陈代谢。
1.6 微板法测定血清ALT、AST 活性严格按照试剂盒说明书步骤操作,在510 nm 波长下检测各孔吸光度值,通过标准曲线计算小鼠血清中ALT、AST 酶活性。
1.7 HE 染色法观察肝脏组织病理变化取各组小鼠肝脏组织,用4%多聚甲醛溶液固定后,经脱水、透明、包埋后切片;肝脏组织切片经脱蜡剂脱蜡、常规苏木素-伊红(HE)染色,乙醇梯度脱水、二甲苯透明、中性树胶封片后晾干,在光学显微镜下观察肝脏组织病理变化。
1.8 免疫组织化学法测定肝组织中YAP1 蛋白表达情况取各组小鼠肝脏组织切片,60 ℃下烘25 min;经脱蜡、乙醇水化后进行抗原修复,PBS 漂洗3 次,每次5 min;加入内源性过氧化物酶,室温下孵育25 min;加入正常山羊血清工作液,室温下孵育25 min;滴加适量一抗YAP(D8H1X)XP(1∶100),4 ℃下孵育过夜;滴加生物素标记山羊抗兔IgG、辣根酶标记链霉卵白素工作液;滴加DAB 显色后,经苏木素复染、脱水,二甲苯透明、封片;在光学显微镜下观察YAP1 蛋白表达情况,细胞核呈棕褐色为阳性表达。
1.9 非靶向代谢组学方法分析肝脏组织差异代谢物
1.9.1 样品处理 解剖、收集小鼠肝脏组织后置于液氮中保存、备用。取小鼠肝脏组织,低速超声研磨后,加入预冷的甲醇乙腈混合水溶液,涡旋混匀,-20 ℃下静置60 min;以4 ℃、14 000 r·min-1(离心半径=8.5 cm)离心20 min,取上清,真空干燥备用。质控样品(QC)为取所有样品10 μL 的混合样品,在检测样品上机前、中、后期插入QC 样品,用于监测和评价系统的稳定性及实验数据的可靠性。
1.9.2 分析条件 色谱条件:ACQUITY UPLC BEH Amide 色谱柱(1.7 μm,2.1 mm×100 mm),柱温:40 ℃,流速: 0.3 mL·min-1;流动相:0.1%甲酸水(A)-乙腈(B);梯度洗脱程序:0~0.5 min,5% B;0.5~1.0 min,5% B;1.0~9.0 min,5%~100% B;9.0~12.0 min,100% B;12.0~15.0 min,5% B;进样体积:5 μL。整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动造成的影响,采用随机顺序进行样本的连续分析,每组样品插入QC样品。
质谱条件:样品经UHPLC 分离后,采用QExactive 四级杆-静电场轨道阱高分辨质谱仪进行质谱分析。亲水相互作用色谱分离后的ESI 源条件如下:离子源气体1:60 Psi;离子源气体2:60 Psi;气帘气:30 Psi;离子源温度:320 ℃;离子源电压:±3 500 V(正负两种模式);质量数检测范围(m/z):80~1 200 Da;离子扫描分辨率:17 500; MS扫描间隔时间:0.20 s;二级质谱采用信息相关获得(Information dependent acquisition,IDA),采用高灵敏度模式,去簇电压(DP):±60 V(正负两种模式);碰撞能量:(35±15)eV;IDA 设置为Exclude isotopes within 4 Da;Candidate ions to monitor per cycle:6。
1.10 统计学处理方法及代谢组学数据分析采用SPSS 23.0统计软件进行数据分析;计量资料以均数±标准差(±s)表示;两组间比较采用t检验;以P<0.05为差异有统计学意义。
采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱联用技术分析样品信息,将质谱采集得到的原始数据经过Compound Discoverer 3.0 软件(Thermo Fisher Scientific 公司)进行峰提取、峰对齐、峰校正、标准化等数据前处理;再应用SIMCA-P 14.1 软件进行无监督主成分分析(PCA)分析、有监督偏最小二乘法判别分析(PLS-DA)和正交偏最小二乘法判别分析(OPLS-DA);以变量投影重要度(VIP)>1、Fold-Change>2、P<0.05 为标准筛选差异代谢物;通过HMDB 数据库(https://hmdb.ca)和METLIN数据库(https://metlin.scripps.edu),根据检测物质的保留时间和二级质谱图匹配信息对代谢物进行鉴定、注释;通过京都基因与基因组百科全书(KEGG)数据库(http://www.genome.jp/kegg/)对差异代谢物进行通路富集分析。
2 结果
2.1 肝细胞特异性Yap1基因敲除小鼠的配繁与基因型鉴定结果见图1。为了获得符合实验条件的小鼠,将Yap1LKO小鼠与Yap1Flox小鼠配繁子F1 代小鼠。通过PCR 法检测了小鼠Cre基因,结果显示Yap1LKO小鼠有Cre基因表达,而Yap1Flox小鼠无Cre基因表达。
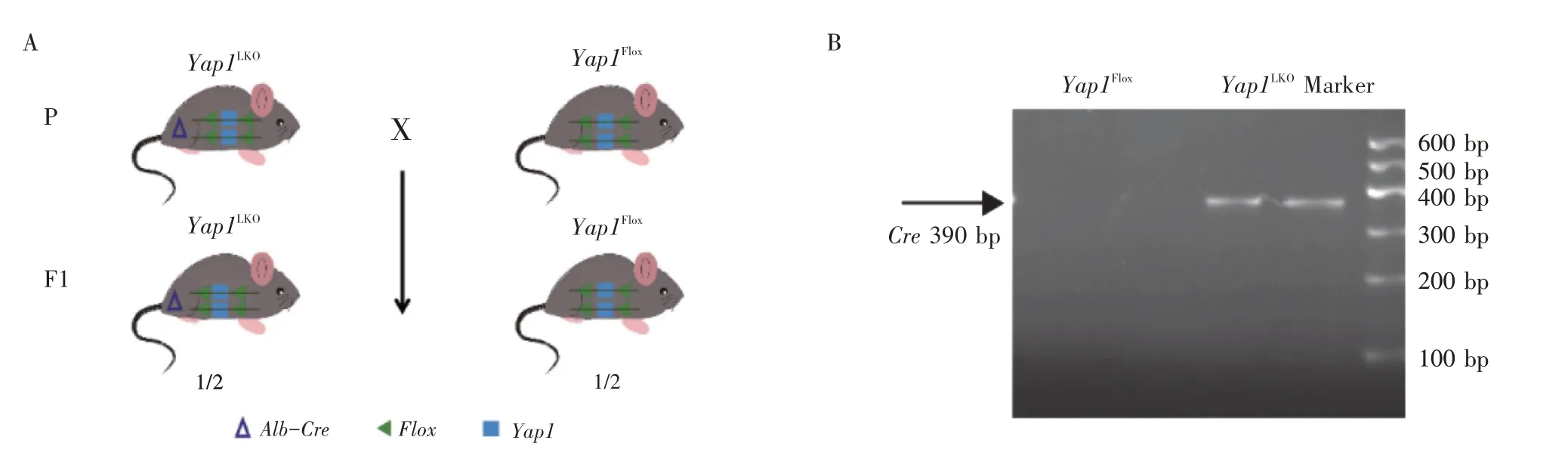
图1 肝细胞特异性Yap1 基因敲除小鼠的配繁(A)与基因型鉴定(B)Figure 1 Breeding(A)and genotype identification(B)of hepatocyte specific Yap1 gene knockout mice
2.2 肝细胞特异性Yap1基因敲除加重了AAI 诱导的小鼠肝脏损伤结果见图2。AAI 诱导14 d,Yap1LKO小鼠的体质量增长低于Yap1Flox小鼠,但差异无统计学意义(P>0.05)。在第14 天,与Yap1Flox+AAI 组比较,Yap1LKO+AAI 组小鼠血清中的ALT、AST 酶活性明显升高(P<0.05)。HE 染色显示,Yap1Flox+AAI 组小鼠肝组织可见部分脂肪变性、点状坏死,肝窦内及汇管区可见少量淋巴细胞浸润。与Yap1Flox+AAI 组比较,Yap1LKO+AAI 组小鼠肝细胞排列紊乱,肝细胞普遍变性、浑浊肿胀、胞浆疏松甚至呈气球样变,肝血窦变狭窄,可见广泛的脂肪变性并有散在的嗜酸性小体形成、灶性坏死甚至大片状坏死、坏死灶及汇管区淋巴细胞浸润,肝细胞再生活跃、核大、深染,有的可见双核,偶见核分裂相,汇管区增宽,有大量的炎性细胞浸润。免疫组化染色显示,Yap1Flox小鼠肝脏有YAP1 蛋白阳性表达,而Yap1LKO小鼠无YAP1 蛋白阳性表达。结果表明,Yap1基因敲除加重了AAI诱导的小鼠肝脏损伤。

图2 肝细胞特异性Yap1 基因敲除加重了马兜铃酸I(AAI)诱导的小鼠肝脏损伤(±s,n=8)Figure 2 Hepatocyte specific Yap1 gene knockout aggravated AAI-induced liver damage in mice(±s,n=8)
2.3 肝细胞特异性Yap1 基因敲除对AAI 诱导小鼠肝脏代谢组的影响
2.3.1 小鼠肝脏代谢轮廓分析 结果见图3。经过峰提取、峰对齐、峰校正、标准化处理后,组内各样本的峰响应强度和保留时间基本一致,表明在整个实验过程中仪器误差较小。正、负离子模式合并后的总离子流图轮廓基本相似,但组间各样本的峰响应强度存在差异[13]。

图3 各组小鼠肝脏组织样品的总离子流图Figure 3 Total ion chromatograms of liver tissue samples in each group of mice
2.3.2 小鼠肝脏代谢物的多元统计分析 结果见图4。在正离子(ESI+)、负离子(ESI-)模式下肝脏组织样品的PCA 及PLS-DA 分析结果显示,Yap1Flox+AAI 组与Yap1LKO+AAI组样本分离趋势显著(P<0.001),2组样本代谢谱发生明显变化,两者间有不同的代谢物簇。OPLS-DA 分析显示R2Y≥0.5、Q2≥0.5,说明模型稳定有效,并以VIP>1 且P<0.05 为标准进一步筛选组间差异代谢物。通过OPLS-DA 模型置换检验显示,ESI+模式下R2=(0.0,1.0),Q2=(0.0,-0.055 1);ESI-模式下R2=(0.0,1.0),Q2=(0.0,-0.041 4)。根据模型是否过拟合评判标准,满足以下任意一项即可认为没有发生过拟合:(1)所有Q2点均低于最右侧的原始Q2点;(2)Q2点的回归线在纵坐标的交叉点小于0。结果显示OPLS-DA 模型未过拟合,说明实验结果可靠。

图4 小鼠肝脏代谢组数据的多元统计分析Figure 4 Multivariate statistical analysis of metabolome data of liver tissue in mice
2.3.3 小鼠肝脏差异代谢物筛选 通过代谢组学分析共筛选出139 种显著变化(VIP>1 且P<0.05)的差异代谢物,进一步采用层次聚类精确筛选标记代谢物并绘制热图,以更全面、直观地评估候选代谢物的合理性以及代谢物表达模式的差异,结果见图5。经过AAI 处理14 d 后,与Yap1LKO+AAI 组小鼠相比,Yap1Flox+AAI 组小鼠的62 种肝脏代谢物上调,包括胆碱、牛磺酸、亚牛磺酸、α-亚麻酸、桐油酸、鹅去氧胆酸等;77 种代谢物下调,包括甘油磷酸胆碱、L-磷脂酰胆碱、L-谷氨酰胺、L-丝氨酸、L-谷胱甘肽、5-甲硫腺、苯丙氨酸、6-磷酸葡萄糖、乳酸、尿酸苷等。

图5 小鼠肝脏差异代谢物筛选Figure 5 Screening of differential metabolites in mice liver
2.3.4 肝脏差异代谢物的KEGG 通路分析 结果见图6。通过KEGG 网站对小鼠肝脏差异代谢物进行通路富集分析,了解代谢物的功能特征和分类。结果显示,139种差异代谢物主要涉及的通路(前10位)包括癌症中的胆碱代谢(Choline metabolism in cancer)、甘油磷脂代谢(Glycerophospholipid metabolism)、胰岛素抵抗(Insulin resistance)、 谷胱甘肽代谢(Glutathione metabolism)、ABC 转运蛋白通路(ABC transporters)、 泛酸与辅酶 A 的生物合成(Pantothenate and CoA biosynthesis)、乙醚脂质代谢(Ether lipid metabolism)、亚油酸代谢(Linoleic acid metabolism)、嘌呤代谢(Purine metabolism),以及甘氨酸、丝氨酸和苏氨酸代谢(Glycine,serine and threonine metabolism)。其中代谢通路9 条,包括脂代谢5 条、氨基酸代谢2 条、胰岛素1 条、核苷酸代谢1 条。结果提示,YAP1 可能通过调控胆碱代谢、甘油磷脂代谢等改善AAI诱导的小鼠肝损伤。

图6 小鼠肝脏组织差异代谢物的KEGG 通路富集分析结果Figure 6 KEGG pathway enrichment analysis of differential metabolites in liver tissue of mice
3 讨论
马兜铃作为传统中药被广泛应用于治疗湿疹、肺炎、中风、炎症性疾病、蛇咬伤、关节炎、痛风和冠心病等疾病[14]。然而近年来研究发现,马兜铃酸(AA)除了具有肾毒性外,还具有肝毒性[15],可通过氧化应激和线粒体凋亡途径诱导大鼠肝损伤[16],在体内代谢形成马兜铃内酰胺氮离子,与DNA 碱基环外氨基结合形成相应的AA-DNA 加合物,导致肝损伤甚至诱发肝癌[6]。本研究结果表明,马兜铃酸I(AAI)诱导3 周龄雄性小鼠14 d后,肝脏发生了明显的病理改变,并且引发代谢紊乱,导致肝损伤。
Yes 相关蛋白1(YAP1)是Hippo 通路下游的一种关键效应蛋白,可调节组织炎症,参与调控机体内环境稳态[17]。YAP 在肝损伤后的恢复中具有重要作用,研究[18]证实,部分肝切除术后核内YAP 表达上调,而YAP 缺失会导致肝再生受损。此外,慢性肝损伤中的导管反应也依赖YAP 信号传导[19]。YAP1 作为潜在的治疗靶点,可提高经脾移植肝祖细胞治疗急性肝损伤的效果[20],并且YAP1 激活可减轻肝脏缺血再灌注损伤及肝纤维化[21]。本研究结果也证明,YAP1能够通过调控代谢稳态缓解AAI诱导的小鼠肝损伤。
马兜铃酸的肝毒性还表现在对肝脏代谢的改变,包括甘油磷脂代谢、牛磺酸和次牛磺酸代谢、D-谷氨酰胺和D-谷氨酸代谢,以及花生四烯酸代谢[8]。YAP1 还能够通过上调葡萄糖转运蛋白以促进糖酵解和能量的供应[22],并通过氨基酸转运蛋白促进氨基酸摄取[23]。本研究发现,在AAI 诱导的小鼠肝损伤中,YAP1 还能够通过调控胆碱代谢、甘油磷脂代谢等脂质代谢来缓解肝损伤。甘油磷酸胆碱磷酸二酯酶(Glycerophosphocholine phosphodiesterase1,GPCPD1)能催化甘油磷酸胆碱水解生成胆碱[24],而激活的YAP通过上调GPCPD1 和卵磷脂胆固醇脂酰转移酶(lecithin-cholesterolacyltransferase,LCAT),直接激活胆碱代谢[25],从而促进细胞竞争。胆碱是动物必需的水溶性营养素,胆碱缺乏会导致机体氧化应激和抗氧化能力减弱[26],还会导致线粒体功能紊乱和DNA氧化损伤[27],从而发生肝脂肪变性和肝细胞死亡。牛磺酸可以提高机体抗氧化酶活性,促进脂肪及其他脂类物质的消化和吸收[28],保护由于过量胆固醇或脂肪沉积造成的脂毒性引起的肝脏细胞损伤和凋亡[29]。临床研究[30]发现,胆汁酸(Bile acids,BAs)和多不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs)与药物性肝损伤(DILI)的严重程度和慢性化转归密切相关。本研究发现,YAP1 能上调小鼠肝脏中胆碱、牛磺酸等不饱和脂肪酸,调控胆碱代谢、甘油磷脂代谢等通路,从而改善AAI诱导的肝损伤。本研究结果可为临床治疗DILI的新靶点提供参考。
综上所述,肝细胞特异性Yap1基因敲除加重了AAI 诱导的小鼠肝脏损伤,YAP1 通过上调胆碱、牛磺酸等不饱和脂肪酸,参与调控胆碱代谢、甘油磷脂代谢等,从而改善AAI诱导的小鼠肝损伤。
