miR156 调控猕猴桃果实抗坏血酸代谢机制初探
2024-02-04周钰雯胡晶金周雨菲陈思懿
周钰雯,陈 超,胡晶金,周雨菲,陈思懿,李 旭,*
(1.浙江万里学院生物与环境学院,浙江 宁波 315100;2.宁波大学科学技术学院/宁波市农业种质资源挖掘与环境调控重点实验室,浙江 宁波 315212;3.慈溪市坎墩玉兰果蔬农场,浙江 宁波 315300)
抗坏血酸(L-ascorbic acid,AsA),又名维生素C,是广泛存在于植物中的小分子抗氧化物质[1],对植物的生长发育及果实品质的形成具有重要作用,也是维持人类正常生长发育所必需的营养物质[2]。因此,提高果蔬中AsA 含量具有重要的产业意义和应用价值。
猕猴桃是猕猴桃科猕猴桃属中多年生落叶藤本植物,果实中AsA 含量是梨和苹果的80~100 倍,享有“水果之王”“VC 之王”的称号[3]。AsA 高效代谢积累成为猕猴桃果实营养物质的研究热点。相关研究表明,猕猴桃AsA 生物合成途径中AcPMM、AcGME2和AcGalLDH基因,循环途径中AcMDHAR2、AcDHAR、AcGR和AcAPX基因是调控红阳猕猴桃果实高AsA 水平的重要基因[4]。猕猴桃果实内外果皮AsA 含量存在显著差异[5-6],内果皮AsA 含量显著大于外果皮,然而内外果皮AsA 差异的生理和分子机制尚不清楚。因此,本研究通过生理生化以及转基因手段,探究猕猴桃内外果皮AsA 代谢差异的原因。
1 材料与方法
1.1 试验材料
以红阳猕猴桃果实为试材,采样时间为2022 年5—9 月,于盛花期后40 d 开始,每隔20 d 采样1 次,选取大小均匀的无损伤猕猴桃果实,果实分内外果皮,于液氮中磨至粉状,放入-80 ℃冰箱中保存,用于测定AsA 含量和基因表达量。
1.2 AsA和T-AsA含量的测定
T-AsA 即总抗坏血酸。AsA 和T-AsA 的提取与测定参照张琰等[7]的方法进行。
1.3 总RNA提取及反转录cDNA的合成
称取约0.1 g 猕猴桃果实(分内、外果皮),使用植物RNA 提取试剂盒来提取果实内外果皮总RNA。根据反转录试剂盒说明书进行操作。
1.4 小RNA提取及反转录
小RNA 提取采用Takara 公司的RNAiso for Small RNA(9753A,Takara,大连,中国)试剂进行提取。采用茎环法设计猕猴桃miR156 和5S rRNA 的反转录茎环引物和半定量引物[8],反转录cDNA,通过实时荧光定量检测miR156 表达量。
1.5 实时荧光定量PCR
采用三步法进行q-PCR 扩增。以猕猴桃AcActin作为内参基因,设置3 个生物学重复,每个基因的相对表达量以2(-ΔCT)方法进行分析。
2 结果与分析
2.1 猕猴桃果实内外果皮AsA和T-AsA含量差异分析
如图1 所示,在幼果时期(盛花后40 d),AsA、T-AsA 含量达到最高值,之后随着果实的生长发育逐渐下降。果实内果皮AsA 含量在花后100 d 趋于稳定,而果实外果皮中AsA 含量在花后80 d 已无明显变化。花后120 d(商业化成熟期)时,内、外果皮中AsA 的含量分别为花后40 d 的29.2%和22.7%。综上所述,猕猴桃果实发育过程抗坏血酸含量逐渐降低,果实内果皮抗坏血酸含量显著大于外果皮。

图1 猕猴桃果实内外果皮AsA 和T-AsA 含量变化
2.2 猕猴桃果实内外果皮AsA合成途径相关基因表达变化分析
根据前期测定的转录组数据,筛选获得AsA 合成途径的基因,采用荧光定量PCR 技术,分析6 个AsA合成途径基因的表达情况。如图2 所示,在果实生长发育过程,合成基因与AsA 含量水平呈现相似的变化趋势。果实发育早期即花后40~60 d,果实内果皮中AsA 合成基因转录水平显著高于外果皮。综上研究结果表明,在AsA 合成途径中,AcPGI、AcPMM、AcGMP、AcGPP、AcGalLDH、AcGME是导致猕猴桃果实内外果皮AsA 含量差异的关键基因且在果实发育早期差异显著。

图2 猕猴桃果实内外果皮AsA 合成途径基因表达
2.3 猕猴桃果实内外果皮AsA循环途径相关基因表达变化分析
在猕猴桃果实发育的过程,AsA 循环途径相关基因AcMDHAR1、AcMDHAR2、AcDHAR、AcGR整体上呈现下降趋势。果实发育后期即花后80~120 d,果实内果皮中AsA 循环途径基因表达水平显著高于外果皮(见图3)。综上表明,在AsA 循环途径中,AcMDHAR1、AcMDHAR2、AcDHAR、AcGR是导致猕猴桃果实内外果皮AsA 差异的主要基因且在果实发育后期差异显著。

图3 猕猴桃果实内外果皮AsA 循环途径基因表达
2.4 猕猴桃果实内外果皮miR156表达变化分析
荧光定量PCR 结果显示(见图4),miR156 基因的表达水平整体呈下降趋势,且在整个生长过程中,果实内果皮中miR156 基因含量显著高于外果皮,在花后120 d 趋于平衡。综上,猕猴桃果实发育过程miR156 基因的表达和抗坏血酸含量变化基本一致。

图4 猕猴桃果实生长过程miR156 表达
2.5 转基因验证miR156对猕猴桃果实抗坏血酸含量的影响
为了验证miR156 基因对猕猴桃果实抗坏血酸含量的影响,通过瞬时转化猕猴桃果实手段进行验证分析。如图5(a)所示,35S:MIR156a过表达猕猴桃果实中miR156 表达水平显著升高,35S:MIM156干扰表达果实中miR156 表达水平显著降低。如图5(b)—(c)所示,与对照组相比,T-AsA 和AsA 含量在35S:MIR156a过表达猕猴桃果实中显著增加,而在35S:MIM156干扰表达果实中显著减少。综上,miR156 基因正调控猕猴桃果实中的抗坏血酸含量。
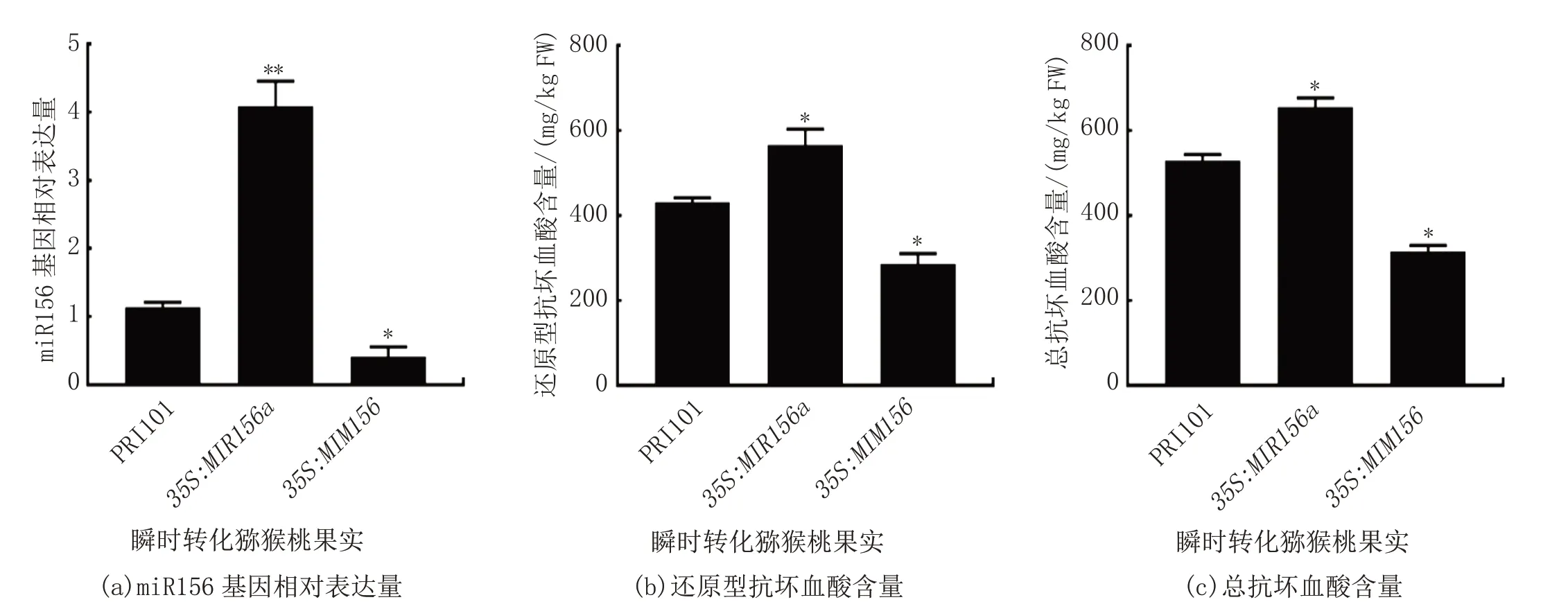
图5 miR156 对猕猴桃果实抗坏血酸含量的影响
2.6 miR156对抗坏血酸合成和循环途径基因表达的影响
为了进一步验证miR156 基因对抗坏血酸的调控作用,利用实时荧光定量PCR 技术测定分析AsA 合成和循环途径相关基因表达水平。如图6 所示,与对照组相比,在35S:MIR156a过表达果实中,AcPGI、AcPMM、AcGMP、AcGPP、AcGaILDH、AcGME、AcMDHARI、AcMDHAR2、AcDHAR、AcGR表达水平显著升高,而在35S:MIM156干扰表达果实中上述基因的表达水平显著下降,但AcPMM表达水平几乎不变。综上,miR156 调控猕猴桃果实中的抗坏血酸合成和循环途径基因表达。

图6 miR156 对抗坏血酸合成和循环途径基因表达的影响
3 讨论与结论
猕猴桃果实果实发育过程中,AsA 在幼果时期含量达到最高值,之后随着果实发育快速下降,这与钟彩虹等研究结果基本一致。荧光定量PCR 结果表明,果实内果皮miR156 基因表达量显著高于外果皮。已有研究表明,miR156-SPL 不仅是调控植物幼年到成年阶段转变的核心分子模块,还参与植物生长发育其他方面,如植株形态建成、质体转化、生殖发育、果实成熟和胁迫响应等[9]。本研究初步结果明确miR156对AsA 代谢具有调控作用,说明miR156-SPL 分子模块功能比较丰富。
本研究发现,猕猴桃果实内果皮AsA 含量显著高于外果皮。在AsA 合成途径中,AcPGI、AcPMM、AcGMP、AcGPP、AcGalLDH、AcGME是导致猕猴桃果实内外果皮AsA 差异的主要基因且差异主要存在于果实发育早期。在AsA 循环途径中,AcMDHAR1、AcMDHAR2、AcDHAR、AcGR是导致猕猴桃果实内外果皮AsA 差异的主要基因且差异主要存在于猕猴桃果实发育后期,降解途径未见差异。瞬时转基因手段证实miR156 调控猕猴桃果实中的抗坏血酸合成和循环途径基因表达。
