松果菊苷对尿毒症大鼠肾损伤的影响及机制 Δ
2024-02-02武汉市中医医院肾病科武汉430014
熊 玮,彭 斌,高 智(武汉市中医医院肾病科,武汉 430014)
尿毒症(uremia,URE)是慢性肾脏病的终末阶段,也是急性肾损伤发展的最后状态。急性肾损伤若不及时有效地治疗,随着疾病的进展会出现恶化或延迟,进而发展为慢性肾功能不全、肾功能衰竭,最终发展为URE。
管花肉苁蓉是一种具有肝、肾、肠保护作用的植物,松果菊苷(echinacoside,ECH)是其主要活性成分,具有抗氧化、抗炎、抗神经毒素、抗细胞凋亡和保护神经等多种生物学效应[1]。目前ECH 在临床上的应用尚未见报道,但有研究显示ECH 可通过降低URE 大鼠血清中白细胞介素1β(interleukin-1β,IL-1β)和IL-18 的含量,改善其肾功能[2];ECH可修复免疫系统动态平衡、抑制炎症反应、保护肾功能,改善脓毒症大鼠急性肾损伤[3]。ECH还能够通过抑制核因子κB(nuclear factor-κB,NF-κB)信号通路来抑制下游炎症因子的产生,减轻炎症反应[4]。p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)是NF-κB 上游的信号通路,抑制p38 MAPK/NF-κB信号通路的激活能减轻5/6肾切除大鼠炎症反应和肾损伤[5]。基于此,本文研究了ECH对URE大鼠肾损伤和p38 MAPK/NF-κB信号通路的影响,初步探讨其作用机制,旨在为URE的治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括JIDI-20D 型台式多用途高速离心机(广州吉迪仪器有限公司)、HBS-1096A型酶标仪(南京德铁实验设备有限公司)、BX53M 型光学显微镜[仪景通光学科技(上海)有限公司]、LSM 900 型共聚焦显微镜(北京普瑞赛司仪器有限公司)、Mini-PROTEAN Tetra Cell 型电泳仪[迪图(上海)生物科技有限公司]、Tanon MINI Space系列多功能凝胶图像分析系统(上海天能生命科学有限公司)。
1.2 主要药品与试剂
ECH(货号HY-N0020,纯度99.65%)和茴香霉素(p38 MAPK 信号通路激活剂,货号HY-18982,纯度99.44%)均购自美国MCE 公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IL-1β、IL-6 酶联免疫吸附测定(ELISA)试剂盒(货号分别为J22405、J22380、J22434)均购自武汉吉立德生物科技有限公司;血尿素氮(blood urea nitrogen,BUN)、β2-微球蛋白(β2-microglobulin,β2-MG)、血肌酐(serum creatinine,Scr)、24 h 尿蛋白(24 h urine protein,24 h UP)、中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、肾损伤分子1(kidney injury molecule-1,KIM-1)、胱抑素C(cystatin C,Cys-C)ELISA 试剂盒(货号分别为CB10659-Ra、CB10155-Ra、CB12464-Ra、CB10651-Ra、CB10849-Mu、CB10747-Ra、CB10229-Ra)均购自上海科艾博生物技术有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)ELISA试剂盒(货号分别为ml077384、ml059387)均购自上海酶联生物科技有限公司;兔抗p38 MAPK单克隆抗体和兔抗磷酸化p38 MAPK(p-p38 MAPK)多克隆抗体(货号分别为AF7668、AF5887)均购自上海碧云天生物技术有限公司;小鼠抗E-上皮钙黏素(E-cadherin)单克隆抗体、兔抗α-平滑肌肌动蛋白(α-smooth muscle protein,α-SMA)单克隆抗体、兔抗NF-κB p65多克隆抗体、兔抗磷酸化NF-κB p65(p-NF-κB p65)单克隆抗体、兔抗β-actin 多克隆抗体和山羊抗兔IgG 二抗(货号分别为ab231303、ab124964、ab19870、ab76302、ab8227、ab6721)均购自英国Abcam公司。
1.3 动物
SPF级SD大鼠,雄性,体重200~220 g,购自湖北贝恩特生物科技有限公司,实验动物生产许可证号SCXK(鄂)2021-0027。本研究方案符合实验动物伦理学要求,经武汉华联科生物技术有限公司伦理委员会审核批准,批件号HLK-202304-03。
2 方法
2.1 URE大鼠模型建立
大鼠在适宜的温度和湿度环境下,自由饮食饮水,适应性喂养7 d。根据参考文献方法[6],利用5/6 肾切除法建立URE 大鼠模型:用3%戊巴比妥钠麻醉大鼠,背部剃毛消毒,左侧背部处切口,暴露肾脏,分离肾组织,解剖肾包膜,切除肾脏上、下极部位约2/3 的左肾,止血复位缝合伤口;1周后,再次打开切口完全切除右肾。以仅切开大鼠左侧背部,暴露肾脏,但不摘除肾脏的大鼠作为假手术组(Sham 组)。术后8 周,检测Sham 组和URE 大鼠血清中BUN 和Scr 水平,如果URE 大鼠血清中BUN、Scr水平为Sham组的2~3倍,则表示URE大鼠模型建立成功。
2.2 分组与给药
将建模成功的URE大鼠分为尿毒症(URE)组、ECH低剂量(ECH-L)组、ECH 中剂量(ECH-M)组、ECH 高剂量(ECH-H)组和ECH 高剂量+茴香霉素(ECH-H+Ani)组,每组12 只。ECH-L、ECH-M、ECH-H 组大鼠分别灌胃10、20、40 mg/(kg·d)ECH[2];ECH-H+Ani 组大鼠灌胃40 mg/(kg·d)ECH,尾静脉注射2 mg/(kg·d)茴香霉素[7];Sham 组和URE 组大鼠灌胃等体积生理盐水,每天1次,连续给药8周。
2.3 炎症、肾功能及肾损伤相关指标检测
各组大鼠末次给药2 h 后,麻醉,眼眶静脉采血,以3 000 r/min离心10 min,取上清液,严格按照ELISA试剂盒说明书操作,检测血清中TNF-α、IL-1β、IL-6、BUN、β2-MG、Scr、NGAL、KIM-1 和Cys-C 水平。使用代谢笼收集各组大鼠24 h的尿液标本,离心,取上清液,严格按照ELISA试剂盒说明书操作,检测其中24 h UP水平。
2.4 脂质过氧化和抗氧化活性指标检测
眼眶静脉采血后,各组随机取6只大鼠断头处死,分离左肾组织,取部分肾组织进行匀浆,严格按照ELISA试剂盒说明书操作,检测肾组织中MDA 水平和SOD活性。
2.5 肾组织病理学观察
将各组剩余的6 只大鼠断头处死,分离肾组织,用4%多聚甲醛固定,将组织包埋于石蜡中,切片,干燥,脱蜡并用乙醇水合,苏木精-伊红(HE)染色5 min,使用光学显微镜观察大鼠的肾组织病理学变化。根据肾小管坏死、细胞肿胀、空泡化和肾小管上皮细胞脱落的病变部位面积占比,采用半定量组织学评分法进行评分:0分,<10%;1分,10%~25%;2分,>25%~50%;3分,>50%~75%;4分,>75%~100%[8]。
2.6 肾组织中α-SMA、E-cadherin阳性表达检测
取“2.5”项下肾组织切片,脱蜡、脱水,分别加入α-SMA和E-cadherin抗体(稀释比例均为1∶1 000),4 ℃孵育过夜;再加入相应二抗,室温孵育;用4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)复染细胞核,使用共聚焦显微镜观察α-SMA、E-cadherin阳性表达情况,并计算阳性表达率:阳性表达率=阳性细胞数/全部细胞数×100%。
2.7 肾组织中p38 MAPK/NF-κB信号通路相关蛋白表达检测
取各组大鼠肾组织,提取总蛋白,检测蛋白浓度,电泳、分离后,将蛋白质转移到聚偏二氟乙烯膜上,并用5%脱脂奶粉封闭1 h;加入p38 MAPK、p-p38 MAPK、NF-κB p65、p-NF-κB p65、β-actin抗体(稀释比例分别为1∶1 000、1∶1 000、1∶500、1∶500、1∶1 000),4 ℃孵育过夜;加入山羊抗兔IgG 二抗(稀释比例为1∶5 000),室温孵育1 h;ECL显影,使用Image J 软件分析,以目标蛋白与内参蛋白(β-actin)灰度值比值表示蛋白表达水平,再以p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65 比值表示p38 MAPK、NF-κB p65的磷酸化水平。
2.8 统计学分析
采用SPSS 19.0 软件对数据进行统计学分析,符合正态分布的资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;不符合正态分布时,组间比较采用Mann-whitneyU秩和检验。检验水准α=0.05。
3 结果
3.1 ECH对URE大鼠血清中炎症因子水平的影响
与Sham 组相比,URE 组大鼠血清中TNF-α、IL-1β和IL-6 水平均显著升高(P<0.05);与URE 组相比,ECH-L、ECH-M、ECH-H 组大鼠血清中TNF-α、IL-1β 和IL-6 水平均呈剂量依赖性降低(P<0.05);与ECH-H 组相比,ECH-H+Ani组大鼠血清中TNF-α、IL-1β和IL-6水平均显著升高(P<0.05)。结果见表1。
表1 ECH 对URE 大鼠血清中炎症因子水平的影响(±s,n=12,pg/mL)
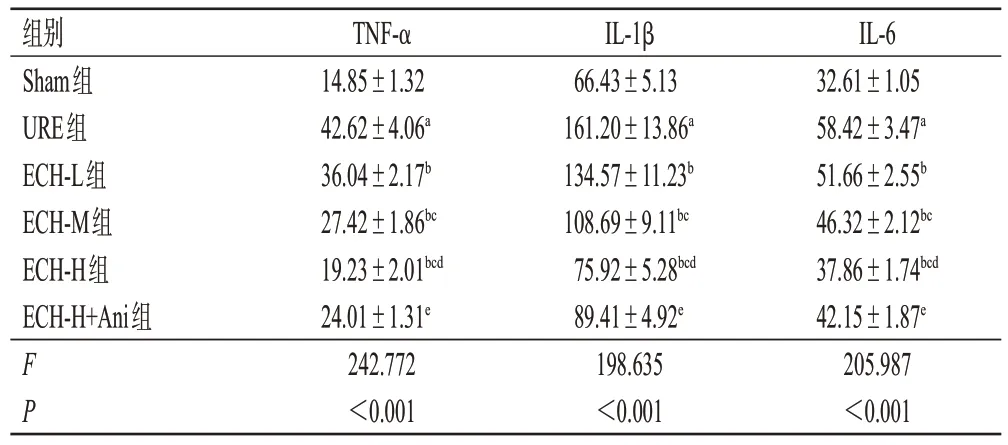
表1 ECH 对URE 大鼠血清中炎症因子水平的影响(±s,n=12,pg/mL)
a:与Sham组相比,P<0.05;b:与URE组相比,P<0.05;c:与ECHL组相比,P<0.05;d:与ECH-M组相比,P<0.05;e:与ECH-H组相比,P<0.05。
IL-6 32.61±1.05 58.42±3.47a 51.66±2.55b 46.32±2.12bc 37.86±1.74bcd 42.15±1.87e 205.987<0.001组别Sham组URE组ECH-L组ECH-M组ECH-H组ECH-H+Ani组FP TNF-α 14.85±1.32 42.62±4.06a 36.04±2.17b 27.42±1.86bc 19.23±2.01bcd 24.01±1.31e 242.772<0.001 IL-1β 66.43±5.13 161.20±13.86a 134.57±11.23b 108.69±9.11bc 75.92±5.28bcd 89.41±4.92e 198.635<0.001
3.2 ECH 对URE 大鼠肾功能及肾损伤相关指标的影响
与Sham 组相比,URE 组大鼠的BUN、Scr、β2-MG、24 h UP、NGAL、KIM-1 和Cys-C 水平均显著升高(P<0.05);与URE 组相比,ECH-L、ECH-M、ECH-H 组大鼠的BUN、Scr、β2-MG、24 h UP、NGAL、KIM-1 和Cys-C水平均呈剂量依赖性降低(P<0.05);与ECH-H组相比,ECH-H+Ani 组大鼠的BUN、Scr、β2-MG、24 h UP、NGAL、KIM-1 和Cys-C 水平均显著升高(P<0.05)。结果见表2。
表2 ECH对URE大鼠肾功能指标的影响(±s,n=12)
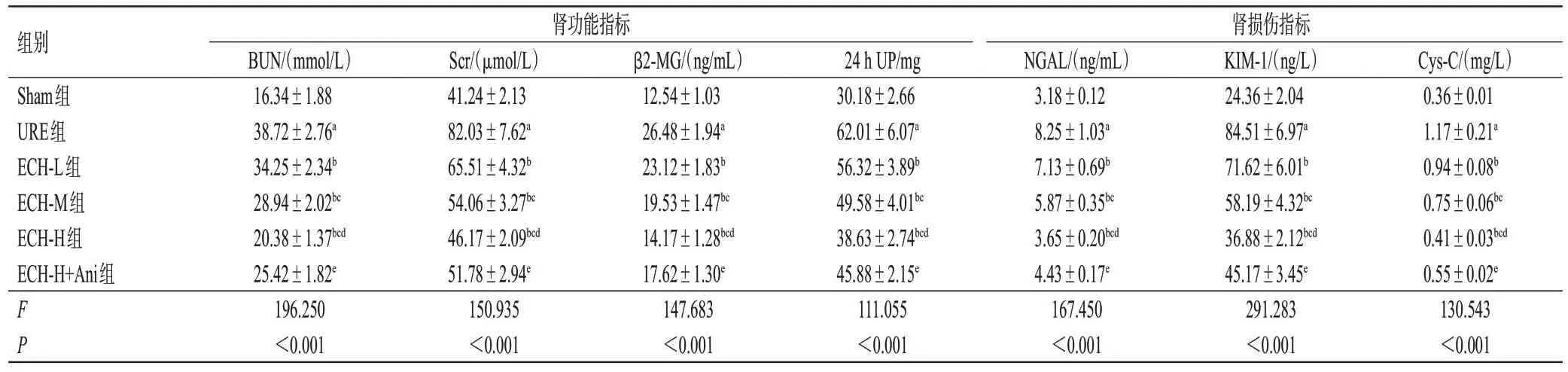
表2 ECH对URE大鼠肾功能指标的影响(±s,n=12)
a:与Sham组相比,P<0.05;b:与URE组相比,P<0.05;c:与ECH-L组相比,P<0.05;d:与ECH-M组相比,P<0.05;e:与ECH-H组相比,P<0.05。
组别Sham组URE组ECH-L组ECH-M组ECH-H组ECH-H+Ani组肾功能指标肾损伤指标KIM-1/(ng/L)24.36±2.04 84.51±6.97a 71.62±6.01b 58.19±4.32bc 36.88±2.12bcd 45.17±3.45e 291.283<0.001 Scr/(μmol/L)41.24±2.13 82.03±7.62a 65.51±4.32b 54.06±3.27bc 46.17±2.09bcd 51.78±2.94e 150.935<0.001 β2-MG/(ng/mL)12.54±1.03 26.48±1.94a 23.12±1.83b 19.53±1.47bc 14.17±1.28bcd 17.62±1.30e 147.683<0.001 24 h UP/mg 30.18±2.66 62.01±6.07a 56.32±3.89b 49.58±4.01bc 38.63±2.74bcd 45.88±2.15e 111.055<0.001 FP Cys-C/(mg/L)0.36±0.01 1.17±0.21a 0.94±0.08b 0.75±0.06bc 0.41±0.03bcd 0.55±0.02e 130.543<0.001 BUN/(mmol/L)16.34±1.88 38.72±2.76a 34.25±2.34b 28.94±2.02bc 20.38±1.37bcd 25.42±1.82e 196.250<0.001 NGAL/(ng/mL)3.18±0.12 8.25±1.03a 7.13±0.69b 5.87±0.35bc 3.65±0.20bcd 4.43±0.17e 167.450<0.001
3.3 ECH 对URE 大鼠脂质过氧化和抗氧化活性指标的影响
与Sham 组相比,URE 组大鼠的MDA 水平显著升高,SOD活性显著降低(P<0.05);与URE组相比,ECH-L、ECH-M、ECH-H组大鼠的MDA水平均呈剂量依赖性降低,SOD活性均呈剂量依赖性升高(P<0.05);与ECH-H组相比,ECH-H+Ani 组MDA 水平显著升高,SOD 活性显著降低(P<0.05)。结果见表3。
表3 ECH 对URE 大鼠脂质过氧化和抗氧化活性指标的影响(±s,n=6)
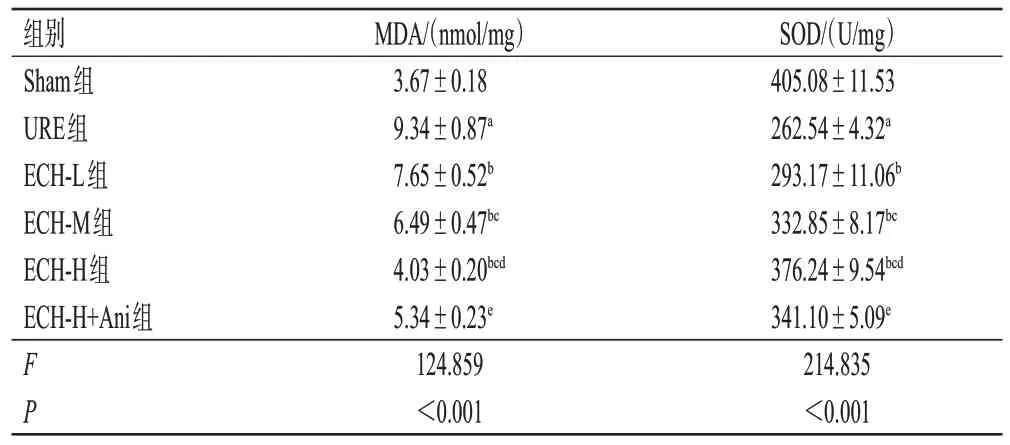
表3 ECH 对URE 大鼠脂质过氧化和抗氧化活性指标的影响(±s,n=6)
a:与Sham组相比,P<0.05;b:与URE组相比,P<0.05;c:与ECHL组相比,P<0.05;d:与ECH-M组相比,P<0.05;e:与ECH-H组相比,P<0.05。
SOD/(U/mg)405.08±11.53 262.54±4.32a 293.17±11.06b 332.85±8.17bc 376.24±9.54bcd 341.10±5.09e 214.835<0.001组别Sham组URE组ECH-L组ECH-M组ECH-H组ECH-H+Ani组FP MDA/(nmol/mg)3.67±0.18 9.34±0.87a 7.65±0.52b 6.49±0.47bc 4.03±0.20bcd 5.34±0.23e 124.859<0.001
3.4 ECH 对URE 大鼠肾组织病理学变化及肾损伤评分的影响
与Sham组相比,URE组大鼠肾组织结构严重破坏,肾小球肿胀严重,基质增多,系膜增厚,肾小管上皮细胞出现大量损伤坏死,并伴有严重的间质炎症,肾损伤评分显著升高[(3.21±0.55)分vs. Sham组(0.00±0.00)分,P<0.05];与URE 组相比,ECH-L、ECH-M、ECH-H 组大鼠肾小球肿胀及上皮细胞损伤坏死明显减轻,炎症细胞浸润明显减少,肾损伤评分呈剂量依赖性降低[(2.77±0.65)分、(2.35±0.49)分、(1.74±0.46)分vs. URE 组(3.21±0.55)分,P<0.05];与ECH-H 组相比,ECH-H+Ani 组大鼠肾小球和肾间质组织学病变加重,肾损伤评分显著升高[(2.13±0.32)分vs. ECH-H 组(1.74±0.46)分,P<0.05]。结果见图1。
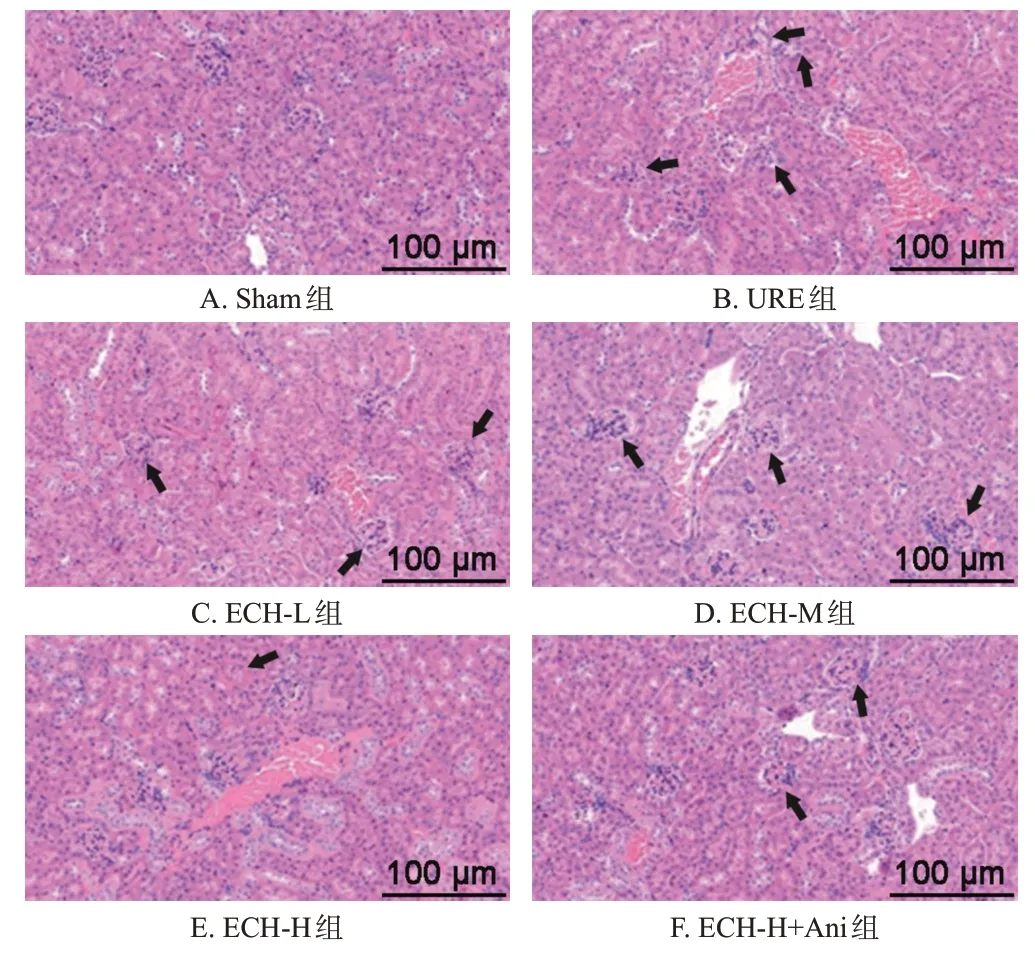
图1 各组大鼠肾组织病理学变化显微图(HE染色)
3.5 ECH 对URE 大鼠肾组织中α-SMA 和E-cadherin阳性表达的影响
与Sham 组相比,URE 组大鼠肾组织中α-SMA 阳性表达率显著升高,E-cadherin 阳性表达率显著降低(P<0.05);与URE 组相比,ECH-L、ECH-M、ECH-H组大鼠肾组织中α-SMA 阳性表达率均呈剂量依赖性降低,E-cadherin 阳性表达率均呈剂量依赖性升高(P<0.05);与ECH-H 组相比,ECH-H+Ani 组大鼠肾组织中α-SMA 阳性表达率显著升高,E-cadherin 阳性表达率显著降低(P<0.05)。结果见图2、图3和表4。
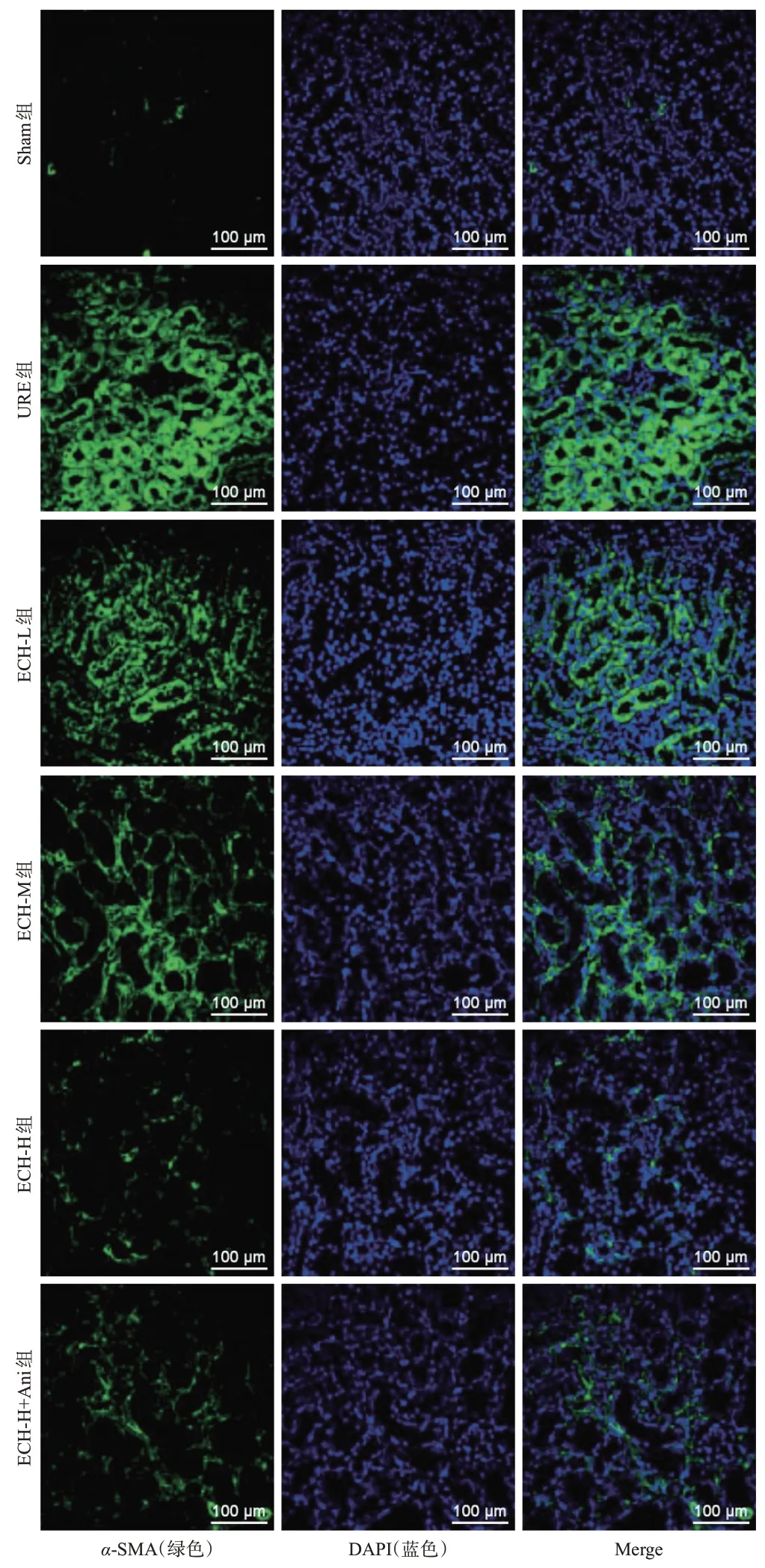
图2 各组大鼠肾组织中α-SMA阳性表达显微图
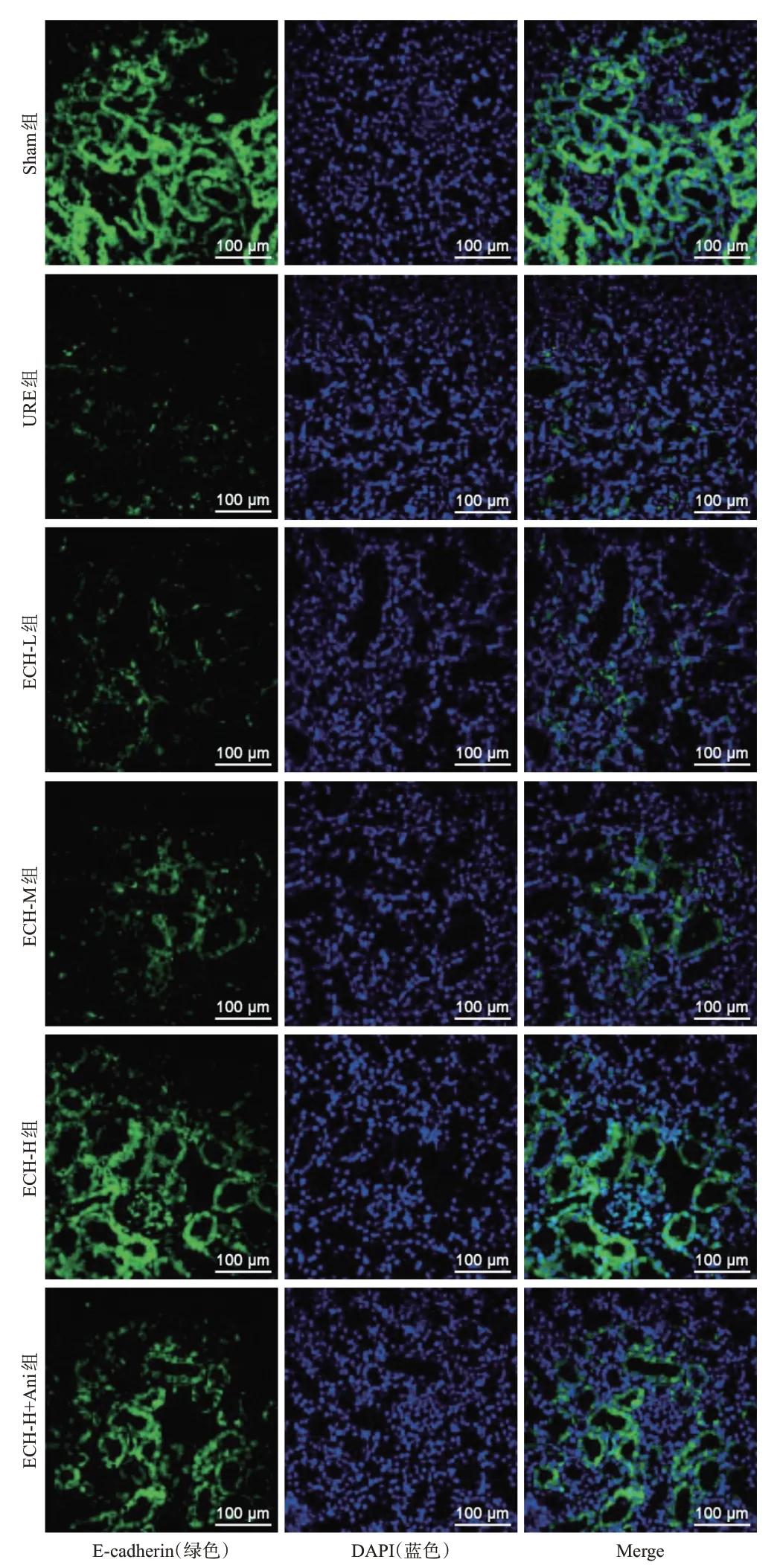
图3 各组大鼠肾组织中E-cadherin阳性表达显微图
表4 ECH对URE大鼠肾组织中α-SMA和E-cadherin阳性表达率的影响(±s,n=6,%)
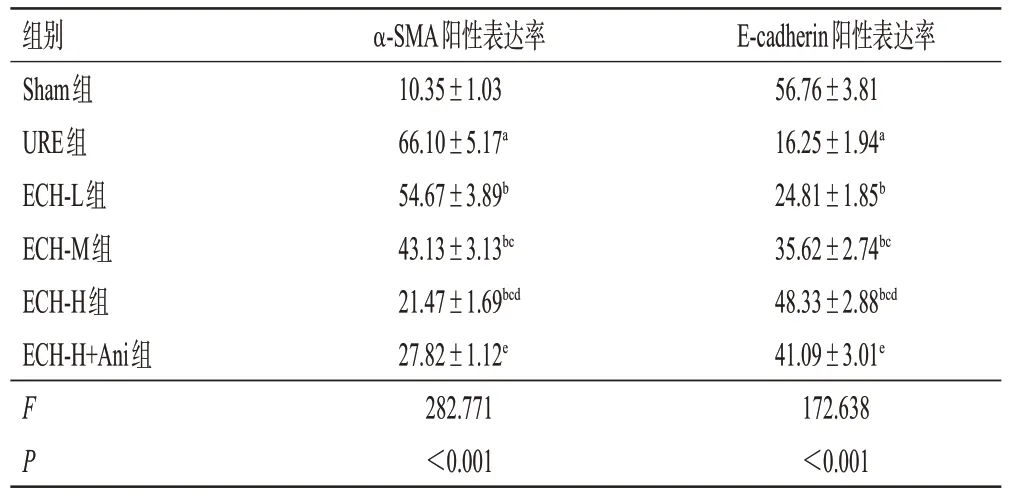
表4 ECH对URE大鼠肾组织中α-SMA和E-cadherin阳性表达率的影响(±s,n=6,%)
a:与Sham组相比,P<0.05;b:与URE组相比,P<0.05;c:与ECHL组相比,P<0.05;d:与ECH-M组相比,P<0.05;e:与ECH-H组相比,P<0.05。
E-cadherin阳性表达率56.76±3.81 16.25±1.94a 24.81±1.85b 35.62±2.74bc 48.33±2.88bcd 41.09±3.01e 172.638<0.001组别Sham组URE组ECH-L组ECH-M组ECH-H组ECH-H+Ani组FP α-SMA阳性表达率10.35±1.03 66.10±5.17a 54.67±3.89b 43.13±3.13bc 21.47±1.69bcd 27.82±1.12e 282.771<0.001
3.6 ECH 对URE 大鼠肾组织中p38 MAPK/NF-κB 信号通路相关蛋白表达的影响
与Sham 组相比,URE 组大鼠肾组织中p-p38 MAPK/p38 MAPK 和p-NF-κB p65/NF-κB p65 均显著升高(P<0.05);与URE 组相比,ECH-L、ECH-M、ECH-H组大鼠肾组织中p-p38 MAPK/p38 MAPK 和p-NF-κB p65/NF-κB p65均呈剂量依赖性降低(P<0.05);与ECHH 组相比,ECH-H+Ani 组大鼠肾组织中p-p38 MAPK/p38 MAPK 和p-NF-κB p65/NF-κB p65 均显著升高(P<0.05)。结果见图4和表5。
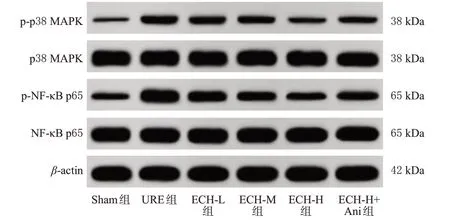
图4 各组大鼠肾组织中p38 MAPK/NF-κB 信号通路相关蛋白表达的电泳图
表5 ECH对URE大鼠肾组织中p38 MAPK/NF-κB信号通路相关蛋白表达的影响(±s,n=6)
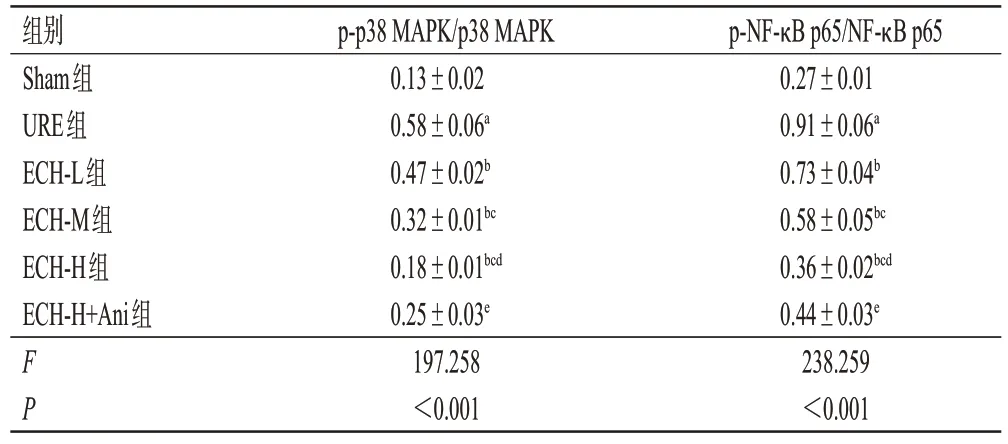
表5 ECH对URE大鼠肾组织中p38 MAPK/NF-κB信号通路相关蛋白表达的影响(±s,n=6)
a:与Sham组相比,P<0.05;b:与URE组相比,P<0.05;c:与ECHL组相比,P<0.05;d:与ECH-M组相比,P<0.05;e:与ECH-H组相比,P<0.05。
组别Sham组URE组ECH-L组ECH-M组ECH-H组ECH-H+Ani组FP p-p38 MAPK/p38 MAPK 0.13±0.02 0.58±0.06a 0.47±0.02b 0.32±0.01bc 0.18±0.01bcd 0.25±0.03e 197.258<0.001 p-NF-κB p65/NF-κB p65 0.27±0.01 0.91±0.06a 0.73±0.04b 0.58±0.05bc 0.36±0.02bcd 0.44±0.03e 238.259<0.001
4 讨论
URE是一种与肾功能恶化相关的临床疾病,严重影响患者的生存质量。炎症和氧化应激反应可能是触发5/6 肾切除大鼠肾损伤的关键原因[5]。α-SMA 增加及E-cadherin 减少会促进上皮间质转化,从而导致肾纤维化[9]。本研究结果显示,ECH 干预后,URE 大鼠肾小球和肾间质组织学病变减轻,肾损伤评分及TNF-α、IL-1β、IL-6、MDA 水平和α-SMA 阳性表达率均显著降低,SOD活性和E-cadherin阳性表达率均显著升高,且呈剂量依赖性。这表明ECH能抑制URE大鼠肾组织炎症和氧化应激反应,避免肾纤维化,改善肾组织病变。
肾功能异常时,肾小球滤过作用降低,尿液中会出现大量的蛋白质,故以UP 水平作为检测肾功能的重要指标之一。BUN 和Scr 常用于评估肾损伤疾病中的肾功能[10]。β2-MG由淋巴细胞产生,是反映肾损伤时肾小球滤过率和近端小管重吸收功能的指标[11]。NGAL、KIM-1 和Cys-C 是检测肾损伤的生物标志物[12]。本研究结果显示,ECH 干预后,URE 大鼠血清中BUN、Scr、β2-MG、24 h UP、NGAL、KIM-1 和Cys-C 水平均显著降低,且呈剂量依赖性。这表明ECH能抑制肾损伤标志物分泌,增强肾功能,改善URE大鼠肾损伤。
有研究表明,URE 患者治疗后NF-κB 水平下降,炎症状态减轻[13]。URE可通过NF-κB信号通路过度激活来诱发心肌损伤,而抑制该信号通路过度激活,能缓解炎症反应,保护心肌细胞,预防URE 心肌病[14]。本研究结果显示,ECH 干预后,URE 大鼠肾组织中p38 MAPK 和NF-κB p65的磷酸化水平均显著下调,且呈剂量依赖性。而在ECH 处理的基础上给予p38 MAPK 激活剂茴香霉素后,与高剂量ECH 组相比,URE 大鼠肾组织中p38 MAPK和NF-κB p65的磷酸化水平均显著升高,血清中TNF-α、IL-1β、IL-6、BUN、Scr、β2-MG、24 h UP、NGAL、KIM-1、Cys-C和肾组织中MDA水平、α-SMA阳性表达率均显著升高,肾组织中SOD活性和E-cadherin阳性表达率均显著降低,可见茴香霉素逆转了高剂量ECH对URE大鼠肾损伤的改善作用。这表明ECH能抑制p38 MAPK/NF-κB信号通路的表达和激活,抑制肾脏炎症反应和氧化应激反应,保护肾功能,减轻URE大鼠肾损伤程度。
综上所述,ECH可能通过抑制p38 MAPK/NF-κB信号通路的激活来抑制URE 大鼠的炎症反应和氧化应激反应,增强肾功能,改善肾损伤。但其在临床上改善URE症状的具体作用效果还需要进一步研究。
