安罗替尼通过调控NF-κB信号通路对脑胶质瘤细胞恶性表型的影响 Δ
2024-02-02李青山谢云鹏张圣林承德医学院附属医院肿瘤科河北承德067000承德医学院附属医院神经外科河北承德067000
柳 新 ,李青山 ,谢云鹏 ,张圣林 ,董 怡 (.承德医学院附属医院肿瘤科,河北 承德 067000;.承德医学院附属医院神经外科,河北 承德 067000)
脑胶质瘤恶性程度高、发展速度快,为临床常见颅内恶性肿瘤,具有高复发率和高病死率的特点。由于脑胶质瘤的位置特殊,早期症状不明显,故大多数患者在确诊时已处于中晚期,错过了最佳手术治疗时机,加之手术后复发率和转移率较高,放化疗毒副作用极大,严重影响了患者的生存质量[1]。可见,探究有效且安全的药物对于脑胶质瘤患者的临床治疗十分必要。
安罗替尼作为一种多靶点酪氨酸激酶抑制剂,对多种生长因子受体激酶具有抑制作用,且能通过抑制相关转移信号通路来发挥抗肿瘤作用[2]。研究指出,肿瘤细胞的迁移、侵袭与上皮间质转化(epithelial-mesenchymal transition,EMT)关系密切,当EMT 发生后,肿瘤细胞更具侵袭力,可进一步入侵周围组织、血管及淋巴管等,从而发生远处转移[3]。核因子κB(nuclear factor-κB,NF-κB)信号通路是经典的信号转导通路,能参与调控肿瘤细胞迁移、侵袭、EMT、血管生成等过程[4―5]。可见,阻断NF-κB 信号通路可作为改善肿瘤细胞恶性表型的重要途径。基于此,本研究拟探讨安罗替尼调控NF-κB信号通路对人脑胶质瘤细胞T98G 黏附、迁移、侵袭及EMT样进程的影响,旨在为该药治疗脑胶质瘤提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括MCO18AIC 型CO2培养箱(日本SANYO 公司)、Multiskan FC 型酶标仪(美国Thermo Fisher Scientific 公司)、WMS-1033 型倒置荧光显微镜(上海无陌光学仪器有限公司)、FluorChem HD2型凝胶成像系统(美国ProteinSimple公司)等。
1.2 主要药品与试剂
安罗替尼对照品(货号S8726,纯度≥98%)购自美国Selleck Chemicals 公司;5-氟尿嘧啶对照品(阳性对照,货号S17073-5g,纯度≥98%)、NF-κB 通路抑制剂BAY 11-7082 对照品(批号J07HS173399,纯度≥98%)均购自上海源叶生物科技有限公司;NF-κB通路激活剂prostratin 对照品(批号0000112801,纯度≥98%)购自上海阿拉丁生化科技股份有限公司;胎牛血清购自美国Gibco公司;DMEM-H培养基购自北京索莱宝科技有限公司;RIPA 裂解液、CCK-8 试剂盒均购自日本Dojindo公司;重组人纤维连接蛋白(recombinant human fibronectin,rFN)购自武汉爱博泰克生物科技有限公司;鼠源NF-κB p65、磷酸化NF-κB p65(phosphorylated NF-κB p65,p-NF-κB p65)、上皮钙黏着蛋白(E-cadherin)、神经钙黏着蛋白(N-cadherin)、波形蛋白(vimentin)、纤维连接蛋白(fibronectin,FN)、β-肌动蛋白(β-actin)抗体和辣根过氧化物酶标记的山羊抗鼠IgG 二抗(批号分别为10021394、10021309、20000374、10010628、10017978、10016772、20000374、20000425)均购自武汉三鹰生物技术有限公司。
1.3 细胞
人脑胶质瘤细胞T98G(编号338721)购自商城北纳创联生物科技有限公司。
2 方法
2.1 人脑胶质瘤T98G细胞培养
取T98G 细胞,复苏后接种于DMEM-H 培养基(含10%胎牛血清、1%青-链霉素)中,于37 ℃、5%CO2条件下培养(培养条件下同),当细胞贴壁至80%~90%时进行传代,取第3代对数生长期细胞用于后续实验。
2.2 安罗替尼对T98G细胞恶性表型影响的考察
2.2.1 细胞增殖活力
取对数生长期细胞,以2×105个/mL接种至96孔板中,每孔100 μL。将细胞分为对照组、安罗替尼不同浓度、阳性对照组,每组设置3个复孔。对照组细胞不进行干预;安罗替尼不同浓度组细胞分别用5、10、20 μmol/L的安罗替尼[6]进行干预;阳性对照组细胞用50 mg/L 的5-氟尿嘧啶[7]进行干预;同时,设置不加细胞的调零孔作为空白组。培养24 h后,每孔加入CCK-8溶液10 μL,孵育2 h后,使用酶标仪于450 nm波长处检测各孔的光密度(OD)值,并按下式计算细胞增殖活力:细胞增殖活力=(OD实验组-OD空白组)/(OD对照组-OD空白组)。
2.2.2 细胞黏附能力
将20 μg/mL 的rFN(以不含胎牛血清的DMEM-H培养基稀释)铺于96 孔板中,风干后用磷酸盐缓冲液(PBS)洗涤20 min×3次,备用。取对数生长期细胞,以2×105个/mL接种至6孔板中,每孔50 μL。按“2.2.1”项下方法分组、处理。培养24 h后,收集各组细胞,用胰蛋白酶消化并制成单细胞悬液(1×104个/mL)。取上述单细胞悬液100 μL,接种至上述铺有rFN 的96 孔板中,于37 ℃培养1 h;以PBS 洗涤3 次,以甲醇固定10 min 后,用结晶紫染液染色15 min;再以PBS洗涤3次,于显微镜下观察细胞黏附情况并记录黏附细胞(呈紫色)数。
2.2.3 细胞迁移和侵袭能力
取对数生长期细胞,以2×105个/mL 接种至6 孔板中,每孔300 μL。按“2.2.1”项下方法分组、处理。待细胞融合至90%时,用200 μL 移液器枪头在每孔底部中央划一直线。分别于培养0、24 h 时用显微镜观察并拍照,记录对应的划痕面积(S0h、S24h),并按下式计算细胞迁移率:细胞迁移率=(S0h-S24h)/S0h×100%。
取对数生长期细胞,以不含胎牛血清的DMEM-H培养基制成单细胞悬液(1×105个/mL),取上述单细胞悬液0.25 mL,置于Transwell小室(需用基质胶处理5 h)上层;取含10%胎牛血清的DMEM-H 培养基0.45 mL,置于Transwell 小室下层。上室细胞按“2.2.1”项下方法分组、处理。培养24 h后,弃去上清液,穿膜细胞用PBS清洗3次,以4%甲醇固定30 min后晾干;用0.1%结晶紫染液染色10 min,用PBS清洗3次,晾干。使用显微镜观察、拍照(每孔随机选择5 个不同区域),并使用Image J图像分析软件记录侵袭细胞(呈紫色)数。
2.2.4 细胞EMT相关蛋白的表达情况
取对数生长期细胞,以2×105个/mL 接种至6 孔板中,每孔300 μL。按“2.2.1”项下方法分组、处理。培养24 h 后,收集各组细胞,提取其蛋白后,进行定量、变性处理。取变性蛋白适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜,封闭2 h;以TBST缓冲液洗膜,加入E-cadherin、N-cadherin、vimentin、FN、β-actin 一抗(稀释比例分别为1∶2 000、1∶10 000、1∶2 000、1∶2 000、1∶ 2 000),4 ℃下孵育过夜;以TBST 缓冲液洗膜,加入相应IgG二抗(稀释比例为1∶2 000),室温下孵育2 h;以TBST缓冲液洗膜,加入显影液,使用凝胶成像系统成像并采用Image J 软件进行分析,以目的蛋白与内参蛋白(β-actin)的灰度值比值作为目的蛋白的相对表达量。
2.3 安罗替尼对T98G细胞恶性表型影响机制的验证
2.3.1 细胞增殖活力
取对数生长期细胞,以2×105个/mL接种至96孔板中,每孔100 μL。将细胞分为对照组、安罗替尼组、抑制剂组和激活剂组,每组设置3个复孔。对照组细胞不进行干预;安罗替尼组细胞分别用10 μmol/L 的安罗替尼(浓度参考“2.2”项下各实验结果设置)进行干预;抑制剂组细胞用10 μmol/L 的安罗替尼+5 μmol/L 的NF-κB 通路抑制剂BAY 11-7082[8]进行干预;激活剂组细胞用10 μmol/L 的安罗替尼+1 μmol/L 的 NF-κB 通路激活剂prostratin[9]进行干预;同时,设置不加细胞的调零孔作为空白组。培养24 h后,按“2.2.1”项下方法检测各组细胞的增殖活力。
2.3.2 细胞黏附能力
取对数生长期细胞,以2×105个/mL 接种至6 孔板中,每孔50 μL。按“2.3.1”项下方法分组、处理,再按“2.2.2”项下方法检测各组黏附细胞数。
2.3.3 细胞迁移和侵袭能力
取对数生长期细胞,以2×105个/mL接种至6孔板中,每孔300 μL。按“2.3.1”项下方法分组、处理,再按“2.2.3”项下方法检测各组细胞迁移率和侵袭细胞数。
2.3.4 细胞EMT及NF-κB通路相关蛋白表达情况
取对数生长期细胞,以2×105个/mL 接种至6 孔板中,每孔300 μL。按“2.3.1”项下方法分组、处理,再按“2.2.4”项下方法检测各组细胞中E-cadherin、N-cadherin、vimentin、FN、NF-κB p65、p-NF-κB p65 蛋白(NF-κB p65、p-NF-κB p65的稀释比例分别为1∶5 000、 1∶2 000)的相对表达量。
2.4 统计学方法
采用SPSS 23.0软件对数据进行统计分析。计量资料均以±s表示,多组间比较采用单因素方差分析,两两比较采用Tukey检验。检验水准α=0.05。
3 结果
3.1 安罗替尼对T98G细胞恶性表型的影响
3.1.1 细胞增殖活力
与对照组(1.00±0.07)比较,10、20 μmol/L 安罗替尼组和阳性对照组细胞的增殖活力(0.76±0.08、0.53±0.05、0.51±0.03)均显著降低(P<0.05);与阳性对照组(0.51±0.03)比较,5、10 μmol/L安罗替尼组细胞的增殖活力(0.90±0.04、0.76±0.08)均显著升高(P<0.05),而20 μmol/L 安罗替尼组细胞的增殖活力(0.53±0.05)则与阳性对照组相当(P>0.05)。
3.1.2 细胞黏附能力
与对照组(239.67±10.26)比较,5、10、20 μmol/L 安罗替尼组和阳性对照组的黏附细胞数(179.67±15.31、143.67±10.02、96.00±5.29、94.00±4.58)均显著减少(P<0.05),且有浓度依赖趋势;与阳性对照组比较,5、10 μmol/L 安罗替尼组的黏附细胞数均显著增加(P<0.05),而20 μmol/L安罗替尼组的黏附细胞数则与阳性对照组相当(P>0.05)。结果见图1。

图1 不同浓度安罗替尼对细胞黏附能力的影响
3.1.3 细胞迁移和侵袭能力
与对照组[细胞迁移率为(43.67±2.08)%、侵袭细胞数为42.67±3.79]比较,5、10、20 μmol/L 安罗替尼组和阳性对照组的细胞迁移率[(35.33±2.08)%、(26.33±2.08)%、(19.00±2.00)%、(18.33±1.53)%]和侵袭细胞数(32.00±2.65、27.67±1.53、15.67±1.53、15.67±2.08)均显著降低(P<0.05),且有浓度依赖趋势;与阳性对照组比较,5、10 μmol/L安罗替尼组的细胞迁移率和侵袭细胞数均显著升高(P<0.05),而20 μmol/L安罗替尼组的上述指标则与阳性对照组相当(P>0.05)。结果见图2、图3。

图2 不同浓度安罗替尼对细胞迁移能力的影响

图3 不同浓度安罗替尼对细胞侵袭能力的影响
3.1.4 细胞EMT相关蛋白的表达情况
与对照组比较,各药物组细胞中E-cadherin 蛋白的表达均显著上调,N-cadherin、vimentin、FN 蛋白的表达均显著下调(P<0.05),且有浓度依赖趋势;与阳性对照组比较,5、10 μmol/L安罗替尼组细胞中E-cadherin蛋白的表达均显著下调(P<0.05),N-cadherin、vimentin、FN蛋白的表达均显著上调(P<0.05);而20 μmol/L安罗替尼组的上述蛋白表达则与阳性对照组相当(P>0.05)。结果见图4、表1。
表1 不同浓度安罗替尼对细胞EMT 相关蛋白相对表达量的影响(±s,n=3)
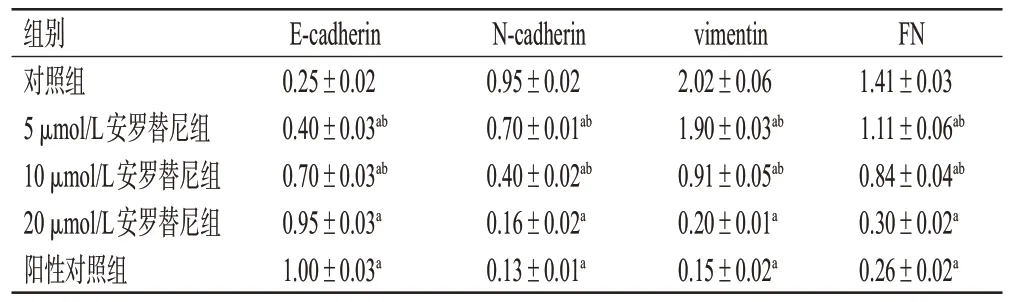
表1 不同浓度安罗替尼对细胞EMT 相关蛋白相对表达量的影响(±s,n=3)
a:与对照组比较,P<0.05;b:与阳性对照组比较,P<0.05。
组别对照组5 μmol/L安罗替尼组10 μmol/L安罗替尼组20 μmol/L安罗替尼组阳性对照组FN 1.41±0.03 1.11±0.06ab 0.84±0.04ab 0.30±0.02a 0.26±0.02a E-cadherin 0.25±0.02 0.40±0.03ab 0.70±0.03ab 0.95±0.03a 1.00±0.03a N-cadherin 0.95±0.02 0.70±0.01ab 0.40±0.02ab 0.16±0.02a 0.13±0.01a vimentin 2.02±0.06 1.90±0.03ab 0.91±0.05ab 0.20±0.01a 0.15±0.02a
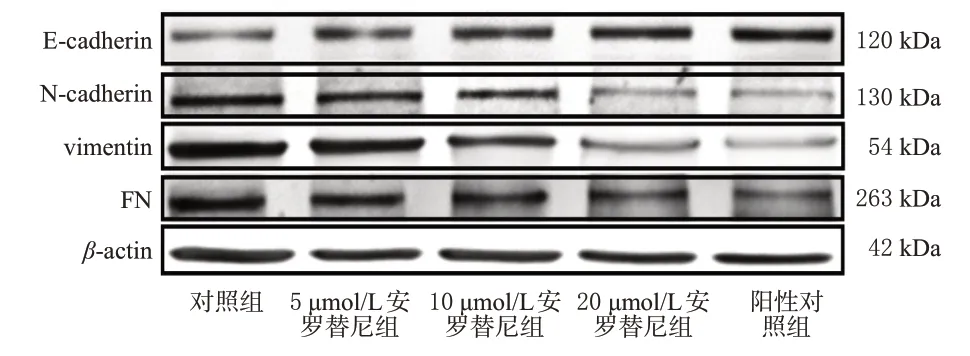
图4 不同浓度安罗替尼对细胞EMT 相关蛋白表达影响的电泳图
3.2 安罗替尼对T98G细胞恶性表型影响的机制
3.2.1 细胞增殖活力
与对照组(1.00±0.08)比较,安罗替尼组细胞的增殖活力(0.76±0.07)显著降低(P<0.05);与安罗替尼组比较,抑制剂组细胞的增殖活力(0.48±0.02)显著降低(P<0.05),而激活剂组细胞的增殖活力(1.01±0.08)则显著升高(P<0.05)。
3.2.2 细胞黏附能力
与对照组(243.00±7.21)比较,安罗替尼组的黏附细胞数(143.67±11.59)显著降低(P<0.05);与安罗替尼组比较,抑制剂组的黏附细胞数(73.67±10.50)显著降低(P<0.05),而激活剂组的黏附细胞数(228.67±13.65)则显著升高(P<0.05)。结果见图5。

图5 机制验证中各组细胞的黏附能力比较
3.2.3 细胞迁移和侵袭能力
与对照组[细胞迁移率为(43.67±2.08)%、侵袭细胞数为41.33±3.51]比较,安罗替尼组的细胞迁移率[(24.00±1.00)%]和侵袭细胞数(26.67±1.53)均显著降低(P<0.05);与安罗替尼组比较,抑制剂组的细胞迁移率[(15.67±1.15)%]和侵袭细胞数(13.33±2.52)均显著降低(P<0.05),而激活剂组的细胞迁移率[(45.33±1.53)%]和侵袭细胞数(40.00±2.65)则显著升高(P<0.05)。结果见图6、图7。
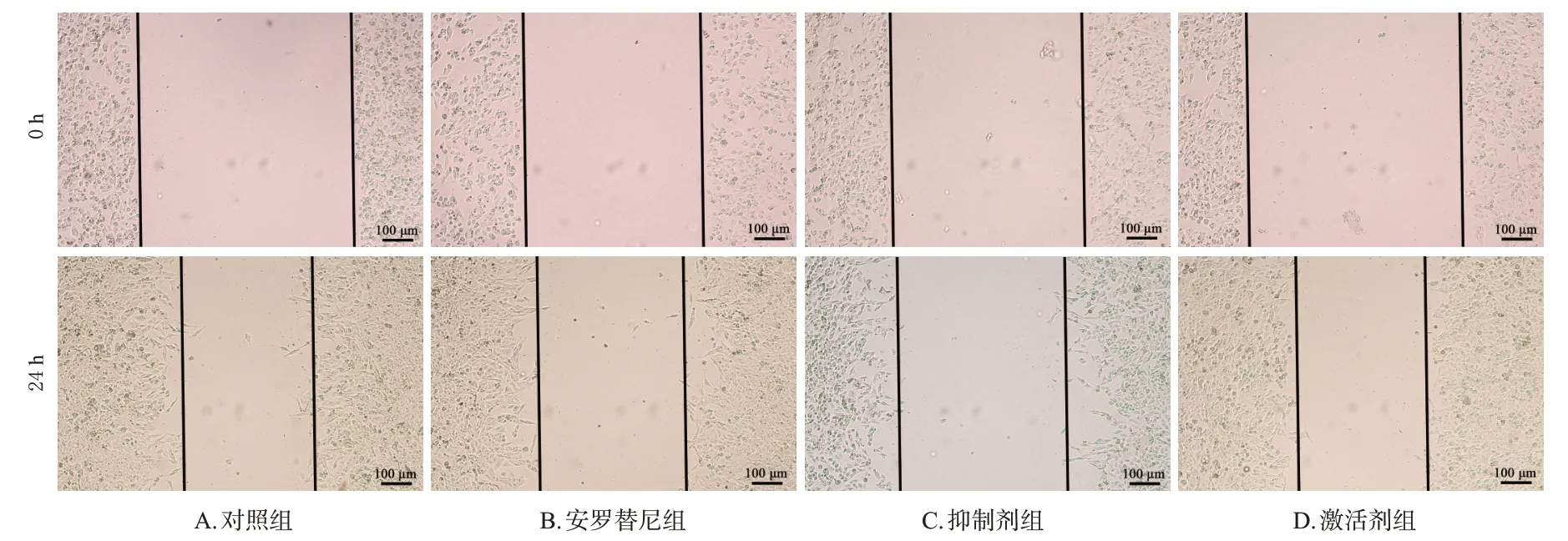
图6 机制验证中各组细胞的迁移能力比较

图7 机制验证中各组细胞的侵袭能力比较
3.2.4 细胞EMT和NF-κB通路相关蛋白的表达情况
与对照组比较,安罗替尼组细胞中E-cadherin蛋白的表达显著上调,N-cadherin、vimentin、FN、p-NF-κB p65蛋白的表达均显著下调(P<0.05);与安罗替尼组比较,抑制剂组细胞中E-cadherin 蛋白的表达显著上调(P<0.05),N-cadherin、vimentin、FN、p-NF-κB p65 蛋白的表达均显著下调,而激活剂组细胞中上述蛋白的变化则相反(P<0.05)。结果见图8、表2。
表2 机制验证中各组细胞中EMT 和NF-κB 通路相关蛋白相对表达量比较(±s,n=3)
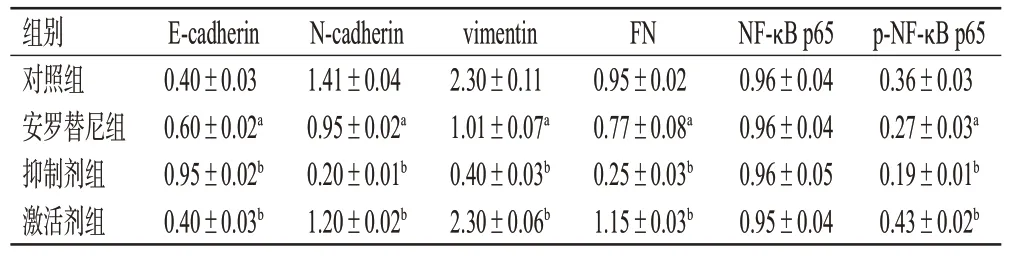
表2 机制验证中各组细胞中EMT 和NF-κB 通路相关蛋白相对表达量比较(±s,n=3)
a:与对照组比较,P<0.05;b:与10 μmol/L安罗替尼组比较,P<0.05。
组别对照组安罗替尼组抑制剂组激活剂组E-cadherin 0.40±0.03 0.60±0.02a 0.95±0.02b 0.40±0.03b N-cadherin 1.41±0.04 0.95±0.02a 0.20±0.01b 1.20±0.02b vimentin 2.30±0.11 1.01±0.07a 0.40±0.03b 2.30±0.06b FN 0.95±0.02 0.77±0.08a 0.25±0.03b 1.15±0.03b NF-κB p65 0.96±0.04 0.96±0.04 0.96±0.05 0.95±0.04 p-NF-κB p65 0.36±0.03 0.27±0.03a 0.19±0.01b 0.43±0.02b

图8 机制验证中各组细胞中EMT 和NF-κB 通路相关蛋白表达的电泳图
4 讨论
脑胶质瘤属于临床常见的具有高死亡率、高发病率特点的中枢神经系统肿瘤。虽然医学治疗水平在不断提高,但脑胶质瘤病灶很难通过手术彻底清除,患者极易复发,且一旦出现转移则难以进行有效治疗。脑胶质瘤细胞有丰富的新生血管,在其侵袭、转移过程中,肿瘤细胞可从原发病灶脱离、降解,随即入侵淋巴管或血管,并经淋巴或血液循环转移至远端形成新的病灶,呈现出高度侵袭性[1],因此探寻有效抑制脑胶质瘤细胞转移及侵袭的药物具有重要意义。
作为新型口服酪氨酸酶抑制剂,安罗替尼可通过抑制肿瘤血管形成而发挥抗肿瘤作用,现已获批用于肺癌、软组织肉瘤、甲状腺髓样癌等多种适应证,并可使晚期或转移性肝细胞癌、食管鳞癌患者在治疗中获益。研究表明,安罗替尼能抑制肺癌细胞生长和瘤体血管生成,且对人肝内胆管上皮肿瘤细胞HCCC-9810 具有杀伤作用[10];另有研究指出,安罗替尼联合替莫唑胺化疗可延缓脑胶质瘤患者的疾病进展[11]。本研究结果显示,10、20 μmol/L 安罗替尼组和阳性对照组细胞的增殖活力均显著低于对照组,提示其可抑制脑胶质瘤细胞的增殖;同时,20 μmol/L安罗替尼组细胞的增殖活力与阳性对照组比较差异无统计学意义,提示此剂量的安罗替尼对脑胶质瘤细胞增殖活力的抑制作用与50 mg/L的5-氟尿嘧啶相当,与陈彦民等[12]的研究结果基本一致。
肿瘤细胞的迁移、侵袭与EMT关系密切,其可借助EMT样进程形成有迁移能力的间充质细胞,从而诱导细胞向其他组织和器官转移[13]。有研究证实,EMT 在肾癌、肺癌、乳腺癌细胞原位侵袭和远端转移中发挥了重要作用[14]。作为具有高度侵袭性的恶性肿瘤,脑胶质瘤的发生与细胞间质性改变关系密切[3]。由于EMT 的影响,纤维细胞快速增多,其所含的细胞外基质也不断增多,从而导致了脑胶质瘤的持续恶化发展[15]。本研究结果显示,不同浓度安罗替尼组和阳性对照组细胞黏附、迁移、侵袭能力均较对照组显著增强,且N-cadherin、vimentin、FN 蛋白的表达均较对照组显著下调,E-cadherin蛋白的表达均较对照组显著上调;5、10 μmol/L安罗替尼组的上述指标改善程度均不及阳性对照组,而20 μmol/L安罗替尼组与阳性对照组比较差异均无统计学意义,表明20 μmol/L安罗替尼对脑胶质瘤细胞迁移、侵袭的抑制作用与阳性对照药相当。研究指出,发生EMT 样进程后,肿瘤细胞的迁移和侵袭能力增强,主要表现为E-cadherin、N-cadherin、vimentin等细胞上皮间质分化标志蛋白表达的显著变化[16]。本研究结果提示,安罗替尼具有抑制脑胶质瘤细胞EMT样进程的能力,并可抑制其黏附、迁移和侵袭,与Nan等[17]的研究结果基本一致。
近年研究表明,多种肿瘤的发生发展和NF-κB信号通路的异常激活有关[18]。NF-κB 作为信号通路的中枢,在多种肿瘤细胞EMT 样进程中发挥了重要作用,且抑制肿瘤细胞EMT 样进程能够明显抑制其侵袭、转移[18]。为验证NF-κB 信号通路的作用,本研究在10 μmol/L 安罗替尼的基础上分别联用通路抑制剂BAY 11-7082 和激活剂prostratin 进行验证,结果显示,与安罗替尼组比较,抑制剂组细胞的增殖活力,黏附、迁移、侵袭能力及N-cadherin、vimentin、FN、p-NF-κB p65 蛋白的相对表达量均显著降低,E-cadherin蛋白的相对表达量显著升高,而激活剂组上述指标的变化趋势则相反。以上结果提示,安罗替尼可通过抑制NF-κB信号通路来抑制细胞的EMT样进程,进而抑制脑胶质瘤细胞的增殖、黏附、迁移和侵袭,说明安罗替尼的抗胶质瘤作用与抑制NF-κB信号通路有关。
综上所述,安罗替尼可抑制人脑胶质瘤T98G 细胞的增殖、黏附、迁移和侵袭,上述作用可能与抑制NF-κB信号通路进而抑制细胞EMT样进程有关。但本研究只针对NF-κB信号通路进行了研究,该药能否通过其他信号通路发挥抗胶质瘤作用尚需进一步探讨。
