润肠颗粒对小鼠便秘的改善作用及机制 Δ
2024-02-02黄梦琴王雪松甘雨涵卢诗勤邓琪琪广东药科大学中医药研究院广东省代谢病中西医结合研究中心糖脂代谢病教育部重点实验室广东省代谢性疾病中医药防治重点实验室广州510006
黄梦琴,王雪松,甘雨涵,卢诗勤,邓琪琪,朱 青 ,郭 姣(广东药科大学中医药研究院/广东省代谢病中西医结合研究中心/糖脂代谢病教育部重点实验室/广东省代谢性疾病中医药防治重点实验室,广州 510006)
便秘是胃肠道疾病中最常见的类型,其主要症状为大便秘结不通、排便时间延长和排便困难。胃肠动力不足及肠道水分和润滑性黏液分泌紊乱导致的肠道蠕动减弱,是便秘发生的主要原因。便秘不仅给患者的身体和精神带来困扰,还严重影响患者的日常生活和健康。中药可通过多成分、多靶点和多机制治疗便秘等症,且副作用小,近年来已被广泛应用于便秘的治疗。
润肠颗粒是广东药科大学中医药研究院的专利复方中药制剂,具有益气养阴的功效,临床主要用于行气润肠通便。该药由白术、枳实、肉苁蓉、厚朴、火麻仁、当归、黄芪、西洋参8 味中药组成[1],其中白术和枳实能够健脾理气,促进肠道蠕动,提高肠道的运动功能;肉苁蓉、厚朴、火麻仁、当归具有润肠通便的作用;黄芪具有益气补中的作用;西洋参具有补气养阴和清热生津的功效。然而,润肠颗粒治疗便秘的具体作用机制尚未阐明。基于此,本研究利用洛哌丁胺诱导便秘小鼠模型,探讨润肠颗粒对便秘的改善作用并探究其潜在作用机制,旨在为阐明润肠颗粒的药效和作用机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括ASP300S型组织脱水机、RM2235 型石蜡切片机(德国Leica 公司),YB-7LF 型石蜡包埋机(湖北省亚光医用电子技术有限公司),BX53型光学显微镜(日本Olympus 公司),5804R 型冷冻离心机(德国Eppendorf公司),SM i3x型多功能酶标仪(美国Molecular Devices公司),Light Cycler 480 Ⅱ型实时荧光定量聚合酶链式反应(PCR)仪(美国Roche 公司),Universal Hood Ⅱ型高灵敏度化学发光成像仪(美国Bio-Rad公司)。
1.2 主要药品与试剂
润肠颗粒(规格10 g/袋,批号分别为201001、201002、201003)来源于广东药科大学中医药研究院;盐酸洛哌丁胺胶囊(规格2 mg,批号KLJOBJ7)购自西安杨森制药有限公司;枸橼酸莫沙必利片(规格0.005 g,批号6600C)购自住友制药(苏州)有限公司;苏木精-伊红(HE)染色试剂(批号1014A21)购自北京雷根生物技术有限公司;阿尔新蓝染色试剂盒(货号G8015-100ml)购自广州捷倍斯生物科技公司;兔黏蛋白2(mucin 2,MUC2)单克隆抗体和兔重组Tubulin 单克隆抗体(货号分别为ab272692、ab176560)均购自英国Abcam公司;兔干细胞因子(stem cell factor,SCF)、酪氨酸激酶受体c-kit 多克隆抗体和兔甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体以及辣根过氧化物酶标记的山羊抗兔IgG(H+L)抗体(货号分别为AF4113、AF6153、AF7021、S0001)均购自江苏亲科生物研究中心有限公司。
1.3 实验动物
SPF级雄性C57BL/6J小鼠,6~8周龄,体重(20±2)g,购自广东省医学实验动物中心,动物生产许可证号SCXK(粤)2022-0002。本实验方案由广东药科大学实验室动物护理和使用伦理委员会批准,批准号gdpulacspf2022056。小鼠在光照周期12 h、温度(22±2)℃、相对湿度(50±10)%的环境下饲养。
2 方法
2.1 分组、造模与给药
将小鼠随机分为正常对照组,模型组,润肠颗粒低剂量组(5 g/kg)、润肠颗粒高剂量组(10 g/kg)和莫沙必利组(0.003 g/kg,阳性对照),每组6 只。正常对照组小鼠灌胃纯水,其余4组小鼠灌胃洛哌丁胺(0.004 g/kg)造模,每天9:00和18:00各灌胃1次,持续灌胃3 d后开始药物治疗,期间造模条件不变[2]。每天上午洛哌丁胺造模结束1 h后,正常对照组和模型组小鼠灌胃纯水,各药物组小鼠灌胃相应药物,给药剂量按照前期预实验结果设置,连续给药7 d。
2.2 小鼠粪便含水量测定
各组小鼠于给药第7天后,单独放于代谢笼中,自由饮食饮水,收集3 h内各组小鼠的粪便,以新鲜的粪便质量作为粪便湿重;随后将粪便放入60 ℃的烘箱中烘干12 h,以此时称定的粪便质量作为粪便干重;计算粪便含水量:粪便含水量=(粪便湿重-粪便干重)/粪便湿重×100%[3]。
2.3 小鼠肠道推进率测定
将阿拉伯树胶100 g倒入烧杯中,加入纯水800 mL,加热并搅拌,煮沸至透明后,加入活性炭粉末50 g,煮沸后冷却至室温,重复3次,加纯水定容到1 000 mL,混匀,制得墨汁,备用。在第7天测定小鼠粪便含水量后,将小鼠禁食不禁水16 h,即第8天上午,正常对照组小鼠灌胃纯水,其余4组小鼠灌胃洛哌丁胺(0.004 g/kg)。30 min后,润肠颗粒低、高剂量组小鼠分别按5、10 g/kg灌胃含润肠颗粒的墨汁,莫沙必利组小鼠按0.003 g/kg 灌胃含枸橼酸莫沙必利片的墨汁,正常对照组和模型组小鼠灌胃纯墨汁。25 min 后立即处死小鼠,取出肠道,并将肠系膜分离干净,缓慢拉直肠道,以此时测量的肠道长度作为“肠道总长度”,以从幽门的位置到墨汁的前沿位置作为“墨汁推进长度”,计算肠道推进率:肠道推进率=墨汁推进长度(cm)/肠道总长度(cm)×100%[4]。
2.4 小鼠结肠和回肠组织结构观察
小鼠取材后,立即将其结肠和回肠组织冲洗干净,取每只小鼠相同位置的一段结肠和回肠放入包埋盒,置于4%多聚甲醛中24 h,乙醇脱水、包埋、切片,将厚度为4 μm 的石蜡切片进行HE 染色,中性树脂封片后,置于显微镜下观察小鼠结肠和回肠组织结构变化。
2.5 小鼠结肠黏液分泌量观察
取厚度为4 μm的小鼠结肠组织石蜡切片进行阿尔新蓝染色,然后置于显微镜下观察小鼠结肠黏液分泌量(结肠切片中的蓝色部分为小鼠结肠黏液)。
2.6 小鼠结肠组织中c-kit蛋白表达检测
取厚度为4 μm的小鼠结肠组织石蜡切片,烤片、脱蜡、水化和抗原修复后,用5%山羊血清室温封闭30 min;加入c-kit 抗体(稀释比例为1∶500),于4 ℃孵育过夜;用0.02%磷酸盐缓冲液洗3 次后,再加入二抗(稀释比例为1∶500),室温孵育1 h。用DAB 显色,封片并于显微镜下拍照观察,使用Image-Pro Plus软件计算5个视野中c-kit阳性染色的面积。
2.7 小鼠结肠组织中炎症因子和促进肠道运动相关因子mRNA表达检测
取小鼠结肠组织适量,采用Trizol 法提取RNA,检测样品RNA的浓度,按照EZBioscience试剂盒说明书将RNA 逆转录为cDNA,用实时定量PCR 仪以GAPDH 为内参,检测炎症因子[肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、IL-1β、诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)]、促进肠道运动相关因子[神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、平滑肌肌球蛋白轻链激酶(smooth muscle myosin light chain kinase,smMLCK)、5-羟色胺受体4(5-hydroxytryptamine 4 receptor,5-HT4R)、MUC2、SCF、c-kit]mRNA表达水平,采用2-ΔΔCt法进行相对定量分析。引物由北京擎科生物科技股份有限公司合成,具体序列及产物长度见表1。
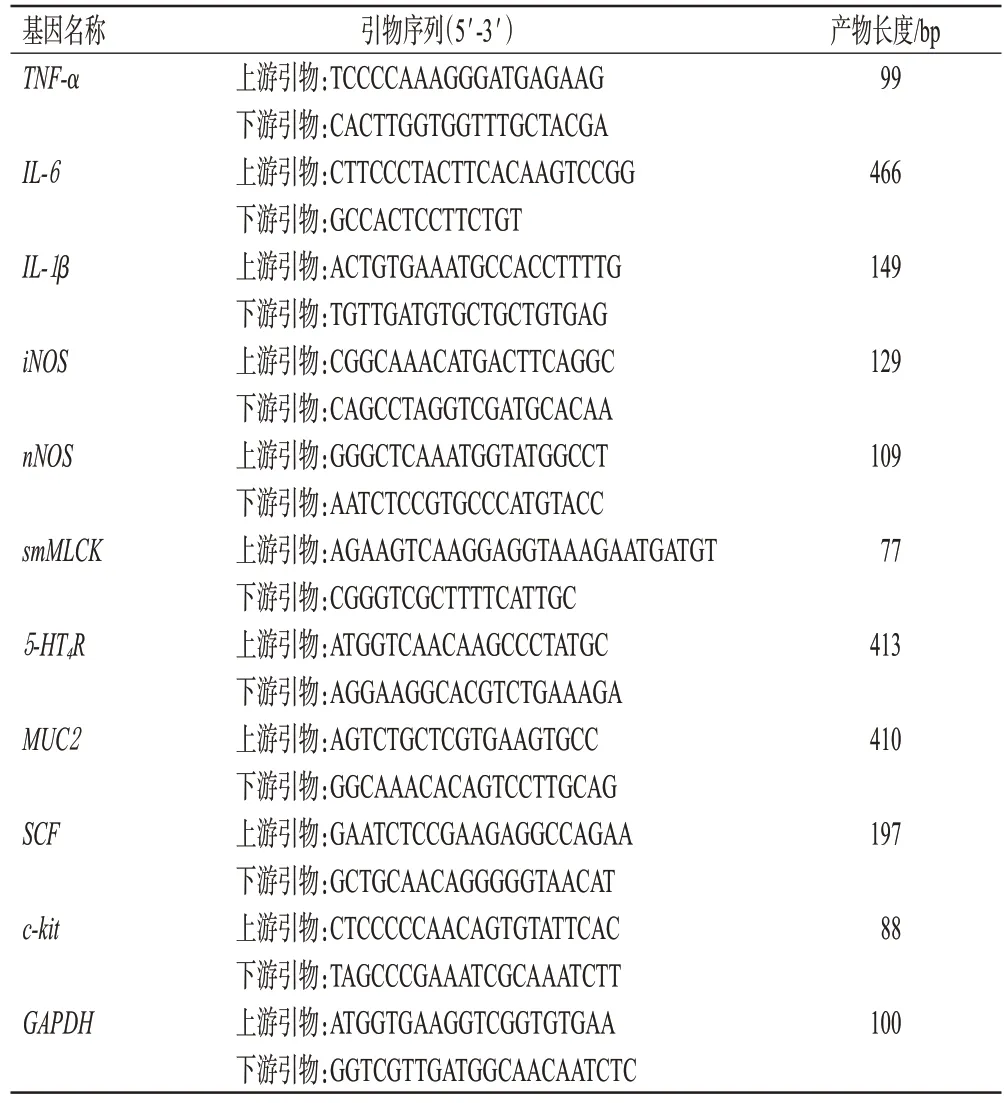
表1 引物序列及产物长度
2.8 小鼠结肠组织中MUC2和SCF蛋白表达检测
取小鼠结肠组织适量,加入裂解液匀浆处理,使用BCA 蛋白浓度测定试剂盒检测上清液中蛋白浓度并制备蛋白样品。取蛋白样品20 μg,电泳、转膜,用5%脱脂牛奶室温封闭1 h,加入MUC2、SCF、GAPDH、Tubulin抗体(稀释比例分别为1∶2 000、1∶1 000、1∶3 000、1∶3 000),于4 ℃过夜;用TBST 缓冲液洗3 次,加入辣根过氧化物酶标记的山羊抗兔IgG(H+L)抗体(稀释比例为1∶3 000),室温孵育1 h;用ECL显影,曝光并拍照保存。使用Image J 软件进行分析,以MUC2 蛋白与内参蛋白Tubulin、SCF 蛋白与内参蛋白GAPDH 的灰度值比值分别计算MUC2和SCF蛋白的相对表达量。
2.9 统计学分析
采用SPSS 21.0软件对数据进行统计分析。所有数据均用±s表示,若方差齐,采用单因素方差分析和SNK-q检验;若方差不齐,采用秩和检验。检验水准α=0.05。
3 结果
3.1 润肠颗粒对便秘小鼠粪便含水量和肠道推进率的影响
与正常对照组比较,模型组小鼠粪便质地坚硬干枯,粪便含水量和肠道推进率均显著降低(P<0.01)。与模型组比较,润肠颗粒低、高剂量组和莫沙必利组小鼠粪便质地蓬松,粪便含水量和肠道推进率均显著增加(P<0.01)。结果见表2。
表2 各组小鼠粪便含水量和肠道推进率的比较(±s,n=6)
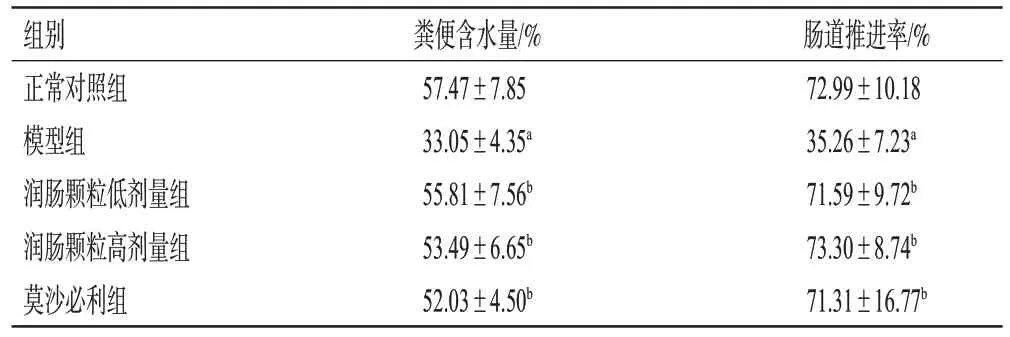
表2 各组小鼠粪便含水量和肠道推进率的比较(±s,n=6)
a:与正常对照组比较,P<0.01;b:与模型组比较,P<0.01。
组别正常对照组模型组润肠颗粒低剂量组润肠颗粒高剂量组莫沙必利组粪便含水量/%57.47±7.85 33.05±4.35a 55.81±7.56b 53.49±6.65b 52.03±4.50b肠道推进率/%72.99±10.18 35.26±7.23a 71.59±9.72b 73.30±8.74b 71.31±16.77b
3.2 润肠颗粒对便秘小鼠结肠和回肠组织结构的影响
与正常对照组比较,模型组小鼠结肠组织出现损伤,炎症细胞明显浸润,杯状细胞数量显著减少,回肠绒毛结构出现断裂。与模型组比较,润肠颗粒低、高剂量组和莫沙必利组小鼠结肠组织损伤均减轻,炎症细胞浸润均减少,杯状细胞数量均增加,回肠绒毛结构断裂均明显改善。结果见图1、图2(润肠颗粒低剂量组图略)。
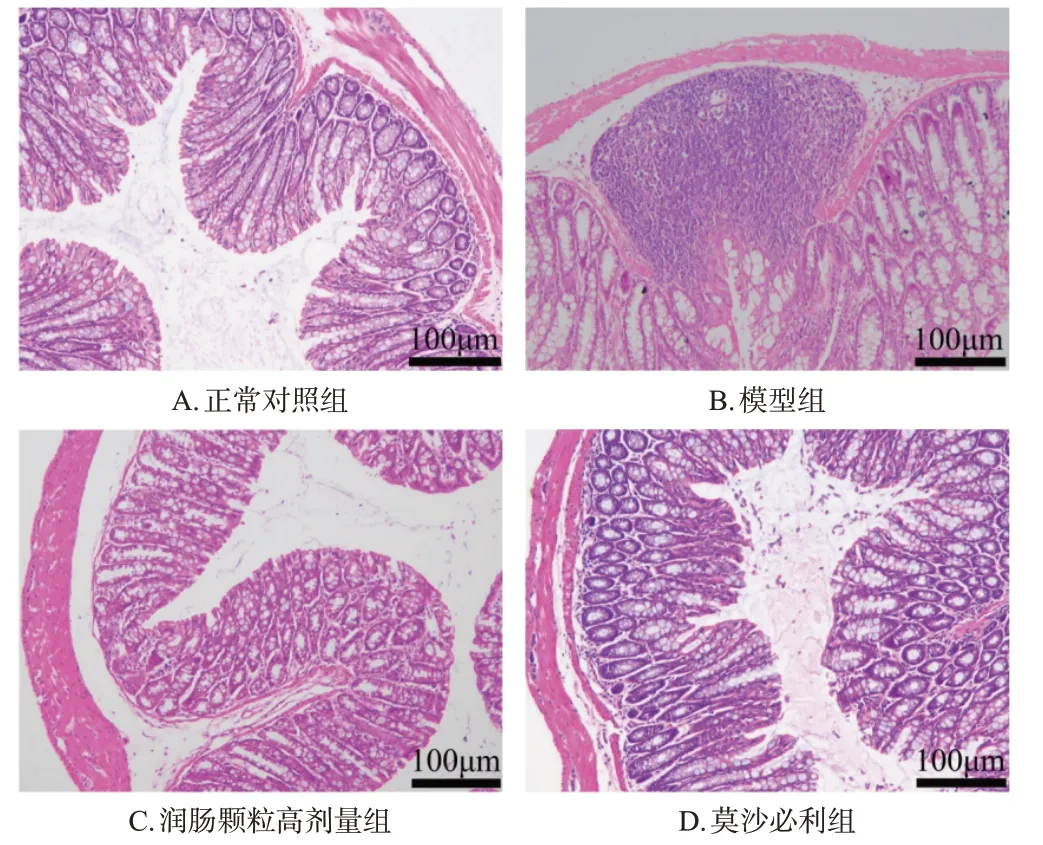
图1 各组小鼠结肠组织结构的显微图(HE染色)
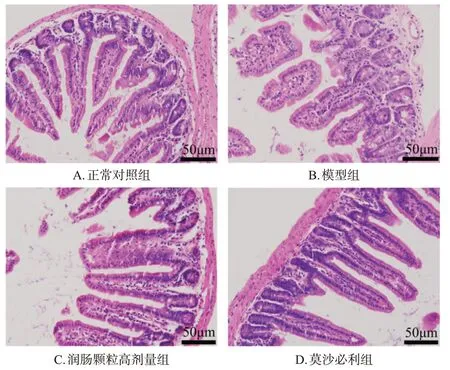
图2 各组小鼠回肠组织结构的显微图(HE染色)
3.3 润肠颗粒对便秘小鼠结肠黏液分泌量的影响
正常对照组、模型组、润肠颗粒低剂量组、润肠颗粒高剂量组和莫沙必利组小鼠结肠黏液分泌量分别为0.10±0.01、0.04±0.02、0.07±0.01、0.09±0.01、0.06±0.01(n=6)。与正常对照组比较,模型组小鼠结肠黏液分泌量显著减少(P<0.01)。与模型组比较,润肠颗粒高剂量组小鼠结肠黏液分泌量显著增加(P<0.01)。结果见图3(润肠颗粒低剂量组图略)。
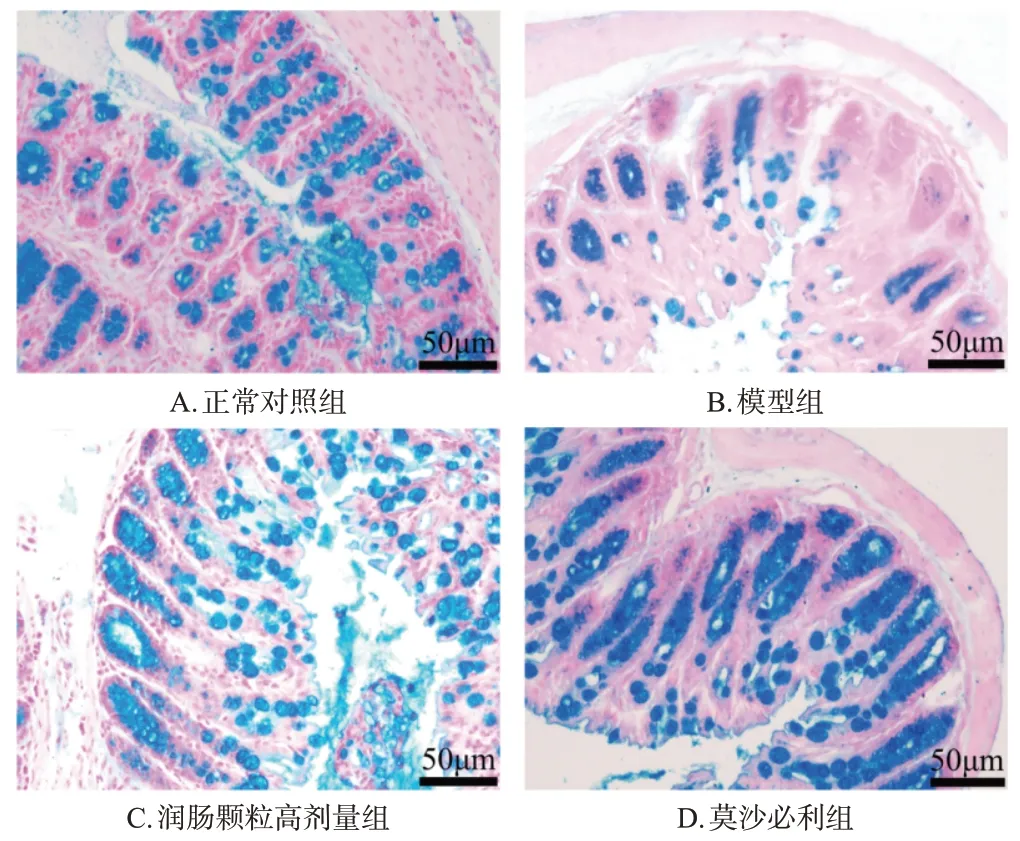
图3 各组小鼠结肠黏液的染色图(阿尔新蓝染色)
3.4 润肠颗粒对便秘小鼠结肠组织中c-kit蛋白表达的影响
与正常对照组比较,模型组小鼠结肠组织中c-kit蛋白表达水平降低。与模型组比较,润肠颗粒低、高剂量组和莫沙必利组小鼠结肠组织中c-kit 蛋白表达水平均增加。结果见图4(润肠颗粒低剂量组图略)。
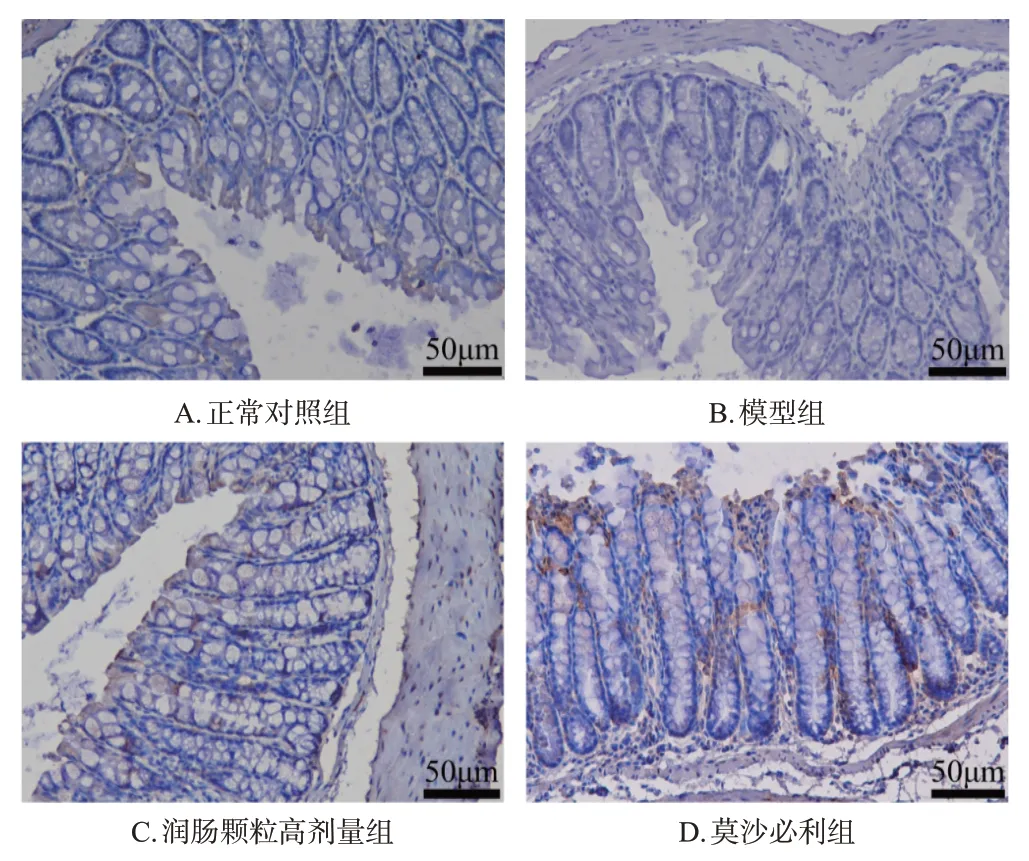
图4 各组小鼠结肠组织中c-kit 蛋白表达的免疫组化图
3.5 润肠颗粒对便秘小鼠结肠组织中炎症因子mRNA表达的影响
与正常对照组比较,模型组小鼠结肠组织中TNF-α、IL-6、IL-1β、iNOS mRNA 相对表达量均显著增加(P<0.01)。与模型组比较,润肠颗粒低、高剂量组和莫沙必利组小鼠结肠组织中TNF-α、IL-6、IL-1β、iNOS mRNA相对表达量均显著降低(P<0.05 或P<0.01)。结果见表3。
表3 各组小鼠结肠组织中炎症因子mRNA 表达水平比较(±s,n=6)
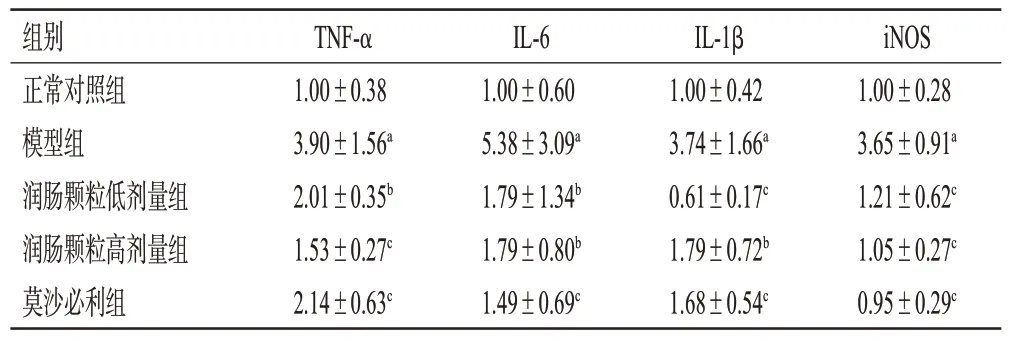
表3 各组小鼠结肠组织中炎症因子mRNA 表达水平比较(±s,n=6)
a:与正常对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
iNOS 1.00±0.28 3.65±0.91a 1.21±0.62c 1.05±0.27c 0.95±0.29c组别正常对照组模型组润肠颗粒低剂量组润肠颗粒高剂量组莫沙必利组TNF-α 1.00±0.38 3.90±1.56a 2.01±0.35b 1.53±0.27c 2.14±0.63c IL-6 1.00±0.60 5.38±3.09a 1.79±1.34b 1.79±0.80b 1.49±0.69c IL-1β 1.00±0.42 3.74±1.66a 0.61±0.17c 1.79±0.72b 1.68±0.54c
3.6 润肠颗粒对便秘小鼠结肠组织中促进肠道运动相关因子mRNA表达的影响
与正常对照组比较,模型组小鼠结肠组织中nNOS、smMLCK、5-HT4R、MUC2、SCF、c-kit mRNA相对表达量均显著降低(P<0.05或P<0.01)。与模型组比较,润肠颗粒低、高剂量组和莫沙必利组小鼠结肠组织中nNOS(润肠颗粒低剂量组除外)、smMLCK、5-HT4R、MUC2、SCF(润肠颗粒低剂量组除外)、c-kit mRNA相对表达量均显著增加(P<0.05或P<0.01)。结果见表4。
表4 各组小鼠结肠组织中促进肠道运动相关因子mRNA表达水平比较(±s,n=6)
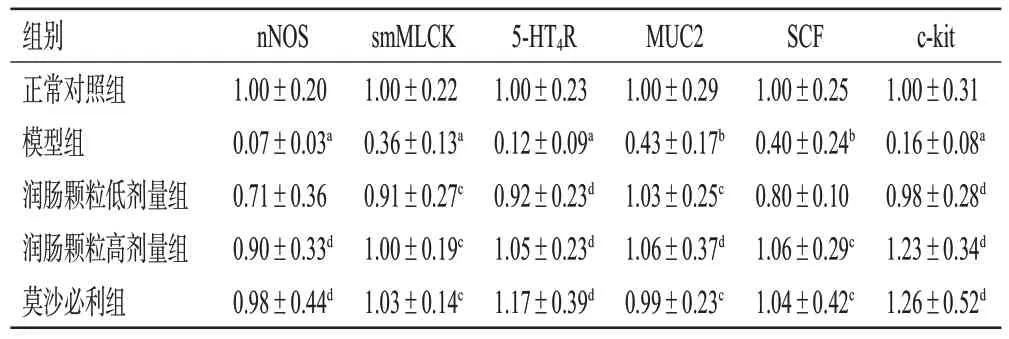
表4 各组小鼠结肠组织中促进肠道运动相关因子mRNA表达水平比较(±s,n=6)
a:与正常对照组比较,P<0.01;b:与正常对照组比较,P<0.05;c:与模型组比较,P<0.05;d:与模型组比较,P<0.01。
组别正常对照组模型组润肠颗粒低剂量组润肠颗粒高剂量组莫沙必利组nNOS 1.00±0.20 0.07±0.03a 0.71±0.36 0.90±0.33d 0.98±0.44d smMLCK 1.00±0.22 0.36±0.13a 0.91±0.27c 1.00±0.19c 1.03±0.14c 5-HT4R 1.00±0.23 0.12±0.09a 0.92±0.23d 1.05±0.23d 1.17±0.39d MUC2 1.00±0.29 0.43±0.17b 1.03±0.25c 1.06±0.37d 0.99±0.23c SCF 1.00±0.25 0.40±0.24b 0.80±0.10 1.06±0.29c 1.04±0.42c c-kit 1.00±0.31 0.16±0.08a 0.98±0.28d 1.23±0.34d 1.26±0.52d
3.7 润肠颗粒对便秘小鼠结肠组织中MUC2和SCF蛋白表达的影响
与正常对照组比较,模型组小鼠结肠组织中MUC2和SCF 蛋白相对表达量均显著降低(P<0.05 或P<0.01)。与模型组比较,润肠颗粒低、高剂量组和莫沙必利组小鼠结肠组织中MUC2 和SCF 蛋白相对表达量均显著增加(P<0.05或P<0.01)。结果见图5、图6。
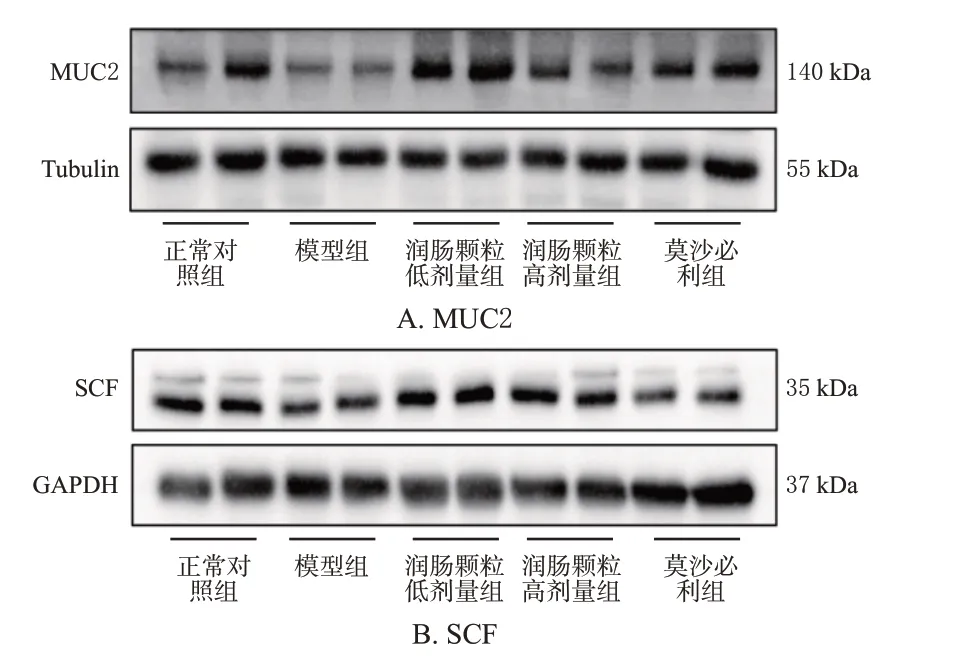
图5 各组小鼠结肠组织中MUC2 和SCF 蛋白表达的电泳图
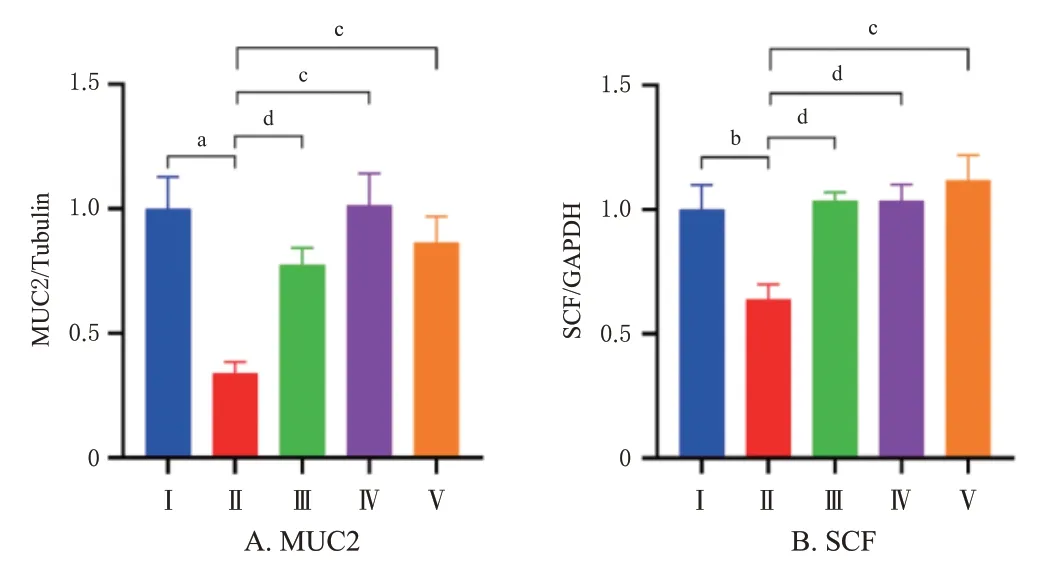
图6 各组小鼠结肠组织中MUC2 和SCF 蛋白表达水平检测结果
4 讨论
中医认为肠道传导失司和肠道失于濡润都将导致便秘。洛哌丁胺是一类μ阿片受体激动剂,其能够通过抑制肠道水分的分泌和结肠的蠕动,从而延长粪便排空时间,并延缓肠道的运输[5],已被广泛用于诱导便秘模型。莫沙必利能够改善胃肠动力,临床上常用于治疗便秘,本研究将其作为治疗便秘的阳性对照药[6]。本研究结果显示,润肠颗粒能改善便秘小鼠的粪便质地,提高粪便含水量和肠道推进率,且高剂量润肠颗粒的作用与莫沙必利相似。这表明润肠颗粒能够促进小鼠粪便软化和肠道蠕动,用于便秘小鼠的疗效与莫沙必利相当。
结肠外黏液层内平坦的管腔表面能够保护肠上皮细胞免受细菌侵害,抑制炎症细胞浸润,防止肠道发生感染[7]。本研究结果显示,润肠颗粒能够减少小鼠结肠炎症细胞的浸润,降低炎症因子TNF-α、IL-6、IL-1β、iNOS mRNA相对表达量。这表明润肠颗粒可通过减轻便秘小鼠结肠炎症,降低肠道通透性,而保护肠道屏障。结肠的黏液分泌是影响排便的重要因素。在肠黏膜中,MUC2是杯状细胞分泌最多的黏液蛋白,其能够使肠上皮细胞免受细菌攻击,保护肠黏膜[8]。本研究结果显示,与正常对照组比较,模型组小鼠结肠组织中MUC2 mRNA和蛋白表达均受到抑制,而润肠颗粒可阻止这种抑制作用,能使MUC2的表达恢复到正常水平。这提示润肠颗粒可能通过润滑肠黏膜,减少肠道刺激和摩擦,而促进肠黏膜细胞产生更多的MUC2蛋白。
肠道传输收缩节律异常在便秘的发生机制中具有关键作用[9]。nNOS 缺陷的小鼠已被证明可表现出运动功能障碍和消化道功能、结肠功能紊乱[10]。smMLCK是控制平滑肌收缩起始的关键调节酶,降低肠道smMLCK活性,会导致以弱蠕动为特征的肠道运动障碍[11]。5-羟色胺是一类对肠道运动具有重要作用的神经递质,其能参与消化道功能的调节,5-HT4R 能够驱动肠道对5-羟色胺产生蠕动反应[12]。本研究结果显示,润肠颗粒能够上调便秘小鼠结肠组织中nNOS、smMLCK、5-HT4R mRNA相对表达量,这表明润肠颗粒可增强肠道运动功能。Cajal 间质细胞(interstitial cells of Cajal,ICC)作为胃肠道的起搏细胞,对于正常的肠道运动至关重要。SCF/c-kit信号传导对ICC的发展具有重要作用[13]。本研究结果显示,润肠颗粒能够上调便秘小鼠结肠组织中SCF 和c-kit mRNA 相对表达量。这提示润肠颗粒改善便秘的作用机制可能是通过激活SCF/c-kit信号通路,增加ICC 的表达,来促进便秘小鼠肠道运动,改善肠道运动障碍。
综上所述,润肠颗粒具有润肠通便的作用,能够改善小鼠便秘,其润肠机制可能与促进结肠黏液分泌和MUC2表达有关,其通便机制可能与激活SCF/c-kit信号通路有关。
