自体造血干细胞移植治疗伴TP53突变的SHH亚型儿童髓母细胞瘤2例并文献复习
2024-02-02林毅漳彭翠翠耿明英李禄生摄渊婷曾东风
林毅漳,彭翠翠,耿明英,李禄生,摄渊婷,王 湘,曾东风△
(1.陆军军医大学大坪医院血液内科,重庆 400042;2.陆军军医大学大坪医院肿瘤科,重庆 400042;3.重庆医科大学附属儿童医院神经外科,重庆 400014)
髓母细胞瘤(medulloblastoma,MB)属于小脑胚胎性肿瘤之一,是儿童发病率最高的一种恶性中枢神经系统肿瘤,约占所有儿童中枢神经系统肿瘤的20%[1]。目前MB的标准治疗是手术后联合全脑全脊髓放疗和辅助全身化疗,标危组MB患者经过规范治疗5年无事件生存(event-free survival,EFS)率为70%~80%,但高危组患者5年EFS率仅为40%~50%,约半数高危患者在5年内复发,且上述患者一旦复发,长期生存率小于20%。因此,探索适合高危MB患者的治疗模式,是提高MB患者总体生存率的重要方向。
自体造血干细胞移植技术是一种造血干细胞支持下的大剂量化疗技术,其能有效地清除肿瘤残留,提高综合治疗效果。自20世纪90年代开始,陆续有研究报道自体造血干细胞移植联合放化疗有助于改善MB患者预后[2-3],但是关于极高危TP53突变SHH亚型儿童MB自体造血干细胞移植治疗的相关研究和报道有限。现将本中心2例放化疗序贯自体造血干细胞移植治疗TP53突变SHH亚型儿童MB病例报道如下,并结合相关进展进行文献复习总结。
1 病例资料
1.1 病例基本资料和诊断
病例1,女性,14岁。2017年3月外院头颅磁共振成像(MRI)提示第四脑室占位,行右侧小脑半球肿瘤切除术,术后病理提示MB。2017年4月至2018年1月行11个周期化疗,化疗方案为甲氨蝶呤+长春新碱+环磷酰胺与顺铂+依托泊苷。2018年1月22日,复查头颅MRI,提示右侧小脑半球新发肿块影,考虑肿瘤复发。行右侧小脑半球肿瘤切除术,术后病理提示:MB(世界卫生组织中枢神经系统肿瘤分类Ⅳ级),灶性间变。基因检测提示:TP53错义突变,分子亚型为SHH型。诊断:SHH型MB,复发,TP53突变型,分组为极高危组。2018年2月至2019年4月行多次化疗和放疗后达到缓解。2019年10月,患者再次因头痛到外院就诊。复查头颅MRI提示小脑占位,考虑肿瘤二次复发。
病例2,女性,9岁。2021年5月外院CT提示脑积水、颅内占位,行神经导航下显微镜下枕骨大孔区肿瘤切除术,术后病理提示:SHH型MB。基因检测共检测到19个基因的33个基因变异,包括PTCH1、SMO、SUFU和TP53等突变,是SHH信号通路的特异调节因子,诊断:SHH型MB,TP53突变型,分组为极高危组。术后1个月行全脑及全脊髓放疗。2021年9—11月以司莫司汀+长春新碱+顺铂方案化疗2个疗程。
两例患者经术前充分评估,无明显移植禁忌,转入陆军特色医学中心血液内科行自体干细胞移植。本研究经陆军特色医学中心伦理委员会批准[医研伦审(2021)第41号]。
1.2 移植前放化疗方案和干细胞动员
病例1于2019年10月至2020年3月行小脑放疗,总剂量(DT):23.0 Gy/10 f,全中枢放疗DT:9.0 Gy/5 f,同时辅以替莫唑胺+长春新碱方案同步联合化疗。2020年4月予以异环磷酰胺+依托泊苷方案动员干细胞,共采集单个核细胞7.8×108/kg,CD34+细胞16.45×106/kg。移植前正电子发射计算机体层显像(PET/CT)、头颅及全脊柱增强MRI检查未见肿瘤征象。
病例2于2021年6—8月行全脑全脊髓放疗,2021年9—11月以司莫司汀+长春新碱+顺铂方案化疗2个疗程。2021年11月以异环磷酰胺+依托泊苷方案动员干细胞后,因粒细胞缺乏伴感染,放弃采集干细胞。于2021年12月再次予异环磷酰胺+依托泊苷方案动员干细胞,采集自体外周血干细胞单个核细胞10.29×108/kg,CD34+细胞11.53×106/kg。采集结束后,再次以司莫司汀+长春新碱+顺铂方案化疗2个疗程。移植前行头颅MRI、全脊柱MRI检查未见肿瘤征象。
1.3 移植过程和并发症防治
两例患者预处理方案均采用CTE方案,具体为:卡铂[500 mg/(m2·d)×3 d,-8~-6 d]+塞替派[300 mg/(m2·d)×3 d,-5~-3 d]+依托泊苷[250 mg/(m2·d)×3 d,-5~-3 d]。于预处理结束后48 h回输自体造血干细胞。预处理期间,予大量水化、碱化,每日监测出入量,适当促进排尿。予盐酸托烷司琼氯化钠止吐,还原型谷胱甘肽、异甘草酸镁保护脏器功能,艾司奥美拉唑抑制胃酸,熊去氧胆酸预防肝静脉闭塞症,复方氯己定含漱液保护口腔黏膜。予阿昔洛韦预防病毒感染。针对血培养的特定病原菌及药敏试验,予联合抗感染治疗。
1.4 治疗结果
病例1,移植后10 d白细胞、13 d血小板植入。移植后82 d(2020年8月31日)复查头颅MRI检查提示未见明显病灶。移植后104 d因左眼闭合不全、口角右斜来院就诊,复查头颅及全脊柱增强MRI提示双侧小脑半球多发强化影,颈4、5,腰2、5及骶1椎体水平椎管内多发结节状异常信号,考虑MB复发,伴肿瘤脑脊液播散可能。疗效评价:进展。后患者继续予以替莫唑胺、依托泊苷等药物治疗,移植后188 d(2020年12月15日)患者出现吞咽困难伴进食呛咳,复查头颅及全脊柱MRI提示:桥脑池结节增大,椎管内病灶较前明显增大。遂放弃治疗出院。病例2,移植后12 d白细胞、16 d血小板植入。移植后第4、10个月多次行头颅及全脊柱MRI检查均提示未见肿瘤征象,目前持续随访中。两例患者治疗随访影像见图1。两例患者均未发生肝静脉闭塞症、严重肝肾功能不全、心肌损伤、严重出血等并发症。两例患者均出现Ⅰ~Ⅱ度口腔黏膜溃疡、腹泻等副反应,予以加强口腔护理、调节肠道菌群、止泻等治疗后缓解。
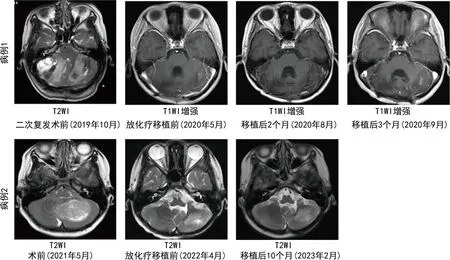
T1WI:T1加权成像;T2WI:T2加权成像。
2 讨 论
MB是儿童最常见的恶性肿瘤之一,世界卫生组织关于中枢神经系统肿瘤分类中将其归为Ⅳ级的胚胎性肿瘤。由于MB在临床病理上的异质性,使其治疗方式的选择和疗效差异巨大。近年来,随着基因组学、表观遗传学、蛋白质组学等学科及技术的发展,对MB的认识不再局限于组织病理形态方面,开始进入到分子水平,特别是DNA甲基化图谱的出现,衍生出了更能反映MB肿瘤异质性的分子亚型及相关亚组[4-6],提供了更加精准的治疗策略[7-8]。2021年世界卫生组织第5版中枢神经系统肿瘤分类,将MB分为3个分子亚型:WNT-激活型、SHH-激活型(含SHH-激活型TP53野生型及SHH-激活型TP53突变型)、非WNT/非SHH型(含Group 3型、Group 4型)[9]。结合分子亚型及不同预后,将MB进一步细分为低危组、标危组、高危组、极高危组[6]。SHH-MB约占所有MB患者的30%,其发病机制与SHH通路密切相关,发病年龄呈两极分布(以<3岁或>16岁为主),性别比例上以男性发病略多,5年总体生存率约70%。在SHH通路上,常见的基因突变包括PTCH1和SUFU的失活突变或缺失、SMO的激活突变、GLI1或GLI2和MYCN的扩增,上述突变激活SHH通路,促进肿瘤增殖[10-11]。TP53基因是SHH-MB的重要致病基因,包括野生型、突变型两种形态,二者间发病年龄、预后的差异明显。TP53野生型在成人和幼儿中多见,5年生存率达80%。TP53突变型在年龄稍大的儿童中多见,常伴随GLI2和/或MYCN基因的扩增[12-13],5年生存率约40%[14],已纳入极高危组。本研究两例患儿均为SHH型MB TP53突变。病例2手术切除肿瘤标本基因检测共检出3个TP53基因变异:TP53-p.Arg175His(变异频率49.7%)、TP53-p.Arg196Ter(变异频率45.5%)及TP53-p.Asp259Gly(变异频率49.0%)。TP53-p.Arg175His可减少p53靶标的激活并干扰野生型p53的激活,抑制细胞凋亡,降低基因组稳定性,促进肿瘤发生[15]。而TP53-p.Arg196Ter突变可明显影响DNA的激活及转录结合[16]。目前已有针对TP53突变靶向药物的多项相关临床研究正在开展中,包括MK-1775、ALT-801等[17-18]。
MB目前主要的治疗模式是手术切除后联合放化疗治疗,且治疗方式根据患者年龄进行了显著区分。对于超过3岁的患儿采用多模式治疗方法,包括最大限度的安全手术切除、颅脊髓放疗及肿瘤床加强放疗、辅助化疗[19]。而小于3岁的患儿,手术切除后进行术后化疗并根据危险分层,不放疗或推迟至3岁后放疗或化疗后行局部瘤床放疗。国外有研究统计,治疗后标危组MB的5年总体生存(OS)率维持在75%左右[20-21]。国内一项纳入115例儿童MB的临床研究提示,低危组3~5年OS率明显高于高危组(85.5%vs.67.7%,P<0.05),与国外相当,且低危组3~5年EFS率明显高于高危组(76.8%vs.47.3%,P<0.05)[22]。对于高危难治MB患儿,通过大剂量化疗药物可一定程度上改善不良预后结局,但大剂量化疗药物带来的骨髓造血功能抑制等毒副作用亟待解决。同时,针对婴幼儿MB患者,其大脑尚未发育成熟,放疗会带来后续的神经认知功能损害、内分泌功能障碍、耳毒性、生长发育迟缓等不良反应,严重影响患儿的生活质量[23-24]。这些都亟待新的治疗策略去改善。通过自体造血干细胞移植,便可以在保证大剂量化疗同时,恢复骨髓造血功能。作者分析总结了既往相关文献中大剂量化疗联合自体干细胞移植治疗高危MB患者的临床研究,证实经手术切除后采用该治疗方案有助于改善患者预后,同时减少或避免放疗[25-26]。
本组两例患儿分子病理诊断均为伴TP53突变的SHH亚型MB,属于极高危组患者,进行自体造血干细胞移植是减少其复发及延长生存期的重要手段。两例患者移植过程中未出现严重的移植相关并发症,且均在2周左右实现造血重建,术后早期评估原发病均完全缓解,提示自体造血干细胞移植在本组两例患者治疗过程中安全有效。病例1在经过手术后标准放化疗治疗后复发2次,后经再次手术切除、放化疗后进行自体造血干细胞移植。患者自体造血干细胞移植术后短期评估完全缓解,但仍在术后3个月出现进展。GAJJAR等[27]报道的SJMB-03自体造血干细胞移植研究中,将MB分子亚型计入临床研究,结果发现高危组患者中SHH亚型移植后无进展生存期明显差于其他亚型。针对本例患者,考虑短期复发可能与2个因素相关:(1)多次复发导致的多药耐药;(2)TP53突变的SHH亚型的不良预后因素。病例2在放化疗后一线接受自体外周血造血干细胞移植治疗,目前随访1年复查评估仍持续完全缓解,提示放化疗序贯自体造血干细胞移植对伴TP53突变的SHH亚型MB具有确切的疗效。
综合分析本组两例MB患儿,结合文献复习,总结如下:(1)对于病理明确诊断为MB的患者,需进一步完善相关基因检测,完善MB分子亚组分型,明确相关突变基因情况,为后续复发难治提供靶向诊疗依据;(2)针对伴TP53突变的高危SHH亚型MB患者,早期一线的自体造血干细胞移植强化巩固治疗可能优于复发后的二线移植治疗,有待后续较大样本前瞻性研究以评估论证;(3)针对复发难治SHH亚型患者,除了序贯自体造血干细胞移植,可能需要考虑针对突变基因及其相关信号通路的分子靶向治疗;(4)鉴于MB肿瘤恶性程度高,移植术后严格按照诊疗指南进行头颅及全脊柱MRI复查随访是必要的。放化疗联合自体造血干细胞移植对伴TP53突变的SHH亚型极高危MB患者具有一定的治疗效果,其治疗时机和应用价值有待后续进一步研究。
