鼻腔鼻窦鳞状细胞癌中PIK3CA、p-AKT、PTEN的表达及意义
2024-02-02赵海清王佳说赵一辰姜菲菲阎艾慧
赵海清,王佳说,赵一辰,姜菲菲,阎艾慧△
(中国医科大学附属第一医院:1.耳鼻咽喉科;2.临床流行病学与循证医学研究室,沈阳 110001)
鼻腔鼻窦鳞状细胞癌(sinonasal squamous cell carcinoma,SNSCC)占鼻腔鼻窦恶性肿瘤的60%~75%,是其最常见的亚型[1]。SNSCC的发生较为隐匿且侵袭性强,罹患者预后往往不佳,所以其分子生物学机制一直是临床医师的重要研究方向。90%的头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)中存在磷脂酰肌醇-3-激酶(phosphatidylino-sitol 3-kinases,PI3K)/蛋白激酶B(phosphorylated protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路的异常激活[2]。 PIK3CA可编码合成PI3K的亚基——p110α蛋白,正向调控PI3K/AKT/mTOR信号通路,诱发肿瘤细胞的增殖和侵袭等,是HNSCC中最常发生突变的癌基因[3-4]。10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)是一种编码双重特异性磷酸酶的抑癌基因,其主要生物学功能是逆转PI3K催化磷脂酰肌醇-4,5-二磷酸(PIP2)转化为磷脂酰肌醇-3,4,5-三磷酸(PIP3)的过程,间接抑制AKT的活性,负向抑制PI3K/AKT/mTOR信号通路激活[5]。PIK3CA和PTEN的致癌突变率在癌症中仅次于P53[6]。而目前,PIK3CA、p-AKT、PTEN与SNSCC关系的研究较为少见。本研究通过生物信息学数据分析PIK3CA、PTEN在HNSCC中的表达趋势,免疫组织化学检测SNSCC中PIK3CA、p-AKT、PTEN蛋白的表达情况,分析它们与其临床病理特征和预后间的关系,旨在探讨SNSCC的机制和发展进程,以期提供新的早期诊疗和预后相关标志物。
1 资料与方法
1.1 生物信息学分析
通过UCSC Xena(https://xenabrowser.net/)检索下载源自癌基因组图谱的头颈鳞癌数据集(TCGA-HNSC),其中包括502例头颈鳞癌组织和44例癌旁组织。具体步骤:(1)R语言(4.2.1版本)fread函数获取肿瘤组织和癌旁组织的表达矩阵;(2)R语言rtracklayer包根据注释文件进行TCGA-HNSC的基因名称转换,若出现多个探针对应1个基因名的情况,则取平均值作为表达量;(3)limma包avereps函数去掉TCGA-HNSC的重复基因并取平均值;(4)ggplot2包将数据可视化,读取处理过的表达矩阵并提取目的基因表达水平,按照肿瘤组织和癌旁组织分组,采用Mann-WhitneyU检验目的基因的表达在两组中是否存在差异。
1.2 一般资料
采用回顾性研究,选取2015年1月至2021年6月于本院手术切除后经病理证实为SNSCC的石蜡标本43例(SNSCC组),男31例,女12例;年龄18~79岁,平均(57.53±11.68)岁;病理分级:高分化6例,中分化18例,低分化19例;根据AJCC第8版TNM分类标准进行分期[7]:Ⅰ期7例,Ⅱ期4例,Ⅲ期14例,Ⅳ期18例;肿瘤原发部位:上颌窦25例,鼻腔13例,筛窦5例。完善整理临床资料及病理资料,预后情况通过电子病例信息、门诊、电话随访至2022年11月1日。对照组为同期收集的20例鼻中隔偏曲患者正常下鼻甲黏膜组织。所有患者术前均未接受放化疗、生物治疗、免疫治疗,均无淋巴结远处转移。本研究通过中国医科大学附属第一医院伦理委员会审核批准(科伦审[2021]386号)。
1.3 方法
甲醛固定标本,常规石蜡包埋,切片,厚度4 μm。采用SP二步法进行免疫组织化学染色,操作步骤严格按照试剂盒说明书。切片二甲苯脱蜡,梯度乙醇脱水,3%H2O2室温避光孵育10 min,高压抗原热修复,依次加入一抗PIK3CA/p-AKT/PTEN(浓度1∶100)单克隆抗体,4 ℃过夜;室温复温,二抗孵育20 min,DAB显色,苏木精复染、脱水、透明,树胶封片。阴性对照使用磷酸盐缓冲液代替一抗。兔抗人单克隆PIK3CA抗体(ab135384)、兔抗人单克隆p-AKT抗体(ab8805)及兔抗人单克隆PTEN抗体(ab170941)均购自美国Abcam公司,SP试剂盒和DAB显色液均购自北京中杉金桥生物技术有限公司。
1.4 结果判定
PIK3CA及p-AKT蛋白表达在SNSCC和正常下鼻甲黏膜组织的细胞质中呈棕黄色,PTEN蛋白表达在细胞核中呈棕黄色。选取每张切片5个视野(400×),观察至少100个细胞。按染色强度无染色为0分,淡黄色为1分,棕黄色为2分,深褐色为3分;阳性细胞百分比计数≤10%为0分,>10%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。将二者分数乘积作为判定结果:<3分为阴性,≥3分为阳性。以上染色结果均由两位高年资病理科医师在双盲情况下评估。
1.5 统计学处理
采用SPSS26.0软件进行统计学分析。计数资料以例数或百分比表示,采用χ2检验或Fisher确切概率法;相关性采用Spearman秩相关分析,生存分析采用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结 果
2.1 HNSCC组织及癌旁组织PIK3CA、PTEN mRNA表达情况
生物信息学数据分析显示,HNSCC组织PIK3CA mRNA表达高于癌旁组织(P<0.01),PTEN mRNA表达低于癌旁组织(P<0.05),见图1。
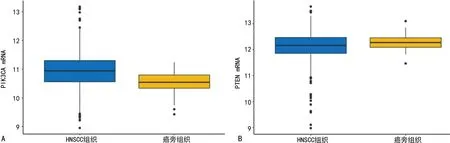
A:PIK3CA mRNA表达;B:PTEN mRNA表达。
2.2 SNSCC组织及正常下鼻甲黏膜组织PIK3CA、p-AKT和PTEN蛋白表达情况
SNSCC组PIK3CA和p-AKT蛋白阳性表达率明显高于对照组,PTEN蛋白阳性表达率明显低于对照组,差异有统计学意义(P<0.01),见图2~4、表1。
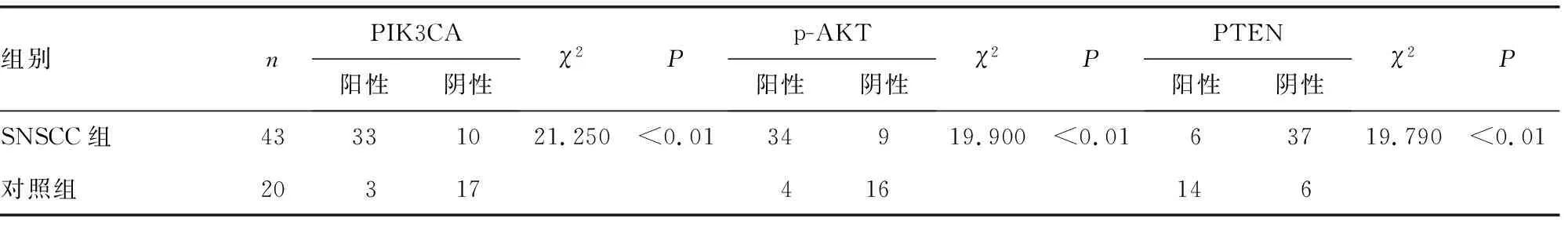
表1 SNSCC组织及正常下鼻甲黏膜组织PIK3CA、p-AKT及PTEN蛋白表达情况(n)
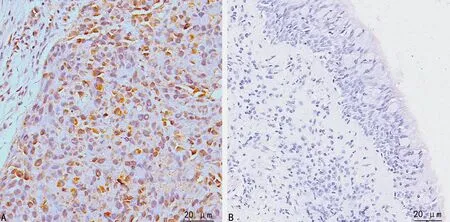
A:SNSCC组;B:对照组。
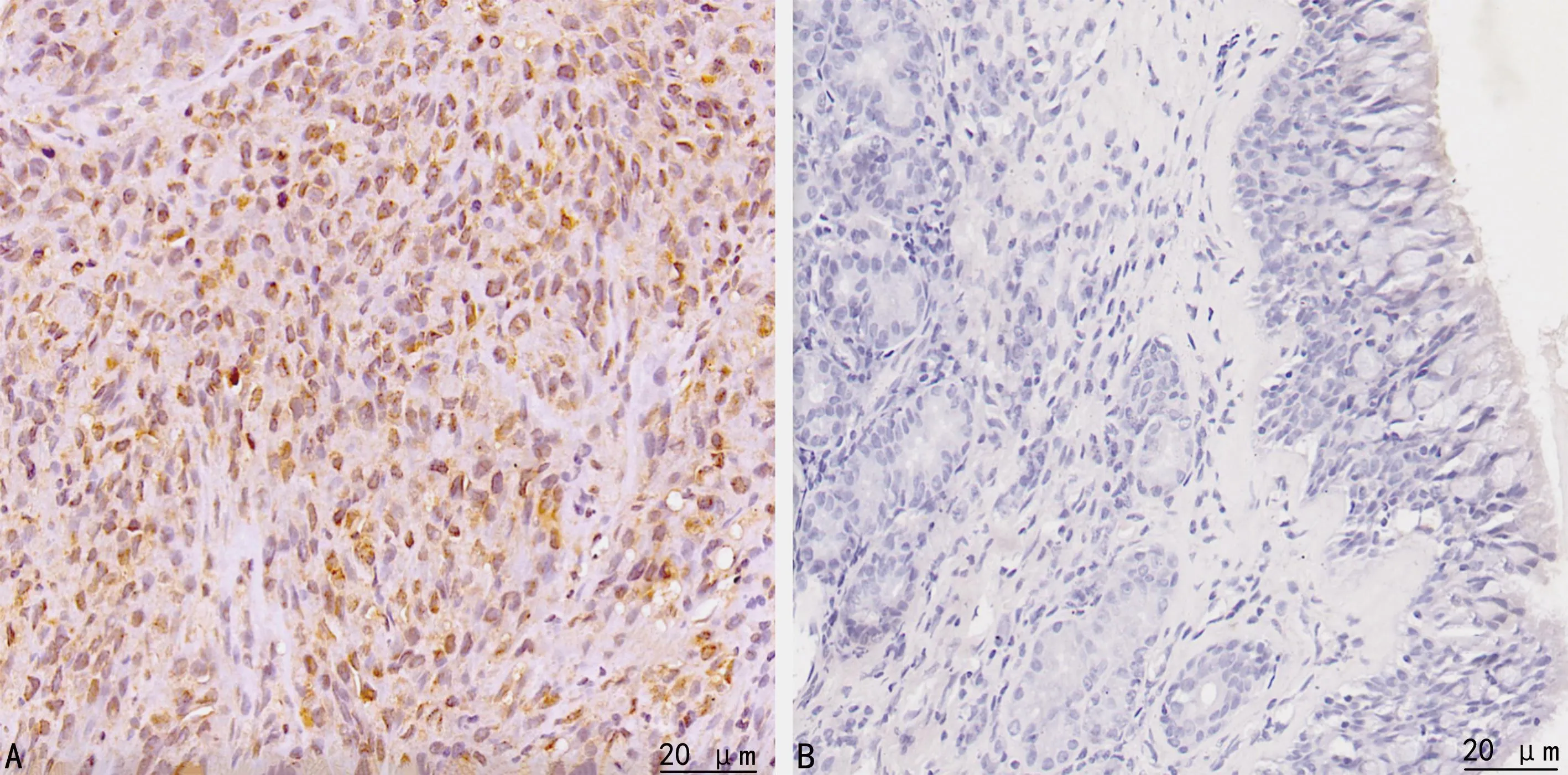
A:SNSCC组;B:对照组。
A:SNSCC组;B:对照组。
2.3 SNSCC患者PIK3CA、p-AKT和PTEN蛋白表达与临床病理特征的关系
PIK3CA、p-AKT蛋白表达与临床分期、分化程度、原发部位有关(P<0.05),而PTEN蛋白表达与临床分期、分化程度和原发部位无关(P>0.05)。PIK3CA、p-AKT和PTEN蛋白表达与年龄、性别、吸烟及饮酒状态均无关(P>0.05),见表2。
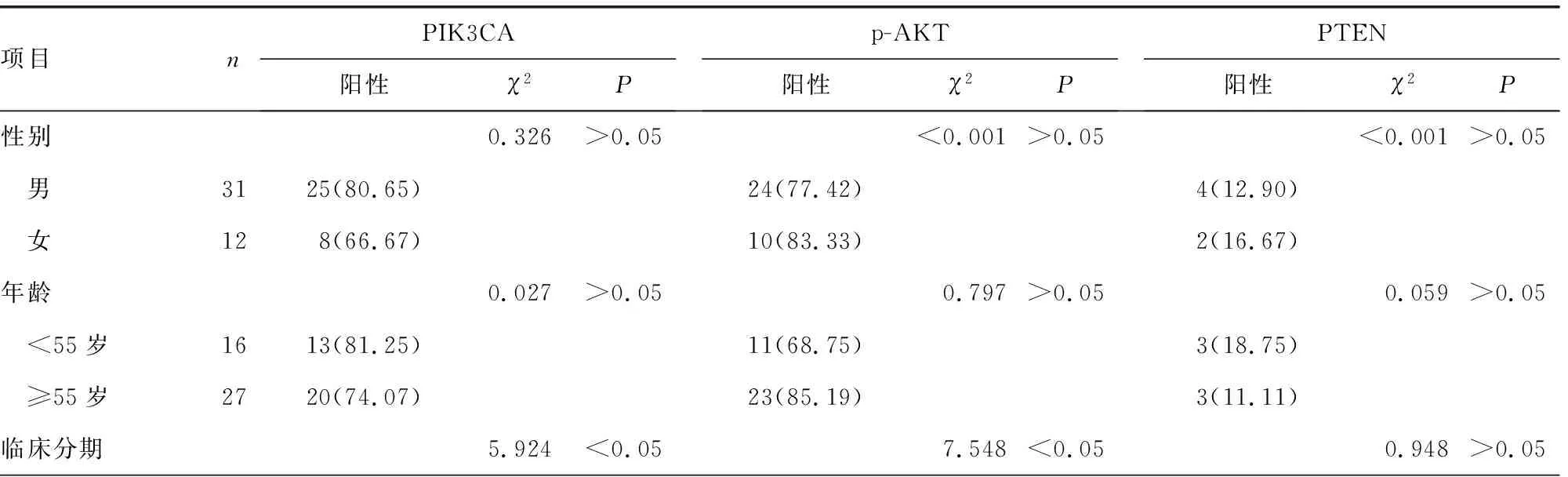
表2 SNSCC患者PIK3CA、p-AKT及PTEN蛋白表达与临床病理特征的关系[n(%)]
2.4 PIK3CA、p-AKT和PTEN蛋白表达的相关性分析
通过Spearman相关分析发现,SNSCC组织中PIK3CA和p-AKT蛋白表达呈正相关(r=0.664,P<0.01),PIK3CA和PTEN蛋白表达呈负相关(r=-0.414,P<0.01),p-AKT和PTEN蛋白表达呈负相关(r=-0.453,P<0.01)。
2.5 SNSCC患者PIK3CA、p-AKT和PTEN蛋白表达对生存时间的影响
SNSCC患者完成随访41例,失访2例,生存时间为5.23~93.27个月,中位生存时间为36.07个月。Kaplan-Meier分析显示,PIK3CA蛋白阳性表达患者中位生存期为28.33个月,阴性表达患者中位生存期为67.27个月,比较差异有统计学意义(P<0.01);p-AKT蛋白阳性表达患者中位生存期为34.27个月,阴性表达患者中位生存期为73.37个月,比较差异有统计学意义(P<0.01);PTEN蛋白阳性表达患者中位生存期为70.30个月,阴性表达患者中位生存期为33.37个月,比较差异无统计学意义(P>0.05),见图5。
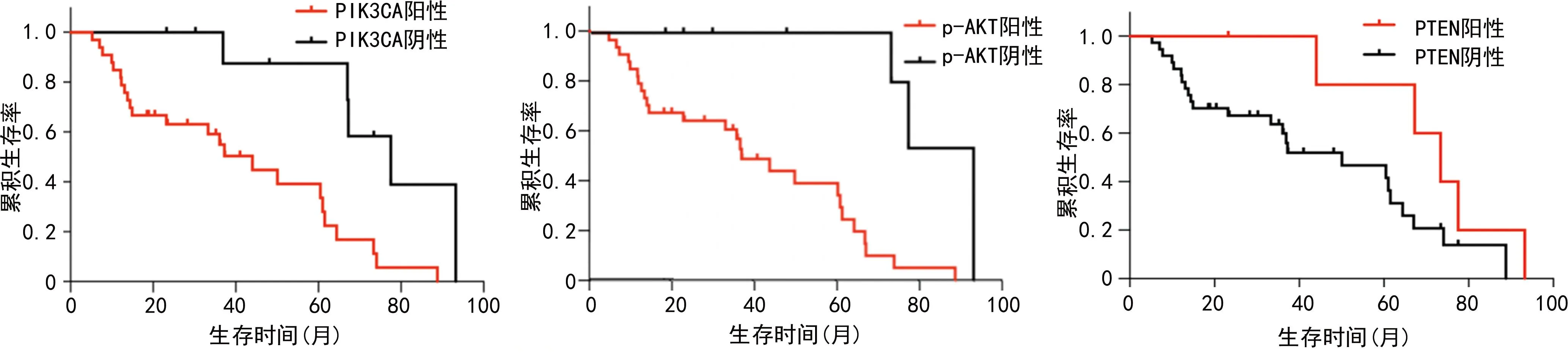
图5 SNSCC患者PIK3CA、p-AKT及PTEN蛋白表达与生存时间的关系
3 讨 论
鼻腔鼻窦恶性肿瘤占头颈部肿瘤的3%~5%,每年发病率约为0.36/10万,易侵犯上颌窦和鼻腔[8-9]。虽然,近年来SNSCC发病率呈下降趋势[10],但因其发生位置和生长模式较为隐匿,同时侵袭性较高易累及邻近器官,就诊时多处于中晚期,罹患者预后较差。尽管多模式多学科的综合治疗具有明显优势,可增加患者生存率和器官保存率,但预后效果仍不好,5年生存率仅为30.2%~59.5%[11-12]。术后上颌骨的缺损会改变头颈部解剖结构,导致颌面畸形和发音障碍等,继而影响患者心理健康和生活质量[13-14]。因此,探究SNSCC相关的肿瘤标记物,对其早期诊治、分期判断、预后评估及精准医学治疗至关重要。
有研究发现,PI3K/AKT/mTOR信号通路可能促进鼻窦鳞状细胞癌的转移潜能[15]。本研究发现,与正常下鼻甲黏膜组织比较,SNSCC组织中PIK3CA及p-AKT蛋白呈高表达,而PTEN蛋白呈低表达。PIK3CA的过表达可激活下游AKT、mTOR等信号分子,导致细胞异常增殖、分化和迁移等生物学效应,促进肿瘤的发生、发展[16]。已有研究报道[17],PIK3CA高表达或突变与宫颈癌、乳腺癌、结直肠癌及头颈癌有关。为进一步了解PIK3CA在SNSCC病理发展中的作用,本研究通过免疫组织化学检测发现,SNSCC患者肿瘤组织中PIK3CA蛋白表达与肿瘤分化程度和临床分期有关,提示高表达的PIK3CA可促进SNSCC病理进展,相关机制可能是PIK3CA对癌细胞的增殖和侵袭具有促进作用。WU等[18]研究发现,单独应用PI3K抑制剂(LY294002)可降低白细胞介素(IL)-11介导的人舌鳞癌细胞的侵袭和迁移能力。此外,本研究发现原发于鼻窦的鳞状细胞癌组织中PIK3CA及p-AKT蛋白阳性表达率更高,可能因为不同于原发鼻腔的SNSCC患者,原发于鼻窦内早期多无明显症状,门诊发现时多已处于中晚期。
细胞周期调控异常是恶性肿瘤发生的关键,而PTEN可参与调节细胞间期及分裂期,在致瘤性转化进程中扮演了关键角色[19]。细胞质中的PTEN可通过其脂质磷酸酶活性拮抗PI3K/AKT/mTOR信号通路,使细胞停滞在G1期,抑制其存活及增殖等[20]。有研究[21-22]提出,PTEN在细胞核中也存在,且在保持基因组的稳定性、DNA的错配修复和肿瘤抑制功能中发挥主要作用。PTEN蛋白异常表达与PTEN基因突变、缺失和甲基化等密切相关,大多数研究表明,突变是其低表达的根本原因[23]。李玉兰等[24]研究表明,miR-144-3p可通过抑制PTEN促进PI3K/AKT信号通路活化,诱导口腔鳞癌细胞的恶性发展。还有研究发现,PTEN是PI3K/AKT信号通路的主要负性调节因子,miR-96-5p上调可通过直接靶点PTEN促进HNSCC细胞的迁移和化疗耐药性[25]。本研究结果显示,PTEN蛋白在SNSCC组织中阳性表达率明显低于正常下鼻甲黏膜组织,由此推测SNSCC中PTEN缺失,可能导致PI3K/AKT/mTOR信号通路的过度激活,进而促进SNSCC的发生、发展。此外,本研究未得出PTEN蛋白表达与SNSCC患者的临床病理特征间存在关系,这与冯钦等[26]在口腔鳞状细胞癌中的研究结果一致。其原因可能是PTEN蛋白缺失是SNSCC发生过程中的晚期分子事件,或是样本量较小,急需增加样本量后进一步研究。
PIK3CA和PTEN的突变可能是HNSCC的始动因素[16]。有研究显示,肿瘤中PIK3CA与PTEN蛋白表达有关[27]。本研究发现,PIK3CA和PTEN蛋白表达在SNSCC组织中呈负相关,对此作者有两种猜想:(1)PIK3CA激活和PTEN缺失共存的SNSCC中,PI3K/AKT/mTOR信号通路传导效率可明显增强[20];(2)随着SNSCC的发展,PTEN表达下调可延缓PI3K/AKT/mTOR信号通路传导效率的衰减。生存分析显示,PIK3CA蛋白阳性表达患者的中位生存期明显低于阴性表达患者,进一步验证了高表达的PIK3CA在SNSCC发展过程中的作用。温菲菲等[28]对食管鳞状细胞癌的研究显示,PIK3CA是其预后的独立危险因素。本研究中,尚未发现PTEN与SNSCC患者预后存在统计学差异,这可能与人乳头瘤病毒(HPV)的感染状态有关,有研究[29]发现,HPV阴性的肿瘤中PTEN缺失更为常见。此外,COCHICHO等[30]发现,联合HPV感染情况及PIK3CA表达状态对HNSCC患者进行分层诊疗,将能更准确预测预后。
SNSCC病例本身较为罕见,且受限于治疗方法,目前收集到的新鲜标本有限,仅采用免疫组织化学检测组织中PIK3CA、p-AKT及PTEN蛋白表达,今后将增加分子生物学实验,通过PCR技术等进一步研究具体机制。PIK3CA、p-AKT及PTEN蛋白在SNSCC中的差异化表达可作为新型细胞因子区分肿瘤与正常组织,有助于早期发现与诊疗;PIK3CA及p-AKT蛋白在辅助判断肿瘤的进展程度及预后也有一定价值。PI3K/AKT/mTOR信号通路虽与SNSCC的发生、发展相关,但其在肿瘤发生过程中的具体机制仍需深入探索与研究,以期为SNSCC个体化精准治疗提供更全面的理论依据。
