降调节+激素替代周期内膜准备方案在高龄女性冻融胚胎移植中的应用结局
2024-02-02王晓燕杨晨曦阿艳妮
王晓燕,杨晨曦,赵 燕,阿艳妮
(青岛大学附属妇女儿童医院:1.生殖医学中心;2.妇科,山东青岛 266011)
随着生育年龄的延迟及国家生育政策的放开,高龄女性在冻胚移植人群中的占比越来越高,但高龄女性有如下特点:(1)周期缩短,面临着内膜与胚胎不同步的弊端,导致内膜容受性下降,临床妊娠率不高[1];(2)排卵提前,甚至月经期即有优势卵泡的发育而导致较高的周期取消率[2]。因此,最初临床多选择激素替代周期(hormone replacement therapy,HRT)准备内膜,但随着HRT的逐渐应用,出现了以下问题:(1)单纯在早卵泡期添加外源性雌激素无法保证垂体被完全抑制,可能有卵泡的发育,导致子宫内膜的种植窗提前[3];(2)卵泡期雌激素浓度的上升可正反馈诱发内源性早发黄体生成素(luteinizing hormone,LH)峰,从而影响子宫内膜微环境状态,降低子宫内膜容受性[4]。目前,越来越多的学者开始探讨高龄女性最佳的冻胚移植方案。本研究比较了高龄患者采用HRT与降调节+HRT的临床效果,试图选择一种妊娠率更高、并发症更少的治疗方案,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2020年6月至2022年6月在本院行冻胚移植患者的临床资料。纳入标准:(1)年龄≥35岁;(2)采用促性腺激素释放激素类似物(gonadotropin-releasing hormone analogue,GnRHa)降调节+HRT(GnRHa+HRT)方案或HRT方案。排除标准:(1)合并生殖系统器质性疾病,如子宫内膜息肉、子宫肌瘤、子宫内膜异位症、卵巢囊肿、输卵管积水、宫腔粘连、子宫腺肌病等;(2)合并严重内、外科疾病;(3)甲状腺功能异常;(4)夫妇任何一方的染色体异常。本研究共纳入患者329例,按照内膜准备方案分为GnRHa+HRT组(A组,n=149)和HRT组(B组,n=180)。再将A、B组按年龄分为两个亚组:A组中年龄35~<40岁者纳入A1组(n=101),≥40岁者纳入A2组(n=48);B组中年龄35~<40岁者纳入B1组(n=99),≥40岁者纳入B2组(n=81)。本研究经本院伦理委员会审核通过(批准号:QFELL-YJ-2023-103),所有受试者均知情同意。
1.2 方法
1.2.1不同子宫内膜准备方案
HRT:于月经第2~3天,超声及内分泌检查正常后给予口服戊酸雌二醇4~8 mg/d(拜尔医药保健有限公司广州分公司),递增或恒量口服,服用戊酸雌二醇12 d及以上、子宫内膜厚度≥7 mm时给予地屈孕酮(荷兰雅培公司)20 mg口服(2次/d),雪诺酮(德国默克雪兰诺公司)90 mg入阴转化内膜(1次/d),在转化内膜的第4天给予移植第3天(D3)卵裂期胚胎。
GnRHa+HRT:月经来潮第2~3天注射长效GnRHa制剂注射用醋酸亮丙瑞林微球(上海丽珠制药有限公司)3.75 mg,注射后28~30 d开始口服戊酸雌二醇,后续同HRT。
1.2.2子宫内膜厚度及血流测定
在内膜转化日测量子宫内膜厚度及子宫内膜血流。内膜厚度为超声固定于子宫最大纵切面测量3次内膜厚度后取平均值。内膜血流分型采用Applebaum分型[5]法:Ⅰ型,血管穿过内膜外侧低回声带,但未达到内膜高回声外边缘;Ⅱ型,血管穿过内膜高回声外边缘,但未进入内膜低回声区;Ⅲ型,血管进入内膜低回声区。
1.2.3胚胎解冻与移植
采用常规玻璃化冷冻方法,Edwards标准进行胚胎评分。选择复苏后卵裂球存活50%以上的4~8细胞的Ⅰ~Ⅱ级胚胎进行移植。所有移植均在超声引导下进行,移植位置位于距宫底0.5~1.0 cm处,采用COOK移植管,专人完成移植。
1.2.4妊娠结局
胚胎移植后14 d查血β-人绒毛膜促性腺激素(β-human chorionic gonadotrophin,β-HCG)>5 IU/L则继续给予黄体支持。移植后35 d如超声提示宫腔内见妊娠囊及原始心管搏动确定为临床妊娠,继续给予黄体支持直至孕12周。
1.2.5观察指标及临床结局
观察患者的基础情况、内膜转化日情况及临床结局。优质卵裂期胚胎判定标准:7~8细胞、碎片程度<10%的D3胚胎。记录胚胎种植率(孕囊数/移植胚胎数×100%)、临床妊娠率(临床妊娠周期数/移植周期数×100%)、早期流产率(12周前流产周期数/临床妊娠周期数×100%)。
1.3 统计学处理

2 结 果
2.1 两组一般资料比较
两组年龄、不孕年限、BMI、血清抗苗勒氏管激素(AMH)水平,以及血清雌二醇、孕酮、卵泡刺激素(FSH)、黄体生成素(LH)、泌乳素及睾酮等基础性激素水平比较,差异均无统计学意义(P>0.05),见表1。

表1 两组一般资料比较[M(Q1,Q3)]
2.2 两组转化日及移植日情况比较
A组转化日血清雌二醇、LH水平均低于B组,转化日内膜厚度、内膜厚度≥8 mm患者比例、Ⅲ型血流内膜患者比例均高于B组,差异有统计学意义(P<0.05);两组移植胚胎数、移植优胚数均无明显差异(P>0.05),见表2。

表2 两组内膜转化日及移植日情况比较
2.3 两组临床结局比较
A组移植胚胎数、临床妊娠周期数分别为231、69,B组分别为278、64。A组临床妊娠率(46.31%vs.35.56%)和临床种植率(33.33%vs.25.18%)明显高于B组(P<0.05);两组早期流产率无明显差异(P>0.05),见表3。
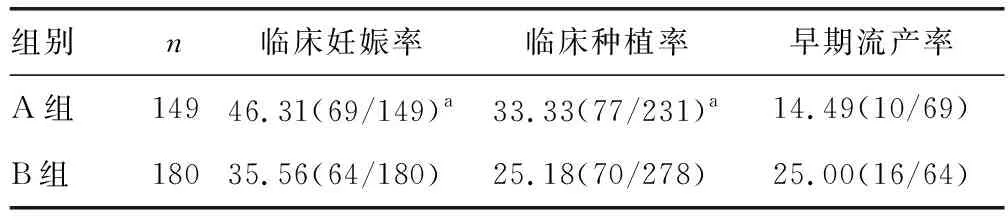
表3 两组临床结局比较[%(n/n)]
2.4 年龄亚组临床结局比较
A1、A2组移植胚胎数分别为147、84,B1、B2组分别为149、129。A1组临床妊娠率和临床种植率均高于B1组,但差异无统计学意义(P>0.05),见表4;A2组临床妊娠率(35.42%vs.18.52%)和临床种植率(21.43%vs.12.40%)均明显高于B2组(P<0.05),见表5。

表4 35~<40岁亚组临床结局比较[%(n/n)]

表5 ≥40岁亚组临床结局比较[%(n/n)]
3 讨 论
随着国家生育政策的放开,越来越多的高龄人群采用辅助生殖技术助孕。调查显示,目前生育二胎的目标人群中,>35岁妇女占60%以上[6],而由于其卵巢功能减退,这部分人群采用个体化的促排卵方案,面临着更高的全胚冻存比例,进而导致冻胚移植周期在临床上占有越来越高的比例。目前常用的冻胚移植方案有自然周期、HRT、GnRHa+HRT、微刺激周期等。既往研究认为,月经周期规律、有自发排卵的患者采用自然周期准备内膜[7],排卵障碍的患者采用HRT[8],而子宫内膜异位症及子宫腺肌病[9]的患者更适合采用降调节+HRT方案。如何提高高龄患者冻胚移植的妊娠率成为越来越多临床工作者关注的重点。在临床工作中,作者发现高龄患者存在周期缩短、排卵提前,甚至月经期即有优势卵泡发育的特点,因此高龄患者应用自然周期会面临着较高的周期取消率[2-3],而应用HRT面临着垂体未完全抑制、早发LH峰等内膜容受性差的问题。随着研究的进一步深入,发现相比自然周期和HRT,降调节方案可以从多个途径增加高龄女性的子宫内膜容受性,改善妊娠结局。
目前已有较多研究表明,高雌激素、高LH对内膜容受性产生不良影响。有学者认为,子宫内膜暴露在高雌激素水平下会降低内膜容受性,影响胚胎着床[10]。FRITZ等[11]发现,雌激素水平>330 pg/mL不利于胚胎着床及妊娠维持。GROENEWOUD等[7]研究发现,HRT过程中使用外源性的雌激素可以对下丘脑-垂体-卵巢轴产生正反馈作用,诱发早发LH峰,降低子宫内膜容受性,影响妊娠结局。万玉婷等[12]发现,>35岁的高龄女性冻融胚胎移植周期,LH水平为1.51~10.4 IU/L可获得较高的妊娠率,>10.4 IU/L时妊娠率降低。GnRHa是促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)类似物,应用GnRHa后其以对受体的高亲和力持续占据垂体GnRH受体,抑制下丘脑-垂体-卵巢轴,降低体内性激素水平[13]。本研究也发现,应用GnRHa进行垂体降调节后可以明显降低内膜转化日的雌二醇及LH水平,提高了临床妊娠率及临床种植率,推测其可以防止早发LH峰出现,以避免内膜过早转化,促进子宫内膜与胚胎的同步发育,从而改善妊娠结局,与郝翊等[14]的结论一致。
成功的妊娠需要高种植潜力的胚胎及良好的子宫内膜容受性,目前子宫内膜厚度及子宫内膜血流均是评价子宫内膜容受性最简便、常用的指标,适合着床的最佳子宫内膜厚度为 9~11 mm。研究认为,内膜厚度≤7 mm可称为薄型子宫内膜。薄型子宫内膜与低妊娠率、低活产率[15]相关。本研究证实,采用GnRHa+HRT方案的A组转化日内膜厚度为10.0(9.0,11.8)mm,高于单纯采用HRT方案的B组;并且,转化日内膜厚度≥8 mm患者比例也明显高于B组,与李赛姣等[16]、陈海啸等[17]的研究结论一致。研究表明,子宫内膜血流灌注是一种更加准确的评价子宫内膜容受性的非侵入性方法,对子宫内膜容受性有一定的预测价值[5,18]。本研究结果提示,应用GnRHa后,转化日Ⅲ型血流内膜患者比例也明显升高,与郝翊等[14]研究结论一致。推测降调节方案可以从提高内膜厚度、改善内膜血流方面改善临床结局,其作用机制可能是GnRHa直接作用于子宫内膜,使其分泌的GnRH-1和GnRH-2增加,与子宫内膜的GnRH受体结合,从而提高了子宫内膜容受性[19]。
子宫内膜异位症及子宫腺肌病的早期病变需要通过腹腔镜手术才能被发现及诊断,因此,临床上存在部分患者具有潜在的盆腔子宫内膜异位病灶,尤其不孕患者的内膜异位症比例较高。孙小花等[20]研究也显示,GnRHa预处理患者的胚胎种植率明显高于接受HRT方案的患者,与本研究结果一致。推测降调节后妊娠结局之所以得到改善,可能是因为GnRHa对潜在子宫内膜异位症病灶和子宫内膜腺肌症发挥抑制作用,从而改善了盆腔环境,提高了妊娠率。
TASKIN等[21]研究发现,在给予GnRHa降调节后,子宫内膜活检发现子宫内膜胞饮突数目增加且治疗反应性增强,妊娠率提高。洪宇等[22]研究表明,给予GnRHa降调节后,子宫内膜整合素αVβ3的表达增加,其可以介导滋养层细胞与子宫内膜上皮细胞之间的相互作用,参与囊胚黏附,提高子宫内膜容受性。GnRHa还可以调节影响母胎界面免疫耐受的1型辅助性T体淋巴细胞/2型辅助性淋巴细胞(Th1/Th2)类细胞因子平衡,从而改善子宫内膜的容受性,利于胚胎种植[23]。本研究中采用GnRHa+HRT方案的A组临床妊娠率、临床种植率明显高于B组,可能与GnRHa通过上述途径对子宫内膜容受性的提高有关。与苏琼等[24]、王蕾等[25]、李赛姣等[16]的研究结论一致。
研究认为,40岁以上高龄女性实施胚胎移植妊娠率明显下降[26-27],因此本研究以女方年龄40岁为界限分为≥40岁及35~<40岁两个亚组分别进行妊娠结局分析,结果显示:年龄≥40岁的女性中,采用GnRHa+HRT方案者的临床妊娠率及临床种植率明显高于采用HRT方案者(P<0.05);而35~<40岁的女性中,采用GnRHa+HRT方案者的临床妊娠率及临床种植率虽高于采用HRT方案者,但差异无统计学意义(P>0.05),这提示≥40岁的女性应用GnRHa+HRT方案可能获益更多,但尚需进一步研究证实。
综上所述,降调节+HRT方案具有以下几个优势:(1)减少自发卵泡发育,降低周期取消率;(2)降低隐匿性LH峰的风险,使子宫内膜与胚胎的同步性更强;(3)通过对子宫内膜容受性的提高改善冻胚移植周期结局;(4)灵活安排胚胎移植时间。本研究也提示,在选择冻胚移植方案时推荐高龄患者使用妊娠结局更好的GnRHa+HRT方案,尤其对于年龄在≥40岁的女性,未来的工作中还将进一步研究其更深入的作用机制。
