RDW-SD、RPR和RLR对原发性胆汁性胆管炎肝硬化失代偿期的评估价值
2024-02-02黄秀香霍明思刘金艳李广丽叶迎宾吕广波党殿杰
黄秀香,霍明思,李 雪,刘金艳,李广丽,叶迎宾△,吕广波,党殿杰
(邯郸市传染病医院:1.肝病科;2.检验科;3.影像科,河北邯郸 056002)
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)的病理特征是以胆汁淤积为主,其严重程度随着病情的进展和病理分期程度增加而相应增加。同时,受到免疫功能变化的影响,部分患者还会出现肝硬化,严重者甚至会形成肝衰竭[1-2]。PBC患者多存在铁负荷和炎性应激,是造成红细胞分布宽度(red cell distribution width,RDW)升高及引起肝硬化的主要原因之一[3]。红细胞体积分布宽度标准差(red cell distribution width standard deviation,RDW-SD)与血小板比值(RDW-SD/platelet ratio,RPR)是用于诊断肝脏疾病患者病理学分期的指标[4],红细胞体积分布宽度标准差与淋巴细胞比值(RDW-SD/lymphocyte ratio,RLR)可以对肝硬化发展程度进行预判[5]。本研究探讨RDW-SD、RPR、RLR对PBC肝硬化失代偿期的评估价值。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年6月在本院就诊的PBC肝硬化患者68例,男12例,女56例;年龄35~78岁,平均(60.7±9.8)岁;代偿期36例,失代偿期32例。诊断均符合中华医学会肝病学分会制定的《原发性胆汁性胆管炎的诊断和治疗指南(2021)》[6]。纳入标准:(1)符合PBC临床诊断标准;(2)PBC肝硬化分组准确且血常规检测数据完整;(3)年龄>18岁。排除标准:(1)除外其他肝病,如自身免疫性肝炎、病毒性肝炎、非酒精性脂肪性肝病、肝癌、药物性肝损伤等;(2)合并严重的心血管系统、血液系统、免疫系统或内分泌系统异常;(3)合并感染。本研究通过医院伦理委员会审批(审批号20221518),患者及家属已签署知情同意书。
1.2 方法
PBC肝硬化患者在清晨空腹抽取静脉血2 mL,注入含有ETDA-K2的血常规真空管,充分颠倒混匀8~10次,采用Sysmex-900i全自动血常规分析仪进行检测,包括红细胞(red blood cell,RBC)、平均红细胞体积(mean corpuscular volume,MCV)、血红蛋白(hemoglobin,Hb)、红细胞比容(hematocrit,HCT)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin,MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、RDW-SD、白细胞(white blood cell count,WBC)、中性粒细胞绝对值(neutrophil,N#)、淋巴细胞绝对值(lymphocyte,L#)、血小板计数(platelet count,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板体积分布宽度(platelet volume distribution width,PDW),计算血小板与淋巴细胞比值(plateletto-to-lymphocyte ratio,PLR)、RPR、RLR。
1.3 统计学处理

2 结 果
2.1 基本情况
PBC肝硬化患者血常规指标检查结果见表1。
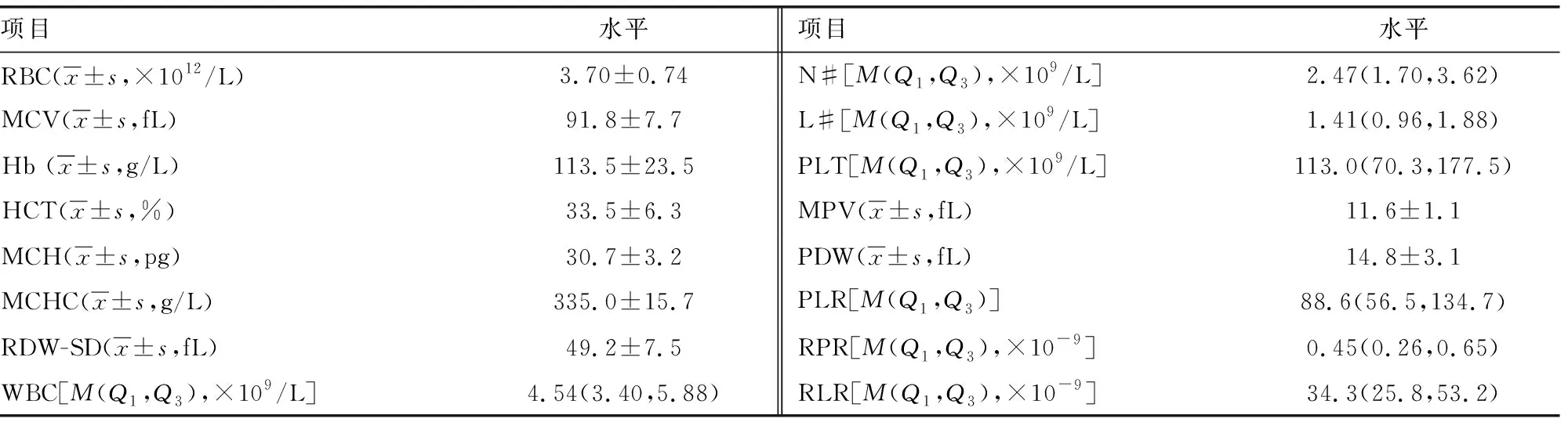
表1 PBC肝硬化患者血常规检查结果
2.2 单因素分析
两组患者年龄、RBC、Hb、HCT、RDW-SD、L#、PLT、RPR、RLR比较差异有统计学意义(P<0.05),见表2。

表2 两组患者临床资料的单因素分析
2.3 多因素分析
以PBC肝硬化患者是否为失代偿期作为因变量,将表2中P<0.05的变量作为自变量代入二元logistic回归方程。结果显示,年龄、RDW-SD及RLR是进展为PBC肝硬化失代偿期的独立影响因素(P<0.05),见表3。
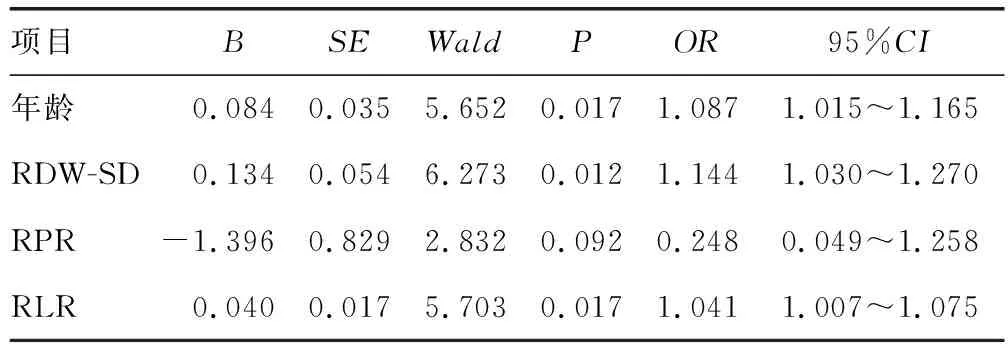
表3 二元logistic回归分析PBC肝硬化失代偿期的影响因素
2.4 RDW-SD、RPR和RLR诊断PBC肝硬化失代偿期的价值
ROC曲线分析显示,RDW-SD、RPR和RLR诊断PBC肝硬化失代偿期的曲线下面积(AUC)分别为0.726、0.778和0.798,诊断效能较高,见图1、表4。RDW-SD与RLR单独诊断差异无统计学意义(Z=0.761,P>0.05),RDW-SD与RPR单独诊断差异无统计学意义(Z=0.416,P>0.05),RLR与RPR单独诊断差异无统计学意义(Z=1.062,P>0.05)。
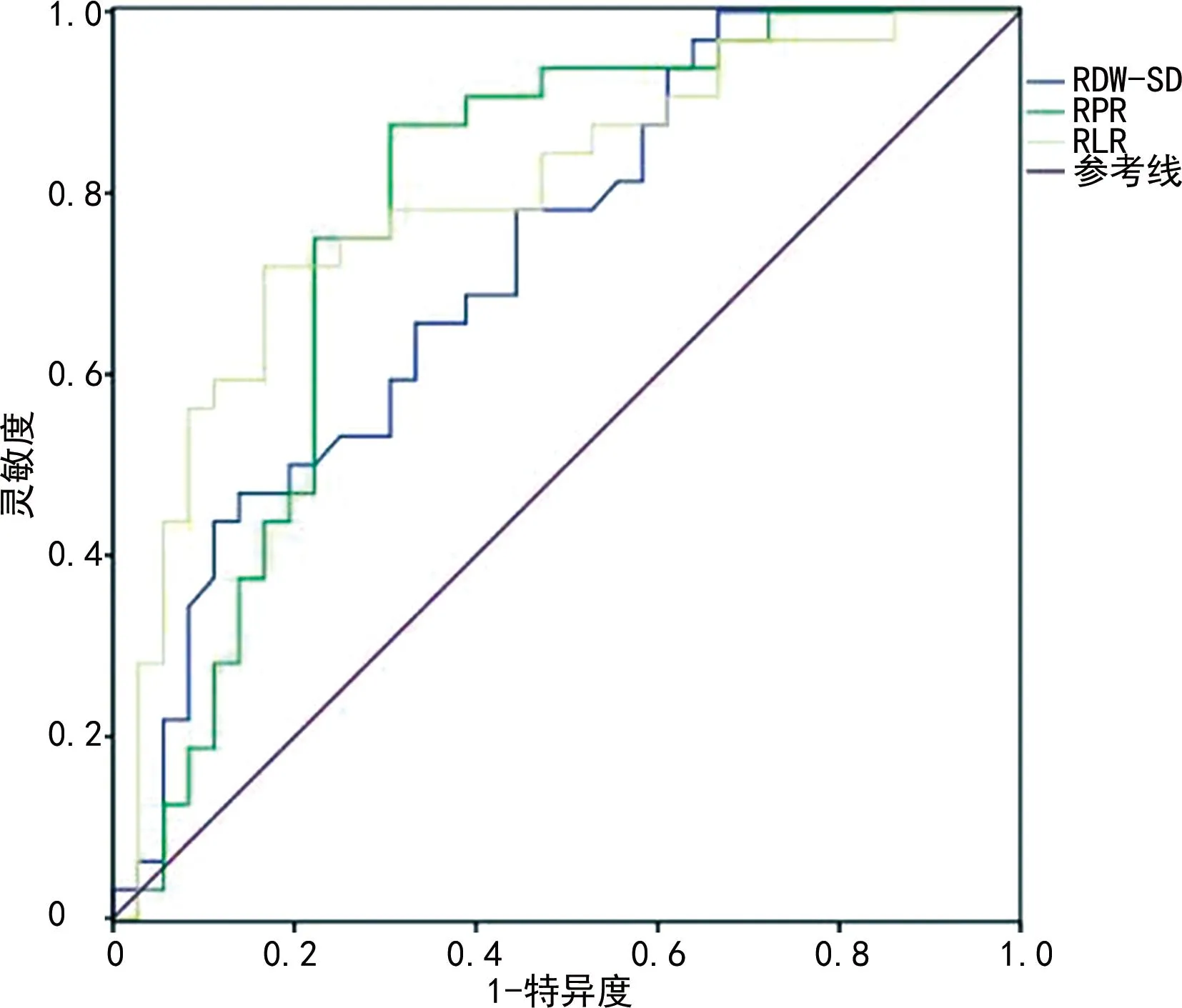
图1 RDW-SD、RPR和RLR诊断PBC失代偿期的ROC曲线
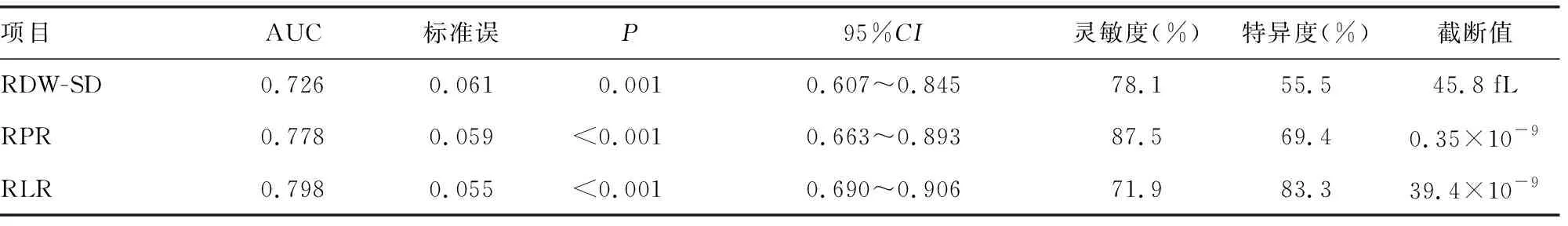
表4 RDW-SD、RPR和RLR对PBC肝硬化失代偿期的诊断效能
3 讨 论
由于肝硬化患者的脾功能亢进加速了红细胞的破坏,促使骨髓释放出更多的未成熟的网织红细胞进入外周血[7],引起RDW-SD升高。邓宝茹等[8]通过Scheuer分期分析发现,病理进展期(3、4期)的PBC肝硬化患者的RDW明显高于早期(1、2期)患者。 RDW-SD升高可能预示PBC患者进展为肝硬化,对PBC患者病情的恶性进展具有一定预测价值[9]。本研究结果显示,PBC肝硬化失代偿期的RDW-SD高于代偿期,RDW-SD是进展为失代偿期的独立影响因素;随着RDW-SD升高,PBC肝硬化代偿期患者发展为失代偿期的风险增高了14.4%。同时,RDW-SD诊断PBC肝硬化失代偿期的AUC为0.726,有较高的诊断价值,提示RDW-SD变化是PBC肝硬化失代偿期患者病程变化的重要指标。
与PBC肝硬化代偿期相比,失代偿期患者的PLT减少,其主要原因是肝硬化患者的肝脏合成和代谢功能降低,影响促血小板生成素(TPO)的产生[10]。本研究显示,PBC肝硬化失代偿期的RPR是代偿期的2倍(P<0.05),升高趋势相对明显,提示RPR随病情的严重程度增加而呈升高趋势。RPR可作为PBC患者组织学严重程度的无创有效预测指标[11]。二元logistic回归分析结果显示,RPR不是PBC肝硬化失代偿期的独立影响因素。可能原因是肝硬化失代偿期的患者样本量小,对统计分析有偏差,因此需要增加样本量来进一步验证。RPR诊断PBC肝硬化失代偿期的AUC为0.778,高于文献[8]报道的诊断进展期(Scheuer 3、4期)PBC的AUC(0.740),可能是绘制ROC曲线选择的参考对象不同所致;RPR诊断PBC肝硬化失代偿期的特异度为69.4%,低于文献[12]在诊断PBC肝硬化的81.6%,可能由于绘制ROC曲线时所选择的患者病程状况不同,导致其诊断效能有差异。但是这些差异并未影响RPR的升高对PBC病情发展趋势的研判,高RPR也可作为18个月死亡率的预后指标[13]。
RLR被应用于预测和评估乙型肝炎肝硬化[14]及肝硬化并发食管静脉曲张的程度[15]。有文献[16]报道乙型肝炎肝硬化并发食管静脉曲张患者RLR明显高于无食管静脉曲张患者,提示肝硬化病情进展加重RLR升高。本研究显示,PBC肝硬化失代偿期的RLR明显高于代偿期(P<0.01),提示RLR随着病程发展呈升高趋势,与上述文献报道一致。二元logistic回归分析结果显示,RLR是进展为PBC肝硬化失代偿期的独立影响因素,PBC代偿期患者的RLR逐渐升高,转变为失代偿期的风险增高4.1%;RLR诊断PBC肝硬化失代偿期的AUC为0.798,诊断效能较高。RLR具有可重复、易测量、成本低等特点,易在临床中运用[17]。RDW-SD、RPR、RLR的AUC无差别(P>0.05),说明对PBC肝硬化失代偿期的诊断价值接近。本研究结果证实年龄也是 PBC肝硬化失代偿期的独立影响因素,年龄每增长1岁,PBC肝硬化代偿期患者发展为失代偿期的风险就提升8.7%。
综上所述,临床中可以通过定期监测RDW-SD、RPR、RLR对患者进行病情发展预测,及时发现治疗反应欠佳的患者并调整治疗策略。
