牛诺瓦病毒和牛轮状病毒双重RAA-LFD快速检测方法的建立及应用
2024-02-01李惠惠董可儿刘馨博张春晓陈利苹马雪连
李惠惠,董可儿,刘馨博,张春晓,马 超,陈利苹,钟 旗,姚 刚*, 马雪连*
(1.新疆农业大学动物医学学院,乌鲁木齐 830052;2.动物保健与畜产品质量安全研究实验室,乌鲁木齐 830052; 3.乌鲁木齐市动物园,乌鲁木齐 830001;4.深圳市真瑞生物有限公司,深圳 518000; 5.新疆畜牧科学院兽医研究所,乌鲁木齐 830000)
犊牛腹泻是全球养牛业中一种常见的消化道疾病,以消化不良、腹泻、痢疾等为主要症状,极易造成犊牛生长发育不良、生长周期延长、继发感染甚至死亡,给牧场主造成巨大的经济损失[1-2]。病毒所致犊牛腹泻是最常见的因素之一[3]。牛诺瓦病毒(bovine norovirus, BNoV)是嵌杯病毒科、诺瓦病毒属的无囊膜单股正链RNA病毒[4]。1978年,首次在英国腹泻犊牛的粪便中被发现[5],2018年,首次在我国犊牛腹泻粪便中检测到[6],BNoV作为一种新发病原,尚未见关于重组酶介导等温扩增检测方法的报道。牛轮状病毒(bovine rotavirus, BRV)属于呼肠孤病毒科,轮状病毒属,是引起犊牛腹泻的主要病原之一,感染犊牛后引起的疾病具有发病率高、流行性广、危害性大等特点,严重影响我国养牛业的发展[7-8]。两者在临床中单凭症状很难区别,给临床诊断带来了极大的困难,且常有混合感染而加重腹泻严重度,造成死亡率增加[7,9]。
重组酶介导等温扩增(recombinase aided amplification, RAA)技术,利用重组酶、单链结合蛋白、聚合酶进行反应,是一种具有反应速度快、特异性强、灵敏度高的恒温扩增技术[10-11]。本研究基于RAA技术,结合侧流层析试纸条(lateral flow dipstick, LFD)对扩增产物进行可视化观察,同时检测BNoV和BRV,为有效防控BNoV和BRV提供技术支持。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 病毒基因组DNA/RNA提取试剂盒(天根生化科技有限公司),感受态细胞pEASY-T1(北京全式金生物技术有限公司),恒温快速扩增试剂盒(安普未来生物科技有限公司),天隆Gentier 48E实时荧光定量PCR仪(西安天隆科技有限公司),电热恒温水浴锅(上海尚普仪器设备有限公司)。
1.1.2 样品来源 BNoV、BRV、牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)、牛冠状病毒(bovine coronavirus, BCoV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus, IBRV)阳性样品采集自喀什、塔城等地区经本实验室收集、鉴定和保存。2022年从新疆博乐、喀什等地采集犊牛腹泻临床样本共计168份,样品放于-80 ℃保存。
1.2 方法
1.2.1 标准质粒的构建 选用NCBI中BNoV(登录号:OM991740)的RdRp和BRV(登录号:MN928486)的VP7基因序列,利用 DNAMAN 软件进行分析比对,选择高同源性的保守区域,利用NCBI Primer-BLAST数据库各设计1条引物,BNoV-F:5′-CCCAGATGGCCCTCTCAGTTCCA-AAGATCTCA-3′,BNoV-R:5′-TGTTCTCAATCCGGTCGCAA-3′;目的片段长度为1 254 bp,BRV-F:5′-GGCTTTAAAAGCGAGAATTTCC-3′,BRV-R:5′-GGTCACATCATACAACTCTAAT-3′,目的片段长度1 062 bp,由生工生物工程(上海)股份有限公司合成。PCR反应体系:上下游引物各0.5 μL,2×Easytaq PCR SuperMix 12.5 μL,Nuclease-free Water 9.5 μL,cDNA 2 μL。反应程序为94 ℃ 3 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min;琼脂糖凝胶电泳鉴定目的片段,纯化后连接到pEASY-T1载体,并计算出pEASY-BNoV和pEASY-BRV的拷贝数分别为5.27×1010和1.12×1010copies·μL-1。
1.2.2 引物探针的设计及筛选 利用NCBI Primer-BLAST数据库针对RdRp和BRV的VP7基因设计多条特异性引物,反应完成后,用2%琼脂糖凝胶电泳检测RAA产物,经多次试验筛选,最后选择了2组引物和探针用于后续试验。引物序列BNoV-F1:5′-CCCAGATGGCCCTCTCAGTTCCAAAGATCTCAG-3′,BNoV-R1:[5′-TAM]GTGAAATTCTGGGACTGCCCTATTCCAGGGTTG-3′,BNoV-P:[5′FAM]GGGCGA-GAGGTGGCCGTACGCCTCAATGACT[THF]GTAACTGCTACACTTTC[3′C3spacer],片段长度为272 bp;BRV-F1:5′-GTTCCTCTTGCACAGTCAAAGTGTGTCCATTAAA-3′,BRV-R1:[5′-biotin]CAGCTGTGATGTCTAAAACGTTCGCACCAC-CTAC-3′,BRV-P:[5′FAM]CGTT-TGAAACAGTTGCAACGACGGAGAAACT[THF]GTGATTACAGATGTTGT[3′C3spacer],片段长度为258 bp。
1.2.3 核酸提取 使用天根生化科技(北京)有限公司的病毒基因组RNA试剂盒提取BNoV阳性样本和BRV阳性样本。将20 μL Proteinase K加入1.5 mL离心管中,并加入200 μL平衡至室温的肛拭子样品。加入200 μL Carrier RNA工作液,涡旋混匀15 s。56 ℃孵育15 min。加入250 μL的无水乙醇,涡旋振荡15 s,室温静置5 min。将离心管中的溶液全部转移至过滤柱,8 000 r·min-1离心1 min,弃废液。加500 μL缓冲液GD,8 000 r·min-1离心1 min,弃废液。加600 μL漂洗液PW,静置2 min,8 000 r·min-1离心1 min,弃废液。重复上一步骤进行二次漂洗。加500 μL无水乙醇,8 000 r·min-1离心1 min,弃废液。12 000 r·min-1将空的过滤柱离心3 min。将过滤柱放入1.5 mL的离心管中,室温放置3 min后,加入50 μL的RNase-Free ddH2O,室温静置5 min后,12 000 r·min-1离心1 min。保存于-80 ℃备用。
1.2.4 双重RAA-LFD反应体系的建立及优化 预试验反应体系为50 μL,其中C buffer 20 μL,L buffer 5 μL,P-core 12 μL,dNTPs(25 mmol·L-1)0.6 μL,上、下游引物和探针稀释至10 μmol·L-1,按照不同的配比进行引物探针浓度的筛选,N-core 0.6 μL,DNA 模板3.8 μL,ddH2O 0.9 μL最后加B buffer 2.5 μL。混合后离心,放入恒温设备中39 ℃孵育30 min。将10 μL RAA混合物加90 μL ddH2O混匀,吸取50 μL溶液直接滴加在样品垫上,10 min后观察质控线与检测线判读结果。当T1检测线出现时表示样品中含有BRV,当T2检测线出现时表示样品中含有BNoV。确定引物探针浓度后,以标准品为模板,选择不同的温度条件(37~42 ℃)和不同时间条件(5、10、15、20、25、30 min)进行反应,以确定最佳反应条件。
1.2.5 特异性试验 以质粒pEASY-BNoV(5.27×107copies·μL-1)、pEASY-BRV(1.12×107copies·μL-1),以及BCoV(4.13×107copies·μL-1)、BVDV(2.21×107copies·μL-1)、IBRV(3.20×107copies·μL-1)为模板进行RAA扩增,上样量均3.8 μL,LFD检测扩增结果,并用ddH2O为模板作为阴性对照,以确定本方法的特异性。
1.2.6 灵敏度和重复性分析 以构建的pEASY-BNoV和pEASY-BRV进行10倍比稀释,稀释度选择107、105、103、102、101copies·μL-1为模板进行双重RAA-LFD试验,使用pEASY-BNoV和pEASY-BRV(稀释度为107和105copies·μL-1)作为模板进行3次双重RAA-LFD试验,以ddH2O为模板作为阴性对照。
1.2.7 临床样品检测 采用建立的双重RAA-LFD方法与PCR、qPCR方法检测168份腹泻样本,并用ddH2O为模板作为阴性对照,以质粒标准品作阳性对照,比较3种检测方法的符合性。
2 结 果
2.1 反应体系和条件的优化
通过引物和探针的优化,确定BNoV上、下游引物(10 μmol·L-1)各1 μL,BRV上、下游引物(10 μmol·L-1)各2 μL,BNoV探针(10 μmol·L-1)0.3 μL,BRV探针(10 μmol·L-1)0.6 μL。结果显示,试验的最佳反应温度为39 ℃(图1A)。在最佳反应温度39 ℃的条件下,分别在5、10、15、20、25、30 min的不同反应时间进行扩增,结果显示,试验的最佳反应时间为15 min(图1B)。
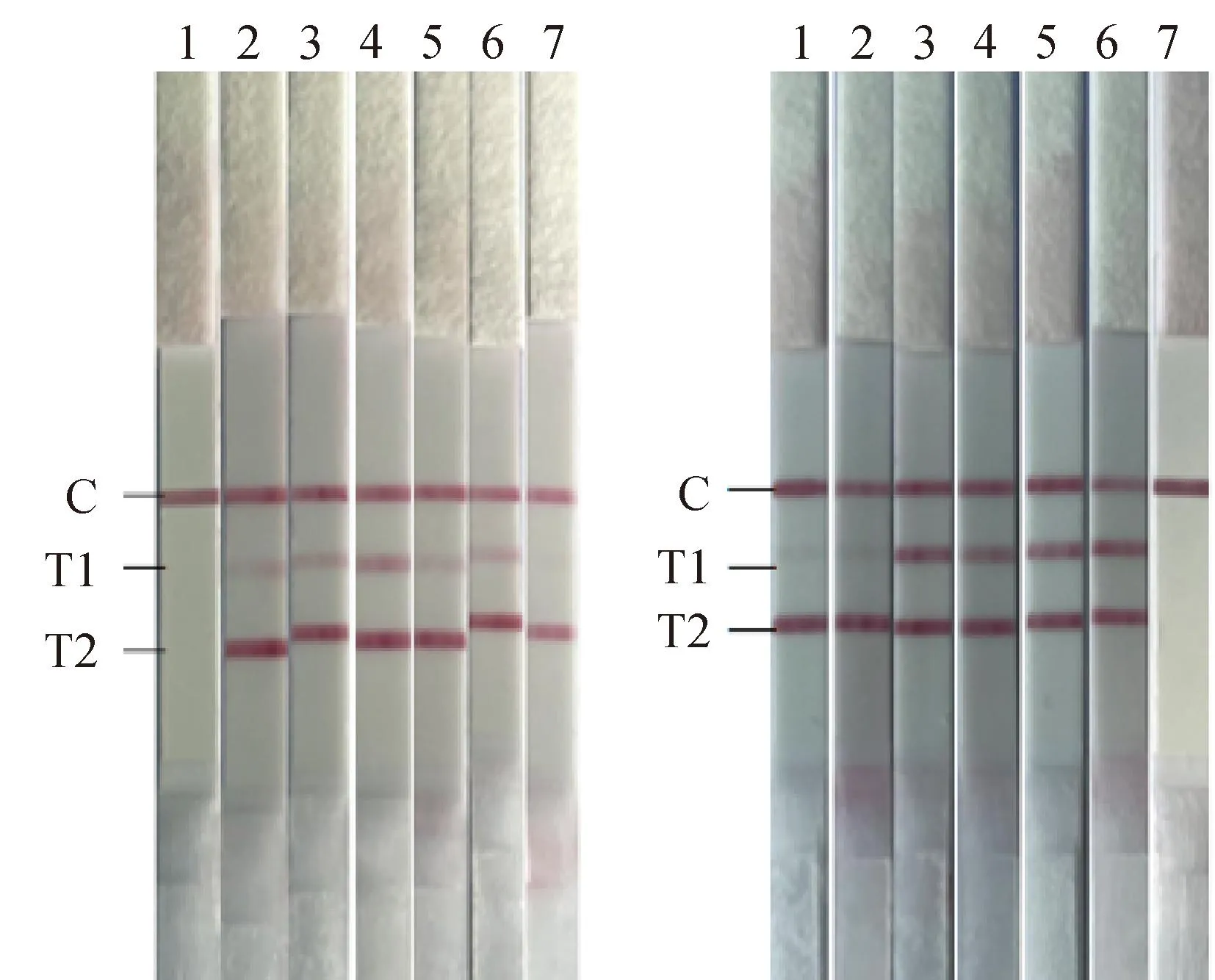
AB A. 反应温度的优化(1. 阴性对照;2. 37 ℃;3. 38 ℃;4. 39 ℃;5. 40 ℃;6. 41 ℃;7. 42 ℃);B. 反应时间的优化(1. 5 min;2. 10 min;3. 15 min;4. 20 min;5. 25 min;6. 30 min;7. 阴性对照) A. Optimization of reaction temperature (1. Negative control; 2. 37 ℃; 3. 38 ℃; 4. 39 ℃; 5. 40 ℃; 6. 41 ℃; 7. 42 ℃); B. Optimization of reaction time (1. 5 min; 2. 10 min; 3. 15 min; 4. 20 min; 5. 25 min; 6. 30 min; 7. Negative control)图1 RAA-LFD反应条件的优化Fig.1 Optimization of reaction conditions of RAA-LFD
2.2 特异性试验
双重RAA-LFD特异性试验结果使用侧流层析试纸条进行分析。结果显示(图2),只有加入了相应的病毒模板,试纸条检测线才会出现红色条带,未出现非特异性扩增,不存在交叉反应。

1. BNoV和BRV;2. BRV;3. BNoV;4. BCoV;5. BVDV;6. IBRV;7. 阴性对照 1. BNoV and BRV; 2. BRV; 3. BNoV; 4. BCoV; 5. BVDV; 6. IBRV; 7. Negative control图2 RAA-LFD的特异性试验Fig.2 Specificity test of RAA-LFD
2.3 敏感性及重复性试验
双重RAA-LFD敏感性及重复性试验结果使用侧流层析试纸条进行分析。结果表明(图3),BNoV和BRV的双重RAA-LFD的敏感性均为103copies·μL-1。BNoV和BRV标准品分别使用107、105copies·μL-1两个稀释度的阳性标准品为模板,结果表明(图4),该方法重复性良好。
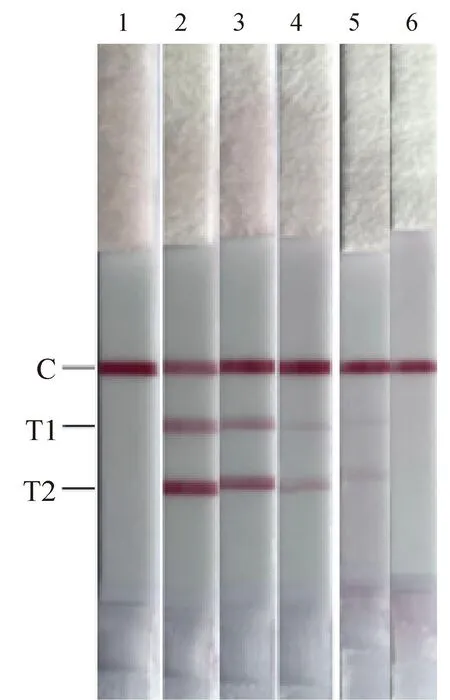
1. 阴性对照;2. 107 copies·μL-1;3. 105 copies·μL-1;4. 103 copies·μL-1;5. 102 copies·μL-1;6. 101 copies·μL-1 1. Negative control; 2. 107 copies·μL-1; 3. 105 copies·μL-1; 4. 103 copies·μL-1; 5. 102 copies·μL-1; 6. 101 copies·μL-1图3 RAA-LFD的敏感性试验Fig.3 Sensitivity test of RAA-LFD
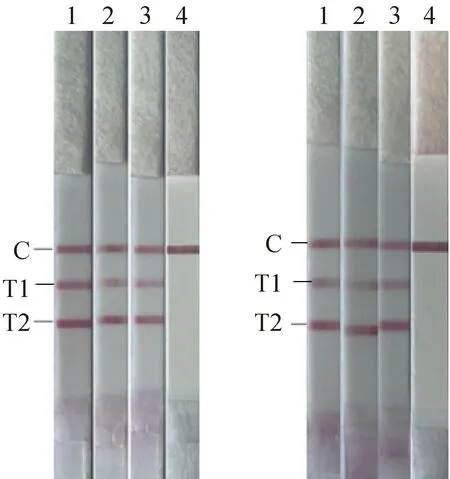
AB A. 质粒拷贝数为107 copies·μL-1 (1~3. 质粒样品;4. 阴性对照);B. 质粒拷贝数为105 copies·μL-1 (1~3. 质粒样品;4. 阴性对照) A. The copy number of plasmids was 107 copies·μL-1 (1-3. Plasmids samples; 4. Negative control); B. The copy number of plasmids was 105 copies·μL-1 (1-3. Plasmids samples; 4. Negative control)图4 RAA-LFD的重复性试验Fig.4 Repeatability test of RAA-LFD
2.4 双重RAA-LFD临床样本检测
用建立的双重RAA-LFD方法检测从牛场采集的腹泻样品168份,使用PCR和qPCR法分别检出BNoV阳性样本70、85份,检出BRV阳性样本40、71份,使用双重RAA-LFD法检出BNoV阳性样本82份,检出BRV阳性样本41份,利用PCR方法和双重RAA-LFD法检测BNoV的阳性符合率为98.57%,阴性符合率为87.86%,总符合率为92.26%;检测BRV阳性符合率为85.00%,阴性符合率为94.53%,总符合率为92.26%;利用qPCR方法和双重RAA-LFD法检测BNoV的阳性符合率为91.76%,阴性符合率为96.39%,总符合率为94.05%;检测BRV阳性符合率为52.11%,阴性符合率为95.88%,总符合率为77.38%;表明本研究建立的双重RAA-LFD方法可用于临床样品检测。
3 讨 论
BNoV和BRV在一些国家和地区的牛群中广泛存在,感染会引起犊牛腹泻导致严重脱水,并可能继发感染加重疾病的严重程度[12],病毒性病原感染导致腹泻较为严重。孙吉等[13]对川西北草原的220份犊牛腹泻样进行检测,BNoV的检出率为5.9%,BRV的检出率高达40.5%,吴静等[14]调查新疆喀什地区犊牛腹泻情况,BNoV检出率为25.07%,BRV检出率9.37%,其混合感染率为24%。在新疆地区,牛群养殖规模不断扩大,病毒混合感染情况较为严重,单一病原诊断多耗时耗力,故需寻找针对多病原诊断且快速简便的方法。常用的病毒鉴定方法如PCR、qPCR和ELISA等在病毒检测中准确、可靠,但由于过程耗时,操作繁琐,无法实现基层腹泻样本的快速检测,因此本试验建立了一种可视化双重RAA-LFD快速检测方法。
RAA是具有我国自主知识产权的等温核酸扩增技术,可在恒温下快速高效地扩增DNA序列,结合LFD可肉眼观察扩增结果,不需要热循环器,只需要一个水浴锅就可以进行RAA反应[15-16],与PCR、qPCR、ELISA、常规病毒分离和LAMP等方法相比,RAA技术最大的优势在于检测时间短[17],后来旺等[18]根据金黄色葡萄球菌的保守基因(nuc)建立RAA-LFD法,20 min即可检测。王姝等[19]建立了现场快速检测鲤疱疹病毒II型的RAA-LFD法,比RT-PCR法灵敏度高出10倍,该方法可在10 min看到目的片段的有效扩增,由此可见,RAA-LFD方法在细菌和病毒方面的快速检测已经全面发展。且RAA技术因其扩增效率高、对设备要求低以及操作简便等特点,在病原检测方面极具优势。近年来,越来越多的研究者开始关注双重荧光RAA检测方法的建立,吴江等[20]根据猪圆环病毒2型和3型的Cap基因建立了双重荧光RAA检测方法,周冬根等[21]建立了检测汉坦病毒的双重荧光RT-RAA技术。但关于同时检测两种病毒的RAA-LFD方法报道较少,且针对BNoV和BRV同时检测尚未见报道。
本试验在重组质粒标准品的基础上建立了同时检测BNoV和BRV的双重RAA-LFD方法。最佳检测时间为20 min,后来旺等[18]检测金黄色葡萄球菌最短时间为20 min,说明了其快速检测的特点;最佳的检测温度为39 ℃,与邓春冉等[22]建立的鸭星状病毒RT-RAA方法优化温度结果一致;且与BCoV、BVDV和IBRV无交叉反应,最低检测限均为103copies·μL-1,可以看出此方法特异性较好;在临床样本检测中,阳性样本符合率较高,且检出阳性样本数与PCR的检测结果基本一致。临床样品检测结果也提示,BNoV在新疆犊牛腹泻中感染率较高,需要持续关注BNoV的流行及其带来的危害。
4 结 论
本研究应用RAA-LFD技术构建了对BNoV和BRV两种病毒的快速诊断方法,经过灵敏性、特异性及重复性试验,验证其在39 ℃恒温条件下20 min内可以检出,为基层地区快速检测提供了可能性,为犊牛腹泻流行的地区快速筛查、诊断和监测提供了便利工具,有利于病毒感染早期诊断,及时治疗,具有良好的应用前景。
