热应激对雄性哺乳动物生殖机能影响的研究
2024-02-01肖艺梅王胜男许悦雯何晓琳尹福泉
肖艺梅,王胜男,许悦雯,何晓琳,尹福泉
(广东海洋大学滨海农学院,湛江 524088)
炎热的环境条件可能会对动物的繁殖力产生不利影响,当调节体温的正常生理机制无法维持动物体温的相对恒定时,动物就会产生热应激(heat stress,HS)[1]。睾丸作为雄性动物产生精子和分泌雄激素的重要器官,其温度通常需要保持在低于核心体温2~7 ℃[2]。绝大多数哺乳动物的睾丸位于体腔外部以确保正常精子的产生,当哺乳动物未能保持睾丸温度时会损害精子发生,并且对精子活力、形态和生育能力产生有害影响,其受影响的严重程度与热暴露的强度、频率和持续时间有关[3-4]。本文旨在综述睾丸的温度调节机制、HS对睾丸细胞的影响、HS对精子质量的影响,以期为HS对哺乳动物雄性生殖的不利影响研究提供参考。
1 睾丸温度调节机制
影响睾丸温度调节的主要因素有阴囊结构、肌肉活动以及热交换机制。从生理结构上来看,阴囊具有皮肤薄、皮下脂肪少、汗腺密集等特点。这些阴囊结构特性使睾丸可以通过脉动的方式释放汗液,而汗液的蒸发可以促进睾丸冷却。在公牛和公羊中,阴囊汗腺受交感肾上腺素能神经支配并受肾上腺激素影响[5-6]。此外,当动物处于较高温度时,其阴囊内层的内膜肌与精索中的提睾肌松弛,使睾丸远离核心躯体并通过调节阴囊表面积来帮助睾丸降温[7]。睾丸温度的热交换机制也有利于睾丸温度的维持,当睾丸内的静脉血流经阴囊皮肤表层时,会迅速散去热量,使静脉血液处于较低温度,当温度较高的动脉血进入睾丸前,会通过精索静脉丛与低温的静脉血进行热量交换,使进入睾丸的动脉血降温,维持睾丸内温度稳定[8]。通过这3种睾丸体温调节机制的协同作用,共同维持适宜、稳定的睾丸温度,保障雄性动物正常的繁殖机能。
2 热应激对睾丸细胞的影响
目前,HS对哺乳动物睾丸细胞的影响研究大多数都是基于啮齿动物实验模型和部分人类睾丸细胞试验,HS模型一般可分为两大类:整体热暴露(人工气候试验室)或睾丸局部热刺激(主要包含4种方式:手术诱导隐睾、阴囊绝缘、阴囊短期水浴加热和睾丸微波辐射)[9]。尽管生殖细胞比支持细胞(sertoli cells,SCs)和间质细胞(leydig cell,LCs)对温度更加敏感,但无论采用何种HS模型,睾丸HS均会对所有类型的睾丸细胞造成不良影响[4],如氧化应激、细胞凋亡、DNA损伤、血睾屏障(blood-testis barrier,BTB)破坏、激素分泌紊乱等。
2.1 睾丸生殖细胞
精原干细胞(spermatogonial stem cells,SSCs)虽然会受到HS的影响,但很少引起SSCs凋亡,并能随着时间推移自动恢复,这也是夏季结束后公畜精液品质能够恢复的原因。Wang等[10]对体外培育的小鼠SSCs进行HS处理后(43 ℃,45 min)发现,HS改变了SSCs的蛋白折叠、蛋白定位和自我更新,显著抑制SSCs的增殖但并未引起SSCs的凋亡,并通过JAK-STAT 和PI3K-AKT信号通路参与HS处理后SSCs的S期细胞周期停滞。此外,HS还可以通过p53、核糖体和碳代谢通路参与SSCs分化抑制过程,导致SSCs分化相关基因c-kit、stra8、Rec8、Sycp3和Ovol1的表达下调[11]。相较于其他类型的生殖细胞,SSCs对HS的抗性在一定程度上有利于缓解HS对雄性动物生育力的不利影响,但尚不清楚是否还有其他信号通路为SSCs提供了抗HS的能力。
HS后细胞内活性氧(reactive oxygen species,ROS)水平显著升高,并且睾丸细胞内血红素氧合酶1 (heme oxygenase 1,HMOX1)和抗氧化酶,即谷胱甘肽过氧化物酶1(glutathione peroxidase1,GPX1)、谷胱甘肽S-转移酶α(glutathione S-transferase alpha,GSTA)和超氧化物歧化酶1 (superoxide dismutase 1,SOD1)发生显著上调,表明HS可诱导睾丸细胞发生强烈的氧化应激反应[12-13]。氧化应激是造成睾丸HS损伤的主要原因,对哺乳动物的精子发生具有非常不利的影响,并最终通过细胞凋亡或DNA损伤导致雄性动物亚不育或不育[14-15],其中粗线期精母细胞、圆形精细胞和附睾精子最易受影响[2,4]。在精子发生的过程中,生精细胞由于分裂频繁和缺乏SOD1,比其他类型的睾丸细胞更易受到HS损伤[16]。近期的研究发现,HS导致雄性不育的潜在机制可能是通过特异性钙通道干扰精子发生。Abd El-Emam等[17]对大鼠阴囊HS后发现(43 ℃,30 min,连续6 d对大鼠阴囊水浴加热),CatSper-1和CatSper-2的表达显著下调、类固醇生成调节因子3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)和促凋亡蛋白BAX(BCL2 associated X protein)的表达显著上调,进而触发生殖细胞凋亡。但其详细的作用机制还需要进一步研究。
2.1.1 氧化应激 ROS是具有至少一个不成对电子的氧分子,因此具有高度不稳定性,并且对脂质、氨基酸和核酸具有极高的活性[18]。HS诱导所产生的过量ROS对生殖细胞的凋亡和DNA损伤存在重要影响[19]。在HS诱导人类精子损伤模型中,HS所导致的精子质量降低与ROS增加和随后的脂质过氧化有关[20]。而精子脂质的过氧化会导致质膜完整性丧失、线粒体膜功能障碍、染色质降解,以及精子形态异常,最终影响精液质量[21]。此外,一些学者认为:睾丸温度升高会增加睾丸代谢和维持睾丸有氧代谢所需的氧消耗,而流向睾丸的血液不会随着睾丸温度的升高而增加,当睾丸血流不足以维持其氧合水平时,睾丸组织出现缺氧进而导致氧化应激,因此睾丸缺氧是HS诱导精子形态和功能改变的根本原因[22-23]。但是Rizzoto与Kastelic[24]近期研究发现,随着氧气浓度的减少,睾丸可以通过增加睾丸血流量和氧气摄取来维持睾丸组织氧气的输送和摄取,阻止了睾丸缺氧和无氧代谢。因此对HS引起的睾丸氧化应激提出了新的观点:睾丸温度升高伴有睾丸血流量增加,没有睾丸缺氧迹象。总之,对HS所引起的睾丸氧化应激的原因还有待进一步研究。
2.1.2 细胞凋亡 细胞凋亡包括外在途径(死亡受体Fas途径)和内在途径(线粒体途径或内质网途径),不同的刺激类型引起的细胞凋亡途径不同[25]。肿瘤抑制因子p53作为一种潜在的HS诱导生殖细胞凋亡因子,睾丸HS后其活性升高,并且可以激活两种不同的细胞凋亡机制:内在分子途径和外在分子途径[4,26-28]。以小鼠精母细胞凋亡为例(图1),内在分子凋亡途径涉及抗凋亡蛋白Bcl-2家族成员的激活,包括BAX对HS做出反应,在细胞内重新定位到近核区域并在线粒体中积累,而Bcl-2被磷酸化并失去活性。随后BAX整合到线粒体外膜,引起构象变化,并将细胞色素C(cytochrome C,Cyt-C)释放到细胞质中。Cyt-C与凋亡蛋白酶激活因子-1(apoptosis protease activating factor,Apaf-1)相互作用,形成激活caspase级联反应的复合物,触发细胞凋亡。在凋亡外在分子途径中,HS通过p53将死亡受体Fas与其配体Fas L连接起来,再通过招募Fas相关死亡结构域FADD形成复合物,该复合物与caspase-8启动子结合,触发caspase级联反应,最终触发细胞凋亡[15,28-31]。此外,HS还可以通过独立于p53信号外的其他途径,直接激活p38-MAPK信号通路来激活精母细胞凋亡[28]。
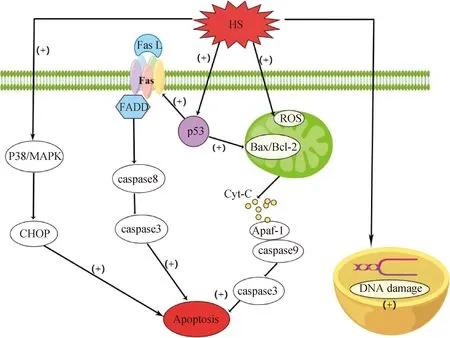
图1 小鼠精母细胞凋亡途径[15,28-31]Fig.1 Apoptosis pathway of mouse spermatocytes[15,28-31]
2.1.3 DNA损伤 DNA损伤也是HS诱导生殖细胞凋亡的原因之一[32]。有研究发现,对大鼠阴囊HS后(42 ℃,阴囊水浴加热30 min),粗线期和双线期的初级精母细胞在1 h内产生了染料嗜色性(伊红或阿尔新蓝),在2 h内,酸性磷酸酶和氨基肽酶反应发生变化,出现染色质丢失,并且30 h后仅有细胞质残留。在更严重的HS情况下(43 ℃,阴囊水浴加热1 h),会导致睾丸中游离酸性磷酸酶和蛋白酶的含量显著增加[33],加剧生殖细胞的DNA损伤。此外,在减数分裂过程中,HS还可引起性染色体的异常分离,导致不成对Y染色体的存在,从而引起精原细胞凋亡[34]。HS还可以影响子代的性别比例。研究发现,在轻度、频繁的HS模型条件下(连续5周,每周1次,39 ℃对小鼠阴囊水浴加热30 min),携带Y染色体的精子数量显著增加,导致子代性别比例改变[35]。许多DNA修复相关基因,如Ogg1(参与碱基切除修复)、Xpg(参与核苷酸切除修复)、Rad51和Rad54(参与双链断裂修复),在HS后受到抑制,最终抑制精母细胞复制和减数分裂,导致生殖损伤[28,36]。
2.2 睾丸体细胞
SCs和LCs主要功能分别为支持生殖细胞和产生睾酮(testosterone,T),为生殖细胞的发育提供适宜的环境。因此,它们功能的损伤可能会影响睾丸的生精功能。
2.2.1 支持细胞 SCs是高度特化的高柱状细胞,是生精上皮的主要支持细胞,为生精细胞的发育提供必要的营养和支持。SCs也是BTB的重要组成部分,当相邻的支持细胞相互接触时,通过各种细胞连接,如紧密连接、基底质外膜特化、桥粒和间隙连接形成BTB[2,28]。研究发现,对大鼠阴囊进行急性HS后(43 ℃,阴囊水浴加热16 min),第1周时SCs核体积减少,第2周时SCs特异性基因Inha和Cld11以及主要由SCs表达的其他BTB基因Gja1、Tjp1和Cldn3的表达下调[37],表明BTB受到了HS的干扰。BTB对精子发生非常重要,睾丸HS不仅破坏SCs的功能和形态[38],还能引起可逆的SCs去分化和BTB超微结构损伤,最终影响雄性生殖细胞的产生[27,39]。此外,HS还可以通过影响SCs的分泌功能与吞噬功能进而影响睾丸的精子发生。研究发现,睾丸HS后,SCs可通过旁分泌Fas诱导多余和受损的生殖细胞凋亡[40],进而利用吞噬功能清除凋亡的生精细胞,确保睾丸生精微环境的稳定[41]。Jin等[41]研究发现,受到凋亡生殖细胞产生的TNF-α调节的LMCD1(LIM and cysteine rich domains 1)启动子可通过NFAT1-Txina(nuclear factor of activated T cells 1/Txina)信号通路调控SCs的吞噬功能,并以STAT3蛋白依赖的方式被氧化应激所抑制。睾丸HS后产生的高水平ROS通过诱导SCs中的STAT3蛋白酪氨酸磷酸化,抑制LMCD1的表达,最终抑制SCs吞噬作用,破坏睾丸微环境内的脂质稳态,使睾丸生精功能受阻[41]。
2.2.2 间质细胞 LCs位于生精小管的睾丸间质部分,其主要功能为分泌T,受到下丘脑、垂体及其自身调节(图2)[42-46]。研究发现,HS后(43 ℃,阴囊水浴加热30 min),小鼠睾丸LCs中合成雄激素原料的脂质沉积显著增加,LCs出现细胞核皱缩,线粒体、内质网扩张,内嵴结构不清,数量减少,巨噬细胞浸润周围区域的现象,其中睾酮阳性细胞数目较对照组明显减少[47]。表明HS对LCs的数目、形态、功能、T分泌等均产生了不利影响,HS可能通过破坏LCs最终导致雄性不育。此外,HS还显著降低了类固醇合成酶和3β-HSD的表达水平。研究发现,对大鼠阴囊热处理(43 ℃,阴囊水浴加热15 min)后,几种关键的LCs特异性类固醇生成酶的基因表达下降(Cyp1la1、Hsd3b1和Hsd17b3),但大鼠血清和睾丸内的T水平却并未发生显著变化[37],这可能与类固醇生成的其他代偿性机制有关。而其他研究报告中HS引起血清T水平变化[47-48],可能与HS后LCs合成活性降低[47],以及类固醇生成蛋白StAR和P450c17的表达下降有关[49],致使类固醇生成受到抑制。总之,HS可导致LCs发生显著的功能变化以及类固醇生成基因表达减少,而类固醇生成的其他代偿性机制可以在一定程度上维持机体内T的正常水平,但还需要进一步的研究。
3 热应激对精子质量的影响
3.1 对精子的影响
研究发现,在不同环境条件下饲养的任何品种的公牛都可能发生HS,季节的变化会对公牛的精子质量产生影响。在轻度自然HS到中度自然HS情况下,精子DNA和精浆中的抗氧化剂会受到损伤,而重度自然HS则会导致精子的形态受到影响[1]。HS导致的精子受损,主要表现为质膜受损与受精能力下降、DNA缺陷与畸形精子增加、线粒体受损与精子活力下降、精子凋亡与精子数量下降[12]以及对精子质量的持续性影响。
3.1.1 质膜受损与受精能力下降 精子质膜在精子获能、顶体反应,以及与卵细胞表面结合中起着不可或缺的作用。精子获能是一种生理氧化应激状态,是精子成熟受精的前提,涉及质膜胆固醇的氧化排出、细胞内cAMP和Ca2+浓度增加以及酪氨酸磷酸化[50]。正常情况下,精子产生的大量ROS,是精子通过酪氨酸磷酸化的氧化还原作用与cAMP/PKA的肌动蛋白聚合来获能的主要途径[51]。由于精子质膜富含多不饱和脂酸,特别是二十二碳六烯酸和花生四烯酸,使其极易受到ROS诱导的氧化应激损伤,导致精子DNA片段化,出现细胞核空泡化以及精子形态异常的现象[52-53]。而HS诱导的精子线粒体ROS释放增加,会促使精子过度氧化应激进入“超获能”状态,并增加获能和顶体反应精子的比例[54],过早获能状态会缩短精子寿命,降低卵子受精率和胚胎发育率。
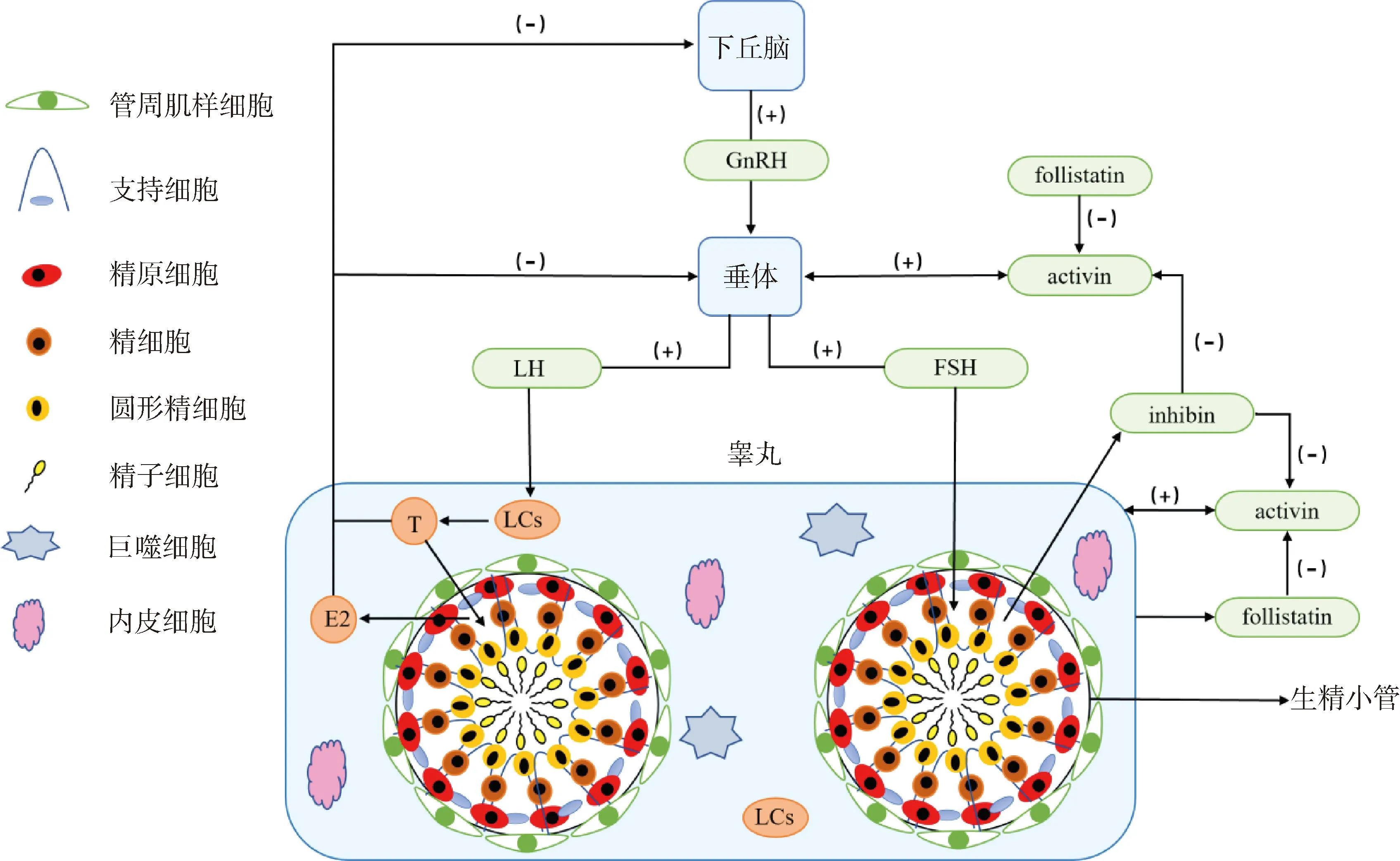
图2 下丘脑-垂体-睾丸轴控制人类睾丸功能[2, 42-46]Fig.2 The hypothalamic-pituitary-testicular axis controls human testicular function[2, 42-46]
3.1.2 DNA缺陷与畸形精子增加 施力光等[55]研究发现,在海南夏季持续性的自然HS条件下,会显著降低海南黑山羊种公羊精子密度,极显著地降低精子活力,极显著地增加精子的畸形率。畸形精子因其通常伴有精子DNA缺陷,是导致雄性不育的主要原因之一。HS后许多DNA修复的相关基因会受到抑制,并且精子在形成过程中丢失了大量与DNA修复相关的酶[56]。尽管附睾中的精子在HS时含有的是正确装配的DNA,但其DNA的完整性仍然受到了损害[32],致使HS引起的DNA损伤难以恢复。睾丸网和输精管中的精子选择性重吸收机制,可防止或减少受损精子在射精中出现的数量,但受损的DNA最终仍然会导致精液中畸形精子数量的增加[57]。
3.1.3 线粒体受损与精子活力下降 线粒体作为维持精子活力的关键细胞器,对精子超激活运动、获能、顶体反应、调控细胞凋亡及受精等多种生理过程起到重要的调节作用。精子线粒体在呼吸作用的过程中形成的高线粒体膜电位(mitochondrial membrane potential,MMP)与适当水平的ROS,对精子活力和受精率至关重要。Zhu等[58]研究发现,当精子在低水平葡萄糖培养基中孵育时,线粒体氧化磷酸化的效率增加,生成足够的ATP,同时ROS水平显著升高,导致精子前进运动性和直线运动速度显著降低,并且精子线粒体的基因表达系统mt-DNA、TFAM与POLRMT遭到破坏,ETC蛋白MT-ND1和MT-ND6损伤增加。此外,使用线粒体靶向抗氧化剂吡咯并喹啉醌二钠盐(pyrroloquinoline quinone disodium salt,PQQ)和辅酶Q10(Coenzyme Q10,CoQ10),可以显著增加精子线粒体基因表达系统的稳定性,降低精子线粒体ROS水平,减轻线粒体蛋白氧化应激所造成的损伤,提高MMP和ATP水平以及精子线性运动能力[58]。总之,HS诱导的过量ROS水平增加了精子线粒体蛋白损伤,影响ATP的产生,导致精子活力下降。
3.1.4 精子凋亡与精子数量下降 精子凋亡会引起精子数量下降,导致精液质量变差[59-60],又因其具有较少的细胞质体积,所以精子凋亡主要是通过线粒体途径诱导而不是细胞质途径[60]。如图1所示,通过Bcl-2蛋白家族或caspase 2可激活不可逆的精子凋亡过程,而Bcl-2可以通过抑制BAX在线粒体中积累,协同调控细胞凋亡。此外,抑制caspase 2可以阻断MAPK14的表达和一氧化氮合酶(nitric oxide synthase,NOS)的合成,保护细胞免受HS或激素的影响[25]。
3.1.5 对精子质量的持续性影响 哺乳动物的精子发生按节律进行,各级生精细胞在曲细精管内的排布具有显著的时空特异性,根据不同类型生殖细胞的排布,这种时间和空间特异性分别称为生精上皮周期和生精上皮波[61]。不同发育阶段的睾丸生殖细胞对HS的敏感性不同,在睾丸HS后、生精上皮彻底恢复前均会对所采集的精液质量产生不利影响,以及表现出对不同恢复阶段的精子形态、功能损伤的影响不同。研究发现,Angus公牛精子在HS终止后长达8周内都不能恢复正常(试验组公牛连续8 h整体热暴露于(35±1)℃,然后连续16 h暴露于(31±1)℃;对照组整体热暴露于(23±1)℃,HS处理后试验组与对照组连续8周均整体热暴露于(23±1)℃的温度控制室中),表现出HS对精子质量的持续性影响[62]。Garcia-Oliveros等[63]对Nellore公牛睾丸HS后发现(阴囊绝缘96 h):HS后0~7 d,精子主要表现为分离性头部缺陷和MMP降低;HS后14~42 d,主要表现为异常精子增加,精子活力、质膜完整性和MMP降低,出现脂质过氧化和DNA片段化的现象;HS后49~63 d,精子则主要表现为异常精子增加和MMP降低;直到HS后70~77 d,试验组与对照组之间的精子特征恢复相似,生精上皮恢复。
3.2 对精浆蛋白的影响
精浆(seminal plasma,SP)作为精液的液体部分,主要由副性腺的分泌物和来自睾丸与附睾的少量液体组成,具有促进精子成熟、为精子的代谢及运动提供营养和保护性环境、调节和控制精子获能状态等作用[64-65]。雄性动物生育力的差异,可能是由于SP的组分发生变化及其对精子和受精雌性造成的影响不同。精浆蛋白(seminal plasma protein,SPP)作为SP中比重最大的物质,因其存在某些具有物种间特异性的特殊蛋白质,可以作为体外评估家养哺乳动物生育力的潜在标记物[66]。这些特殊的蛋白标记不仅可以在使用前就甄选出高生育力的公畜,还能作为添加剂减少精子体外低温冻存所造成的损伤、提高人工授精后精子在雌性生殖道中的存活率[66-67]。
以公牛为例,许多研究已经证实,公牛SP中与生育力有关的SPP标记主要为BSPs蛋白家族(binder of sperm proteins,包括PDC-109、A3、BSP-30 ku,也分别称为BSP1、BSP3和BSP 5[68])。作为公牛精子获能的关键因素,BSPs蛋白家族由精囊分泌,约占牛SPP 50%~60%[69],可与精子质膜的胆碱磷脂结合,其作用具有两面性:一方面可以保护精子,避免质膜的游离磷脂运动,使精子成功运输至输卵管;另一方面可以刺激精子质膜的胆固醇和磷脂排出,并且能与获能因子高密度脂蛋白(high-density lipoproteins,HDL)和糖胺聚糖(glycosaminoglycans,GAGs)结合,促进获能因子诱导精子获能[70-71]。一般情况下,SP中低至中等水平的BSPs含量与精子生育力呈正相关,而高水平的BSPs则导致负相关。公牛精子与其SPP成分都容易受到阴囊绝缘的影响,并且可以检测到睾丸HS的SPP标记[72]。睾丸HS后,SP中BSPs的异常增加[69],可能会促使精子进入过早获能的状态,缩短精子的寿命,导致精子质量变差。对公羊阴囊绝缘8 d也观察到了类似的精囊蛋白(BSPs蛋白类似物,包括BSP1、BSP 5)在HS后增加的现象,并且其在SP中的表达变化与精液参数的变化一致[73]。由于HS直接作用于阴囊而不直接影响精囊,HS可能是通过影响LCs的T合成,进而影响副性腺的功能,导致BSPs分泌改变,最终影响精液参数,但还需要进一步的研究验证。
由于家畜SPP种类繁多、功能复杂且存在种间特异性,例如猪SPP中的PSP-1和PSP-2可介导子宫内免疫反应,并与猪精子的功能和生育力呈正相关,而AQN-3和SPMI则与精子生育力呈负相关[74-75]、公牛SPP中的SPADH1(spermadhesin-1,精子黏附素-1,也被称为酸性精液蛋白aSFP)和SPADH2(精子黏附素-Z13)与牛精子抗冷冻能力和冷冻精液生育力呈正相关[76]、公羊SPP中的ZAG含量与羊精子活力呈正相关,可作为羊精子保存效果鉴别的阴性标记[77]。目前对家畜SPP标记与精子功能之间的联系研究难点在于:如何对不同类型精液的SPP进行有效的分离、纯化、鉴别,并证实其对精子储存、精子生育力等的影响。如果能提取出有利于精子冷冻储存和生育力的SPP成分,或利用重组蛋白技术使其量产,那么可将其作为一种天然的精液稀释添加剂,用于补充夏季高温时节精液品质下降所导致的精液使用缺口,减少夏季高温对畜牧业生产的不利影响。总之对于如何将SPP规模化生产与应用,还需要未来进一步的研究解决。
4 热应激对精子的受精能力和支持胚胎发育的能力的影响
HS对雄性动物生育力的最直接影响体现在精子的受精能力和支持胚胎发育能力。前面已经提到,HS会造成精子DNA损伤,而DNA损伤会进一步抑制蛋白质的合成并损害染色质,这两者都与受精和胚胎发育不良有关[78]。由于常规精子质量检查不容易发现精子DNA损伤,即使精子表面正常,HS也会导致雄性动物的低生育力表现。Yaeram等[79]通过体外受精试验发现,HS后(小鼠整体热暴露,36 ℃,24 h),精子穿透透明带的速率和卵子受精率都发生了显著降低,并且受精后出现胚胎发育迟缓以及胚胎死亡率增加的现象。尽管卵母细胞DNA修复机制可以修复部分精子受损DNA片段,但是在大范围的精子DNA损伤的情况下,这种修复能力的作用可能会弱化,最终导致胚胎死亡[80]。Pea等[81-82]研究发现,引起母猪夏季季节性不孕现象及其所导致的相关生育力和胚胎存活率低的问题,可能与HS所诱导的公猪精子DNA损伤有关。公猪精子DNA损伤会引起对早期细胞谱系(如滋养外胚层)分化至关重要的关键发育基因的表达中断,致使卵裂率降低和胚泡形成减少,延迟胚胎发育或出现早期胚胎死亡现象,导致胚胎着床失败并最终流产[81-82]。绵羊的繁殖受到相对温和的HS水平(≥32 ℃)的影响,短期和长期整体暴露于热环境不仅会显著损害母羊的生育能力和繁殖力,还降低了公羊的精液产量和质量。在HS后的14~50 d进行交配,公羊的生育能力(以受精率和胚胎存活率衡量)出现降低,并且母羊与HS公羊交配,母羊的生育力也会受到影响[83]。这些缺陷反映HS可能是通过损伤精子DNA的完整性,进而影响雄性动物的生育能力。
5 结语与展望
作为雄性动物产生精子和分泌雄激素的重要器官,睾丸的温度调节对其正常生育能力的维持至关重要。HS诱导的睾丸细胞氧化应激、细胞凋亡、精子DNA损伤等一系列不良反应,抑制了精子发生并对LCs和SCs产生不利影响,进而影响精子质量以及精子的受精能力和支持胚胎发育的能力,最终导致雄性动物生育力下降。
因此在实际生产中,除了可以通过环境控制预防公畜HS外,还可根据睾丸HS的分子机制,针对性地制定有助于治疗雄性不育或亚不育的方法,降低HS对公畜生育力的不利影响。对于已经遭受热损伤的公畜,可根据HS后精子的恢复周期调整生产安排,或通过相应的药物干预,使公畜在夏季也能保持较好的生产力。SPP作为体外评估家畜生育力的潜在标记物,不仅可以在用前甄选高生育力公畜,还具有开发为精液稀释添加剂的潜能,但由于家畜SPP种类、功能繁多且存在种间特异性,目前还难以对其进行有效的开发和利用,因此家畜SPP的相关研究具有广阔的科研前景。
