帕利亚姆病毒实时荧光定量RT-PCR检测方法的建立与应用
2024-02-01李占鸿宋子昂李卓然廖德芳李华春
杨 恒,李占鸿,宋子昂,高 林,李卓然,廖德芳,肖 雷*,李华春*
(1.昆明学院农学与生命科学学院,昆明 650214;2.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病 重点实验室,昆明 650224;3.南京农业大学动物医学院,南京 210095)
帕利亚姆血清群病毒(Palyam virus, PALV)隶属呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus),广泛分布于世界范围的热带、亚热带与温带地区。病毒通过库蠓(Culicoidesspp.)对动物的叮咬传播,主要感染牛、羊等反刍动物,引起妊娠期家畜出现生产异常(流产、死胎或脑组织发育不全的畸形胎)[1-2]。1985—1986年,日本爆发妊娠牛感染PALV导致的分娩异常,给日本养牛业造成了严重的经济损失[3-4]。对牛、羊等反刍动物的血清学调查结果显示,PALV在我国由南(海南)至北(内蒙),由东(江苏)至西(新疆)的广泛区域流行[5-7],建立PALV诊断方法,对防止疫情的发生十分重要。
本实验室于2012年首次从我国云南省的哨兵牛上分离出Chuzan virus(CHUV)[8],随后在云南、广东与广西设立的哨兵牛中开展PALV的监测与病毒分离工作,除分离获得多株CHUV外,还在我国首次分离出D’Aguilar Virus(DAV)与Bunyip Creek virus(BCV)[9],表明多种血清型的PALV流行于我国南方地区,对我国牛羊养殖业的健康发展构成了潜在威胁。实时荧光定量RT-PCR(qRT-PCR)具有特异性强、灵敏度高与重复性好的优势,目前国内外尚未见PALV血清型实时荧光定量RT-PCR检测方法的报道。本研究根据我国流行PALV毒株基因节段2(Seg-2)序列特征,首次报道了我国流行PALV三种血清型(CHUV、BCV与DAV)的qRT-PCR检测方法,为开展PALV诊断与流行病学监测提供了技术手段。
1 材料与方法
1.1 病毒、血液样品与核酸样品
自我国云南省、广西壮族自治区与广东省分离到的CHUV(14株)、BCV(8株)与DAV(6株)共计28株PALV由本实验室分离保存。蓝舌病毒(BTV)、流行性出血症病毒(EHDV)、西藏环状病毒(TIBOV)与阿卡斑病毒(AKAV)由本实验室从设立于云南省的哨兵牛上分离保存。CHUV、BCV与DAV阳性血液样本各30份,采集自云南省设立的哨兵动物。PALV基因节段7全长序列克隆质粒PLB-CHUV/V144/Seg-7质粒由本实验室构建[10]。
1.2 主要试剂
磁珠法病毒RNA抽提试剂盒MagMAX-96 Viral RNA Isolation Kit购自美国Thermo-Fisher公司;RNAiso-Plus、病毒DNA/RNA提取试剂盒、实时荧光定量RT-PCR试剂盒、实时荧光定量PCR试剂盒与逆转录酶等购自大连宝生物公司。
1.3 引物和探针的设计与合成
从GenBank中下载PALV的Seg-2序列,与本实验室获取中国流行CHUV、BCV与DAV毒株Seg-2全长序列进行序列比对,选择序列保守区域,使用Beacon Designer 8.0软件进行特异性扩增引物与TaqMan探针的设计(表1)。

表1 CHUV、BCV与DAV检测用qRT-PCR引物与探针信息Table 1 Information of qRT-PCR primers and probes for CHUV, BCV and DAV detection
1.4 标准曲线的绘制和敏感性试验
以10倍梯度稀释的PLB-CHUV/V144/Seg-7质粒为模板(核酸拷贝数1.2×102~1.2×108copies·μL-1)建立标准曲线,取1 μL合成的CHUV、BCV与DAV参考毒株 cDNA为模板,通过PALV群特异性qRT-PCR[10]进行绝对定量qPCR反应,计算参考毒株cDNA拷贝数。将cDNA稀释为101~108copies·μL-1,使用设计的血清型特异性荧光定量引物(表1),每个稀释度重复进行3次qPCR反应。以病毒核酸拷贝数的对数值为横坐标,以荧光信号值为纵坐标建立标准曲线,计算相关系数(R2)和扩增效率(E值),分析PALV 血清型qRT-PCR方法可检测核酸拷贝数的下限。
1.5 重复性试验
分别取低浓度(102copies·μL-1)、中浓度(105copies·μL-1)与高浓度(108copies·μL-1)的CHUV、BCV与DAV参考毒株cDNA 1 μL为模板,进行3次批次内和批次间平行qPCR试验,计算所得Ct值的标准差(STD)与变异系数(CV),分析方法的重复性。
1.6 qRT-PCR检测效果的验证
提取我国分离28株PALV的核酸,取1 μL核酸为模板进行PALV血清型qRT-PCR检测。取90份PALV感染阳性动物的血液样本,使用MagMax Express核酸自动提取仪提取病毒核酸,取5 μL提取的核酸为模板,进行PALV血清型的qRT-PCR验证,将反应产生扩增曲线,而且Ct值<38.0判定为阳性结果。
1.7 PALV血清型qRT-PCR检测方法的应用
取2019年在云南省师宗县五龙乡采集的库蠓样本,将50~60只库蠓分为一批。在库蠓样本中加入200 μL PBS,使用TissueLyser II匀浆器(Qiagen)进行匀浆,使用RNAiso-Plus提取匀浆样本的核酸,使用PALV群特异性qRT-PCR检测样本中PALV核酸,对阳性样本进行病毒血清型qRT-PCR鉴定。
2 结 果
2.1 PALV血清型特异性qRT-PCR的灵敏度性分析
反转录合成CHUV、BCV与DAV参考毒株的cDNA,进行绝对定量qPCR分析,显示其拷贝数分别为2.45×108、2.28×108与2.85×108copies·μL-1。将合成的cDNA稀释为101至108copies·μL-1,每个稀释度设置3个重复进行qPCR反应。结果显示,3种血清型PALV的qPCR反应扩增效率(E)范围为92.53%~106.00%,相关系数(R2)值>0.998,可检出核酸最低拷贝数均<30 copies(图1、表2),表明建立的PALV血清型qRT-PCR方法具有良好的灵敏度。
2.2 PALV血清型特异性qRT-PCR的特异性与重复性试验
取1 μL提取的 CHUV、BCV、DAV、BTV、EHDV、TIBOV与AKAV核酸为模板,以RNase-Free H2O为阴性对照,进行PALV血清型qRT-PCR反应,显示仅CHUV、BCV与DAV的核酸模板有相应的扩增曲线产生,而其它病毒的核酸检测结果均为阴性,表明建立PALV血清型特异性qRT-PCR检测方法具有良好的特异性(图1)。分别以102、105和108copies·μL-1等3个浓度的CHUV、BCV和DAV核酸为模板,进行组内和组间的重复性试验,结果显示组内Ct值的CV值在0.42%~1.41%之间,组间Ct值的CV值在1.03%~1.88%之间,组内与组间CV值均小于2%,表明方法具有良好的重复性。
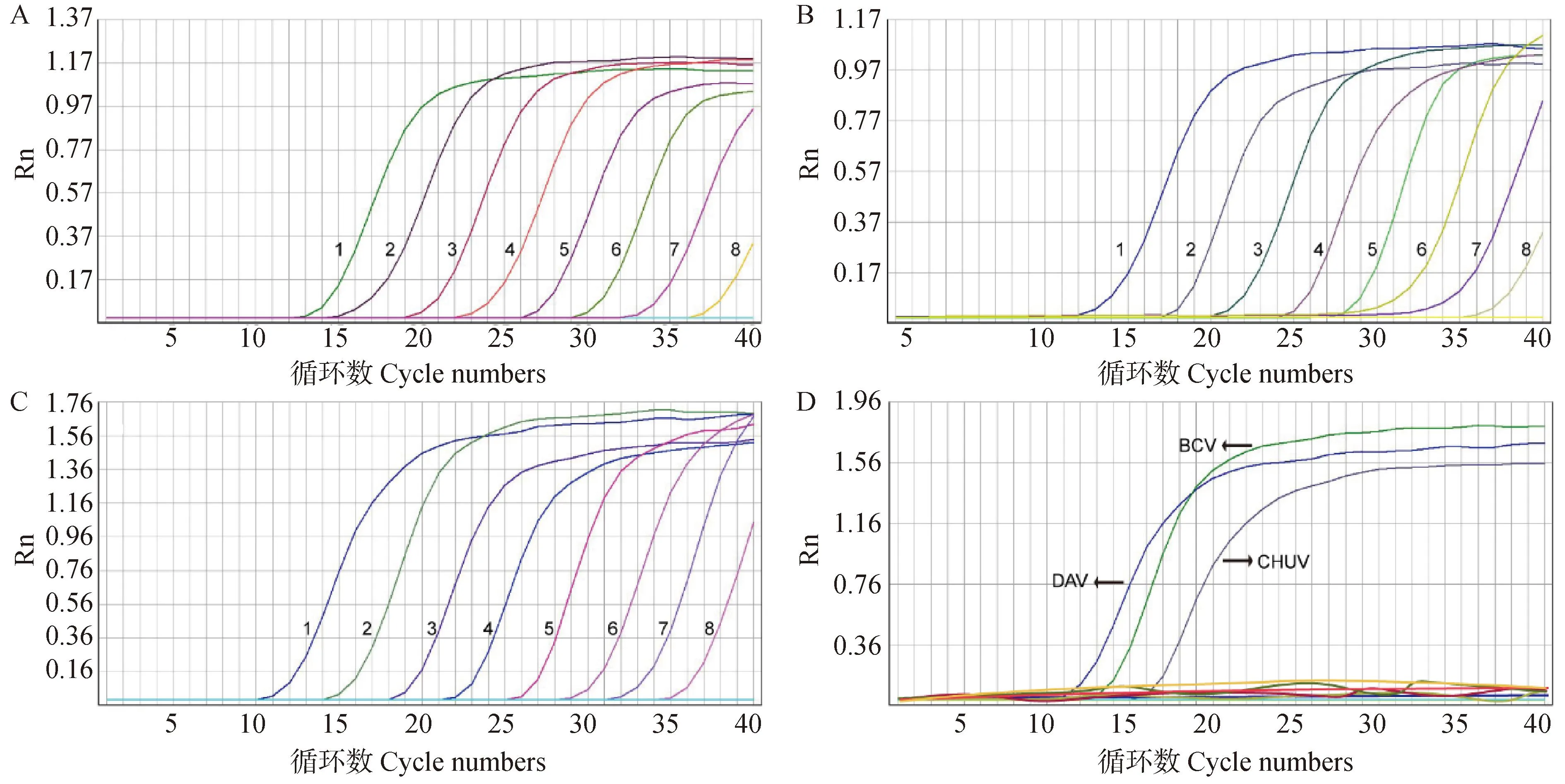
A~C. 分别为CHUV、BCV与DAV 血清型特异性qRT-PCR灵敏度分析结果:1~8. 将病毒的cDNA模板进行1×10-1至1×10-8倍梯度稀释。D. 特异性分析结果。图中横坐标表示PCR循环数,纵坐标(Rn)表示荧光信号强度 A-C. Results of CHUV, BCV and DAV qRT-PCR sensitivity analysis: 1-8. cDNA templates were gradient diluted from 10-1 to 10-8. D. Results of specificity analysis. Abscissa and ordinate indicated number of PCR cycles and fluorescence signal intensity (Rn), respectively图1 PLAV血清型特异性qRT-PCR检测方法的灵敏度与特异性分析结果Fig.1 Sensitivity and specificity analysis results of PLAV serotype-specific qRT-PCR

表2 PALV血清型特异性qRT-PCR检测方法的标准曲线和灵敏度分析Table 2 Standard curves and sensitivity assay results of PALV serotyping qRT-PCR
2.3 PALV血清型特异性qRT-PCR的验证结果
选择我国2012年至2020年在云南省、广西壮族自治区与广东省分离的28株PALV,进行PALV血清型qRT-PCR的回复验证。结果显示,建立的CHUV、BCV与DAV血清型特异性qRT-PCR均可检测对应血清型PALV毒株,吻合率为100%,反应的Ct值在9.9~19.7之间,表明建立的PALV血清型qRT-PCR可对我国不同时间与不同地域流行的PALV毒株进行血清型定型。
取CHUV、BCV与DAV感染哨兵动物上采集的血液样本各30份,提取核酸进行PALV的群特异性qRT-PCR检测。根据获取的Ct值,可将血液样本分为“强阳性样本”(Ct值在29.0~34.0之间)与“弱阳性样本”(Ct值在34.0~37.0之间)。建立的PALV血清型特异性qRT-PCR检测方法对“强阳性”与“弱阳性”血液样本均可产生有效的扩增曲线,获取的Ct值与PALV群特异性qRT-PCR检测结果基本保持一致,表明本研究建立的qRT-PCR方法可准确鉴定动物感染PALV的血清型。
2.4 库蠓样本中PALV血清型的检测
对2019年在师宗县采集的6批库蠓进行PALV核酸的检测。结果在4批库蠓中检测到PALV核酸,Ct值在25.7~35.3之间。对库蠓携带的PALV的血清型进行qRT-PCR检测,与预期结果一致,在不同批次的库蠓中检测到CHUV、BCV与DAV核酸。值得注意是,其中一批库蠓,虽然PALV群特型qRT-PCR的Ct值为35.3,但3种血清型PALV的qRT-PCR检测结果均为阴性,提示在师宗县还可能存在血清型未知的PALV的流行。
3 讨 论
建立的PALV血清型qRT-PCR方法能否对我国不同时间与不同地域流行PALV毒株进行鉴定,是衡量方法可靠性的重要指标之一。对此,本研究选择了2012—2020年我国云南、广东与广西等地分离的28株PALV[9]进行血清型的qRT-PCR回复验证,结果显示,研究建立的PALV血清型qRT-PCR鉴定结果与分离毒株的测序鉴定结果一致,表明方法具有良好的“覆盖度”,可有效鉴定我国不同时间、不同地域流行PALV毒株的血清型。
为分析建立的血清型qRT-PCR方法能否检测PALV不同感染阶段动物血液中的病毒核酸,取CHUV、BCV与DAV感染哨兵动物抗体转阳前1周(病毒感染早期)、抗体转阳后1~2周(病毒血症高峰期)以及抗体转阳后2个月(病毒感染晚期)的血液样本进行PALV血清型qRT-PCR检测。结果显示,建立的PALV血清型qRT-PCR既可检测PALV核酸含量较高的“强阳性”样本(病毒血症高峰期),也可检测病毒含量较低的“弱阳性”样本(感染早期与病毒感染晚期)。以上结果证实,本研究建立的PALV血清型特异性qRT-PCR检测方法具有良好的敏感度,可用于不同感染时期动物血液中PALV的血清型鉴定。
将本研究建立的PALV血清型特异性qRT-PCR方法对2019年师宗县采集库蠓样本中携带的PALV的血清型进行鉴定。在库蠓中鉴定出了CHUV、BCV与DAV。然而值得注意的是,其中一批被测库蠓虽然PALV核酸检测为阳性,但是PALV血清型qRT-PCR检测结果均为阴性。以上结果表明,建立的PALV血清型qRT-PCR方法可用于媒介中携带PALV血清型的鉴定,同时也提示在师宗县可能还存在其它血清型的PALV的流行。
4 结 论
本研究建立的PALV血清型qRT-PCR定型方法具有良好的特异强、敏感性与重复性,可用于PALV感染动物与媒介中PALV血清型的鉴定,具有良好的应用价值。
