牛支原体能量耦合因子转运蛋白S组件MbBioY摄取外源生物素的功能分析
2024-02-01陈启伟陈胜利刘东慧于永峰李彩玉宫晓炜储岳峰
陈启伟,权 衡,陈胜利,刘东慧,于永峰,李彩玉,宫晓炜,储岳峰
(中国农业科学院兰州兽医研究所/兰州大学动物医学与生物安全学院,动物疫病防控全国重点实验室 甘肃省病原生物学基础学科研究中心,兰州 730046)
动物养殖业是抗菌药物排放和细菌耐药性产生的源头之一[1],坚持“人病兽防、关口前移”,更应加强细菌耐药性的基础研究[2-3]。鉴于哺乳动物不存在与病原细菌类似的生物素代谢调控机制,这使得“阻断细菌生物素的合成和转运途径”可作为一类崭新的抗细菌药物靶标[4-5]。牛支原体(Mycoplasmabovis)是一种能引起牛发生肺炎、乳房炎和关节炎等疾病的高度传染性病原体,在全球范围内分布和流行,为目前发现的能在无细胞培养基生长的最简单原核生物,其感染与生存依赖于外界微环境提供的各类营养代谢因子[6-7]。目前,世界范围内M.bovis疫苗的研制尚无显著成果[8],临床中只能采用抗生素治疗和综合防控措施相结合的方法进行防控,M.bovis菌株严重耐药,是该病防控中全球面临的共同难题[9-11]。生物素(Vitmin H或B7)是一个具有7个碳原子骨架的含硫脂肪酸衍生物,是所有生物体所必需的微营养辅助因子[12]。基于此,开展M.bovis的B7转运机制研究,以期拓宽对细菌B7代谢调控领域的认知,揭示介导细菌B7代谢调控的多样性和复杂性,将对M.bovis防控具有极其重要的意义[13-14]。
从自然选择的能量最优化的角度来看,B7对细菌的生理代谢起着关键作用[12]。科学家发现存在于革兰阳性菌(乳酸菌、链球菌属、金黄色葡萄球菌、荚膜红细菌)之中的能量耦合转运蛋白(energy-coupling factor transporter,ECF)负责摄入一些维生素及其他微量元素[15-19],是近年来新鉴定的一类ATP结合盒(ABC)转运蛋白家族。通常,ECF 转运蛋白复合物包含三个原件:S成分(一个识别和转运底物的膜蛋白),A/A′成分(能量耦合模块,包括两个结合并水解 ATP 提供能量的亲水蛋白),以及T组分(一个传递能量的跨膜蛋白)。研究显示,ECF转运蛋白的S组件BioY搬运蛋白[20-21]能积极地发挥B7的吸收功能[22],并且仅表达BioY搬运蛋白就可以从环境中摄入足够的生物素,以支持这类B7缺陷型细菌的存活[16,19]。近年来,原核生物中B7代谢调控的研究已逐步深入,但还有很多问题亟待解决[5,23-24]。从作者对M.bovis生长所需的营养丰富型培养基(需额外添加B7),到对M.bovis生理学的初步了解,暗示其可能存在生物素转运代谢相关的系统,但有关M.bovis代谢调控的研究甚少[25-26],迄今更未见到M.bovisB7代谢相关的研究报道[6-7,27-29]。
近期全基因组重测序和比较基因组学分析发现M.bovisPG45染色体上的基因MbBioY(MBOVPG45_0349)与ECF转运蛋白 S成分中的BioY基因同源。明确MbBioY具有摄取外源B7的功能,可作为一类潜在的抗牛支原体药物靶标,为缓解M.bovis耐药性的严峻形势提供独特视角和解决方案。
1 材料与方法
1.1 菌株与质粒
牛支原体 PG45株、PG45株荧光突变体库由本实验室构建、阿拉伯糖诱导性表达的pBAD表达载体,均由中国农业科学院兰州兽医研究所草食动物细菌病团队保存。大肠杆菌MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)的缺失株由浙江大学赠送,大肠杆菌Red同源重组系统由南京农业大学赠送;大肠杆菌ATCC25922购自美国菌种保藏中心,大肠杆菌DH5α、BL21(DE3)感受态细胞均购自北京全式金生物技术有限公司。pMD19-T载体购自宝生物大连工程有限公司。
1.2 主要材料
DL2000 DNA Marker(南京诺唯赞生物科技股份有限公司)。细菌基因组DNA 提取试剂盒(北京天根生化科技有限公司)。质粒小提试剂盒(美国Omega)、DNA 凝胶回收试剂盒(美国Omega)。2×Taq Master Mix (Thermo Fisher)。胰蛋白酶大豆肉汤(TSB)、胰蛋白酶大豆琼脂(TSA)均购自美国 BD difcoTM公司;LB肉汤(英国Oxoid);琼脂粉(北京Solarbio公司);0.22 μm无菌硝酸纤维素膜和过滤器购自美国 Millipore公司;限制性内切酶,T4 DNA连接酶,质粒提取试剂盒,胶回收试剂盒均购自TaKaRa公司。改良 Thiaucourt’s 液体培养基或固体培养基: PPLO肉汤(21 g·L-1)或PPLO 琼脂(35 g·L-1)、丙酮酸钠(2 g·L-1)、灭活马血清(200 mL·L-1)、酵母浸出液(100 mL·L-1)、葡萄糖(2 g·L-1)、1% 酚红(2. 5 mL·L-1)、青霉素(20 万U·L-1)、10% 醋酸铊(1 mL·L-1),调节pH 至7. 2~7. 4。紫外分光光度计购于美国 Backman 公司;台式高速离心机购自Beckman公司;PCR热循环仪(杭州博日科技公司);CO2恒温培养箱(美国Thermo公司);摇床(上海苏坤实业有限公司);凝胶成像仪(美国Bio-Rad 公司);全自动化学发光成像仪(天能科技有限公司)。
根据M.bovisPG45株MBOVPG45_0349基因序列(GenBank登录号:NC_014 760.1),利用NCBI在线设计引物,其中上游引物0349-F序列:5′-cggaattcCTAATATGAAACTTTGTTTCTTT-CA-3′;下 游 引 物0349-R序列:5-gcgtcgacATGGAGGGTATATATAGTAGCAAAGAATT-3′,产物大小966 bp,引物由西安擎科生物科技有限公司合成。
1.3 突变株的筛选
取出已成功构建的M.bovisPG45荧光突变体库,利用Southern blot鉴定出基因插入的次数,目前的库容量含有约1 368株突变株。将待测转座突变菌分别接种在Thiaucourt’s培养基和不含生物素的Thiaucourt’s筛选培养基(利用海狸生物科技有限公司链霉亲和素BeaverBeadsTMStreptavidin 试剂盒去除培养基中的生物素,即取50 mL改良Thiaucourt’s培养基加入500 μL的链霉亲和素磁珠,放置于4 ℃摇床上,结合16 h后,在超净台中用磁性分离架去除磁珠,将上清液倒于新的离心管中。为防止污染,可再用0.22 μmol·L-1过滤器进行过滤一次)平板上连续培养,通过平行比较,当同一单克隆菌落在改良Thiaucourt’s培养基上能正常生长,而在去除生物素的Thiaucourt’s筛选培养基上无法生长时,即初步判定该单克隆菌株为生长缺陷突变株,通过对靶基因MBOVPG45_0349进行PCR扩增鉴定,最终筛选出MbBioY基因突变株。
1.4 功能性克隆
取出-80 ℃冻存的MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)的缺失株复苏。同时从MG1655中提取pBAD质粒,并对提取的质粒进行质量浓度测定。用EcoR Ⅰ/SalⅠ对质粒进行双酶切鉴定。酶切体系如下:pBAD质粒1 μg,EcoR Ⅰ/SalⅠ酶各1 μL,buffer 3 μL,去离子水补足至30 μL。放置于37 ℃水浴锅中2~3 h,核酸电泳进行产物分离。按照Omega的琼脂糖凝胶回收试剂盒对核酸产物进行回收,得到线性化的pBAD质粒。以PG45基因组为模板,以0349-F/0349-R为引物,扩增MBOVPG45_0349基因全长。进行琼脂糖核酸电泳,胶回收,并测定基因片段的浓度。基因片段进行EcoR Ⅰ/SalⅠ双酶切,酶切体系如上。将酶切完成的质粒pBAD和MBOVPG45_0349片段,进行连接。连接体系如下:2×ligation mix 5 μL,酶切质粒pBAD 1 μL,酶切片段 MBOVPG45_0349 4 μL。25 ℃连接2 h。将连接完成的体系加入到MG1655感受态细胞,具体操作:冰浴30 min,42 ℃热激60 s,立即转回冰上放置2 min左右,加入1 mL LB培养基37 ℃,220 r·min-1振荡培养1 h。5 000 r·min-1,离心3 min,收集菌体,弃上清(保留底部200 μL),重悬菌体,全部涂布于Amp+LB平板。37 ℃培养箱静置培养 16 h 后,挑菌接种于Amp+LB 液体培养基,37 ℃ 220 r·min-1振荡培养4 h以上至菌液浑浊,PCR鉴定,标记为MG1655(ΔbioC+pMbBioY、ΔbioH+pMbBioY、ΔbioHΔyigM+pMbBioY)。
1.5 生物素敏感性检测
复苏野生株PG45,突变株PG45ΔMbBioY,利用CFU计数法绘制M.bovisPG45株的生长曲线,开展MG1655及其缺失株,PG45ΔMbBioY与PG45亲本株生物素敏感性检测,评价PG45ΔMbBioY和PG45亲本株在不同生物素浓度下对其生长的影响。复苏MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)缺失株及MG1655(ΔbioC+pMbBioY、ΔbioH+pMbBioY、ΔbioHΔyigM+pMbBioY)构建的回补株,转接于10 mL LB培养基或者去除生物素的LB培养基(方法同上),放置于37 ℃,220 r·min-1摇床每2 h取出200 μL 测定OD600 nm,记录OD600 nm,绘制生长曲线。同时制备包含0.2%阿拉伯糖的0 nmol·L-1生物素和4 nmol·L-1生物素的LB平板,进行划线培养,评估MbBioY对生物素代谢营养缺陷大肠杆菌缺失株的生长影响。
2 结 果
2.1 牛支原体PG45 和PG45ΔMbBioY生物素敏感性检测
利用Southern blot及PCR鉴定出实验室筛选获得的MbBioY(MBOVPG45_0349)基因突变株,同时利用CFU计数法绘制的M.bovisPG45株的生长曲线,开展PG45ΔMbBioY与PG45亲本株生物素敏感性检测,评价PG45ΔMbBioY和PG45亲本株在不同生物素浓度下对其生长的影响(图1)。
2.2 大肠杆菌 MG1655及其缺失株生物素敏感性检测
利用OD600 nm检测大肠杆菌MG1655及其MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)缺失株的生物素敏感性,绘制大肠杆菌MG1655及其MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)缺失株生长曲线,评价大肠杆菌MG1655及其MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)在不含生物素的LB培养基中的生长情况(图2)。结果显示,在去除生物素的LB培养基中,MG1655能正常生长,而MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)缺失株均无法正常生长,在添加1 nmol·L-1生物素的LB培养基中,MG1655 与MG1655(ΔbioC、ΔbioH)能缓慢生长,而MG1655ΔbioHΔyigM缺失株不能正常生长,表明yigM的缺失,影响大肠杆菌获取外源生物素的能力。
2.3 牛支原体MbBioY功能性克隆验证
根据大肠杆菌MG1655及其MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)对生物素的敏感性,将MbBioY基因异源敲入生物素代谢营养缺陷大肠杆菌MG1655(ΔbioC+pMbBioY、ΔbioH+pMbBioY、ΔbioHΔyigM+pMbBioY)后,开展M.bovis功能性克隆验证(图3),表明MbBioY单独存在时,就能够恢复生物素代谢营养缺陷大肠杆菌缺失株MG1655ΔbioHΔyigM的正常生长。
3 讨 论
M.bovis作为极简微生物的代表,介于细菌和病毒之间,无细胞壁,是一种最小的有细胞结构的微生物[6]。因基因组很小,研究证实其编码基因主要与分解代谢有关,而缺失大量涉及生物合成的相关基因[6,9]。通过对M.bovisPG45株全基因组重测序和比较基因组学分析,发现M.bovis不具有完整的生物素代谢合成途径(BioFADB),生物素敏感性检测后发现M.bovis在去除生物素的培养基中不能正常生长,只有在添加了生物素的培养基中,通过从外界摄取生物素来维持正常的生理功能,说明生物素是M.bovis生长的必须元素(图1)。PG45染色体上存在能量偶合因子(ECF)转运蛋白复合物,包含三个完整的原件,其中与能量偶合因子(ECF)转运蛋白 S成分的BioY同源的基因MbBioY(MBOVPG45_0349),全长996 bp,GC含量30.95%,预测编码产物MbBioY蛋白长度为332个氨基酸,是一个识别和转运底物的膜蛋白,MbBioY与目前已知的能量偶合因子(ECF)转运蛋白家族的S成分亲缘关系都很近,在支原体种属中的氨基酸相似性为23.58%~100.00%,在不同种属细菌中的氨基酸相似性为10.41%~79.01%,属于ECF转运蛋白家族的S成分一员,由7个跨膜结构域组成,与之前发现的能够转运外源生物素的S成分BioY蛋白(6个跨膜结构域)不同,提示该蛋白结构更复杂有待进一步探索;同时,分子对接(UCSF DOCK 6)显示(与乳酸乳杆菌LactococcuslactisBioYPDB 4DVE比较),MbBioY蛋白转运生物素的结合位点位于几个跨膜片段的周质部分,表明可能是一种崭新的生物素膜转运蛋白。试验验证后发现,当M.bovis缺失能量偶合因子转运蛋白S组件MbBioY会影响其生长,表现出生物素代谢营养缺陷的表型(图1)。通过构建生物素代谢营养缺陷大肠杆菌,检测大肠杆菌 MG1655及其缺失株生物素敏感性,发现MG1655ΔbioC、MG1655ΔbioH的缺失,主要与MG1655的生物素合成相关,所以在添加了生物素的培养基中可以恢复正常的生长,而yigM是大肠杆菌生物素外源转运的关键基因,yigM的缺失影响大肠杆菌获取外源生物素的能力,MG1655ΔbioHΔyigM缺失株既不能自身合成生物素也不能从外源获得生物素(图2),因此MG1655ΔbioHΔyigM缺失株在无生物素的环境下无法正常生长,当开展MbBioY异源功能性克隆验证时,通过将MbBioY异源敲入生物素代谢营养缺陷大肠杆菌MG1655ΔbioHΔyigM+pBAD-MbBioY后,发现MbBioY在添加了生物素的培养基中,能够恢复MG1655ΔbioHΔyigM缺失株的正常生长,MbBioY与大肠杆菌生物素合成的关键基因bioC、bioH不同,而与yigM一样,具有获取外源生物素的能力,表明MbBioY单独存在时就能够恢复生物素代谢营养缺陷大肠杆菌缺失株MG1655ΔbioHΔyigM的生理功能(图3)。
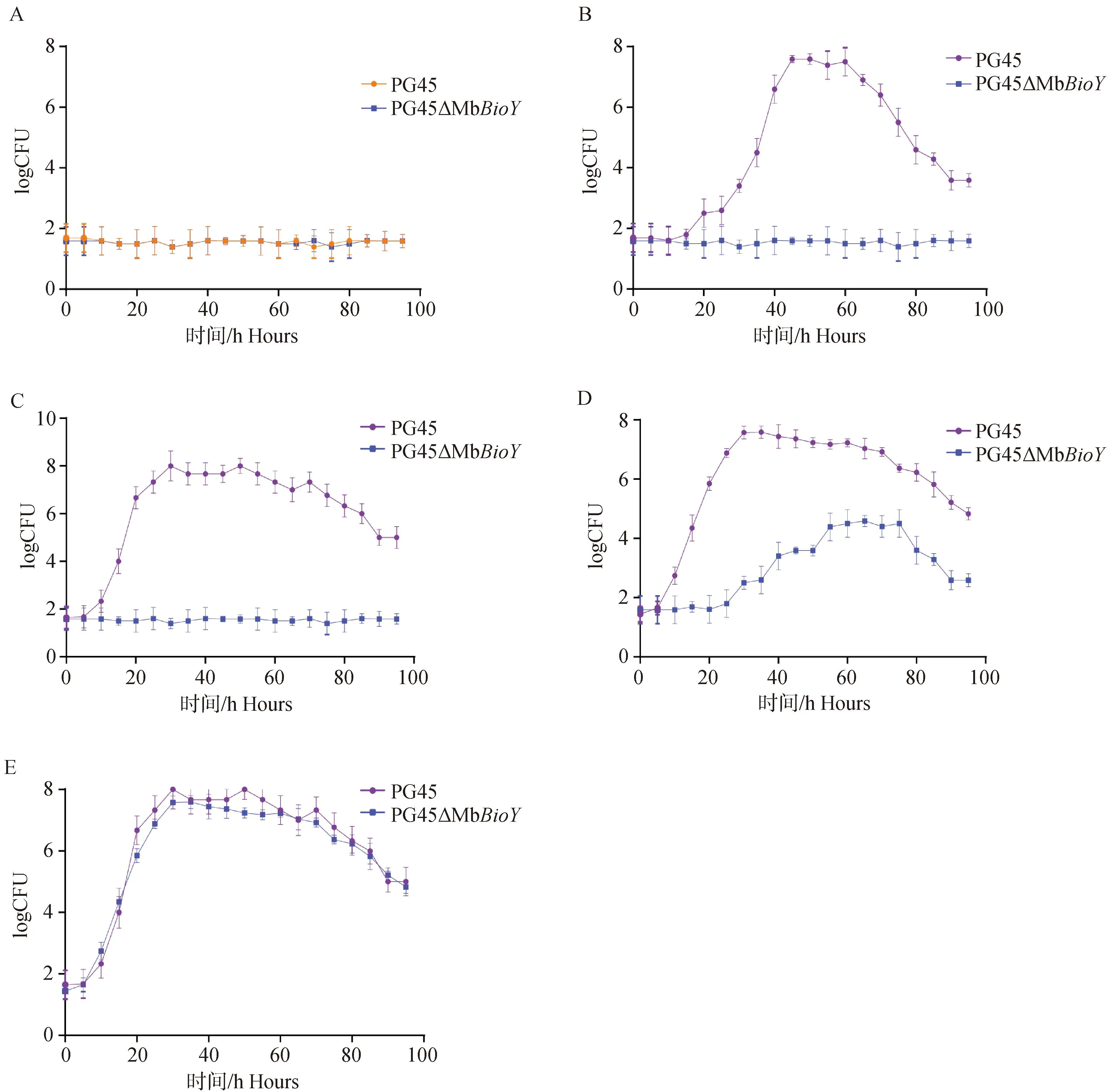
A.亲本株PG45与PG45ΔMbBioY在不添加生物素的培养基中均无法生长;B.亲本株PG45在添加1 nmol·L-1生物素的培养基中可正常生长,而PG45ΔMbBioY在添加1 nmol·L-1生物素的培养基中无法生长;C.亲本株PG45在添加10 nmol·L-1生物素的培养基中可正常生长,而PG45ΔMbBioY在添加10 nmol·L-1生物素的培养基中无法生长;D.亲本株PG45在添加100 nmol·L-1生物素的培养基中可正常生长,而PG45ΔMbBioY在添加100 nmol·L-1生物素的培养基中可以缓慢生长;E.亲本株PG45和PG45ΔMbBioY在添加1 μmol·L-1生物素的培养基中均可正常生长 A. Neither PG45 nor PG45ΔMbBioY could grow in the absence of biotin; B. The parent strain PG45 could grow normally, but PG45ΔMbBioY could not grow when 1 nmol·L-1 biotin was added to the medium;C. When 10 nmol·L-1 biotin was added to the medium, the parent strain PG45 could grow normally, but PG45ΔMbBioY could not grow; D. When 100 nmol·L-1 Biotin was added to the medium, PG45 could grow normally, but PG45ΔMbBioY grew slowly; E. Both parental strains PG45 and PG45ΔMbBioYgrew normally when 1 μmol·L-1 biotin was added to the medium图1 PG45ΔMbBioY与PG45亲本株生物素敏感性检测Fig.1 Biotin sensitivity test of PG45ΔMbBioY and PG45 parental strain
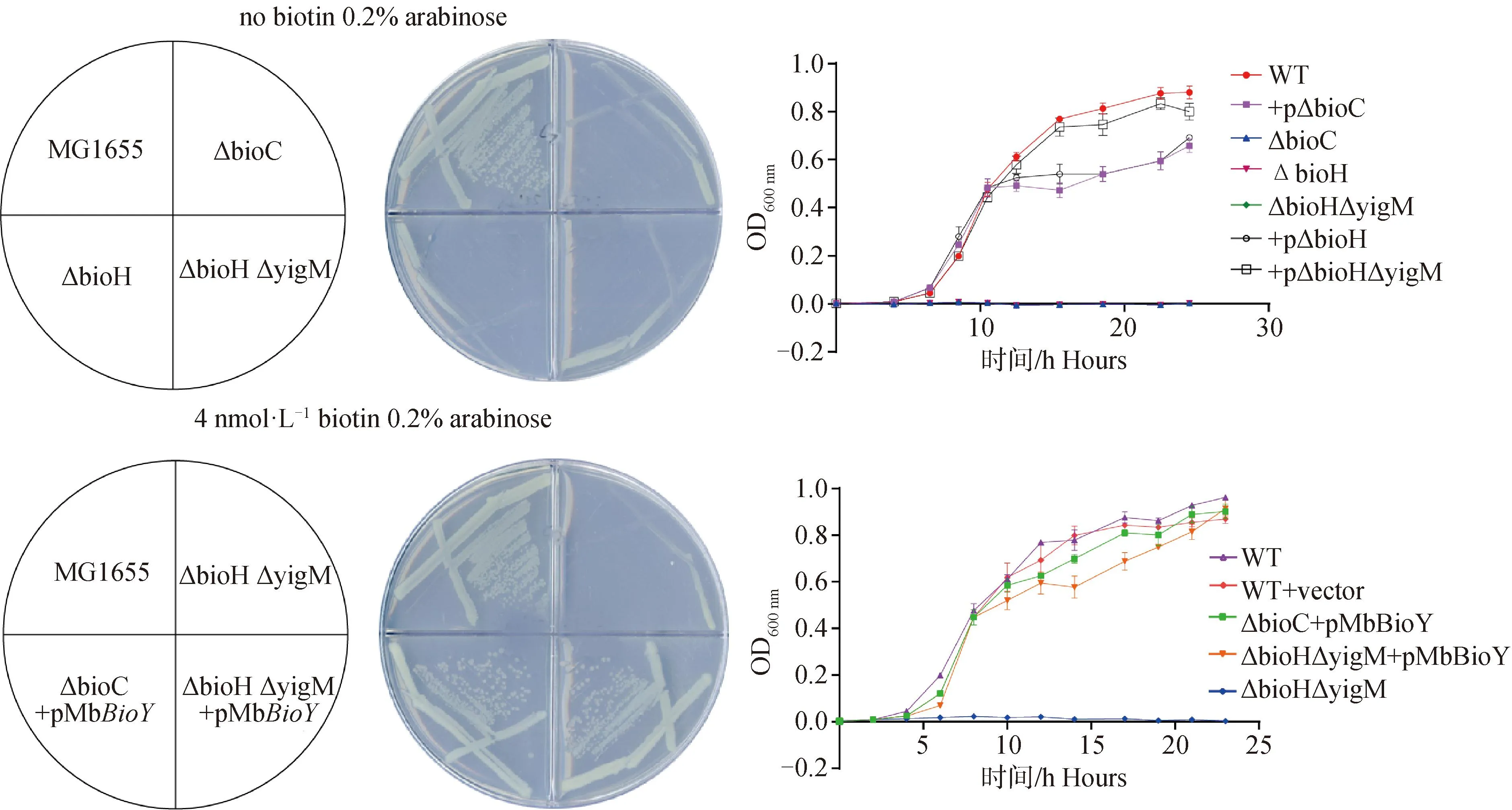
当培养基不添加生物素时,MG1655(ΔbioC、ΔbioH、ΔbioHΔyigM)的缺失株均无法生长;当培养基添加4 nmol·L-1生物素时,异源基因敲入生物素代谢营养缺陷大肠杆菌MG1655(pBAD-MbBioY)、MG1655ΔbioHΔyigM无法生长,MG1655ΔbioC+pBAD-MbBioY、MG1655ΔbioHΔyigM+pBAD-MbBioY的缺失回补株可正常生长,表明MbBioY单独存在时,就能够恢复生物素代谢营养缺陷大肠杆菌缺失株的生理功能 MG1655 without adding biotin (ΔbioC, ΔbioH, ΔbioHΔyigM) were unable to grow; When adding 4 nmol·L-1 biotin, heterologous genes knock into biotin metabolically deficient E. coli MG1655 (pBAD-MbBioY), MG1655ΔbioH ΔyigM cannot grow, MG1655 ΔbioC+pBAD-MbBioY, MG1655 Δ bioH ΔyigM+pBAD-MbBioY can grow normally, indicating that MbBioYalone can restore the physiological function of the deficient strain of Escherichia coli with biotin metabolism and nutrition deficiency图3 MbBioY功能性克隆验证Fig.3 MbBioY functional clone verification
4 结 论
通过MbBioY在大肠杆菌生物素代谢合成障碍缺失株中的异源表达,初步证明,MbBioY编码的是能量偶合因子(ECF)转运蛋白的S成分,具有摄取外源生物素的能力,揭示了一种潜在的ECF转运蛋白运输新机制。这些结果将有助于完善细菌生物素代谢调控的复杂网络,对M.bovis防控提供独特视角。
