Nesfatin-1对3T3-L1脂肪细胞糖代谢和自噬的影响
2024-02-01玉斯日古楞白兆星罗雨晨么宏强
玉斯日古楞,白兆星,罗雨晨,么宏强
(1. 内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018 ; 2. 农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018)
Nesfatin-1是Oh-I等[1]于2006年首先发现的食欲抑制因子,其氨基酸序列在不同物种间有高度保守性[2]。Nesfatin-1不仅通过中枢和外周分泌的方式对机体的血糖稳态和胰岛素分泌进行刺激,还可以抑制食欲和脂肪细胞分化,起到对糖脂代谢的调节作用[3]。因此,近年来,越来越多的研究证明,Nesfatin-1作为一种新的能量调节肽,对糖尿病和肥胖等具有潜在的治疗作用[4],但其作用机理仍有待于明晰。
双峰驼经过长期的演变,具备了很多独特的生物学特性。在恶劣的环境中可以长时间不饮水和进食,其驼峰中沉积大量的脂肪,且其血糖水平比其他反刍动物高2倍多[5],但它们不会因此发生代谢性疾病或显示相关的病理学特征。有报道称,Nesfatin-1可参与改善机体胰岛素靶器官对胰岛素的敏感性,纠正血糖和血脂异常,从而改善糖尿病及其并发症[6]。在前期的研究工作中,本课题组通过抗原表位分析和多肽合成方式,成功制备双峰驼Nesfatin-1抗体,并分析双峰驼体内Nesfatin-1的分布表达情况。本试验试图通过模拟双峰驼高糖环境,探究Nesfatin-1对脂肪细胞糖代谢和自噬的影响,以期明确Nesfatin-1改善糖脂代谢的功能是否与自噬有关,为研究糖尿病的发生发展和防治措施提供新的思路。
自噬(Autophagy)是广泛存在于真核细胞内的一种溶酶体依赖性的降解途径,可降解细胞质中错误折叠的蛋白、受损细胞器和脂质等胞内物质[7],是细胞应对应激的一种自我保护机制。饥饿、缺氧和寒冷等因素均可引发自噬[8]。自噬在脂肪细胞的分化过程中起着重要的作用,但是目前对于脂肪细胞分化过程中自噬的发生发展及其功能的研究还相对匮乏。Nesfatin-1改善脂肪代谢的作用,是否与细胞自噬存在一定的关系,目前尚无定论。因此,本试验主要探讨Nesfatin-1对高糖状态下3T3-L1脂肪细胞代谢的影响,并进一步分析其对脂肪细胞自噬过程的影响,以期为Nesfatin-1的应用研究提供参考。
1 材料与方法
1.1 主要试剂 DMEM细胞培养液和胎牛血清,均购自Gibco公司;高糖DMEM细胞培养液,购自HyClone公司;胰岛素、3-异丁基-1-甲基-黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松(Dexamethasone,DEX)和油红O染色试剂,均购自Sigma公司;Nesfatin-1,购自北京华大蛋白质研发中心有限公司;非放射性葡萄糖吸收检测试剂盒,购自Promega公司;丙酮酸含量检测试剂盒、己糖激酶活性检测试剂盒和磷酸果糖激酶活性检测试剂盒,均购自北京索莱宝科技有限公司;RNA提取试剂盒,购自Axygen Scientific公司;反转录试剂盒和荧光定量PCR试剂盒,均购自TaKaRa公司;LC3和p62抗体,均购自Abcam公司;PCR引物均合成于生工生物工程(上海)股份有限公司。
1.2 主要仪器 恒温CO2培养箱,Thermo-fisher公司产品;多功能酶标仪,BioTek公司产品;TU-1901双光束紫外可见分光光度仪,北京普析通用仪器有限公司产品;CFX96 荧光定量仪,Bio-Rad公司产品。
1.3 细胞 小鼠前脂肪胚胎成纤维细胞(3T3-L1细胞株),购自上海青旗生物技术发展有限公司。
1.4 试验方法
1.4.1 3T3-L1前脂肪细胞培养和诱导分化 3T3-L1细胞株置于含10%胎牛血清、50 g/mL青霉素和100 g/mL链霉素的DMEM培养液中,于37 ℃、5% CO2培养箱中培养;在细胞培养至汇合度为70%~80%时,用含0.01% EDTA、0.25%胰蛋白酶的消化液消化,进行传代。3T3-L1前脂肪细胞接种于6 孔细胞培养板继续培养,细胞融合后2 d开始进行诱导。加入诱导液(1.67 μmol/L 胰岛素、1 μmol/L DEX和0.5 mmol/L IBMX),培养48 h,换只含1.67 μmol/L胰岛素的全培养液再培养48 h,随后以含10%胎牛血清的DMEM培养液继续培养至细胞成熟。在培养6~8 d后如观察到90%以上的细胞变圆并有大量脂滴出现,则表明3T3-L1前脂肪细胞已被诱导成为成熟的脂肪细胞。
1.4.2 3T3-L1脂肪细胞的油红O染色鉴定 吸弃诱导细胞的上清液,6孔板中的细胞每孔加入2 mL PBS缓冲液,轻柔漂洗3次。将6 孔板倒扣于滤纸上,静置5 min晾干,加入现用现配的10%多聚甲醛固定1 h。吸弃多聚甲醛溶液,使用PBS缓冲液轻柔漂洗,室温晾干,每孔加入0.5 mL油红O染色试剂,室温避光染色1 h,吸弃6孔板中的油红O染色液,使用PBS缓冲液轻柔漂洗3次,在倒置显微镜下观察细胞内脂滴的形态。油红O是脂肪特异性染色剂,能与脂肪结合,使脂肪细胞中的脂滴着色,因此常用来染色分化成熟的脂肪细胞,以观察脂肪细胞中脂肪的含量。
1.4.3 3T3-L1脂肪细胞葡萄糖摄取水平的测定 葡萄糖是维持细胞代谢和生命活动的重要原料,细胞通过摄取葡萄糖为机体活动提供能量。将3T3-L1脂肪细胞随机分为对照组和试验组,试验过程中均使用高糖DMEM细胞培养液。参照参考文献[9]的方法,试验组细胞以100 nmol Nesfatin-1干预1 h,对照组细胞使用等量生理盐水进行处理。按照非放射性葡萄糖吸收检测试剂盒说明书操作,每孔加入1 000 μL 1 mmol 2-脱氧葡萄糖(2-deoxyglucose,2DG),室温孵育10 min;依次加入500 μL终止缓冲液和25 μL中和缓冲液,摇晃;加入100 μL 2-DG-6-磷酸(2-deoxyglucose-6-phosphate,2-DG6P),在室温孵育1 h,采用多功能酶标仪检测葡萄糖摄取水平。
1.4.4 3T3-L1脂肪细胞丙酮酸含量的测定 丙酮酸是糖代谢中具有关键作用的中间代谢物,是所有生物细胞糖代谢和体内多种物质相互转化的重要中间体。在测定样品的丙酮酸含量之前,首先使用标准品绘制出标准曲线,再分析样品中丙酮酸的含量。通过Nesfatin-1干预后,对照组和试验组3T3-L1脂肪细胞离心后去上清,按照细胞数量(104个)∶提取液体积(mL)为500~1 000∶1的比例加入提取液,超声波破碎(超声3 s,间隔10 s,重复30 次),静置30 min,8 000 g离心10 min,取上清即为待测样本。根据丙酮酸含量检测试剂盒说明书,将标准品用蒸馏水稀释至25、12.5、6.25、3.125、1.562 5、0.781 25和0 μg/mL。在96 孔板中加入75 μL标准液或待测样本和25 μL试剂I,混匀,静置2 min,加入125 μL试剂II,混匀,于520 nm波长处测定吸光度(Optical density,OD)值。
1.4.5 3T3-L1脂肪细胞己糖激酶和磷酸果糖激酶活性的测定 己糖激酶在细胞葡萄糖代谢中起重要作用,是催化葡萄糖代谢的第一个必需步骤,用于催化葡萄糖转化为6-磷酸葡萄糖,能影响细胞内葡萄糖通量的程度和方向。磷酸果糖激酶是一类催化不可逆反应的激酶,可将果糖-6-磷酸和ATP转化为果糖二磷酸和ADP。所以己糖激酶和磷酸果糖激酶的活性对3T3-L1脂肪细胞的糖代谢起着至关重要的作用。
参照1.4.4所描述的方法,将超声波处理后的细胞离心取上清待测。按照己糖激酶和磷酸果糖激酶活性检测试剂盒说明书操作,在96 孔板中分别加入180 μL和170 μL试剂II、10 μL试剂III和10 μL试剂IV、10 μL样本,混匀,立即记录340 nm处20 s时的OD值,检测后将96孔板放入37 ℃恒温箱中反应5 min,再记录340 nm处20 s时的OD值。
1.4.6 3T3-L1脂肪细胞总RNA的提取和cDNA的合成 收集细胞,按照RNA提取试剂盒说明书操作提取3T3-L1脂肪细胞总RNA,纯化后用1%琼脂糖凝胶电泳检测其完整性,并用分光光度仪测定其浓度和纯度。应用反转录试剂盒得到相应的cDNA,并保存于-80 ℃冰箱备用。
1.4.7 实时荧光定量PCR检测3T3-L1脂肪细胞自噬相关基因mRNA的表达 由Primer Premier 5.0软件设计合成自噬相关基因引物(引物序列见表1),采用实时荧光定量PCR方法对微管相关轻链蛋白(Microtubule-associated protein light chain 3,LC3)、Beclin-1(也称BECN1基因)和p62(Sequestosome 1,自噬选择性底物)蛋白的mRNA表达量进行分析,以α-微管蛋白(α-tubulin)作为内参。实时荧光定量PCR反应体系(25 μL):SYBR 12.5 μL,上、下游引物各1 μL(10 pmol/μL),cDNA模板2 μL,无RNA酶的去离子水8.5 μL。实时荧光定量PCR反应条件:95 ℃ 预变性3 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸60 s,45个循环。
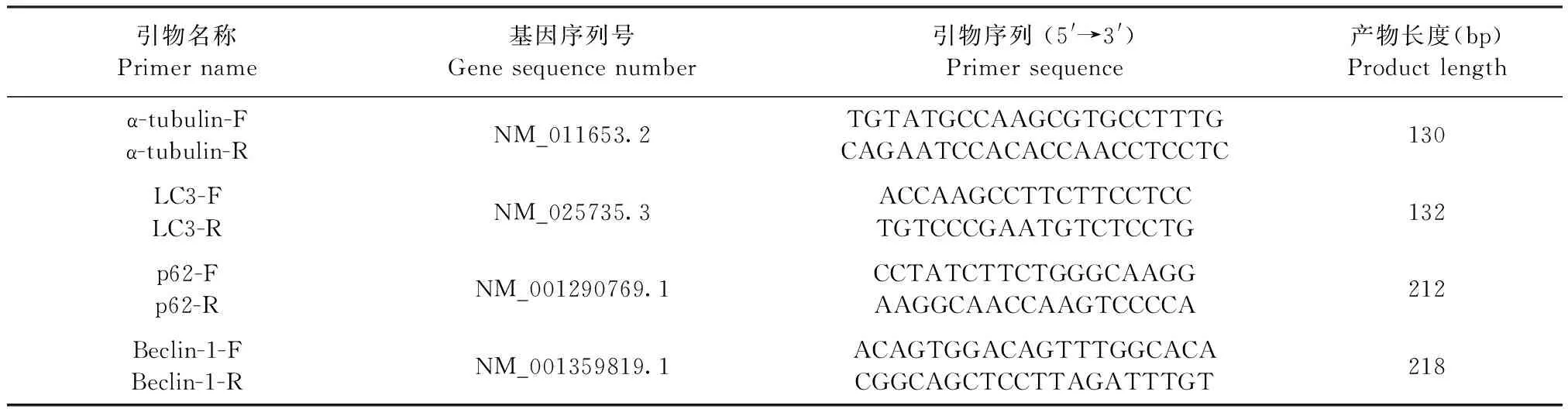
表1 引物信息Table 1 Primer details
1.4.8 Western blot检测3T3-L1脂肪细胞自噬相关蛋白的表达 为探索Nesfatin-1对3T3-L1脂肪细胞自噬的影响,参照1.4.4所描述的方法,将收集的细胞中加入PIPA裂解液,提取其总蛋白。运用BCA法测定蛋白浓度后,以α-tubulin为内参,采用Western blot检测LC3-II和p62蛋白的表达。使用Image J软件分析蛋白质条带的灰度值,统计分析蛋白相对表达量。
1.5 数据统计与分析 采用GraphPad Prism 5.0统计软件对数据进行分析,每个试验重复3次,数据以“平均值±标准差”方式表示。荧光定量PCR结果数据使用2-ΔΔCt法进行处理。
2 结果
2.1 3T3-L1脂肪细胞的形态学特征和油红O染色鉴定 光学显微镜下观察,3T3-L1前脂肪细胞形态与成纤维细胞相似,呈长梭型,细胞内没有脂肪积聚,油红O染色后细胞不着色(图1)。诱导分化后,细胞形态变圆,胞浆出现脂滴,随着分化程度的加深,脂滴积聚增多。诱导分化8 d后,90%以上的细胞呈脂肪细胞表型,胞浆中积聚大量脂滴,油红O染色后着色(图2)。
图1 前脂肪细胞显微镜观察(40×)Fig.1 Microscopic observation of preadipocytes (40×)

图2 油红O染色观察脂肪细胞(40×)Fig.2 Oil red O staining for adipocyte observation(40×)
2.2 Nesfatin-1对3T3-L1脂肪细胞葡萄糖摄取水平的影响 结果显示,与对照组相比,通过Nesfatin-1干预后,试验组脂肪细胞的葡萄糖摄取水平极显著降低(P<0.01)(图3),表明3T3-L1脂肪细胞的糖消耗量明显降低。
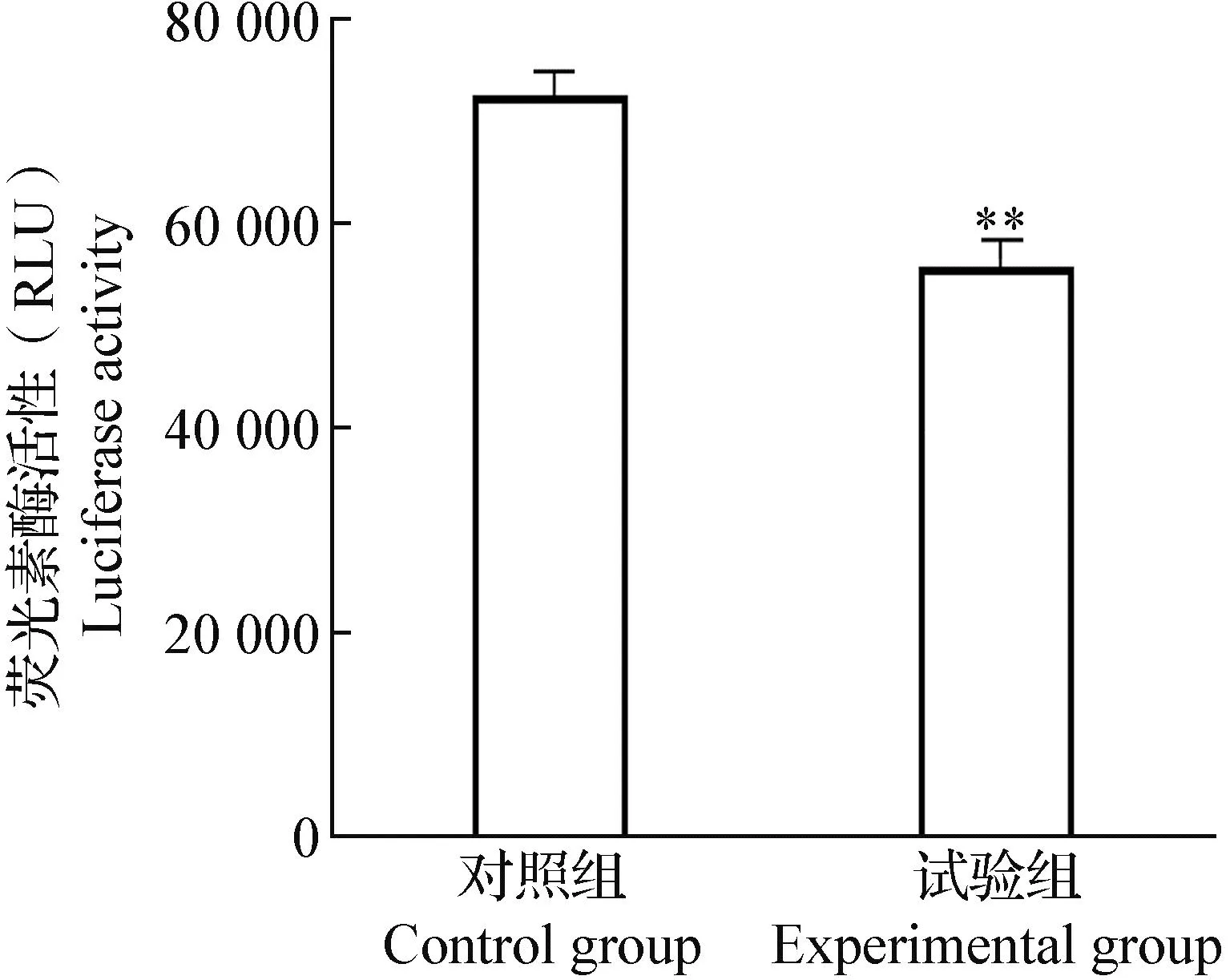
图3 Nesfatin-1对3T3-L1脂肪细胞葡萄糖摄取水平的影响Fig.3 Effects of nesfatin-1 on glucose uptake levels in 3T3-L1 adipocytes与对照组比较,*:P<0.05,差异显著; **:P<0.01,差异极显著; ***:P<0.001,差异非常显著;下同Compared with the control group,*:P<0.05,significant difference; **:P<0.01,very significant difference; ***:P<0.001,extremely significant difference. The same as below
2.3 Nesfatin-1对3T3-L1脂肪细胞丙酮酸含量的影响 结果显示,标准品的丙酮酸含量标准曲线为y=0.025 7x+0.081 9,R2=0.999 7,符合检测标准(图4)。对照组与试验组3T3-L1脂肪细胞的丙酮酸含量没有显著差异(P>0.05)(图5)。

图4 丙酮酸含量标准曲线Fig.4 Standard curve of pyruvate content
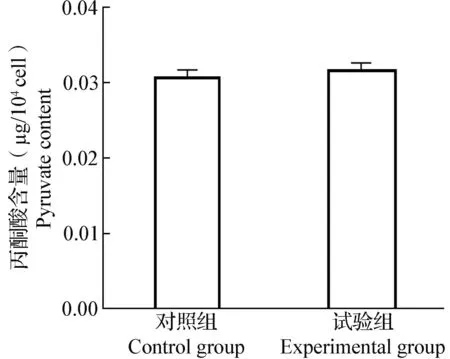
图5 Nesfatin-1对3T3-L1脂肪细胞丙酮酸含量的影响Fig.5 Effects of nesfatin-1 on pyruvate contents of 3T3-L1 adipocytes
2.4 Nesfatin-1对3T3-L1脂肪细胞己糖激酶和磷酸果糖激酶活性的影响 结果显示,与对照组相比,试验组3T3-L1脂肪细胞的己糖激酶和磷酸果糖激酶活性非常显著地降低(P<0.001)(图6)。
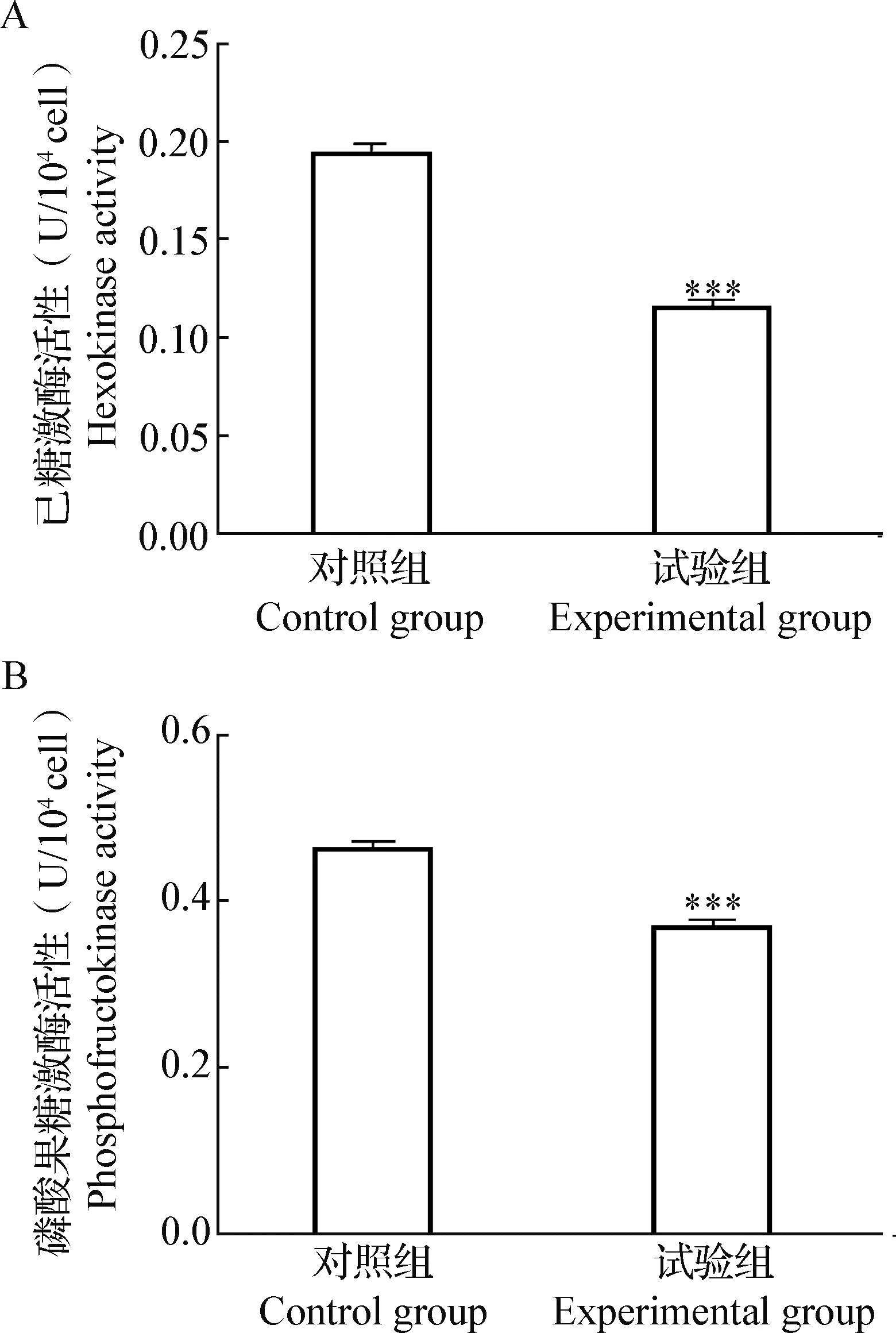
图6 Nesfatin-1对3T3-L1脂肪细胞己糖激酶(A)和磷酸果糖激酶(B)活性的影响Fig.6 Effects of nesfatin-1 on hexokinase (A) and phosphofructokinase (B) activities of 3T3-L1 adipocytes
2.5 Nesfatin-1对3T3-L1脂肪细胞自噬相关因子mRNA表达的影响 通过实时荧光定量PCR检测后发现,与对照组相比,以Nesfatin-1干预后,试验组3T3-L1脂肪细胞LC3和Beclin-1 mRNA表达量并没有显著改变(P>0.05),但p62 mRNA表达量极显著降低(P<0.01)(图7)。

图7 Nesfatin-1对3T3-L1脂肪细胞LC3(A)、Beclin-1(B)和p62(C) mRNA表达量的影响Fig.7 Effects of nesfatin-1 on the mRNA expression levels of LC3(A),Beclin-1(B) and p62(C) in 3T3-L1 adipocytes
2.6 Nesfatin-1对3T3-L1脂肪细胞LC3-II和p62蛋白表达量的影响 结果显示,与对照组相比,试验组3T3-L1脂肪细胞的LC3-II蛋白表达量无显著差异(P>0.05),而p62蛋白表达量极显著降低(P<0.01)(图8)。
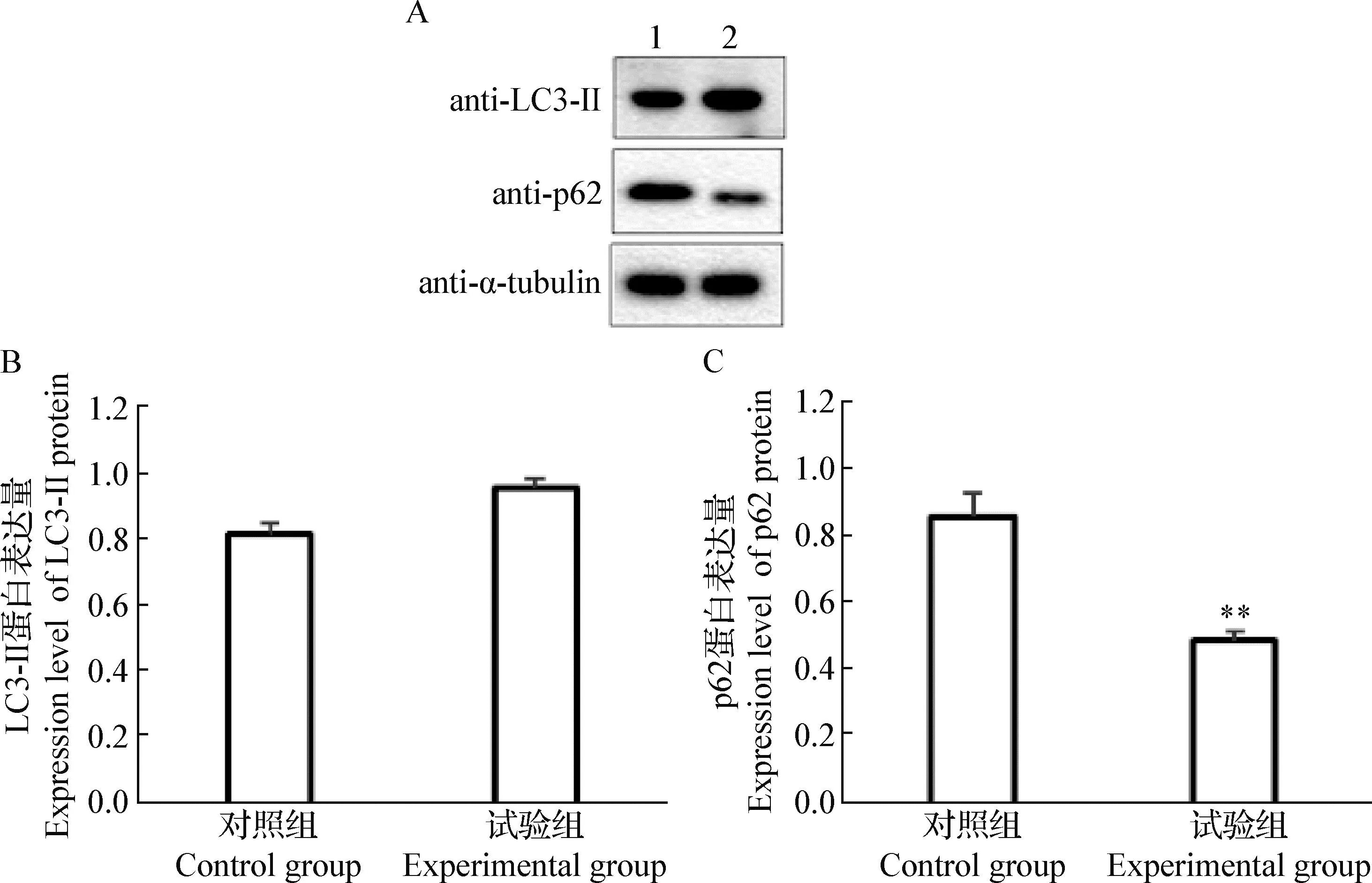
图8 Nesfatin-1对3T3-L1脂肪细胞LC3-II和p62蛋白表达量的影响Fig.8 Effects of nesfatin-1 on the protein expression levels of LC3-II and p62 in 3T3-L1 adipocytesA:Western blot结果(1:对照组; 2:试验组); B:LC3-II蛋白表达量的检测; C:p62蛋白表达量的检测A:Western blot results (1:Control group; 2:Experimental group); B:Expression level of LC3-II protein; C:Expression level of p62 protein
3 讨论
3T3-L1前脂肪细胞作为一种成熟的细胞系,具有一定分化能力,通过特定诱导液的诱导,可以将其诱导为成熟的脂肪细胞。因此,在脂肪细胞的研究中常将3T3-L1前脂肪细胞作为研究对象。本试验通过诱导3T3-L1前脂肪细胞向成熟脂肪细胞分化,并在细胞分化后,以Nesfatin-1进行干预,探讨在高糖状态下Nesfatin-1对脂肪细胞糖代谢和自噬的影响。
前脂肪细胞分化为成熟脂肪细胞后,有2个主要特征:一是细胞形态的变化,由梭形转变为圆形或椭圆形;二是成熟脂肪细胞开始合成甘油三酯,以脂滴的形式储存在胞质内,并且脂滴的数量和大小能够间接反映脂肪细胞的分化程度[10]。在本试验中,诱导3T3-L1前脂肪细胞分化后,细胞形态变化符合以上描述,表明诱导细胞分化成功,油红O染色结果也提示诱导细胞分化成功。
Nesfatin-1是一种新型饱腹因子,经侧脑室注射可呈现摄食行为抑制,并可控制体重增长,由此将其命名为Nesfatin (减肥之意),并将其归为厌食肽[11],它的氨基酸序列在不同物种间有高度的保守性[2]。Nesfatin-1广泛地分布在中枢神经系统和外周组织中,尤其在下丘脑、垂体、肝脏和脂肪组织中大量表达。现已证实,Nesfatin-1参与脂肪代谢、摄食、睡眠、生殖、胃功能、心血管以及血糖等多种生理和病理过程的调控[12],但目前其在脂肪细胞代谢中的作用和机制并不十分清楚。本试验试图探究在高糖状态下Nesfatin-1对3T3-L1脂肪细胞糖代谢和自噬的影响。
自噬是真核细胞通过溶酶体途径,采用“丢卒保车”方式降解细胞质中错误折叠的蛋白、受损细胞器和脂质等胞内物质,是一种基本的调控细胞物质代谢(包括糖代谢)和内环境稳态的方式[13-14]。自噬对机体糖代谢的变化非常敏感,自噬缺失将导致组织葡萄糖耐受性下降[15]。另有研究发现,肥胖小鼠肝脏自噬功能的阻断是造成胰岛素抵抗和代谢损伤的重要原因[16];高糖环境下肾小球足细胞存在自噬功能紊乱[17];急性高糖条件可诱导自噬,通过自噬清除受损线粒体,恢复动态平衡[18]。以上结果均提示,细胞糖代谢与自噬之间存在密切联系。此外,Tao等[8]研究发现,在3T3-L1 前脂肪细胞白色成脂分化过程中,Beclin-1 表达显著上调,表明自噬在脂肪细胞分化过程中发挥重要作用。那么,Nesfatin-1的脂肪代谢调节作用与脂肪细胞的自噬过程是否有关联?在高糖应激下,Nesfatin-1会影响脂肪细胞的自噬吗?目前尚无定论。
本试验体外诱导分化3T3-L1前脂肪细胞后,在高糖状态下以Nesfatin-1对脂肪细胞进行干预,并检测脂肪细胞的糖代谢和自噬情况。根据前期试验结果和文献报道[9],本试验中均选择100 nmol Nesfatin-1,时间点确定为1 h。一般情况下,细胞糖代谢主要涉及葡萄糖的摄取、糖酵解生成丙酮酸等过程,涉及多种蛋白,如己糖激酶、磷酸果糖激酶和丙酮酸激酶等,最终合成大量ATP,供给细胞生命活动所需能量[19]。本试验发现,通过Nesfatin-1干预后,高糖状态下的3T3-L1脂肪细胞对葡萄糖的摄取水平极显著降低(P<0.01),同时,细胞内己糖激酶和磷酸果糖激酶活性也非常显著地减弱(P<0.001)。此结果表明,Nesfatin-1能够有效地降低3T3-L1脂肪细胞对糖的消耗量,其作用机制有待于进一步深入研究。
同时,细胞脂质和葡萄糖代谢的变化会影响自噬。研究发现,I型糖尿病病人脑内自噬分子LC3的表达增加[20]。LC3编码的蛋白是在高等真核细胞中发现的第1种自噬体膜蛋白,细胞内存在2种形式的LC3分子(LC3-I和LC3-II),可作为自噬标志性分子以监测自噬活动,反映自噬进展,因此被作为自噬体的标记分子[21]。Beclin-1是自噬的关键启动子,在自噬早期发挥重要作用,在细胞自噬发生的早期促进自噬体膜的形成和扩张[22]。p62是一种多功能蛋白,参与自噬等多种细胞信号转导和调控。自噬发生时,p62蛋白在细胞质中会不断被降解;自噬发生受到阻碍或自噬功能出现缺陷时,p62蛋白会在细胞质中不断累积增多。因此,p62被认为是反映自噬活性的标记蛋白之一[23]。
在本试验的脂肪细胞自噬检测中发现,与对照组相比,试验组p62 mRNA和蛋白表达量均极显著降低(P<0.01),Beclin-1 mRNA以及LC3 mRNA和蛋白表达量并没有显著性差异(P>0.05)。此结果表明,Nesfatin-1干预不仅能降低脂肪细胞的糖消耗能力,还能上调脂肪细胞的自噬水平。因此,Nesfatin-1可能通过上调自噬水平,降低3T3-L1脂肪细胞对葡萄糖的摄取,从而保护高糖对脂肪细胞的损伤,但其机制有待于进一步探究。在今后研究中,本课题组将从细胞线粒体指标测定和相关蛋白表达量测定、细胞周期和凋亡检测等方面进行相关探讨,以便从多个方向、多个角度和多个水平对Nesfatin-1对高糖作用的机制进行更加深入的探究。
