不同猪繁殖与呼吸综合征疫苗组合体液免疫效果评估
2024-02-01任文慧阮胜男库旭钢张海峰于学祥田梓翰何启盖江云波
任文慧,阮胜男,库旭钢,张海峰,于学祥,田梓翰,何启盖,,江云波,
(1.华中农业大学动物医学院 农业微生物学国家重点实验室,湖北 武汉 430000 ; 2.华中农业大学动物疫病诊断中心,湖北 武汉 430000 ; 3.武汉绿色巨农农牧股份有限公司,湖北 武汉 432000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起,以怀孕母猪繁殖障碍及各阶段猪只呼吸系统障碍为主要特征[1]。PRRSV感染可导致免疫抑制,常与猪链球菌[2]和副猪嗜血杆菌[3]等细菌病原、猪圆环病毒和猪伪狂犬病毒等病毒病原共感染,造成猪场疾病暴发,病死率增高[4],给养殖业造成巨大的经济损失[5]。
PRRSV属于动脉炎病毒科动脉炎病毒属,是有囊膜的单股正链 RNA病毒,容易发生变异。1996年,我国首次分离到经典猪繁殖与呼吸综合征病毒(Classical PRRSV,C-PRRSV),并将该毒株命名为 CH-1a株[6];2006年,国内暴发毒力更强的高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic PRRSV,HP-PRRSV)[7];2014年,国内又报道了NADC30-like毒株的出现[8]。目前,NADC30-like重组毒株(NADC30-like PRRSV,N-PRRSV)成为我国PRRSV主要流行毒株[9]。PRRSV不断变异且重组模式趋于复杂,至今为止,PRRSV在猪场循环传播且没有开发出针对PRRSV的有效药物,因此,选择合适的疫苗并优化疫苗免疫方案是应对PRRS暴发的有效手段。
接种疫苗可以诱导机体产生特异性中和抗体,中和抗体可阻断病毒对猪肺泡巨噬细胞(Porcine alveolar macrophage,PAM)的附着和内化,从而抑制PRRSV在PAM中的复制[10],降低病毒血症以及呼吸和生殖系统障碍。灭活疫苗(Inactivated vaccines,INV)安全性高,弱毒疫苗(Modified live vaccines,MLV)免疫原性好。临床研究显示,在感染PRRSV时,预先接种过PRRS疫苗的母猪场较未接种者损失更低[11],并且接种过2次PRRS弱毒疫苗猪只的死亡率低于仅接种过1次疫苗的猪只[12]。使用灭活疫苗加强免疫时,加强免疫2次比加强免疫1次诱导更强的免疫反应[13-15]。以上研究表明,接种疫苗可以诱导一定的免疫保护,能够比较有效地预防和减少猪群发生PRRS疫情。但目前临床上对疫苗种类和疫苗免疫程序的选择存在多样化,对具体如何选择合适的疫苗及相应的免疫程序对比存在空缺。
本试验设计3种免疫方案,采用酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)检测N蛋白抗体[16]来反映机体的免疫状态,通过病毒中和试验(Virus neutralization test,VNT)检测免疫后机体对不同毒株的中和抗体效价水平,反映疫苗的交叉保护作用[17],不同指标综合评估不同疫苗免疫程序的体液免疫效果[18],以期为猪场免疫程序制定提供参考依据。
1 材料与方法
1.1 主要毒株和细胞 C-PRRSV毒株 R98(GenBank:DQ355796.1)、HP-PRRSV 毒株HUN3 (GenBank:HM853673.2)和N-PRRSV毒株(经典毒株VR2332和NADC30毒株重组),均由本实验室分离保存。猴胚胎肾上皮细胞Marc-145,由本实验室保存。
1.2 主要试剂 猪繁殖与呼吸综合征弱毒疫苗(CH-1R株)和猪繁殖与呼吸综合征灭活疫苗(CH-1a株),均购自兆丰华生物科技有限公司;猪繁殖与呼吸综合征ELISA抗体检测试剂盒,购自荷兰BioChek公司;DMEM培养基干粉,购自美国Gibco公司;胎牛血清,购自内蒙古奥普赛生物科技有限公司;FastPure Viral DNA/RNA Mini Kit和Hiscript Ⅲ All-in-one RT SuperMix Perfect for qPCR,均购自诺维赞生物科技股份有限公司。根据中华人民共和国国家标准(GB/T 35912—2018)设计的探针和引物序列,均由生工生物工程(上海)股份有限公司合成。
1.3 主要仪器 酶标仪,瑞士Tecan公司产品;CO2培养箱,日本SANYO公司产品;小型高速离心机,德国SIGMA公司产品;CFX Connect荧光定量PCR检测系统,美国BIO-RAD公司产品。
1.4 实验动物 于湖北省3个后备母猪场内引入长白二元母猪,经PRRSV特异性实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)和ELISA检测试剂盒检测,血清中PRRSV抗原和抗体均为阴性,将各猪场猪只按体重分为3个阶段,分别为7~20、20~35和35~50 kg,于每个猪场的每个体重阶段猪只中随机挑取20头,共180头。
1.5 试验分组和设计
1.5.1 试验分组 2021年12月—2022年3月,3个猪场随机选择3种免疫方案:第1组,首次免疫PRRS弱毒疫苗(MLV),间隔28 d后加强免疫PRRS灭活疫苗(INV)(混合疫苗组);第2组,首次和加强免疫均使用PRRS弱毒疫苗(弱毒疫苗组);第3组,首次和加强免疫均使用PRRS灭活疫苗(灭活疫苗组)。
1.5.2 免疫接种方式 试验猪群采用肌肉注射的方式接种PRRS疫苗,每次1头份。
1.5.3 样品采集和临床数据统计 分别于免疫前(0 d)以及首次免疫后14、28、42和56 d采集试验猪只的前腔静脉血并标记,分离血清,用于猪繁殖与呼吸综合征ELISA抗体检测试剂盒检测和中和试验检测(中和试验不检测免疫前血清);采集首次免疫后14和28 d试验猪只的血液,用于PRRSV RT-qPCR检测;试验猪只分娩后统计试验猪只头胎的活仔数、断奶仔猪数和窝均总仔数。
1.6 RT-qPCR检测 取200 μL血液样品使用FastPure Viral DNA/RNA Mini Kit提取其基因组RNA,使用Hiscript Ⅲ All-in-one RT SuperMix Perfect for qPCR对RNA进行反转录,取反转录产物按照中华人民共和国国家标准(GB/T 35912—2018)中的反应体系和反应条件进行RT-qPCR,检测血液中是否存在PRRSV。
1.7 ELISA 按照猪繁殖与呼吸综合征ELISA抗体检测试剂盒说明书进行操作,于405 nm波长处检测各样品孔的吸光度(Optical density,OD)值,按照公式(1)计算各样品孔的S/P值(样品和阳性对照的比值),当样品S/P值≥0.5时即判为阳性。根据ELISA判定结果,按公式(2)计算试验猪群的阳性率。
S/P=(待检样品的OD值-阴性对照的平均OD值)÷(阳性对照的平均OD值-阴性对照的平均OD值)
(1)
阳性率(%)=阳性猪只的数量÷该组试验猪只的总数量×100%
(2)
1.8 VNT 应用固定病毒稀释血清法,将Marc-145细胞接种于96孔板A,置于37 ℃、5% CO2细胞培养箱内培养,待细胞铺满70%~80%时开始试验。另取96孔板B每孔加入50 μL DMEM培养液,第1列加入50 μL预先于56 ℃灭活30 min的血清,混匀后吸取50 μL混合液于第2列,如此重复稀释至第6列,吸取50 μL弃去,将第1列血清进行2倍倍比稀释,每个稀释度设4个重复。同时设置病毒阳性对照孔和无病毒血清对照孔。将PRRSV病毒液(C-PRRSV、HP-PRRSV和N-PRRSV)稀释为200 TCID50/100 μL,向以上血清稀释孔和病毒阳性对照孔内加入50 μL病毒液,置于培养箱孵育1 h。将96孔板B内的混合培养液转移到96孔板A中,孵育2 h,弃去上清,加200 μL含2%胎牛血清和1%双抗的DMEM培养液,培养3~5 d,在倒置显微镜下观察细胞病变,以能完全抑制细胞病变的最大稀释度为该血清的中和抗体效价,按照Karber法计算每份血清针对不同病毒的中和抗体效价[19]。当中和抗体效价>4时,判定待测血清为PRRSV中和抗体阳性血清。根据VNT得到的试验猪只血清对C-PRRSV、HP-PRRSV和N-PRRSV毒株的中和抗体效价,按公式(3)计算试验猪群中和抗体阳性率。
中和抗体阳性率(%)=(中和抗体效价>4的猪只数量)÷该组试验猪只总数量×100%
(3)
1.9 统计学方法 采用Graphpad Prism 生物学软件对数据进行分析,使用方差分析进行差异显著性检验,P≥0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 RT-qPCR检测 免疫前及首次免疫后14和28 d时分别采集试验猪只的血液,通过RT-qPCR检测PRRSV,结果显示,所有样品均为阴性。
2.2 不同免疫程序诱导的ELISA抗体水平 针对混合疫苗组,免疫前(0 d)以及首次免疫后14、28、42和56 d采集血清进行的ELISA抗体检测结果显示,首次免疫后14 d时,各体重阶段均存在抗体转阳的试验猪只,7~20、20~35和35~50 kg体重阶段猪只血清的抗体阳性率分别为10%、15%和20%。与免疫前(0 d)相比,首次免疫后28 d时,仅35~50 kg体重阶段猪只血清S/P值显著升高(P<0.05),抗体水平增高程度较其他2个体重阶段更大;首次免疫后42和56 d时,所有试验猪只血清S/P值均极显著升高(P<0.01)(图1)。
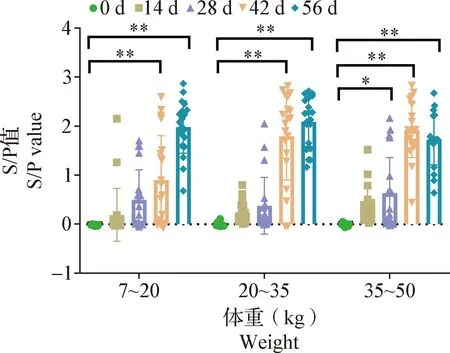
图1 混合疫苗组ELISA抗体检测结果Fig.1 ELISA antidody detection results of Mixed vaccine group*:P<0.05,**:P<0.01,下图同*:P<0.05,**:P<0.01. The same as below
对于弱毒疫苗组,免疫前(0 d)以及首次免疫后14、28和56 d采集血清进行的ELISA抗体检测结果显示,首次免疫后14 d时,各体重阶段均存在抗体转阳的试验猪只,7~20、20~35和35~50 kg体重阶段猪只血清的抗体阳性率分别为25%、15%和55%,28 d时,分别为10%、35%和65%。与免疫前(0 d)相比,首次免疫后28 d时,仅35~50 kg体重阶段猪只血清S/P值极显著升高(P<0.01),抗体水平增高程度较其他2个体重阶段更大;首次免疫后56 d时,所有试验猪只血清S/P值均极显著升高(P<0.01)(图2)。

图2 弱毒疫苗组ELISA抗体检测结果Fig.2 ELISA antidody detection results of Attenuated vaccine group
对于灭活疫苗组,免疫前(0 d)以及首次免疫后14、28、42和56 d采集血清进行的ELISA抗体检测结果显示,所有试验猪只血清检测结果均为阴性(P>0.05)(图3)。
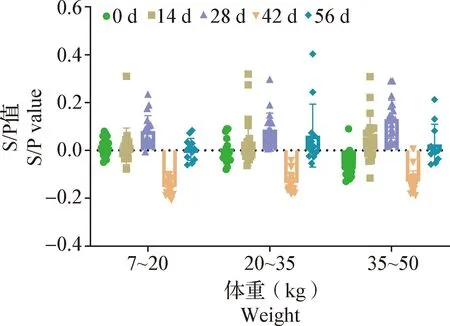
图3 灭活疫苗组ELISA抗体检测结果Fig.3 ELISA antidody detection results of Inactivated vaccine group
比较以上3种免疫程序的ELISA抗体检测结果,在首次免疫后14、28、42和56 d时,混合疫苗组血清S/P值显著高于灭活疫苗组(P<0.05或P<0.01);首次免疫后56 d时,混合疫苗组血清S/P值极显著高于弱毒疫苗组(P<0.01);在首次免疫后14、28和56 d时,弱毒疫苗组血清S/P值极显著高于灭活疫苗组(P<0.01),即混合疫苗组的免疫效果最好,其次为弱毒疫苗组(图4)。
2.3 不同免疫程序诱导的交叉保护水平 对于混合疫苗组,首次免疫后14、28、42和56 d时,试验猪只血清针对C-PRRSV的VNT结果显示,首次免疫后28 d时,仅7~20 kg体重阶段猪只中存在2头(2/20)中和抗体效价转阳;首次免疫后56 d时,所有试验猪只均转为中和抗体效价阳性;首次免疫后42 d时,7~20、20~35和35~50 kg体重阶段中和抗体效价达8的试验猪只分别占比25%、10%和20%,56 d时,分别占比80%、70%和85%。与首次免疫后14 d相比,首次免疫后42 d时,试验猪只血清中和抗体效价显著升高(P<0.05或P<0.01);首次免疫后56 d时,所有试验猪只血清中和抗体效价均极显著升高(P<0.01),均值为14(图5A)。针对HP-PRRSV的试验结果显示,首次免疫后28 d时,仅20~35 kg体重阶段猪只存在1头(1/20)中和抗体效价转阳。与首次免疫后14 d相比,首次免疫后42 d时,7~20和20~35 kg体重阶段试验猪只血清中和抗体效价均极显著升高(P<0.01);首次免疫后56 d 时,所有试验猪只血清中和抗体效价均极显著升高(P<0.01),此时,7~20、20~35和35~50 kg体重阶段中和抗体效价达8的试验猪只分别占比65%、45%和40%,试验猪只血清中和抗体效价均值为8.5(图5B)。针对N-PRRSV的试验结果显示,中和抗体效价仅在首次免疫后56 d时可检测到,但效价低于4(图5C)。结果表明,混合疫苗组免疫可以促进免疫猪中和抗体水平的显著提升。
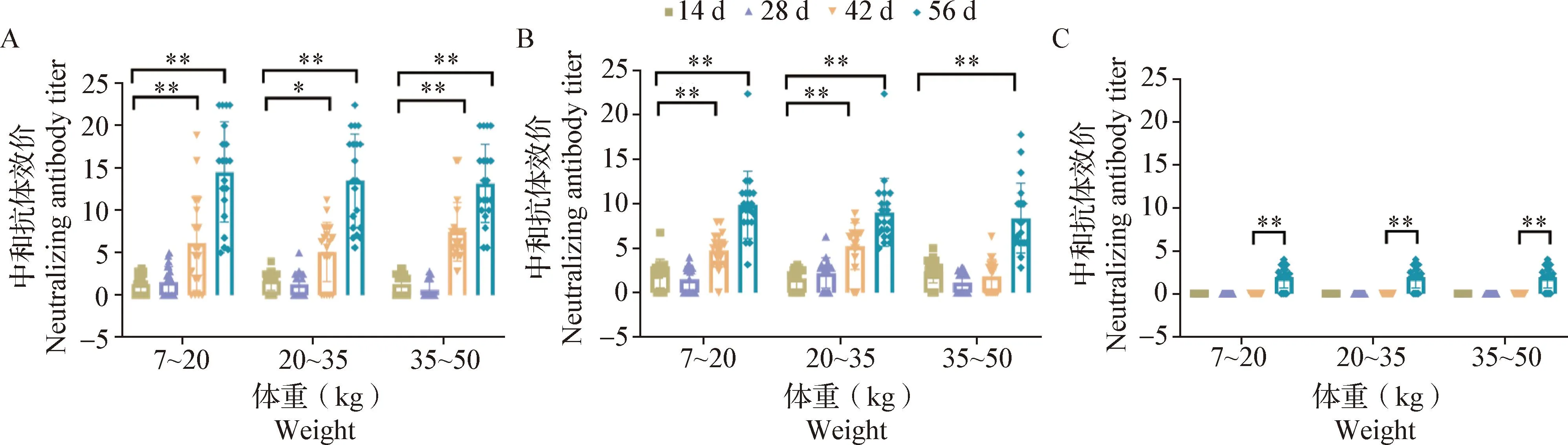
图5 混合疫苗组对C-PRRSV(A)、HP-PRRSV(B)和N-PRRSV(C)的中和抗体效价Fig.5 Neutralizing antibody titers of Mixed vaccine group against C-PRRSV(A),HP-PRRSV(B) and N-PRRSV(C)
对于弱毒疫苗组,首次免疫后14、28和56 d时,试验猪只血清针对C-PRRSV的VNT结果显示,首次免疫后28 d时,7~20、20~35和35~50 kg体重阶段中和抗体效价阳性的试验猪只分别占比30%、10%和10%,56 d时,分别占比5%、10%和20%,但试验猪只中和抗体效价均低于8。首次免疫后56 d时,35~50 kg体重阶段的试验猪只的中和抗体效价极显著高于首次免疫后14 d(P<0.01)(图6A)。针对HP-PRRSV的试验结果显示,在首次免疫后28 d时,7~20、20~35和35~50 kg体重阶段中和抗体效价阳性的试验猪只分别占比10%、5%和0,56 d时,分别占比0、15%和10%,但试验猪只中和抗体效价均低于8;首次免疫后56 d时,20~35和35~50 kg体重阶段的试验猪只血清中和抗体效价极显著高于首次免疫后14 d(P<0.01)(图6B)。针对N-PRRSV的试验结果显示,所有试验猪只的血清中和抗体效价均未转阳(图略)。
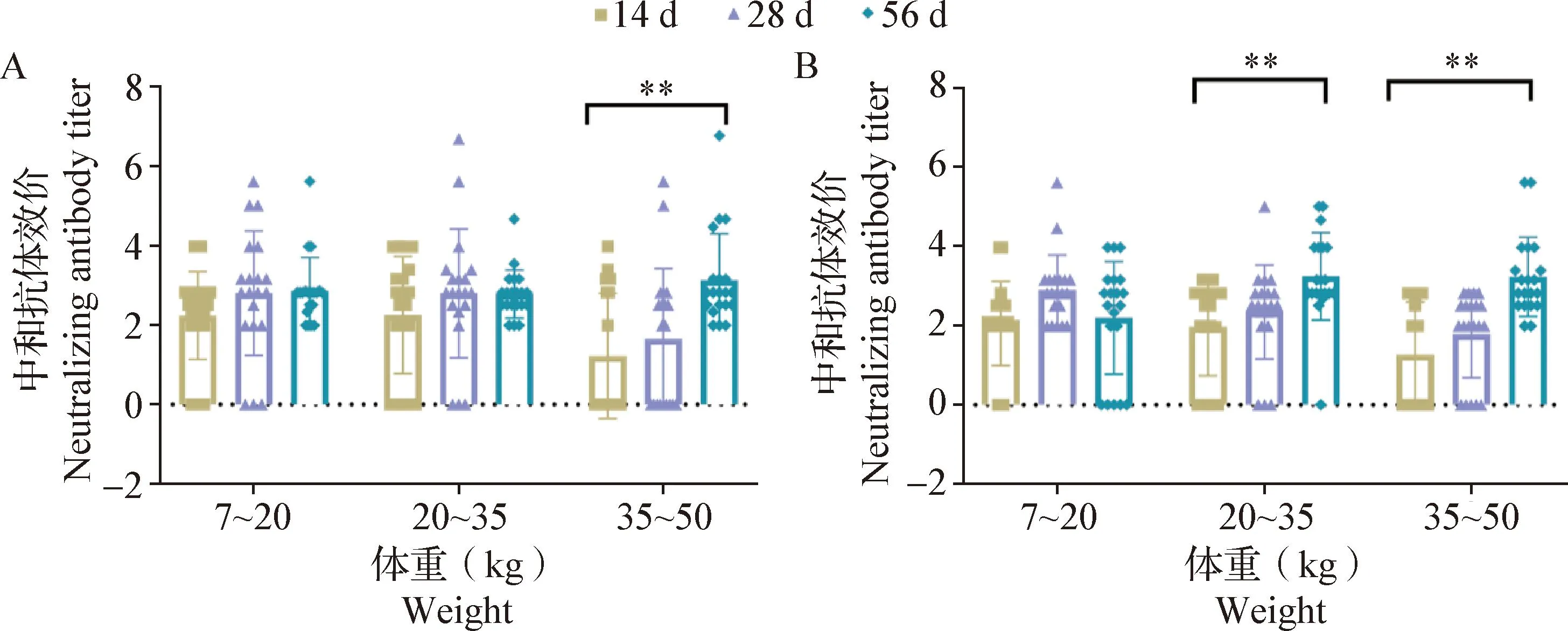
图6 弱毒疫苗组对C-PRRSV(A)和HP-PRRSV(B)的中和抗体效价Fig.6 Neutralizing antibody titers of Attenuated vaccine group against C-PRRSV(A) and HP-PRRSV(B)
对于灭活疫苗组,针对C-PRRSV、HP-PRRSV和N-PRRSV的VNT结果显示,与首次免疫后14 d相比,首次免疫后28、42和56 d试验猪只血清中和抗体效价均无显著差异(P>0.05),且均低于8。针对C-PRRSV,在首次免疫后28 d时,7~20、20~35和35~50 kg体重阶段中和抗体效价阳性的试验猪只分别占比0、20%和10%(图7A);针对HP-PRRSV,首次免疫28 d时仅20~35 kg体重阶段试验猪只中有2头(2/20)血清中和抗体效价转阳(图7B)。针对N-PRRSV的试验结果显示,所有试验猪只的血清中和抗体效价均未转阳(图略)。
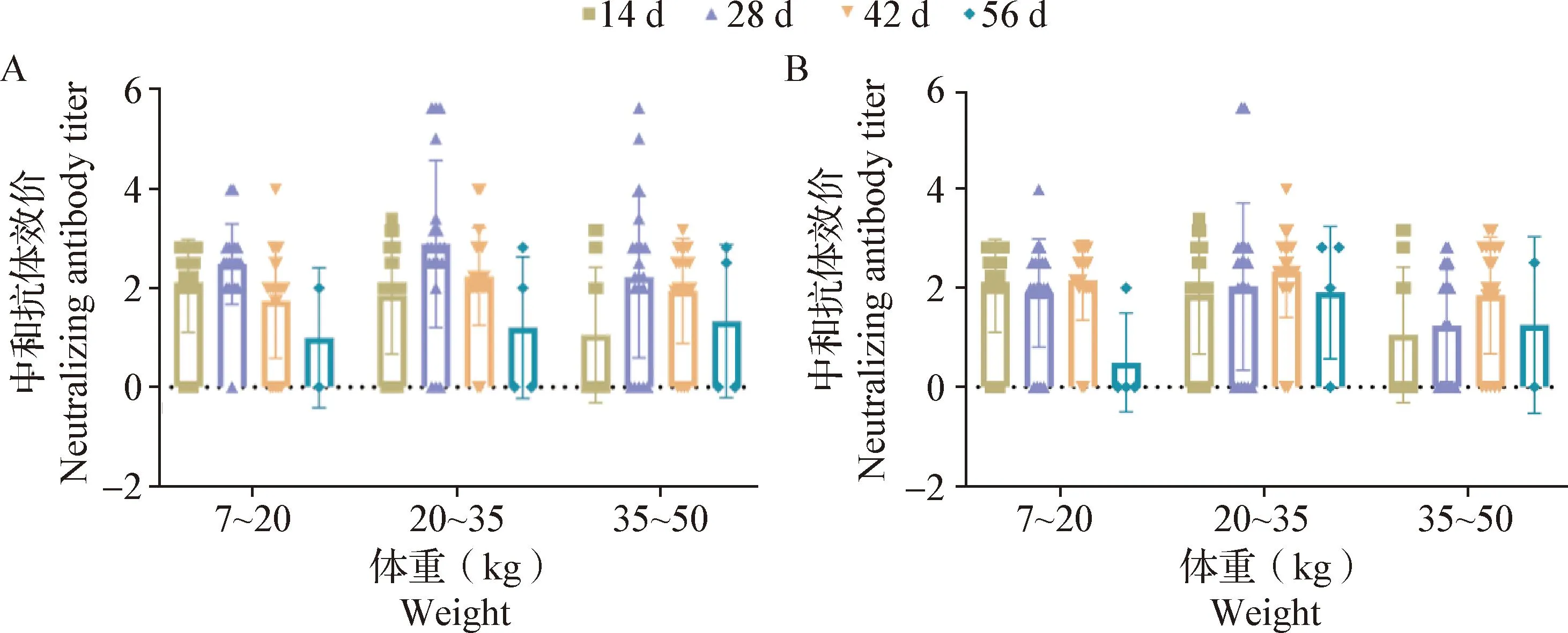
图7 灭活疫苗组对C-PRRSV(A)和HP-PRRSV(B)的中和抗体效价Fig.7 Neutralizing antibody titers of Inactivated vaccine group against C-PRRSV(A) and HP-PRRSV(B)
比较以上3种免疫程序的VNT结果,首次免疫后14和28 d时,各组之间中和抗体效价水平差异不显著(P>0.05);首次免疫后42和56 d时,混合疫苗组试验猪只血清针对C-PRRSV的中和抗体效价极显著高于HP-PRRSV和N-PRRSV(P<0.01),疫苗对同源毒株的保护效价较好。针对C-PRRSV的中和抗体效价结果显示,首次免疫后42 d时,混合疫苗组中和抗体效价水平极显著高于灭活疫苗组(P<0.01),首次免疫后56 d时,混合疫苗组中和抗体效价极显著高于弱毒疫苗组和灭活疫苗组(P<0.01)。针对HP-PRRSV的中和抗体效价结果显示,首次免疫后42 d时,混合疫苗组中和抗体效价极显著高于灭活疫苗组(P<0.01);首次免疫后56 d时,混合疫苗组中和抗体效价极显著高于弱毒疫苗组和灭活疫苗组(P<0.01)(图8)。结果表明,混合疫苗组的免疫效果优于弱毒疫苗组和灭活疫苗组。
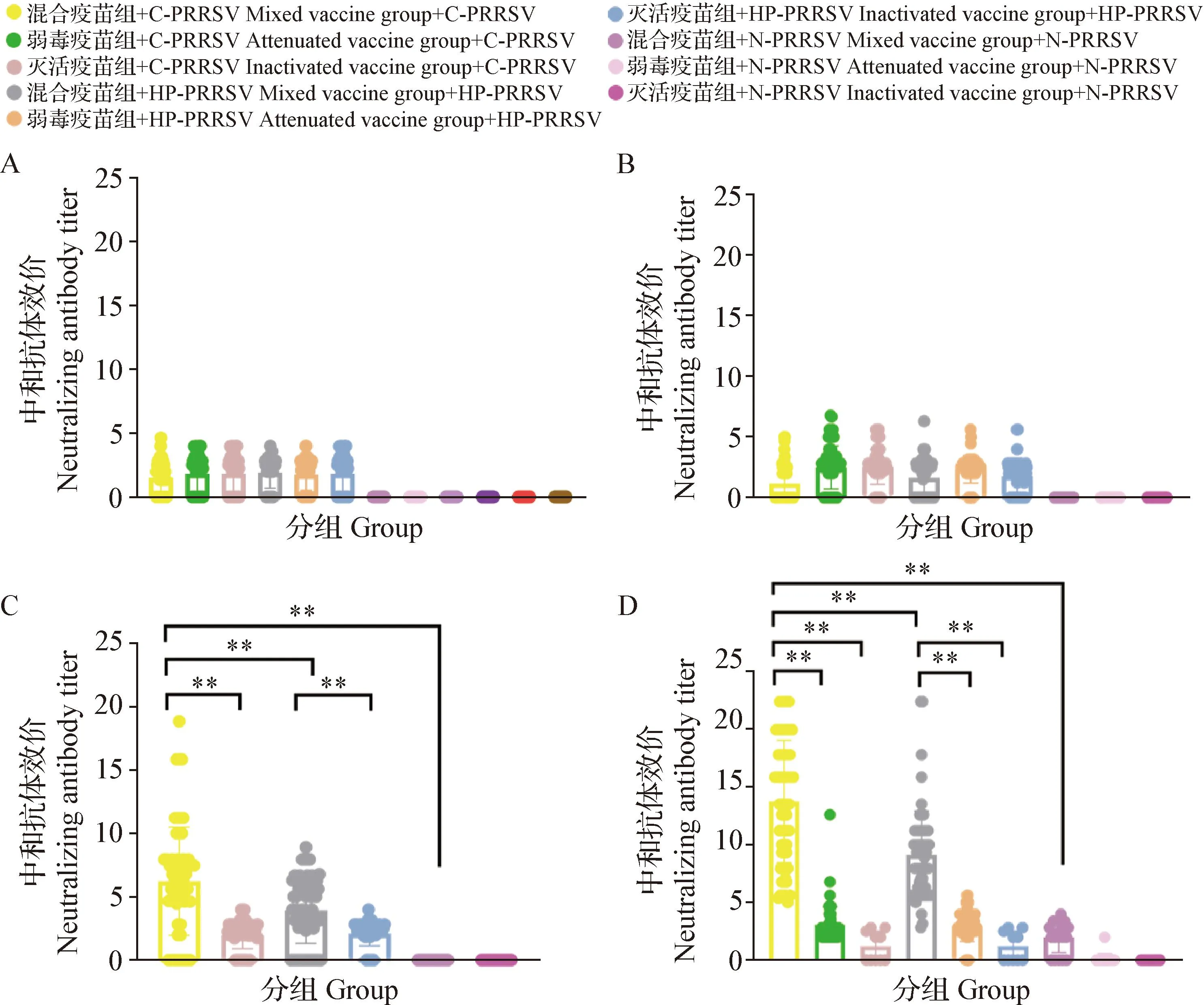
图8 3个组中和抗体效价结果比较Fig.8 Comparison of neutralizing antibody titer results among the three groupsA:14 d; B:28 d; C:42 d; D:56 d
2.4 不同免疫程序的临床生产指标 后备猪生长至约100 kg时开始配种,统计分娩后母猪头胎产仔的活仔数、断奶仔猪数和窝均总仔数,结果显示,3个组之间差异均不显著(P>0.05)(图9)。

图9 不同免疫组每胎次产仔数Fig.9 Number of offspring per litter in different immunization groupsns:P>0.05
3 讨论
PRRSV感染给养猪场造成巨大经济损失,猪场主要通过淘汰阳性猪只和加强生物安全等措施来防控PRRS[20-21]。但是,这些措施通常耗时长,而疫苗免疫相对而言更经济有效,已经广泛应用于PRRS防控。研究表明,PRRS弱毒疫苗可比灭活疫苗诱导更强的免疫反应[13,22]。但由于PRRSV的基因组不断变异,导致疫苗难以起效[23],因此,探讨疫苗在临床中的应用效果具有重要意义。
本试验通过ELISA检测到,首次免疫后14 d时,部分试验猪只血清由PRRSV抗体阴性转为阳性,而VNT在首次免疫后28 d时才可检测到血清中和抗体效价转为阳性。研究显示,ELISA检测到抗体的时间较早,中和抗体约在免疫后1个月产生[24-25],与本试验结果一致。研究显示,PRRSV可诱导试验猪机体产生多克隆B细胞,随后形成抗体[26],这些抗体可通过ELISA检测到[27-28],但不具有中和活性,同时可激发抗体依赖性增强效应,最终表现为低水平的中和抗体效价。C-PRRSV、HP-PRRSV和N-PRRSV之间均可发生该现象[29-30]。本试验结果显示,使用混合疫苗组接种的试验猪群相比另2个组可更显著地克服抗体依赖性增强现象,表现更高水平的中和抗体效价水平。
本试验中混合疫苗组在首次免疫后56 d时,针对C-PRRSV和HP-PRRSV的中和抗体效价均值分别为14和8.5。PRRS疫苗对于同源毒株的中和抗体效价水平更强,与先前的研究结果一致[31-32]。研究显示,试验猪只受到PRRSV攻击时,疫苗对同类PRRSV复制的抑制作用更强,因此VNT中会表现出针对经典毒株更高的中和抗体效价水平[33]。研究认为,当对PRRSV的中和抗体效价达到8时,猪只在临床上才能免受该PRRSV毒株的感染[18],本试验中混合疫苗组的试验猪只已经具有在临床上抵抗C-PRRSV和HP-PRRSV感染的能力,而弱毒疫苗组和灭活疫苗组试验猪只则不具有抵抗PRRSV感染的能力。研究显示,灭活疫苗生产时的灭活程序会破坏病毒中和表位,导致试验猪只仅接种灭活疫苗后不能检测到中和抗体[26],但灭活疫苗会诱导高水平的免疫记忆,所以经过PRRSV感染后的试验猪只免疫灭活疫苗可检测到中和抗体和细胞免疫反应[34],这可能是混合疫苗组免疫效果好于灭活疫苗组的原因之一。
本试验设置了3种免疫程序:首次免疫弱毒疫苗,28 d后加强免疫灭活疫苗;首次和加强免疫均为弱毒疫苗;首次和加强免疫均为灭活疫苗,通过RT-qPCR、ELISA和VNT检测试验猪只体内PRRSV和抗体水平。试验中猪只日增重和病毒血症可作为疫苗免疫后影响猪只健康状况的重要依据,但由于本试验于养殖场内开展,同时由于非洲猪瘟疫情原因导致试验人员不能每日进场进行日增重测定,且缺少了弱毒疫苗组首次免疫后42 d的血清样品。最终选取了各猪场统一数据,以母猪头胎活仔数、断奶仔猪数和窝均总仔数作为生产方面的数据。试验中未对猪只进行攻毒,缺少相关数据,下一步将继续完善试验设计,监测试验猪只的日增重和健康状况等数据。
综上所述,进行3种免疫程序后,所有试验猪只均未检测出针对N-PRRSV的有效中和抗体。但通过ELISA和VNT对比3种免疫程序的试验猪只抗体水平,证实首次免疫PRRS弱毒疫苗,28 d后加强免疫PRRS灭活疫苗,抗体水平优于首次和加强免疫均使用弱毒疫苗或者灭活疫苗。
