3例犬炎性乳腺癌的病理学诊断和组织学分级评价
2024-02-01石俊超贾茜涵贺文琦陆慧君
高 蕊,石俊超,张 竞,贾茜涵,马 莹,贺文琦,陆慧君
(吉林大学动物医学学院,吉林 长春 130062)
炎性乳腺癌(Inflammatory mammary carcinoma,IMC)是犬所患最具侵袭性的乳腺肿瘤类型之一,发病率在犬恶性乳腺肿瘤中占17.7%[1],患犬通常伴有全身水肿、红斑、溃疡和肿瘤区域疼痛等临床特征,这些炎性特征与乳腺炎或严重皮炎较为相似,因此,仅通过临床检查无法进行精确诊断,常需借助病理学技术进行实验室检测分析。本试验通过苏木精-伊红(Hematoxylin-eosin,H.E.)染色和免疫组织化学染色进行组织病理学分析,结合临床表现将3例病例确诊为犬IMC。
1 材料与方法
1.1 病例基本信息 2019年10月—2022年11月,于吉林大学动物医学学院动物病理解剖学实验室所收集的3例雌性犬疑似乳腺肿瘤临床病例。
病例1:混种犬,雌性,未绝育,15岁,曾患肾病和胰腺炎。肿物位于右侧第四、五乳腺之间,出现破溃(图1A)。

图1 病灶大体检查Fig.1 Gross examination of lesionsA:病例1; B:病例2; C:病例3箭头:肿瘤A:Case 1; B:Case 2; C:Case 3 Arrow:The tumor
病例2:吉娃娃,雌性,已绝育,11岁。肿物位于右侧第五乳腺,出现破溃(图1B)。
病例3:泰迪犬,雌性,未绝育,9岁。肿物位于最后一对乳腺,已发现2年,肿物出现表皮破溃(图1C)。
1.2 主要试剂 甲醛(37%~40%)、乙醇(99.5%)、二甲苯(99.5%)、伊红染色液、苏木素染色液、碳酸锂和中性树胶封片剂,均购自生工生物工程(上海)股份有限公司;石蜡,购自江苏世泰实验器材有限公司;浓盐酸,购自国药集团化学试剂有限公司;全角蛋白(Pan-cytokeratin,Pan ck)抗体(货号:914204),购自Biolegend公司;角蛋白8(Cytokeratin 8,CK8)抗体(货号:GB11231)和血管性血友病因子(Von Willebrand factor,VWF)抗体(货号:GB11020),均购自武汉赛维尔生物科技有限公司。
1.3 主要仪器 组织包埋机(KD-BM)和摊片机(KD-P),科迪仪器设备有限公司产品;石蜡切片机(RM2245)和病理组织切片刀(E0997),Leica Biosystem产品;包埋盒(EM102)和不锈钢包埋盒底膜(80203-0002),江苏世泰实验器材有限公司产品;电热鼓风干燥箱(DHG-9023A)和水浴锅(KD-8D),上海一恒科学仪器有限公司产品;扫描仪(250/MIDI),3D Histech Panoramic产品;水平摇床(KJ-201BD),吉林库美生物科技有限公司产品;光学显微镜(TS100),上海尼康仪器有限公司产品;制冰机(IMS-40),常熟雪科雪花制冰机产品;分析天平(TP-A200),福建华志电子科技有限公司产品。
1.4 苏木精-伊红染色 将手术切除的乳腺肿物置于10%中性福尔马林固定液中固定24 h以上。修块后将组织置于包埋盒中,放入100%Ⅰ、100%Ⅱ、95%、90%、80%和70%乙醇溶液中,各脱水30 min;然后放入二甲苯Ⅰ和Ⅱ溶液各透明30 min;分别3次放入65 ℃石蜡溶液中,各透蜡40 min,取出后于组织包埋机中进行包埋。利用石蜡切片机将石蜡块切成厚度为3 μm的切片,置于42 ℃水浴锅中展片,待切片展平后贴于载玻片上,放入65 ℃烘箱中烤30 min。将3 μm的石蜡切片脱蜡,复水,进行H.E.染色,经梯度乙醇脱水、二甲苯透明后,滴加中性树胶封片,自然晾干24 h,于光学显微镜下观察肿物的组织病理学变化。
1.5 免疫组织化学染色 石蜡切片脱蜡复水,在柠檬酸钠缓冲液中煮沸20 min进行抗原修复,滴加内源性过氧化物酶阻断剂,磷酸盐吐温缓冲液(Phosphate buffer solution tween,PBST)冲洗后,使用正常动物非免疫血清进行封闭,选择Pan ck抗体、CK8抗体和VWF抗体作为一抗,4 ℃孵育过夜,PBST冲洗后滴加生物素标记的二抗,孵育10 min,PBST冲洗3次后滴加链霉菌抗生物素蛋白-过氧化物酶,PBST冲洗3次,滴加DAB显色液进行显色,自来水冲洗终止显色,用苏木精进行复染,于光学显微镜下观察组织中阳性产物的表达位置。
2 结果
2.1 苏木精-伊红染色 3例病例的病理组织学特征具有一定的相似性,即肿瘤均位于皮下,表皮发生溃疡(图2A),肿瘤内部可见大小不一的巢状结构(图2B)。深部的肿瘤细胞排列呈腺体结构或实性岛状或筛状结构,边缘由多层大小不一的腺上皮细胞构成,细胞之间界限不清,细胞呈圆形至多角形,胞浆丰富,核仁清晰,可见中央泡状核,细胞和胞核异型性高,有丝分裂常见,形成管状癌或致密型癌(图2C和2D);部分肿瘤形成的管腔非常小,呈圆形或不规则形,聚集在一起形成筛状癌的特征(图2E);部分腺体区域中央为脱落的上皮细胞并混有坏死的细胞碎片,形成干酪样坏死区,具有粉刺性癌的特征(图2F)。淋巴结内部充满侵犯的肿瘤细胞(图2G);肿瘤边缘真皮内的淋巴管明显扩张,管内出现大量肿瘤细胞栓子(图2H和2I)。

图2 H.E.染色显微镜观察Fig.2 H.E. staining microscopic observationA:肿瘤区域表皮发生溃疡; B:肿瘤内部排列紊乱; C:肿瘤细胞排列呈腺体样结构; D:肿瘤细胞排列呈实性岛状结构(红圈:有丝分裂象); E:肿瘤细胞排列呈筛状结构; F:肿瘤细胞形成粉刺性癌; G:淋巴结内充满侵犯的肿瘤细胞; H、I:真皮淋巴管明显扩张,管内出现大量肿瘤细胞栓子A: Ulceration in the epithelium of the tumor area; B: Disordered arrangement inside the tumor; C: Tumor cells arranged in glandular-like structures; D: Solid island-like arrangement of tumor cells (red circle: mitosis); E: Tumor cells arranged in cribriform structures; F: Tumor cells forming comedocarcinoma; G: Lymph node filled with invasive tumor cells; H, I: Marked dilation of dermal lymphatic vessels, with numerous tumor cell emboli inside the vessels
2.2 免疫组织化学染色 为了进一步证实3例病例肿瘤细胞的来源,选择Pan ck、CK8和VWF抗体进行免疫组织化学染色。结果显示,3例病例Pan ck染色后肿瘤细胞胞浆均呈阳性(图3A和3B);CK8染色后肿瘤细胞胞浆呈阳性(图3C和3D);VWF染色后内皮细胞胞质呈阳性,证实这些肿瘤细胞均位于淋巴管/血管内(图3E和3F)。

图3 免疫组织化学染色显微镜观察Fig.3 Immunohistochemical staining microscopic observationA:病例3 Pan ck免疫组织化学染色; B:病例2 Pan ck免疫组织化学染色; C、D:病例1 CK8免疫组织化学染色; E:病例2 VWF免疫组织化学染色; F:病例1 VWF免疫组织化学染色A:Immunohistochemical staining of Pan ck in case 3; B:Immunohistochemical staining of Pan ck in case 2; C,D:Immunohistochemical staining for CK8 in case 1; E:Immunohistochemical staining for VWF in case 2; F:Immunohistochemical staining for VWF in case 1
2.3 综合诊断 经过H.E.染色和免疫组织化学染色,证实3例病例的肿瘤细胞均为腺上皮起源,肿瘤灶中存在几种不同的生长模式,如管状、实性、筛状和粉刺性,且淋巴管和血管内存在大量肿瘤细胞栓子,肿瘤细胞均具有极高的异型性,分化程度差;结合临床特征(术前肿瘤出现溃疡和红肿)进行综合诊断,3例病例均符合炎性乳腺癌的特征。
根据Pena分级系统[2],以导管形成、核异型性和有丝分裂数为评判标准。当导管形成范围大于75%时,评分为1分;当导管形成范围为10%~75%时,评分为2分;当导管形成范围小于10%时,评分为3分。若核均匀规则,偶见核仁,评分为1分;若核大小和形状具有中等程度差异,核深染,存在核仁,评分为2分;若核大小差异明显,核深染,常有1个或多个明显的核仁,评分为3分。在10个高倍视野下,有丝分裂数0~9个为1分,10~19个为2分,大于20个为3分。三者相加,若总评分在3~5分为Ⅰ级,总评分在6~7分为Ⅱ级,总评分在8~9分为Ⅲ级。在此标准下,将病例1诊断为Ⅲ级炎性乳腺癌,病例2和病例3均诊断为Ⅱ级炎性乳腺癌(表1)。
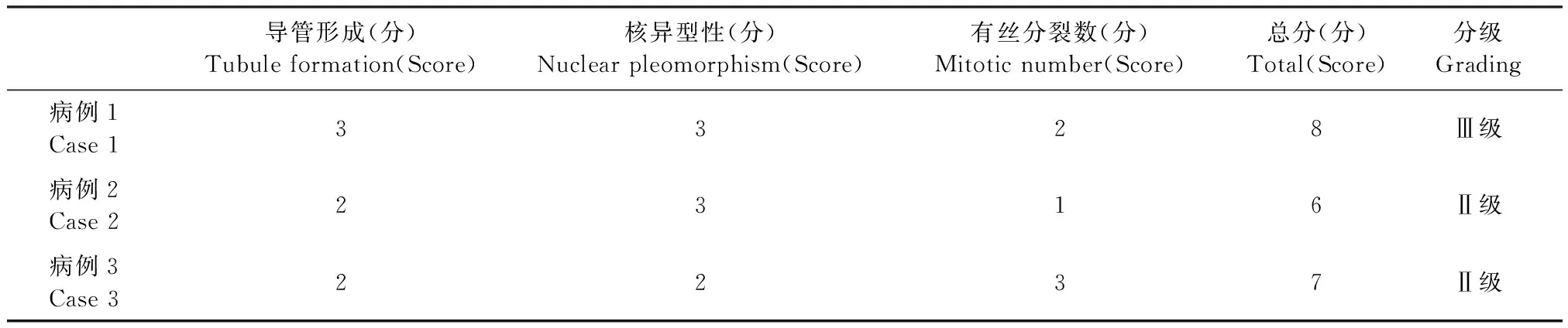
表1 犬炎性乳腺癌分级评分Table 1 Grading scores for canine inflammatory mammary carcinoma
3 讨论
人类炎性乳腺癌(Human inflammatory breast carcinoma,HIBC)最初是用于描述一种特殊类型的人类乳腺癌,临床表现类似于皮炎或乳腺炎,该肿瘤具有发病率低和死亡率高的特点[3]。1983年,Susaneck等[4]报道了10只雌性自发IMC的患犬,因其与HIBC表现相似的临床和病理学特征而得名。IMC是一个临床病理学的术语,包含一类肿瘤实体,例如致密型乳腺癌(Solid carcinoma)、管状乳突癌(Tubulopapillary carcinoma)、未分化癌(Anaplastic carcinoma)和富含脂质的癌(Lipid-rich carcinoma)等[5],此类肿瘤特征为生长迅速[6],皮肤红、肿、热、痛,触感坚硬,外观与急性乳腺炎或皮炎相似。IMC的典型组织病理学特征为真皮淋巴管内出现肿瘤栓子,由于肿瘤栓子阻塞淋巴管导致临床出现红、肿、热、痛的特征,部分病例由于肿瘤细胞侵犯邻近的表皮而导致皮肤出现溃疡。该病的诊断依赖于临床特征与病理组织学特征结合。
IMC是一种具有高转移潜力和低生存率的侵袭性癌症,常伴有肿瘤栓子侵犯淋巴管,这种特征通常会使患病动物预后较差。本文的3例犬IMC病例在组织学上具有相似的特征,多数肿瘤形成广泛的小管,肿瘤细胞大小不一、形态各异,具有明显的核异形性和高有丝分裂数,并伴有淋巴管扩张,肿瘤栓子浸润淋巴管,该结果与Jong-Hyuk等[7]确诊的西施犬炎性乳腺癌所描述的病理组织学特征相吻合。
本文中3例IMC患犬均表现出严重的真皮淋巴管浸润,且病例2出现肿瘤细胞侵犯淋巴结的现象,符合IMC病理诊断的组织学标准。与以往报道不同之处在于,本文3例病例在组织学上除表现管状癌外,均出现典型的粉刺性癌、致密型癌和筛状癌等不同的生长模式。由于粉刺性癌在组织学上也常出现严重的淋巴管和血管浸润,所以,需要一个界定值来区分粉刺性癌和炎性乳腺癌。据文献报道,当粉刺模式占肿瘤细胞群的50%以上,可诊断为粉刺性癌[8]。而本文的3例病例虽有粉刺性癌的生长模式,但占比约30%,不足以诊断为粉刺性癌。因此,此占比指数(50%)可用于在组织学上鉴别粉刺性癌与炎性乳腺癌。
病理组织学诊断是肿瘤诊断中最重要的一个环节,对于一些分化程度差,尤其是特殊上皮型乳腺癌需要进一步应用免疫组织化学染色进行诊断。本试验在H.E.染色的基础上进行免疫组织化学染色,以确定肿瘤细胞的起源,评估肿瘤栓子是否侵入淋巴管/血管内。对存在于上皮组织胞浆中特异性的Pan ck进行免疫组织化学染色,证明3例病例的肿瘤细胞均来源于上皮细胞;对存在于腺上皮组织胞浆中特异性的CK8进行免疫组织化学染色,证明3例病例的肿瘤细胞均来源于腺上皮;对存在于内皮细胞的胞浆中特异性的VWF进行免疫组织化学染色,证实淋巴管内出现肿瘤栓子。三者联合应用,可对组织和细胞中的抗原进行准确定位,从而确定原发部位,预测肿瘤的预后。虽然淋巴管侵犯是IMC的组织学标志,但并不具备特异性[8],需要与临床特征相结合以达到精确诊断。
肿瘤的组织学分类和良恶性是反映肿瘤细胞形态学特征和生物学行为的重要参数,恶性肿瘤的组织学分级常能反映肿瘤的分化程度,是疾病转归的重要预测因子;分级越高的肿瘤越具有侵袭性,低级别肿瘤通常比高级别肿瘤生长更慢,不容易发生扩散和转移[9]。在人类医学中,组织学类型和分级共同评估比单独的组织学类型更能准确地判断乳腺癌的预后情况。同样,在犬中,肿瘤的分型结合分级可以比较准确的预测不同类型肿瘤特有的生物学行为和侵袭转移能力[10]。本文所分析的3例犬IMC,在组织学分型的基础上应用Pena分级系统,通过观察乳腺肿瘤的导管形成、核异型性和有丝分裂数来评估其分级,结果显示,3例犬IMC组织学分级为Ⅱ级或Ⅲ级,表明其分化程度差,有扩散转移的风险,通常预后不良。
由于肿瘤细胞阻塞皮肤淋巴管,导致IMC患犬出现水肿、红斑、溃疡、乳腺坚硬、温热,或伴有乳腺结节,并涉及腋窝、乳腺和腹股沟区域的疼痛。虽然这些特征与乳腺炎和皮炎等炎症性疾病的临床症状相似,但在IMC中,炎症细胞浸润并不常见[11]。临床上现已发现原发性和继发性2种IMC,原发性IMC发生在无乳腺肿瘤病史的患犬,继发性IMC发生在有乳腺肿瘤病史的患犬,原发性IMC更具侵袭性,生长速度更快,预后较差[12-13]。在现有的治疗手段中,手术切除仍是治疗犬IMC的首选方法,由于IMC是一种侵袭性的肿瘤性疾病,并伴有广泛的炎症表现,手术边缘难以确定,存在不完全切除的风险。所以,仅依靠手术治疗往往无法缓解,并有复发的可能性,应进一步实施辅助化疗、放疗或舒减疗法[14]。一项临床研究显示,使用非选择性环氧合酶-2(Cyclooxygenase-2,COX-2)抑制剂,并单独或联合使用其他化疗药物,如卡铂(Carboplatin)、卡霉素(Doxorubicin)、卡培他滨(Capecitabine)或顺铂(Cisplatin)治疗IMC有更好的效果[15-16]。
本试验的3例犬炎性乳腺癌病例的病理学诊断和组织学分级评价结果不仅为IMC的病理诊断提供重要依据,而且为临床病例治疗方案的制定和预后评估提供参考。由于犬IMC与HIBC具有相似的临床、病理和分子疾病模式[17],本试验也可为HIBC的研究提供一定的参考价值。
