大约克公猪精液质量与粪便菌群的相关性分析
2024-01-30锁云鹏李晓彤李延森沈丹李春梅
锁云鹏,李晓彤,李延森,沈丹,李春梅
(南京农业大学动物科技学院家畜环境控制与智慧生产研究中心,江苏 南京 210095)
目前对于养猪产业来说,公猪精液质量的好坏直接影响猪群的繁殖效率和生产安全[1]。环境内分泌干扰物[2]、日粮结构或外界不良环境等因素极易造成公猪的精子损伤,影响精液质量,导致繁殖性能下降,给养猪业造成严重的经济损失[3]。因此,探究改善公猪精液品质的有效方法对于养猪生产具有重要意义。研究表明,老龄小鼠补充益生菌后其生精小管萎缩和睾丸间质细胞面积减少的症状得到减缓[4]。将通过褐藻寡糖调控的肠道菌群移植到糖尿病的小鼠体内后,糖尿病小鼠的精子质量得到了提升[5]。这些研究结果提示,肠道菌群可能对雄性的精子质量具有一定的调节作用。
很多研究已经证明肠道菌群与机体健康密切相关[6-7],在多糖消化,维生素和营养物质合成以及免疫功能调节等多方面发挥着关键作用[8]。特别是近年来,肠-脑轴[6,9]、肠-肝轴[10-11]以及肠-肾轴[12]等概念的提出,也证明了肠道微生物对宿主代谢和生理功能的影响不仅仅局限于肠道[13]。也有研究者提出肠-睾丸轴,提示肠道微生物可能参与雄性生殖功能的调控作用[14-15]。众所周知,睾丸分泌的睾酮在维持雄性第二特征、促进性腺发育、精子生成与成熟过程中发挥着积极作用[16-17]。有研究报道,环境内分泌干扰物不仅可引起小鼠睾酮浓度和精液质量的下降,而且肠道菌群多样性和丰度也发生了改变,这表明肠道菌群与类固醇激素的合成及精子生成具有一定关系[18-19]。Li等[20]和Liu等[21]研究阐明了肠道微生物菌群不仅调控雄性激素的合成和代谢,甚至能够以其他形式穿过血睾屏障来调控精子发生。Ding等[22]通过建立小鼠高脂饮食模型,诱导小鼠肠道菌群失调后发现血液中内毒素含量升高,附睾组织炎症因子水平上升,精子受损[23]。对不同精液利用率公猪的肠道菌群组成分析中也发现,低精液利用率公猪的血液内毒素含量明显偏高[1]。Tremellen等[24]也提出,肠道革兰氏阴性菌产生的内毒素是猪强效免疫刺激物,可以引发全身慢性炎症(代谢性内毒素血症),损害睾丸功能和性腺功能。在菌群移植试验中,异常精子的表型可以通过粪菌移植传递给正常人群,而来自正常人群的粪菌移植又可缓解其他因素引起的精子损伤[25-26]。上述研究均表明,肠道菌群与精液质量关系紧密。
为了进一步阐明肠道菌群与精液质量间的关系,本试验通过检测不同精液质量的公猪粪便睾酮和内毒素含量,以及粪便的菌群组成,并进一步分析粪便菌群结构是否与精液质量、睾酮和内毒素存在相关性,为其作用机制研究及通过调控肠道菌群来提高公猪的精液质量提供试验依据。
1 材料与方法
1.1 试验设计
本试验于2021年7月下旬在江苏淮阴某种猪场开展。根据文献报道[27]和试验公猪站要求,精子活力评分在0.8以上为高质量精液,精子活力评分低于0.6为低质量精液。本试验以圈舍内全部公猪试验前3个月的精液质量参数为参考,挑选出33头日龄(479.33±2.85)和体况相近的大约克公猪,分为低精液质量(LSQ)组12头,高精液质量(HSQ)组21头。LSQ组和HSQ组公猪精液质量参数详见表1。试验公猪自由饮水,定时定量采食(每日09:30和16:30各饲喂1.25 kg日粮)。基础日粮组成及营养组成见表2。
表1 试验前3个月内公猪精子质量指标Table 1 Boar sperm quality indicators within 3 months before the

表2 本试验基础日粮组成及营养组成(风干基础)Table 2 The basic diet composition and nutritional composition of this experiment(as-dry basis) %
每日07:00—09:00收集试验公猪新鲜粪便,连续收集5次。粪便尽量不要接触地面,防止地面或尿液对粪便造成污染,倘若接触地面使用一次性手套将其外面一层剥离。每次收集粪便样品约50 g并放入自封袋中,于-20 ℃保存备用。
1.2 饲养管理
猪舍及种公猪按常规程序进行清洁、免疫、消毒和喂料,每次饲喂结束后舍内关灯保证猪只躺卧休息。圈舍采用正压通风和单栏单猪饲养模式。风机和湿帘根据温度梯度分为15个等级管理,当夏季温度达22.5 ℃时部分风机自动开启,当温度达到23 ℃时开启部分湿帘。试验期间公猪舍内温度为(26.3±1.8)℃。
1.3 精液质量分析
使用计算机辅助精子分析(computer-assisted sperm analysis,CASA)和特定分析软件Magavision、Magapor、Zaragoza和Spain检测精液质量,测定指标包括精液量、精子活力、精子畸形率和精子密度。总精子数和有效精子数根据计算公式:总精子数=精液量×精子密度;有效精子数=精液量×精子密度×精子活力[28]。
1.4 粪便睾酮和内毒素含量检测
混合粪便样本后检测粪便睾酮和内毒素含量,HSQ组每3个样本混合,LSQ组每2个样本混合。
1.4.1 粪便睾酮的抽提与测定睾酮提取参照殷亚杰[29]的方法并加以改良:取0.75 g样品置于10 mL离心管中,加入5 mL 浓度为90%的甲醇溶液,振荡1 min,置于60 ℃水浴锅中20 min,2 000 r·min-1离心10 min,取上清液,于-20 ℃保存备用。使用翼飞雪生物科技公司的猪总睾酮ELISA试剂盒进行睾酮水平测定,具体操作步骤根据说明书进行。
1.4.2 粪便内毒素的抽提与测定粪便中内毒素提取方法在Clark等[30]和梅灵[31]的基础上稍作改进:粪便样本加入无菌PBS溶液,含量为10 g·mL-1,并轻微混悬,1 200g离心10 min,再通过0.2 μm滤膜过滤,滤液于-20 ℃保存备用。使用厦门鲎试剂生物科技公司的内毒素检测试剂盒(试管定量显色基质法)测定内毒素含量,详细操作步骤参照说明书。检测所用耗材均为无内毒素来源。
1.5 16S rRNA基因测序
将粪便样本混合,HSQ组每3个样本混合,共得到7个混合样本;LSQ组每2个样本混合,共得到6个混合样本。根据基因测序步骤,对所有粪便样品提取总基因组DNA并检测其纯度、浓度和完整性,扩增16S rRNA的V3-V4高变区,引物对为338F(5′-ACT CCT ACG GGA GGC AGC AG-3′)/806R(5′-GGA CTA CHV GGG TWT CTA AT-3′)。在55 ℃的退火温度下进行27个循环。经预试验得出样品结果代码为A,表明PCR产物目的条带大小正确、浓度合适,可进行后续试验。在预试验完成后进行PCR正式试验。PCR仪:ABI GeneAmp®9700型。PCR产物用于文库的构建,在上海美吉生物技术有限公司的基因测序平台上进行高通量测序与分析。所有测序数据均提交到NCBI数据库,登录号为PRJNA851983。
1.6 数据统计与分析

2 结果与分析
2.1 粪便睾酮与内毒素含量分析
基于单因素方差分析,从结果(图1)中可以看出:HSQ组的粪便睾酮水平显著高于LSQ组(P<0.01),HSQ组的粪便内毒素水平略低于LSQ组,但无显著差异(P=0.13)。

图1 不同精液质量公猪的粪便睾酮(A)和内毒素(B)水平Fig.1 Fecal testosterone(A)and endotoxin(B)levels of boars of different semen qualities**P<0.01
2.2 粪便菌群的α和β多样性分析
采用16S rRNA基因测序技术,分析不同精液质量公猪粪便菌群的组成。所有粪便样本共获得464 373个有效序列片段。按照97%相似性对非重复序列(不含单序列)进行OTU聚类,Venn(维恩)图显示LSQ组和HSQ组共获得1 211个OTU,其中两组共有1 069个OUT,LSQ组和HSQ组分别鉴定出53个和89个特有OTU。粪便菌群α多样性分析结果表明,HSQ组的物种丰富度(Sobs、Ace、Chao指数)和多样性(Shannon指数)均高于LSQ组,但两组之间差异不显著(P>0.05)。β多样性方面,主成分分析结果表明,两组之间粪便菌群有一定的差异性,但存在部分重叠,PC1轴和PC2轴对结果的解释度分别为39.35%和17.44%。基于Weighted-unifrac距离计算的非度量多维排列(NMDS)分析显示,距离差值Stress<0.1表明分组具有一定意义,但两组间无显著性差异(图2)。
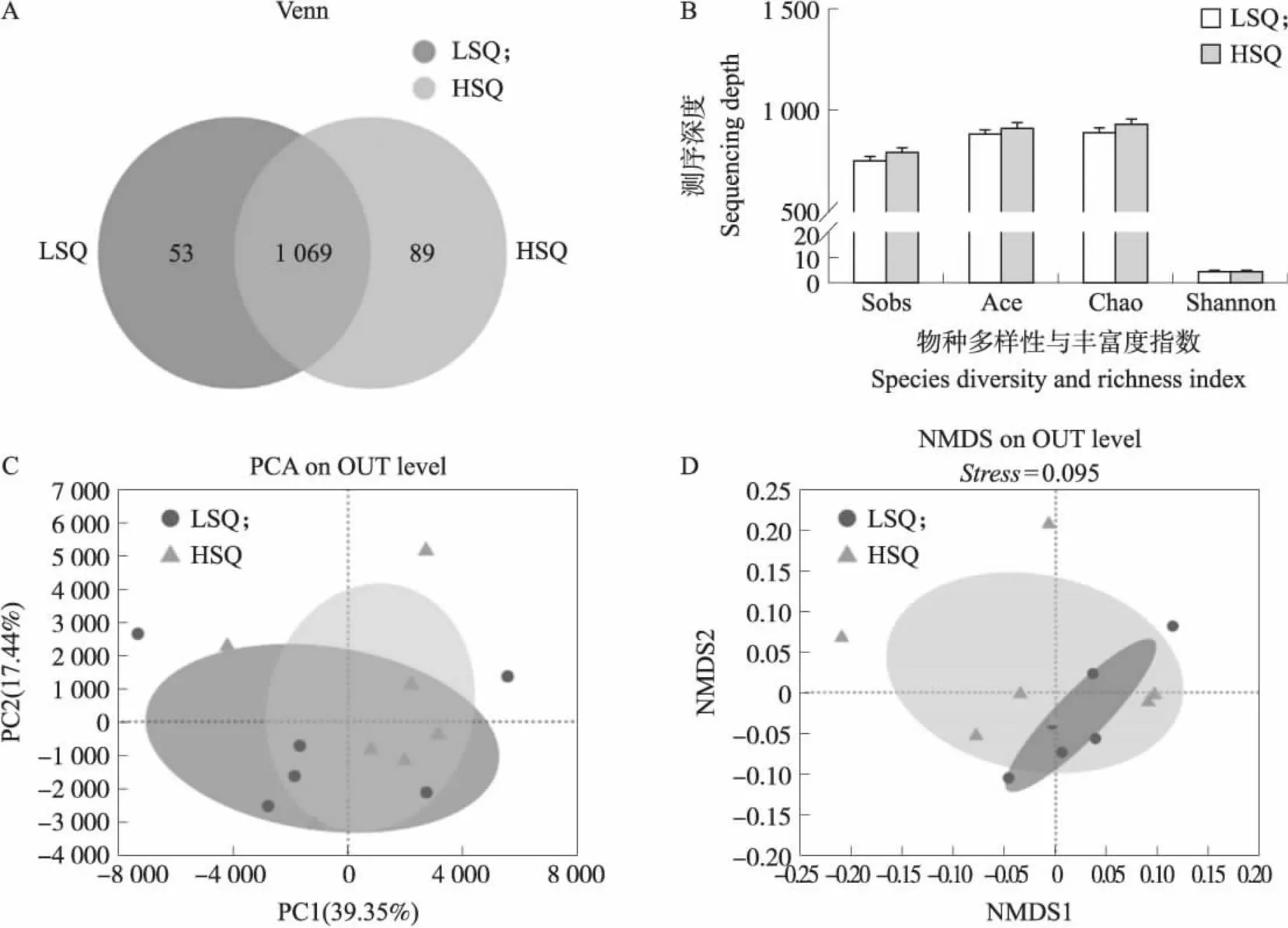
图2 不同精液质量的公猪粪便菌群的α和β多样性分析Fig.2 Analysis of α and β diversity in boar feces of different semen quality A.物种Venn图分析;B.物种多样性与丰富度指数,Sobs指数代表物种丰富度实际观测值,Ace指数代表物种丰富度,Chao指数代表物种丰富度,Shannon指数代表物种多样性;C.两组间主成分分析(PCA);D.基于Weighted-unifrac距离的非度量多维排列(NMDS)分析(Stress=0.095)。A.Species Venn diagram analysis;B. Species diversity and richness index,the sobs index represents actual observations of species richness,the ace index represents species richness,the chao index represents species richness and the shannon index represents species diversity;C. PCA analysis between the two groups;D. Non-metric multidimensional scaling(NMDS)analysis based on weighted-unifrac distance calculation(Stress=0.095).
2.3 粪便菌群组成和差异分析
基于16S rRNA测序数据分析,比较HSQ组和LSQ组之间粪便菌群的差异。结果如图3所示:在门水平,两组公猪粪便菌群都是以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、螺旋菌门(Spirochaetota)、变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)为主;在科水平上,以大于1%含量为标准,两组公猪粪便菌群都检测出18个相同优势菌群科,以Oscillospiraceae(颤螺旋菌科)、Lachnospiraceae(毛螺菌科)、Peptostreptococcaceae(消化链球菌科)、Streptococcaceae(链球菌科)、Clostridiaceae(梭菌科)、Christensenellaceae(克里斯滕森菌科)、Prevotellaceae(普雷沃氏菌科)、Spirochaetaceae(螺旋体科)和Lactobacillaceae(乳酸杆菌科)等丰度最高。对HSQ组和LSQ组的粪便差异菌群分析,在科水平,HSQ组的Eubacterium_coprostanoligenes_group(产粪甾醇真杆菌科)丰度显著低于LSQ组(P<0.05),HSQ组Atopobiaceae(阿波托菌科)和Akkermansiaceae(阿克曼菌科)丰度显著高于LSQ组(P<0.05);在属水平,HSQ组g_norank_f_Eubacterium_coprostanoligenes_group和Faecalibaculum(粪杆菌属)的丰度显著低于LSQ组(P<0.05),然而在g_norank_f_Atopobiaceae、Akkermansia(阿克曼菌属)和Clostridium_sensu_stricto_6的丰度上HSQ组显著高于LSQ组(P<0.05)。在LEfSe多级物种分析结果中,同样可以看出Eubacterium_coprostanoligenes_group在LSQ组中显著富集,Atopobiaceae和Akkermansiaceae在HSQ组中显著富集。

图3 不同精液质量的公猪粪便菌群物种差异分析Fig.3 Analysis of fecal flora species differences in boars of different semen quality A. HSQ组和LSQ组在门水平上的物种组成;B. HSQ组和LSQ组在科水平上的物种组成(含量>1%);C. HSQ组和LSQ组在科和属水平上的差异分析,采用Wilcoxon和检验方法来检验显著性差异;D. HSQ组和LSQ组区分显著作用的微生物类群的判别分析,LDA评分通过LEfSe计算(P<0.05,LDA>2)。 *P<0.05。A. Species composition of groups HSQ and LSQ at phylum level;B. Species composition of groups HSQ and LSQ at family level,content>1%;C. Differences between groups HSQ and LSQ at family level or at genus level,Wilcoxon data sum test was used to test significant differences;D. Discriminant analysis of microbial taxa with significant roles distinguished between the HSQ group and the LSQ group,and the LDA score was calculated by LEfSe(P<0.05,LDA>2). *P<0.05.
2.4 粪便差异菌群丰度与精液质量的相关性分析
采用Pearson相关性分析方法分析差异菌群与精液质量的关系,由于属水平上菌属未被定义,因此后续在科水平分析。从图4可以看出:试验公猪粪便差异菌群丰度与精液质量、粪便睾酮水平之间存在较强的相关性。Eubacterium_coprostanoligenes_group丰度与精子活力(r=-0.45,P<0.01)、精子密度(r=-0.48,P<0.01)呈显著的负相关关系,与睾酮水平存在负相关关系,但并不显著(r=-0.48,P=0.11)。Atopobiaceae丰度与精子活力(r=0.42,P<0.05)、精子密度(r=0.38,P<0.05)和睾酮水平(r=0.57,P<0.05)之间有显著的正相关关系。Akkermansiaceae丰度与精子活力(r=0.46,P<0.01)、精子密度(r=0.43,P<0.05)有显著的正相关关系,与睾酮水平存在弱正相关关系(r=0.50,P=0.09)。因此推测Eubacterium_coprostanoligenes_group、Atopobiaceae和Akkermansiaceae可能对精液质量起着关键作用。

图4 粪便差异菌群丰度与精液质量、粪便睾酮水平的相关性分析Fig.4 Correlation analysis of fecal differential microbiota abundance with semen quality and fecal testosterone level A. Eubacterium_coprostanoligenes_group丰度与精子活力、精子密度、睾酮水平之间关联的散点图;B. Atopobiaceae丰度与精子活力、精子密度、睾酮水平之间关联的散点图;C. Akkermansiaceae丰度与精子活力、精子密度、睾酮水平之间关联的散点图。A.Scatter plot of the association between Eubacterium_coprostanoligenes_group abundance and sperm motility,sperm density,testosterone level;B. Scatter plot of the association between Atopobiaceae abundance and sperm motility,sperm density,testosterone level;C.Scatter plot of the association between Akkermansiaceae abundance and sperm motility,sperm density,testosterone level.
3 讨论
睾酮由睾丸间质细胞产生,在精子生成过程中发挥着积极作用[32]。本试验发现高精液质量公猪的粪便睾酮浓度显著偏高,这也表明了睾酮对精子生成和精液质量上升具有促进作用。已有研究指出,睾酮的产生受机体内毒素含量的影响,在大鼠腹腔注射内毒素试验中发现,睾酮生成被内毒素直接抑制[33],造成上述结果的原因可能是由于内毒素通过血液循环作用于睾丸,导致睾丸组织受损[34-35]。本试验中高、低精液质量公猪的粪便内毒素含量无明显差异,推测这可能是粪便作为机体的一种排毒方式,其含有大量细菌脱落裂解物质,内毒素含量较高导致的结果。
研究表明,移植褐藻寡糖调控的肠道菌群到高脂饮食的小鼠体内,可以缓解高脂饮食对小鼠精液质量造成的损伤[36]。据报道,肠道菌群可以从营养调控、免疫激活、信号传导和胰岛素抵抗等多个方面影响雄性的精液质量[37-39]。在对犬补充复合乳酸杆菌后,其精子渐进运动性和顶体完整性显著增强[40]。上述研究结果均提示,肠道菌群与精液质量联系密切。因此,本试验利用16S rRNA基因测序,在菌群α和β多样性分析中发现,高、低精液质量公猪的粪便菌群虽然没有体现出明显的差异,但有一定的分离趋势,表明不同精液质量的公猪粪便菌群组成和丰度存在一定程度上的差异。厚壁菌门与拟杆菌门的丰度在公猪粪便菌群中占据优势地位,这与先前对猪肠道菌群分布比例的研究结果是一致的[41]。在不同精液质量公猪的粪便差异菌群中发现,Eubacterium_coprostanoligenes_group在低精液质量的公猪粪便菌群中显著富集,并且Eubacterium_coprostanoligenes_group与公猪精子活力、精子密度和睾酮之间存在负相关关系。据报道,Eubacterium_coprostanoligenes_group具有将胆固醇转化为粪甾醇的功能,进而影响宿主的脂肪代谢[42-43]。胆固醇已被证明参与动物机体许多重要的生理过程,对睾酮合成也有明显的促进作用[44]。He等[45]发现,在热应激环境下,仔猪血清胆固醇水平增加,且Eubacterium_coprostanoligenes_group含量也伴随着上升。因此推测,低精液质量组Eubacterium_coprostanoligenes_group丰度上升可能与试验在夏季高温环境下进行有关。本试验在高精液质量公猪的粪便菌群中发现Atopobiaceae和Akkermansiaceae菌群显著富集,且Atopobiaceae与公猪的精子活力、密度和睾酮存在显著的正相关关系。有研究报道,在食物厌氧发酵试验中,Atopobiaceae与短链脂肪酸的产生呈正相关[46],并且对小鼠补充代谢产物为丁酸的丁酸梭菌,其血清中睾酮水平显著提高[47]。Chang等[48]在高脂日粮诱导的糖尿病小鼠模型中发现,抑制C-C趋化因子配体(CCL)4表达后产生的有益作用,可能是肠道微生物菌群发生变化(尤其是Atopobiaceae家族丰度增加)改善了糖尿病小鼠的葡萄糖代谢和脂代谢。先前研究表明,成熟精子表面有葡萄糖转运蛋白,其功能为转运葡萄糖进入精子内部,给精子提供能量[49],并且在患有糖尿病的雄性小鼠模型中,发现小鼠的生殖功能也受到一定影响(睾丸受损,精液质量下降)[5,50]。另外,本试验显示,与Atopobiaceae类似,Akkermansiacea与公猪的精子活力、精子密度和睾酮水平也存在正相关关系。Akkermansiaceae作为一种黏蛋白降解细菌,具有益生菌特性,在肥胖症、糖尿病、炎症、代谢紊乱等疾病中参与免疫反应[51],并且发现其丰度与小鼠的肥胖和相关代谢紊乱成反比[52],而肥胖对雄性精液质量具有负面影响[53]。更有研究表明,Akkermansiaceae菌群的增加可能有助于改善肠道通透性和减少内毒素释放,缓解全身炎症,维持机体代谢稳态[54]。以上结果提示,Eubacterium_coprostanoligenes_group、Atopobiaceae和Akkermansiaceae三种菌群可能通过调控机体的代谢来影响公猪的精液质量,然而三者对精液质量的具体调控机制尚不明确,需要进一步探究。
综上,本研究发现不同精液质量公猪的粪便睾酮水平和粪便菌群组成、丰度存在差异,并且粪便菌群与精液质量和睾酮水平之间存在不同程度的相关关系。研究结果为阐明肠道菌群对公猪精液质量的影响提供了新的理论基础,为改善公猪精液质量提供了新的思路。
