大豆黄酮影响青春期小鼠乳腺发育的潜在机制
2024-01-30谢娜娜黄心河张亚锋张源淑韩正康
谢娜娜,黄心河,张亚锋,张源淑,韩正康
(南京农业大学动物医学院/农业农村部动物生理生化重点开放实验室,江苏 南京 210095)
乳腺是一个上皮器官,由导管和小叶间腺泡形成分支网络。乳腺的发育主要是在出生后完成,经历了胚胎期、青春期、妊娠期、泌乳期和干奶期几个不同的阶段。在青春期,乳腺组织的初级上皮导管树开始进入分支形态形成的过程,利于形成初级导管网络和末端芽。导管分支增殖并伸入乳腺导管上皮细胞中,间质脂肪细胞消失,为妊娠期乳腺发育奠定基础[1];末端芽在上皮-间充质转化起主导作用,有利于腺泡芽的发展。而腺泡的形成及泌乳的启动主要发生于妊娠期和哺乳期[2]。因此青春期乳腺的发育直接决定妊娠期导管延伸和泌乳期腺泡细胞的数量,是动物乳腺发育历程中的重要过程。
乳腺的生长发育、泌乳和排乳均受到神经、内分泌的调节,激素起主要调控作用。雌激素,特别是雌激素—1,7-β-雌二醇(E2)是卵巢分泌的类固醇激素之一,是哺乳动物自身合成的雌激素中活性最高,也是青春期乳腺细胞的重要“有丝分裂原之一”[3]。Bocchinfuso 等[4]研究发现E2具有促进乳腺腺泡形成、调节导管形态发生、促进乳腺上皮细胞(mammary epithelial cell,MEC)增殖的作用。有研究表明,切除卵巢的大鼠持续应用E2,可使乳腺的DNA含量增加到接近妊娠18~20 d的水平[5];E2可使空怀的山羊和牛乳腺小叶腺泡增加[5]。提示E2对促进乳腺发育具有重要作用。
大豆黄酮(daidzein,DZ)是一种天然的植物雌激素,主要从大豆中提取而来。DZ的化学结构类似哺乳动物的雌激素,其通过取代或阻碍雌激素及相应的受体而发挥作用[6]。研究表明,DZ可以延缓女性绝经过程,促进乳腺发育,发挥雌激素样活性[7],还能发挥抗炎、抗溶血和抗氧化等非雌激素样作用[8]。也有研究证实,植物雌激素DZ与乳腺发育有关。1946年,Bennetts首次发现奶牛食用三叶草后,可促进乳腺发育,提高奶产量,提示植物雌激素可促进乳腺发育[9]。1995年,张荣庆等[10]研究发现去卵巢大鼠皮下注射DZ后可增加乳腺质量,提高RNA和DNA的含量,显著促进乳腺发育。2021年,Chen等[11]研究发现,黄酮类物质黄芩苷可促进青春期小鼠乳腺导管的延长。刘春龙等[12]和Tsugami等[13]先后证明了DZ可促进牛和小鼠乳腺上皮细胞的增殖,对体外诱导小鼠乳腺细胞成导管和腺泡均具有促进作用。本实验室前期试验证实,DZ通过促进细胞周期进展从而上调细胞周期蛋白D1(cyclinD1)和D3(cyclinD3)的表达,促进牛乳腺上皮细胞的增殖[14]。以上研究提示,DZ具有促进青春期小鼠乳腺发育的潜力。但DZ作为植物雌激素中的重要一员,目前有关其在调节乳腺发育中的作用研究较少,具体的分子机制仍不清楚。
本研究以青春期C57BL/6雌性小鼠为研究对象,以DZ处理并以雌激素作为阳性对照,通过检测小鼠体重、采食量、乳腺指数、血液和乳腺组织中E2的含量等基础指标,观察乳腺组织形态结构变化和核增殖抗原蛋白(PCNA)的表达情况,并结合细胞周期蛋白的变化等,阐明DZ对青春期小鼠乳腺发育的影响,为大豆黄酮及其他植物雌激素类在畜牧生产和临床上的应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂和仪器大豆黄酮(DZ)由南京农业大学韩正康教授赠送;E2(纯度≥99%)购自ALfa Aesar;鼠源E2 ELISA检测试剂盒购自建成生物工程研究所。组织/细胞裂解液RIPA购自北京索莱宝科技有限公司;蛋白酶抑制剂—苯甲基磺酰氟(PMSF)和细胞周期蛋白D1(cyclinD1)一抗均购自巴傲德科技有限公司;核增殖抗原蛋白(PCNA)购自Proteintech;细胞周期蛋白B1(cylinB1)、雌激素受体β(ERβ)一抗均购自Affinity;β-ACTB一抗、羊抗鼠IgG二抗(AS003)和羊抗兔IgG二抗(AS014)均购自武汉爱博泰克科技有限公司;ECL显色液购自上海翊圣生物科技有限公司。
仪器:POWER-PAC 300电泳仪(美国BIO-RAD)、POWER-PACHC转印仪(美国BIO-RAD)、Tanon-3900全自动化学发光图像分析系统(上海天能科技有限公司)、BS223S精密电子天平(德国Ssrtorius)、Tecan Spark多功能酶标仪(瑞士Tecan公司)、Servince高速组织研磨仪(武汉赛维尔)等。
1.1.2 试验动物2周龄青春期SPF级C57BL/6雌性小鼠购自河南斯克贝期生物科技股份有限公司,许可证号SCXK(浙)2019-0002。饲养于南京农业大学动物实验中心。
1.2 试验方法
1.2.1 动物分组及处理小鼠适应1周后,按体重相近原则,随机均分为3组:对照组(CON组)、大豆黄酮组(DZ组)和雌二醇处理组(E2组),每组16只。饲养环境温度(22±2)℃、相对湿度50%~60%、光暗周期12 h,自由采食和饮水。每日08:30,DZ组腹腔注射大豆黄酮(100 mg·kg-1);E2组腹腔注射E2(0.2 mg·kg-1),CON组注射等量的无菌PBS。连续注射14或21 d,每7 d称重1次,每日统计小鼠饲料重,并计算采食量。每2~3 d更换1次垫料。每天观察小鼠精神状态,并做记录。
1.2.2 样品采集血样采集:饲养至21、28 d时,所有小鼠禁食12 h,眼球采血,3 000 r·min-1离心获得血清,-20 ℃保存备用。乳腺组织采集:颈椎脱臼处死小鼠,剖开皮肤,摘取所有乳腺,称重并拍照。取腹部第5对左侧乳腺组织置于固定液,剩余的乳腺组织-80 ℃保存。
1.2.3 血液和乳腺组织中E2含量测定将制备的血清用样本稀释液稀释2倍后备用,用预冷的PBS(0.01 mol·L-1,pH7.4)冲洗组织,去除残留血液,称重后将组织剪碎。称取30 mg剪碎的组织加入270 μL的PBS,并在PBS中加入蛋白酶抑制剂,匀浆机匀浆。ELISA法检测血液和组织液中E2含量。具体步骤按试剂盒说明书进行。用酶标仪在450 nm波长下测定D450值。按公式计算样品浓度:Y=39.57x-5.04。式中:Y为样品浓度(pmol·L-1);x为样品D450值。
1.2.4 乳腺指数的测定取出所有乳腺称重并记录。按公式计算乳腺指数:Y=m/M×100%。式中:Y为乳腺指数(%);m为乳腺湿重(g);M为小鼠体重(g)。
1.2.5 乳腺组织的HE染色参照Pai等[15]的方法,将固定24 h以上的乳腺组织经过脱水、透明、透蜡、包埋、切片与展片和染色等步骤,显微镜下观察并拍照。乳腺导管的量化以乳腺导管数量为指标,利用Image J软件统计每组5个视野中乳腺导管的数量。
1.2.6 乳腺组织PCNA的免疫组化(IHC)检测参照吴海琴[16]的方法。具体步骤:石蜡切片脱蜡处理,对切片进行复水,放入抗原修复液水浴15 min;自然冷却,PBS清洗;将切片放入3%过氧化氢中去除非特异性过氧化物酶;清洗后擦干,5%封闭液封闭90 min;吸去血清,滴加兔源PCNA抗体,孵育过夜;PBS清洗后加羊抗兔二抗IgG,37 ℃温箱孵育1 h;PBS清洗后滴加SABC孵育1 h;清洗后DAB 显色,蒸馏水清洗;切片脱水、透明、封片、拍摄及分析。利用Image J软件统计每组10个视野中阳性细胞数量。
1.2.7 细胞周期相关蛋白和雌激素受体β(ERβ)的Western blot检测检测各组小鼠乳腺组织中cyclinD1、cyclinB1和ERβ的表达变化。参照Cohick[17]的方法,称取乳腺组织30 mg置于EP管中,加入RIPA裂解液和蛋白酶抑制剂PMSF后匀浆,4 ℃下12 000 r·min-1离心10 min,收集上清液。加入蛋白上样缓冲液,使终浓度为1 mg·mL-1。120 g·L-1分离胶、50 g·L-1浓缩胶进行SDS-PAGE电泳,湿法转印,孵育一抗(cyclinD1、cyclinB1和ERβ一抗均按1∶1 000稀释),4 ℃振摇过夜。TBST漂洗,cyclinD1加入 1∶10 000 的山羊抗鼠IgG二抗,cyclinB1和ERβ加入1∶10 000稀释的山羊抗兔IgG二抗,室温孵育2 h,TBST漂洗,ECL化学发光液处理,凝胶成像系统中曝光拍照。ImageJ软件检测各蛋白条带灰度值,以 β-actin 作内参,目的条带与其相比得到目的蛋白的相对表达量,然后对数值进行归一化处理。
1.3 数据处理与分析

2 结果与分析
2.1 大豆黄酮对青春期小鼠体重和采食量的影响
2.1.1 小鼠体重变化从图1可知:试验起始阶段各组小鼠体重大致相近;从21 d开始,DZ和E2处理组小鼠平均体重均极显著高于对照组(P<0.01);28 d时DZ和E2处理组小鼠的体重显著增加;体重增加由高到低依次为E2组、DZ组、对照组。
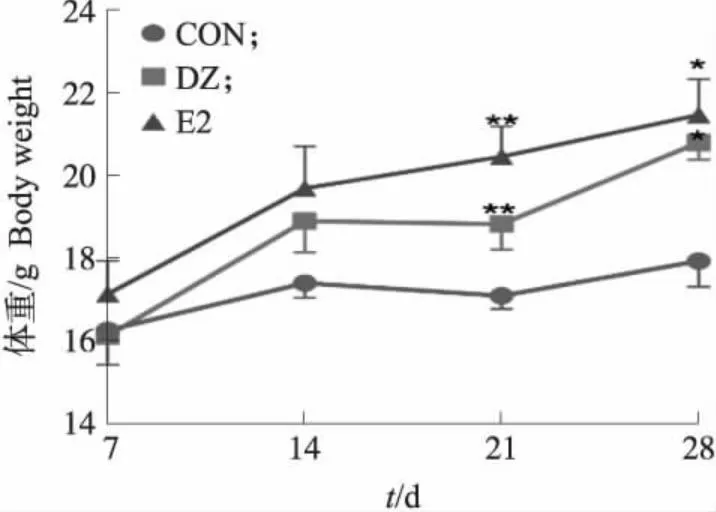
图1 大豆黄酮对青春期小鼠体重的影响(n=8)Fig.1 Effects of daidzein on body weight of adolescent mice(n=8) CON:对照组;DZ:大豆黄酮组;E2:雌二醇组。*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01)。下同。CON:Control group;DZ:Daidzein group;E2:1,7-β-estradiol group. *shows significant difference compared with control group(P<0.05);**shows very significant difference compared with control group(P<0.01). The same as follows.
2.1.2 小鼠采食量变化由图2可知:试验刚开始阶段,采食量基本相同;随着时间的推移,与对照组相比,DZ处理组小鼠的采食量增加;3组小鼠采食量由高到低的处理依次为DZ组、E2组、对照组。

图2 DZ对青春期小鼠日采食量的影响(n=8)Fig.2 Effects of daidzein on daily food intake of adolescent mice(n=8)
2.2 大豆黄酮对青春期小鼠血清和乳腺组织中E2含量的影响
血清结果见表1。与对照组相比,饲养21 d DZ处理组血清中E2含量增加,但未有显著性差异,E2处理组E2含量显著增加(P<0.05);饲养28 d DZ和E2处理组血清中E2含量极显著增加(P<0.01)。

表1 DZ对青春期小鼠血清和乳腺组织中E2水平的影响(n=8)Table 1 Effect of daidzein on E2 level in serum and mammary gland of adolescent mice(n=8) pmol·L-1
乳腺组织中E2水平结果见表1。与对照组相比,饲养21 d,DZ处理可增加乳腺组织中E2含量,但未有显著性差异(P>0.05),E2处理组略有降低;饲养28 d DZ处理组和E2处理组与21 d E2含量变化具有相同的趋势,均极显著增加了E2含量(P<0.01)。
2.3 DZ对青春期小鼠乳腺组织及乳腺指数的影响
2.3.1 乳腺指数与对照组相比,DZ处理组青春期小鼠乳腺指数略增加,但未达到显著水平;E2处理组具有相同的趋势(图3-A)。与对照组相比,DZ处理组青春期小鼠乳腺指数显著增加(P<0.05),E2处理组具有相同的趋势,且DZ处理组乳腺指数的增量略高于E2处理组(图3-B)。

图3 DZ对青春期小鼠乳腺指数的影响(n=8)Fig.3 Effects of daidzein on mammary index of adolescent mice(n=8)A. 饲养21 d乳腺指数变化;B. 饲养28 d乳腺指数变化。A. The change of breast index on the 21 day of feeding;B. The change of breast index on the 28 day of feeding.
2.3.2 乳腺组织HE染色结果饲养至21 d,乳腺组织形态学变化见图4-A,与对照组相比,DZ组乳腺小叶间导管的数量极显著增加(P<0.01);E2组具有类似的趋势。DZ处理组优于E2处理组(P<0.05)。

图4 DZ对青春期小鼠乳腺组织导管数量的影响(n=5)Fig.4 Effects of daidzein on bud numbers in breast tissue of adolescent mice(n=5) A.饲养21 d乳腺组织导管数变化;B. 饲养28 d乳腺组织导管数变化。AC:脂肪细胞;A:腺泡;CT:结缔组织;ID:小叶间导管。A. Changes of the bud number in breast tissue on the 21 day of feeding;B. Changes of the bud number in breast tissue on the 28 day of feeding. AC:Adipose cell;A:Alveolar;CT:Connective tissue;ID:Interlobular duct.
饲养至28 d,乳腺组织形态学变化见图4-B。运用Image J统计每个视野中乳腺小叶内导管的数量,以直方图形式表示。与对照组相比,DZ组乳腺小叶间导管的数量极显著增加(P<0.01),E2组具有类似的趋势(P<0.01)。E2处理组优于DZ处理组。
2.3.3 IHC检测乳腺组织PCNA变化运用Image J软件,利用阈值分割法统计每组10个视野中PCNA阳性细胞数,以直方图形式表示。饲养至21 d,PCNA阳性细胞数变化结果见图5-A。与对照组相比,DZ组PCNA阳性细胞的数极显著增加,E2组具有相同的趋势。

图5 DZ对青春期小鼠乳腺组织PCNA蛋白表达的影响(n=10)Fig.5 Effect of daidzein on PCNA protein expression in breast tissue of adolescent mice(n=10) A.饲养21 d乳腺组织PCNA阳性细胞数变化;B.饲养28 d乳腺组织PCNA阳性细胞数变化。红色箭头代表PCNA阳性细胞。A. Changes of the number of PCNA positive cells in breast tissue on the 21 day of feeding;B. Changes of the number of PCNA positive cells in breast tissue on the 28 day of feeding. The red arrows represent PCNA positive cells.
饲养至28 d,PCNA阳性细胞数变化结果见图5-B。与对照组相比,DZ组PCNA阳性细胞的数极显著增加,E2组具有相同的趋势。此结果与2.3.2节结果一致。
2.4 DZ对青春期小鼠乳腺组织细胞周期蛋白和ERβ蛋白表达的影响
2.4.1 DZ对青春期小鼠乳腺组织细胞周期蛋白表达的影响饲养至21 d,细胞周期蛋白变化结果见图6-A。与对照组相比,DZ处理组cyclinB1的表达上调,但无显著性差异;E2处理组具有相同的趋势。与对照组相比,DZ和E2处理均可显著上调cyclinD1的表达(P<0.05)。饲养至28 d,细胞周期蛋白变化结果见图6-B。与对照组相比,DZ处理可显著上调cyclinB1的表达(P<0.05),E2处理组cyclinB1蛋白的表达也显著上调(P<0.05),且E2与DZ组上调蛋白水平相当。与对照组相比,DZ处理组cyclinD1的表达显著上调(P<0.05),E2处理组cyclinD1的表达极显著上调(P<0.01)。E2处理组cyclinD1的蛋白表达水平显著高于DZ组(P<0.05)。

图6 DZ对青春期小鼠周期蛋白表达的影响(n=3)Fig.6 Effect of daidzein on cyclin expression in adolescent mice(n=3) A.饲养21 d乳腺组织周期蛋白表达变化;B.饲养28 d乳腺组织周期蛋白表达变化。A. The change of cyclin expression of breast tissues on the 21 day of feeding;B. The change of cyclin expression of breast tissues on the 28 day of feeding.
2.4.2 DZ对青春期小鼠乳腺组织ERβ蛋白表达的影响饲养至21 d,ERβ蛋白表达变化结果见图7-A。与对照组相比,DZ处理组ERβ蛋白表达上调,但无显著性差异;E2处理组具有相同趋势。且E2处理组ERβ蛋白表达水平高于DZ处理组。饲养至28 d,ERβ蛋白表达变化结果见图7-B。与对照组相比,DZ处理显著上调ERβ蛋白表达水平(P<0.05),E2处理具有相同趋势(P<0.05)。

图7 DZ对青春期小鼠ERβ蛋白表达的影响(n=3)Fig.7 Effect of daidzein on the expression of ERβ protein in adolescent mice(n=3) A.饲养21 d乳腺组织ERβ蛋白表达变化;B.饲养28 d乳腺组织ERβ蛋白表达变化。A. The change of ERβ protein expression in breast tissues on the 21 day of feeding;B. The change of ERβ protein expression in breast tissues on the 28 day of feeding.
3 讨论
乳腺是合成乳汁和分泌乳汁的重要外分泌腺,腺泡是分泌乳汁的功能单位。腺泡由乳腺上皮细胞分化而来,乳腺上皮细胞的增殖分化为乳汁的形成奠定良好的基础。青春期乳腺主要有脂肪组织和结缔组织构成,腺体不发达,仅有少量的腺泡和导管。青春期乳腺的发育是由一系列激素和其他因子协调进行的,这些因子促进乳腺导管网络的延伸,其特征是最前端存在高度增殖的末端芽结构,在不断分化过程中,导管也逐渐分支,为泌乳期腺泡的发育做准备。导管密度、分支结构、乳腺组织结构变化是乳腺发育过程的重要因素[18]。姜晶晶[9]发现,异黄酮类植物雌激素染料木素和亚麻籽木脂素均能促进青春期大鼠乳腺导管的生长和腺泡发育。Tsugami等[13]研究发现DZ对体外小鼠乳腺细胞诱导成导管、腺泡形成也有一定的促进作用。Chen等[11]最新研究表明,将黄酮类黄芩苷连续给3周龄雌性小鼠注射,直至5和6周龄,均显著增加乳腺导管的延伸。本研究结果显示,大豆黄酮连续给药14和21 d均增加青春期小鼠乳腺导管数量,使腺泡体积变大,脂肪细胞填充减少,与上述的研究结果一致。
乳腺发育主要受雌激素和孕酮的调节,E2可刺激乳腺导管生长和延长,是促进乳腺小叶腺泡发育的基础。随着青春期雌激素的分泌增加,腺体增加,导管增多,腺泡增大。在青春期E2在一定水平上可以反映乳腺发育的水平[5]。DZ是一种天然的植物雌激素,为异黄酮类植物雌激素中的重要一员。有研究发现,大豆黄酮可增加泌乳奶牛血液中E2含量,提高雌马酚水平,促进泌乳[19];朱河水等[20]发现,大豆黄酮可以提高泌乳后期E2水平,间接影响奶牛泌乳性能。本研究结果发现,大豆黄酮可提高青春期小鼠血清和乳腺组织中的E2含量,该研究结果与朱河水等[20]研究结果一致。这提示DZ可能通过上调E2水平来促进青春期小鼠乳腺发育。
cyclinD1/cyclinB1和PCNA在调控细胞增殖过程中发挥最要作用。研究表明cyclinD1可通过结合并激活CDK4/激酶,推动Rb-E2F1复合物解离,促进细胞由G1向S期过渡,到G2期时cyclinD1就会自动降解[21]。因此,cyclinD1是细胞S期稳定表达的周期蛋白。PCNA是一种在DNA损伤和修复中起主要作用的核蛋白,其在细胞S期表达显著增加[22]。同时,PCNA可作为DNA聚合酶的辅助蛋白,促进DNA的复制[23]。cyclinB1与cyclinD1具有相似的功能,而cyclinB1促进细胞由S期向M期过渡,在M期高表达[24]。Tan等[25]研究表明,异黄酮植物雌激素可显著增加乳腺的DNA含量,促进乳腺细胞的有丝分裂,从而促进乳腺发育。本研究结果表明,DZ极显著增加PCNA的阳性细胞数和PCNA的表达,也显著提高cyclinD1和cyclinB1蛋白的表达水平。
综上,植物雌激素DZ处理可以通过上调细胞周期和增殖相关蛋白的表达来促进细胞分裂,促进青春期小鼠乳腺发育,这种作用可能与提高内源性E2水平及上调ERβ受体表达有关,相关机制有待进一步研究。
