H9N2 AIV灭活疫苗免疫SPF鸡攻毒后肺组织免疫相关基因表达变化研究
2024-01-30李丽蒋作仪李茵婧常丽凤辛震东平继辉苏娟
李丽,蒋作仪,李茵婧,常丽凤,辛震东,平继辉,苏娟
(南京农业大学动物医学院,江苏 南京 210095)
禽流感病毒(avian influenza virus,AIV)属于正黏病毒科、流感病毒属、有包膜的RNA病毒[1]。H9N2 AIV是禽流感病毒的主要亚型之一,在世界多地广泛分布。H9N2 AIV是一种低致病性禽流感病毒(low pathogenic avian influenza virus,LPAIV),然而,与其他病原体混合感染可使患病禽病情加重,导致病死率增加进而给养殖业造成严重的经济损失[2-3]。
在家禽养殖业中通常使用灭活疫苗控制H9N2 AIV感染,尽管体液免疫是禽类抵抗AIV感染的主要保护性免疫,但疫苗接种并不能带来完全理想的效果,疫情仍持续发生[4]。
由CD4+T和CD8+T细胞介导的细胞免疫反应是抗流感病毒免疫的重要组成部分[5]。CD8+T细胞是主要效应细胞,可杀死受到流感病毒感染的细胞,而CD4+T细胞则产生适应性免疫反应所需的细胞因子[6-7]。流感病毒感染后,活化的CD4+T细胞分化成多种Th细胞亚群,例如Th1、Th2、Th17等[8]。Th1细胞分泌细胞因子IFN-γ、TNF、IL-2等和Th2细胞产生细胞因子IL-4、IL-5、IL-13等参与细胞免疫反应[9-11]。已有研究表明,小鼠经皮肤接种cGAMP佐剂多价流感mRNA疫苗利于平衡Th1/Th2型反应,增加脾脏中IFN-γ、IL-4分泌细胞和病毒特异性CD8+T细胞以及肺中CD4+常驻记忆T细胞(TRM)数量,并对同源毒株提供完全保护[12]。细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK)通过穿孔素/颗粒酶和Fas-FasL途径诱导靶细胞凋亡进而发挥免疫调节的作用[13]。鸡T细胞已被证明在抵抗病毒感染、提供持久和交叉保护方面发挥关键作用,并具有开发通用疫苗的潜力[14]。
然而目前关于已免疫动物受同源病毒攻击后肺组织中免疫相关基因表达变化的研究报道较少。因此,本研究基于H9N2 AIV疫苗免疫后再次发生病毒感染,机体仍向体外排毒这一重要临床现象,通过探究在H9N2 AIV灭活疫苗免疫情况下,H9N2 AIV感染SPF鸡后排毒情况、呼吸道器官的形态学变化以及肺组织中免疫相关因子的表达水平差异,以期了解H9N2 AIV灭活疫苗在肺组织中发挥免疫作用及不能有效抑制H9N2流感感染的潜在机制。
1 材料与方法
1.1 试验动物及分组处理
36只3周龄SPF鸡购自济南赛斯家禽科技有限公司。SPF鸡随机分为对照组(Con)、攻毒组(Flu)、免疫后攻毒组(Vac+Flu)3组。免疫后攻毒组,以A/chicken/Anhui/BRI-99/2017(H9N2)(简称:Anhui/99 H9N2)毒株制备的油乳剂灭活疫苗在每只鸡颈背部皮下免疫接种0.4 mL,对照组和攻毒组鸡免疫无菌PBS。3周后,通过滴鼻点眼的方式用同源病毒Anhui/99进行攻毒,攻毒剂量为每只1×106EID50。对照组用等量PBS滴鼻点眼。攻毒后观察各组SPF鸡临床症状并做好记录。
1.2 样品采集及处理
在攻毒后1、3、5和7 d,对每组SPF鸡采集喉头和泄殖腔拭子,分别置于含1 mL样品保存液(含青、链霉素)的2 mL离心管中,-80 ℃保存。采集血液样品,静置30 min,3 000g离心10 min后取血清,-20 ℃保存备用。同时每组3只鸡通过颈动脉放血处死,采集气管、肺脏,其中一部分放入液氮速冻,后转入-80 ℃冰箱保存,另一部分置于4%多聚甲醛中固定。
1.3 血凝抑制(HI)抗体测定
在96孔V型血凝板的1~12孔分别加入25 μL灭菌PBS缓冲液,吸取25 μL待检血清加至第1孔,反复吹打混匀。依次从前一个孔中吸取25 μL液体加至下一个孔,进行倍比稀释,至第11孔时弃去 25 μL 液体,最后1个孔为对照孔,然后,每孔加入8单位抗原25 μL,混匀后室温静置30 min。随后每孔加入50 μL 1%的鸡红细胞悬液,室温静置30 min。结果判定:倾斜血凝板,从背面观察,当对照孔的结果成立时,观察被测样品孔红细胞有无呈泪滴状流淌,记录红细胞未发生凝集的最高稀释倍数。
1.4 SPF鸡排毒情况分析
喉头和泄殖腔拭子样品经反复挤压后弃去棉拭子,4 ℃、12 000g离心10 min后取上清液。每个拭子样品经尿囊腔接种3枚10日龄鸡胚,置于37 ℃温箱培养48 h。48 h后收集每个鸡胚的尿囊液,检测鸡胚尿囊液HA效价,分析各组SPF鸡的呼吸道和泄殖腔排毒情况。
1.5 RT-PCR法检测肺组织中流感病毒M基因的表达
称取20 mg肺组织,加入液氮后快速研磨均匀,用RNA提取试剂盒(南京诺唯赞生物科技公司)提取总RNA。测定总RNA浓度后用DEPC水将其稀释为500 ng·μL-1,利用反转录试剂盒(南京诺唯赞生物科技公司)将RNA反转录为cDNA。PCR反应体系:TaqMix 12.5 μL,双蒸水8.5 μL,cDNA 2 μL,上、下游引物各1 μL。以H9N2 AIV的M基因序列设计PCR扩增引物,并以GAPDH为内参基因。引物序列见表1。PCR扩增结束后,琼脂糖凝胶电泳分析PCR扩增结果。

表1 基因引物序列Table 1 Primer sequences of the target genes
1.6 HE染色观察气管、肺脏组织的病理变化
气管和肺组织经4%多聚甲醛固定48 h后,修剪出适当大小的组织块,放入梯度浓度乙醇中脱水,二甲苯透明,石蜡包埋,切片(厚度为5 μm)。苏木精-伊红(HE)染色,脱水透明后用中性树胶封片。最后利用光学显微镜(尼康,日本)观察并拍照。
1.7 免疫组织化学染色检测病毒抗原
将制备好的石蜡切片进行脱蜡、水化,再放入3%H2O2溶液封闭,置于0.01 mol·L-1柠檬酸-磷酸氢二钠缓冲液中(pH6.0)进行抗原修复,滴加BSA封闭液并于37 ℃温箱中封闭40 min。弃封闭液,切片上滴加一抗(鼠源流感病毒核蛋白抗体,1∶1 000稀释)并置于4 ℃过夜,阴性对照用PBS替代一抗。第2天,PBS缓冲液冲洗后用HRP标记抗鼠IgG(Proteintech,USA)在室温孵育0.5 h。滴加DAB显色工作液50~100 μL,室温孵育5~10 min。蒸馏水润洗15 s以终止显色;苏木素复染2 min,蒸馏水润洗5 min。置于梯度浓度乙醇中脱水,放入二甲苯2 min后,中性树胶封片,显微镜下观察。结果判定:在显微镜下视野中细胞核/或细胞质出现棕黄色染色为病毒阳性反应。
1.8 RT-qPCR法检测肺脏中免疫相关基因mRNA相对表达水平
提取肺脏组织RNA并反转录为cDNA,步骤同1.5节。用SYBR Green酶(南京诺唯赞生物科技公司)进行荧光定量PCR,体系为10 μL,包括SYBR Green 5 μL,上、下游引物各0.5 μL,双蒸水3 μL,cDNA 1 μL。以GAPDH为内参基因,每个样品3次重复。用荧光定量PCR仪(Roche)按照扩增程序进行扩增反应。结果用2-ΔΔCT法进行相对定量分析。引物由南京金斯瑞生物科技有限公司合成。引物序列见表1。
1.9 数据处理与结果统计
2 结果与分析
2.1 攻毒后各组SPF鸡临床症状
H9N2 AIV感染后,对照组和免疫后攻毒组SPF鸡均未出现临床症状,精神状况、采食状况良好。感染后,攻毒组SPF鸡出现精神沉郁,食欲下降,咳嗽、打喷嚏等轻度呼吸系统症状。说明SPF鸡提前接种灭活疫苗可改善H9N2 AIV引起的轻微临床症状。
2.2 各组SPF鸡HI抗体水平
通过血凝抑制试验监测SPF鸡免疫H9N2 AIV灭活疫苗后攻毒对血清抗体水平的影响。结果如图1所示,对照组SPF鸡血清中抗H9N2 AIV的HI抗体为阴性。攻毒组在感染后第1、3天未检测到HI抗体,在第5天检测到HI抗体,抗体滴度(log2)平均值为4.5。在第9天,攻毒组中抗体滴度(log2)平均值为8.3。免疫后攻毒组在试验期间抗体滴度都大于6,第9天的抗体滴度(log2)平均值为11。感染后第5、9天,免疫后攻毒组的HI抗体滴度均极极显著高于对照组、攻毒组(P<0.001),感染后第7天,免疫后攻毒组HI抗体滴度与攻毒组差异不显著(P>0.05)。从整体来看,SPF鸡接种H9N2 AIV后可产生较高的H9N2亚型AIV抗体效价。
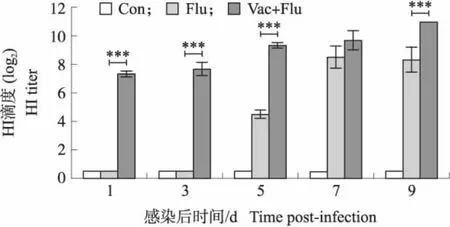
图1 H9N2 AIV灭活疫苗免疫后攻毒在不同时间 点SPF鸡体内HI抗体水平Fig.1 HI antibody levels in SPF chickens at different time points after immunization with H9N2 AIV inactivated vaccine and followed by viral infectionCon、Flu、Vac+Flu分别代表对照组、攻毒组和免疫后攻毒组。下同。Con,Flu and Vac+Flu represent the control group,the challenge group and the immunization followed challenge group,respectively. The same below.*P<0.05,**P<0.01,***P<0.001. The same below.
2.3 灭活疫苗免疫并攻毒后不同脏器中的病毒水平检测与鉴定
2.3.1 咽喉/泄殖腔的病毒水平咽喉/泄殖腔的病毒水平如表2所示,在感染后的第3、5天,攻毒组在咽喉、泄殖腔中均能检测到病毒,其中咽喉的排毒率最高;而免疫后攻毒组在感染后第3、5天,只有在咽拭子中检测到病毒。SPF鸡提前接种灭活疫苗,病毒感染后仍能检测到机体排毒,说明H9N2 AIV灭活疫苗不能提供完全免疫保护。

表2 SPF鸡接种H9N2 AIV灭活疫苗并攻毒后的排毒情况Table 2 The virus shedding of SPF chickens after inoculation with H9N2 AIV inactivated vaccine and followed by viral infection
2.3.2 肺组织中的病毒检测研究表明流感病毒感染可对肺组织造成损伤,因此,本研究对攻毒后第1、3、5和7天肺组织中的流感病毒M基因表达进行测定。如图2所示:在感染后第3、5天,攻毒组在肺组织中均能检测到流感病毒M基因的表达;免疫后攻毒组肺脏组织中仅在感染后第5天检测到流感病毒M基因的表达。以上结果表明H9N2灭活疫苗免疫可以明显抑制流感病毒在肺脏组织中的复制,但不能完全抑制。

图2 H9N2 AIV灭活疫苗免疫并攻毒后在不同时间点SPF 鸡肺脏组织中流感病毒M基因表达情况Fig.2 The expression of influenza virus M gene in lung tissues of SPF chickens at different time points after immunization with H9N2 AIV inactivated vaccine and followed by viral infection
2.4 灭活疫苗免疫并攻毒后气管、肺脏组织病理变化
免疫H9N2 AIV灭活疫苗后病毒感染对SPF鸡气管以及肺组织形态学变化的影响结果如图3所示。对照组SPF鸡气管黏膜比较完整,无脱落,肺组织有散在的少量红细胞、炎性细胞。感染后第3天,攻毒组气管有黏膜层脱落现象,免疫后攻毒组无明显病变。感染后第5天,攻毒组气管黏膜层炎性细胞增多,免疫后攻毒组气管有轻微的黏膜层脱落现象。感染后第7天,攻毒组和免疫后攻毒组气管未见明显病变。在感染后第3天,攻毒组和免疫后攻毒组肺脏组织可见散在大量红细胞和少量炎性细胞。在感染后第5、7天,攻毒组中可见肺脏组织结构损伤加剧,大量炎症细胞聚集,肺泡间隔明显增厚。免疫后攻毒组肺脏组织红细胞、炎性细胞数量相较对照组明显增多,但损伤程度轻于攻毒组。以上结果表明,免疫后攻毒组中SPF鸡气管、肺组织损伤轻于攻毒组;疫苗免疫可以有效减轻H9N2亚型流感病毒对SPF鸡气管、肺组织的损伤。
图3 H9N2 AIV灭活疫苗免疫后攻毒在不同时间点对SPF鸡气管、肺脏组织形态的影响Fig.3 The effect of immunization with H9N2 AIV inactivated vaccine and followed by viral infection on the morphology of trachea and lung in SPF chickens at different time points 黄色箭头示气管黏膜层脱落,黑色箭头示肺组织中散在的大量红细胞,红色箭头示肺组织中聚集的炎性细胞。The yellow arrow indicates the detachment of the tracheal mucosal layer,the black arrow indicates a large number of scattered red blood cells in the lung tissue,and the red arrow indicates the accumulation of inflammatory cells in the lung tissue.
2.5 灭活疫苗免疫并攻毒后气管和肺组织病原学观察
通过免疫组织化学方法来检测病毒感染后SPF鸡气管和肺脏组织中流感病毒抗原核蛋白(NP)的表达情况。结果如图4所示:在感染后第3天,攻毒组和免疫后攻毒组气管中均可检测到大量NP蛋白存在,攻毒组肺脏组织中有大量NP蛋白存在,而免疫后攻毒组肺脏组织中基本无NP蛋白存在。在感染后第5天,攻毒组气管和肺脏组织有大量NP蛋白存在,免疫后攻毒组气管、肺脏组织可见少量NP蛋白存在。在感染后第7天,攻毒组及免疫后攻毒组气管中仅见少量NP蛋白存在,肺脏组织中均未见NP蛋白存在。以上结果表明,疫苗免疫可以明显抑制流感病毒在气管、肺脏组织中的复制。
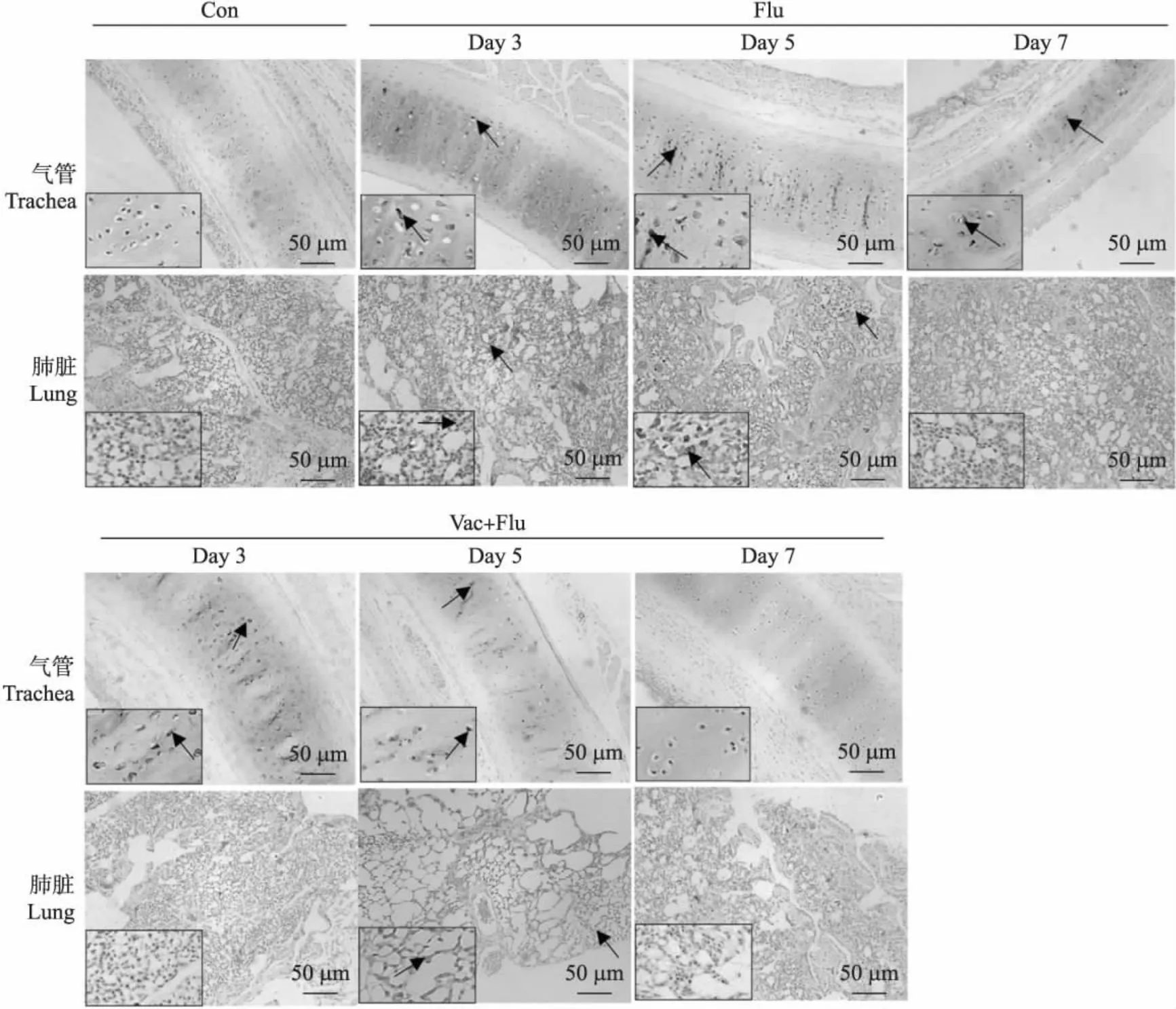
图4 H9N2 AIV灭活疫苗免疫后攻毒在不同时间点SPF鸡气管和肺组织中NP蛋白表达情况Fig.4 The expression of NP protein in trachea and lung tissues of SPF chickens after immunization with H9N2 inactivated AIV vaccine and followed by viral infection at different time points箭头表示NP抗原阳性。Arrows indicate NP antigen positivity.
2.6 灭活疫苗免疫并攻毒后肺组织中CD4和CD8分子基因表达的变化
白细胞表面分化抗原CD4和CD8在宿主免疫应答中发挥着重要作用[15],因此,本试验检测了SPF鸡免疫H9N2 AIV灭活疫苗后再感染流感病毒对肺组织中CD4和CD8表达的影响。结果如图5所示:感染后第5天,免疫后攻毒组鸡肺脏中CD4 mRNA表达量与对照组相比显著升高(P<0.05),与攻毒组相比略有升高但差异不显著(P>0.05);感染后第7天,攻毒组鸡肺脏中CD8 mRNA表达量极显著高于对照组、免疫后攻毒组(P<0.01)。以上结果表明,先免疫后病毒感染能够促进肺组织中CD4分子基因的表达,而病毒感染能促进肺组织中CD8分子基因的表达。
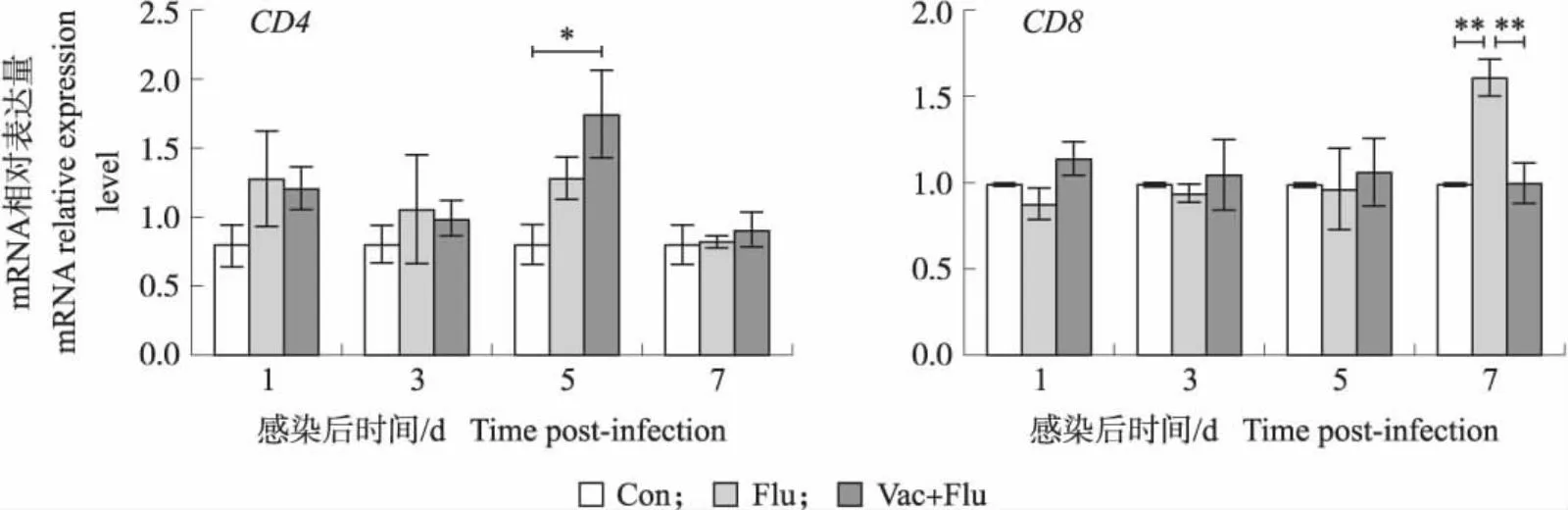
图5 H9N2 AIV灭活疫苗免疫后攻毒不同时间点肺组织中CD4、CD8基因的表达Fig.5 The expression of CD4 and CD8 genes in lung tissue at different time points after immunization with H9N2 AIV inactivated vaccine and followed by viral infection
2.7 灭活疫苗免疫并攻毒后对肺组织Th1/Th2细胞分化特异性转录因子及细胞因子基因表达的影响
GATA3和T-bet分别是Th2和Th1细胞特异性转录因子,IL-4、IL-13为Th2细胞标志性细胞因子,IFN-γ、TNF-α为细胞毒性Th1细胞标志性细胞因子[9-10]。以上因子可调节T细胞分化、参与细胞免疫反应,本试验检测了SPF鸡免疫H9N2 AIV灭活疫苗后再感染流感病毒对肺组织中上述因子表达的影响。结果如图6所示:感染后第5天,免疫后攻毒组GATA3 mRNA表达量显著高于对照组(P<0.05),极显著高于攻毒组(P<0.01)。感染后第7天,攻毒组T-betmRNA表达量极显著高于对照组(P<0.01)。虽然攻毒组T-betmRNA表达量高于免疫后攻毒组但差异不显著(P>0.05)。感染后第5天,免疫后攻毒组IL-4 mRNA表达量极显著高于对照组和攻毒组(P<0.001);感染病毒后,鸡肺组织中IL-13 mRNA表达量在各组之间差异均不显著(P>0.05)。感染后第3天,免疫后攻毒组TNF-αmRNA表达量极显著高于攻毒组(P<0.01),也高于对照组但差异不显著(P>0.05);感染后第7天,攻毒组与免疫后攻毒组中TNF-αmRNA表达量均显著高于对照组(P<0.05)。感染后第5天,攻毒组IFN-γmRNA表达量极显著高于对照组、免疫后攻毒组(P<0.01);感染后第7天,免疫后攻毒组IFN-γmRNA表达量极显著高于对照组、攻毒组(P<0.001)。以上结果表明,疫苗免疫后病毒感染促进了SPF鸡肺组织中Th2细胞转录因子及Th1、Th2相关细胞因子的表达以增强细胞免疫反应,而未免疫鸡感染病毒则主要促进肺组织中Th1细胞转录因子及相关细胞因子的表达进而增强细胞免疫反应。

图6 H9N2 AIV灭活疫苗免疫后攻毒不同时间点肺组织Th1、Th2细胞分化特异性转录因子及细胞因子基因的表达Fig.6 The expression of Th1,Th2 cell differentiation specific transcription factor and cytokines in lung tissue at different time points after immunization with H9N2 AIV inactivated vaccine and followed by viral infection
2.8 灭活疫苗免疫并攻毒后肺组织中细胞毒性相关基因表达的变化
本试验检测了SPF鸡免疫H9N2 AIV灭活疫苗后再感染流感病毒对肺组织中穿孔素/颗粒酶和Fas和FasL两种相互作用的细胞溶解途径相关基因表达的影响。结果如图7所示:感染后第3天,与对照组相比,攻毒组PerforinmRNA表达量显著升高(P<0.05),免疫后攻毒组PerforinmRNA表达量极显著升高(P<0.01)。感染后第7天,攻毒组PerforinmRNA表达量极显著高于对照组(P<0.01),高于免疫后攻毒组但差异不显著(P>0.05)。感染后第3天,攻毒组GranzymemRNA表达量极显著高于对照组(P<0.001),免疫后攻毒组GranzymemRNA表达量极显著高于对照组(P<0.001)、攻毒组(P<0.01)。感染后第7天,攻毒组GranzymemRNA表达量与对照组相比极显著升高(P<0.01),与免疫后攻毒组相比显著升高(P<0.05)。感染后第1天,免疫后攻毒组FasLmRNA表达量显著高于对照组(P<0.05),高于攻毒组但差异不显著(P>0.05)。感染后第5天,免疫后攻毒组FasLmRNA表达量显著高于攻毒组(P<0.05)。感染后,FasmRNA表达量在各组之间差异不显著(P>0.05)。以上结果表明,流感病毒在肺脏组织中可能主要通过促进穿孔素/颗粒酶途径相关基因的表达引发细胞毒性反应进而引起T细胞介导的流感病毒在肺组织中被清除。
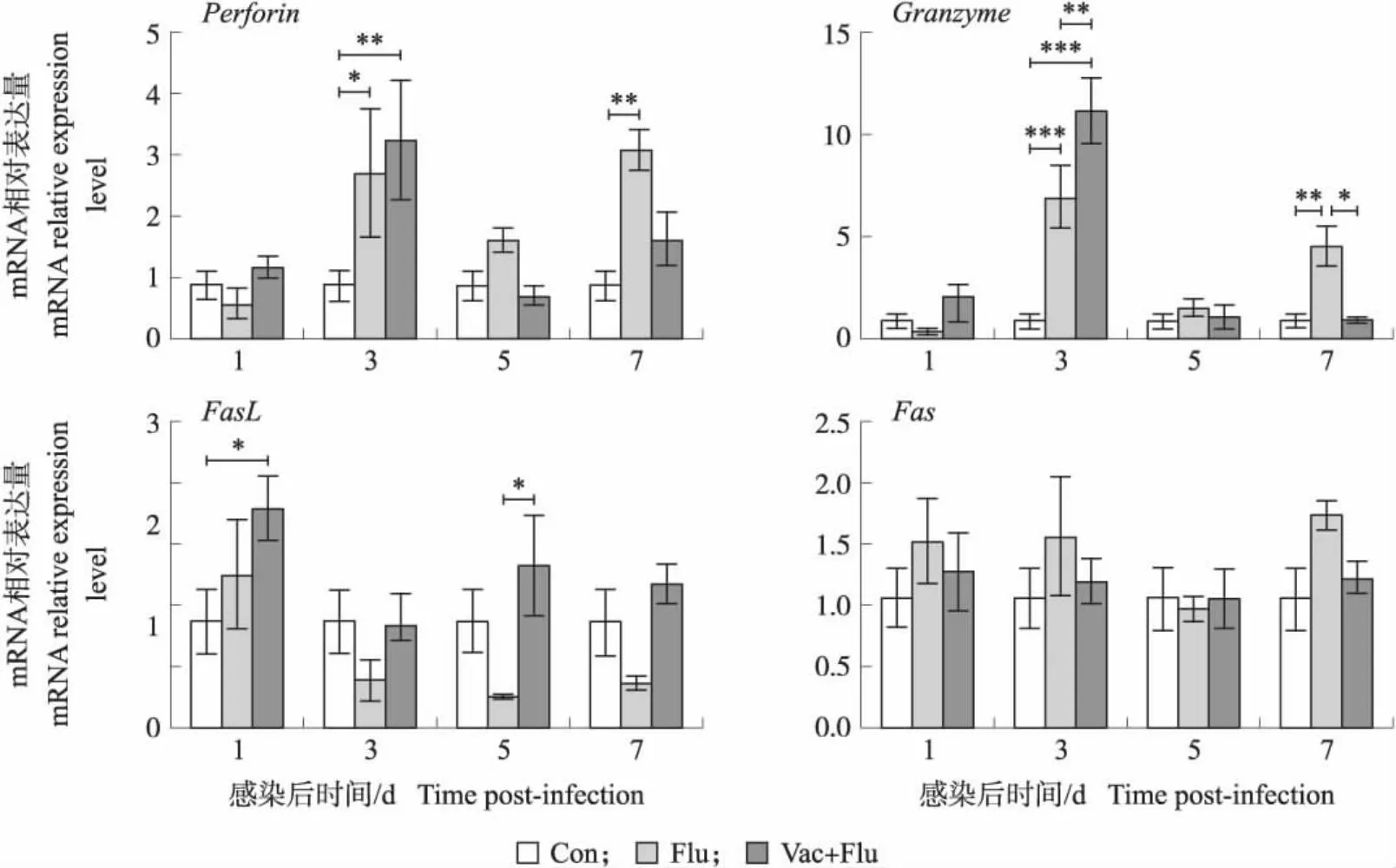
图7 H9N2 AIV灭活疫苗免疫后攻毒不同时间点肺组织中细胞毒性相关基因的表达Fig.7 The expression of cytotoxicity related genes in lung tissue at different time points after immunization with H9N2 AIV inactivated vaccine and followed by viral infection
3 讨论
H9N2 AIV感染对家禽养殖业影响巨大,而疫苗接种仍然是控制和预防AIV在家禽中传播的最有效方法。目前,大多数商用禽流感疫苗是全病毒灭活疫苗[16]。但灭活疫苗只能刺激体液免疫,无法有效抑制禽流感病毒在群体中的复制和传播[8]。禽流感灭活疫苗免疫后血清中HI抗体滴度是反映免疫效果的重要指标。本研究结果表明SPF鸡接种灭活疫苗后10 d内HI抗体效价就可达到6以上。H9N2 AIV在禽类之间可通过消化道或呼吸道传播[17-18]。有研究发现,SPF鸡提前接种H9N2 AIV灭活疫苗或HA突变体灭活苗,流感病毒感染后仍能在口咽、泄殖腔中检测到不同程度的病毒脱落[19]。本研究结果表明,对SPF鸡提前进行免疫保护可减少病毒感染后经咽喉、泄殖腔的排毒,但仍不能完全阻断排毒。
有研究发现,提前接种H9N2灭活疫苗的鸡再感染AIV后,仍引起轻度肺炎,并在肺脏组织中检测到H9基因的表达[20]。本试验中,免疫后攻毒组的SPF鸡肺间质有少量红细胞和炎性细胞聚集,但与攻毒组相比气管、肺组织结构破坏较轻,说明H9N2 AIV灭活疫苗能减轻流感病毒感染后导致的气管、肺脏组织结构损伤。本试验结果与先前的研究一致:免疫后再攻毒通过RT-PCR能检测到肺组织中流感病毒M基因的表达。免疫组化与RT-PCR结果一致,免疫后再攻毒在肺组织中出现病毒特异性抗原NP阳性信号。这可能与接种灭活疫苗后不产生IgA和IgM,仅出现高水平的IgG,且IgG不能转运到肺部有关[21]。
已有研究表明,疫苗免疫后促进外周血淋巴细胞(PBL)中CD4+T细胞百分比的增加,而没有促进CD8+T细胞百分比的增加[16]。本试验中,只病毒感染促进肺组织中CD8 mRNA表达量的上调,而免疫后病毒感染则促进肺组织中CD4 mRNA表达量的上调。说明在肺组织中,疫苗免疫更易诱导CD4+T细胞反应。Th1、Th2细胞及其产生的细胞因子对调节细胞内外病原体引起的免疫应答反应至关重要[13]。本研究发现,免疫后攻毒能够增加肺组织中Th2细胞转录因子及Th1、Th2相关细胞因子的表达,而只攻毒仅增加肺组织中Th1细胞转录因子及相关细胞因子的表达,对Th2细胞转录因子及相关细胞因子的表达未产生明显影响。因此,明确疫苗免疫后攻毒对SPF鸡肺组织免疫相关细胞因子表达的影响对完善H9N2灭活疫苗的免疫效果提供研究思路及方向。
有研究者发现,在巨噬细胞中,H9N2感染10 h后FasL基因表达量上调25.1倍[22]。本试验中,攻毒组鸡肺脏中FasL基因表达量与对照组相比未出现显著差异。有研究者通过全基因组宿主基因表达分析,发现鸡感染H5N1病毒会引起肺组织中与炎症和免疫反应相关基因表达水平的强烈变化,但是在感染H9N2病毒的鸡肺组织中大多数这些基因的表达水平保持不变[23]。由此可见,病毒毒株的强弱、检测样本或取样时间点的不同可能会导致结果出现差异。本研究发现,病毒感染后鸡肺组织Perforin和Granzyme基因表达量均显著上调,免疫后攻毒组中肺组织FasL基因表达量显著上调,而Fas基因表达量在各组肺组织中无显著差异变化。以上结果提示,病毒感染肺脏后,病毒主要通过穿孔素/颗粒酶途径引起细胞毒性反应介导流感病毒在肺组织中的清除。
综上,SPF鸡接种灭活疫苗后再进行H9N2 AIV感染,易引起肺组织中Th2、Th1细胞因子的产生,以促进抗体的产生,诱导体液免疫应答。但是免疫后攻毒组SPF鸡肺组织在前期通过穿孔素/颗粒酶途径引起细胞毒性反应能力较强,后期减弱,这可能是导致灭活疫苗免疫保护不足的部分原因。这些发现进一步解释了H9N2 AIV灭活疫苗在肺组织中发挥免疫作用的机制及可能导致免疫保护不足的原因,但是疫苗免疫对T细胞分化通路的具体影响仍需进一步研究。
