衣康酸二甲酯对H2O2诱导的AML-12细胞线粒体功能障碍的调节作用及机制研究
2024-01-30闫巍元张锐马海田
闫巍元,张锐,马海田
(南京农业大学动物医学院/农业农村部动物生理生化重点开放实验室,江苏 南京 210095)
线粒体是机体产生ATP并维持细胞正常生理活动的主要场所,其功能异常会导致多种代谢性疾病的发生。已有研究发现,线粒体功能障碍与肥胖、胰岛素抵抗和脂肪肝病等多种营养代谢性疾病密切相关[1-2]。活性氧(ROS)主要由线粒体产生,且线粒体是其主要的攻击靶点,其可通过破坏线粒体的结构进而导致线粒体功能障碍[3]。线粒体功能障碍主要体现为ATP合成减少,呼吸链功能减弱,抗氧化能力下降[4]。AMP-依赖性蛋白激酶(AMPK)是一种参与多种代谢调控的关键蛋白,其在调节线粒体生物学功能、脂质代谢、氧化应激及炎症等方面起着至关重要的作用[5]。有研究表明,AMPK下游关键蛋白NAD-依赖性去乙酰化酶1(SIRT1)和过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)参与调节线粒体功能[6]。营养性代谢疾病与线粒体功能障碍联系紧密,因而通过活化AMPK缓解线粒体功能障碍可作为预防相关营养代谢性疾病的有效手段。
衣康酸是线粒体三羧酸循环的次生代谢物,其由三羧酸循环直接产物柠檬酸盐脱水生成顺乌头酸,再通过免疫应答基因1催化脱羧而生成[7]。衣康酸含有共轭双键和2个羧基的高极性α、β-不饱和二羧酸,不易穿过细胞膜;因此,衣康酸的衍生物如衣康酸4-辛酯(4-OI)或衣康酸二甲酯(DMI)通常被用于其分子机制研究[8]。已有研究表明,衣康酸在抗氧化与免疫调节中发挥重要的作用[9-10]。衣康酸可将Keap1上的半胱氨酸残基烷基化,进而促进Nrf2入核,激活下游抗氧化因子的转录表达而发挥其抗氧化功能[11]。然而,目前对DMI的研究主要涉及其对机体抗氧化能力的调节方面,对其缓解线粒体功能障碍的效应及机制方面的研究报道较少。因此,本试验以H2O2诱导的小鼠肝细胞系(AML-12细胞)为研究对象,旨在探究DMI对线粒体功能障碍的缓解效应,并围绕AMPK-SIRT1-PGC1α信号通路揭示其作用机制,为其作为一种生理调节剂用于防控畜禽因线粒体功能障碍引发的相关疾病提供理论依据。
1 材料与方法
1.1 主要仪器和试剂
主要仪器:超净工作台、倒置荧光显微镜(美国Thermo Fisher公司);全波长酶标仪、Western blot电泳及转印系统、曝光仪(美国BIO-RAD公司);实时荧光定量PCR仪(美国Agilent Technologies公司);核酸浓度测定仪、高速冷冻离心机(德国Eppendorf公司)。
主要试剂:DMI购于美国Sigma公司;AML-12细胞购置于南京宏昇生物科技有限公司;胎牛血清购于美国Gibco公司;DME/F-12培养基购于美国Hyclone公司;BCA试剂盒、RIPA裂解液、蛋白酶抑制剂购于上海碧云天生物科技有限公司;AMPK、p-AMPK、SIRT1、PGC-1α、核呼吸因子1(Nrf1)、线粒体转录因子A(TFAM)和Tubulin β抗体购于美国Abcam公司;HRP-二抗购于武汉博士德生物工程有限公司。ATP含量测定试剂盒以及DNA提取试剂盒购于索莱宝科技有限公司;Compound C(AMPK抑制剂)购于美国Selleck公司;线粒体活性氧检测试剂盒以及线粒体膜电位试剂盒购于上海碧云天生物科技有限公司;所有引物均使用Premier 5软件设计,并由赛默飞生物科技有限公司负责合成。
1.2 细胞培养
取液氮中冻存的AML-12细胞置于37 ℃水浴锅中迅速融化,1 000 r·min-1离心5 min后弃上清液,加入含有10%胎牛血清的DME/F-12培养基,吹散悬浮后转移至10 cm培养皿,于37 ℃、5% CO2的细胞培养箱中进行培养,然后制成细胞密度为1×105mL-1的细胞悬浮液,用于后续试验。
1.3 细胞活力检测
将100 μL AML-12细胞悬浮液接种于96孔细胞培养板并孵育24 h,分别用0、0.031 25、0.062 5、0.125、0.25、0.5、0.75和1 mmol·L-1DMI处理4 h后,每孔加入20 μL MTT试剂(5 mg·mL-1)继续孵育4 h后弃上清液,再向每孔加入150 μL二甲基亚砜(DMSO)并低速振荡10 min,使蓝紫色结晶物充分溶解,酶标仪测定吸光值(D490)。
1.4 H2O2致细胞损伤模型的建立
将100 μL AML-12细胞悬浮液接种于96孔细胞培养板并孵育24 h,分别用0、25、50、100、150、200、300、400和500 μmol·L-1H2O2处理4 h,然后向每孔加入20 μL MTT试剂(5 mg·mL-1),继续孵育4 h后弃上清液,向每孔加入150 μL DMSO并低速振荡10 min,使蓝紫色结晶物充分溶解,酶标仪测定吸光值(D490)。
1.5 线粒体活性氧水平检测
将2 mL AML-12细胞悬浮液接种于6孔细胞培养板并孵育24 h后,分别加入0或0.5 mmol·L-1DMI培养4 h后,再加入0或150 μmol·L-1H2O2继续培养4 h。根据线粒体活性氧检测试剂盒说明书配制MitoSOX Red稀释液,再将其与处理后的细胞样品混匀,配制成5 μmol·L-1的稀释液,置于37 ℃细胞培养箱孵育20 min,吸去稀释液,PBS清洗3次,用倒置荧光显微镜观察并拍摄mROS堆积情况。
1.6 线粒体膜电位(mROS)变化情况
将2 mL AML-12细胞悬浮液接种于6孔细胞培养板并孵育24 h,分别加入0或0.5 mmol·L-1DMI并培养4 h,再加入0或150 μmol·L-1H2O2继续培养4 h。根据线粒体膜电位试剂盒说明书配制JC-1(线粒体膜电位荧光探针)染色工作液与JC-1缓冲液,细胞加入适量JC-1染色工作液置于37 ℃细胞培养箱避光孵育20 min,弃去上清液后用JC-1缓冲液洗涤2次,用倒置荧光显微镜观察并拍摄线粒体膜电位(MMP)状态。
1.7 ATP含量测定
将2 mL AML-12细胞悬浮液接种于6孔细胞培养板并孵育24 h,分别加入0或0.5 mmol·L-1DMI培养4 h,再加入0或150 μmol·L-1的H2O2继续培养4 h,收集细胞,按照试剂盒说明书检测ATP含量。
1.8 mtDNA拷贝数分析
将2 mL AML-12细胞悬浮液接种于6孔细胞培养板并孵育24 h,分别加入0或0.5 mmol·L-1DMI并培养4 h,再加入0或150 μmol·L-1H2O2继续培养4 h,收集细胞,利用DNA提取试剂盒提取细胞中的DNA,使用RT-qPCR测量mtDNA拷贝数。线粒体DNA特定引物对序列为5′-AGGTTGTCTCCTGTGACT-TCAA-3′,5′-CTGTTGCTGTAGCCATATTCATTG-3′。采用2-ΔΔCT法分析目的基因相对表达量。
1.9 AMPK通路关键因子蛋白表达水平分析
1.9.1 蛋白样本的制备将2 mL AML-12细胞悬浮液接种于6孔细胞培养板并孵育24 h,分别加入0或0.5 mmol·L-1的DMI并培养4 h,加入0或150 μmol·L-1的H2O2并继续培养4 h。弃上清液,PBS清洗细胞后加入蛋白提取液(RIPA和蛋白酶抑制剂体积比为100)并于冰上静置15 min以充分裂解,12 000 r·min-1离心10 min后取上清液,BCA法检测蛋白浓度并将各组蛋白样本校准至同一浓度,随后将蛋白样本与SDS-PAGE 上样缓冲液混匀,100 ℃条件下煮沸10 min,冷却后置-20 ℃保存备用。
1.9.2 蛋白表达水平的相对定量分析配制不连续的SDS-PAGE胶(上层为50 g·L-1浓缩胶,下层为100 g·L-1分离胶),将蛋白样本加入SDS-PAGE胶中进行电泳。电泳过程中,电压设置为80 V,电泳30 min后调整电压为110 V,待溴酚蓝迁移至分离胶底部时停止电泳。将分离胶中的蛋白转印PVDF膜,(100 V电压下转膜90 min)。转印结束后,参考蛋白标准分子质量裁剪目的条带,置于50 g·L-1脱脂奶粉中常温封闭2 h。封闭结束后,使用TBST清洗PVDF膜5次,分别加入p-AMPK、AMPK、SIRT1、PGC-1α、Nrf1、TFAM或Tubulin β一抗稀释液,4 ℃条件下摇床孵育过夜。回收一抗,TBST清洗PVDF膜5次(每次10 min),随后加入TBST稀释的相应二抗,室温中孵育2 h。弃二抗,TBST清洗5次,每次10 min。加入ECL发光液,在凝胶成像分析系统中曝光并拍照,以Tubulin β作为内参,使用Image J软件对蛋白条带灰度值进行分析。
1.10 AMPK在衣康酸二甲酯(DMI)缓解H2O2诱导的线粒体功能紊乱中的作用
1.10.1 AMPK及线粒体功能相关蛋白表达水平分析AML-12细胞使用10 μmol·L-1AMPK抑制剂Compound C预处理1 h。Compound C使用剂量参照文献[12]。预处理结束,AML-12细胞分别加入0或0.5 mmol·L-1DMI继续培养4 h,加入0或150 μmol·L-1H2O2,孵化4 h,收集细胞后提取总蛋白,采用Western blot法检测p-AMPK、AMPK、SIRT1、PGC1α或Nrf1蛋白的表达水平。具体检测方法同1.9.2节。
1.10.2 mtDNA拷贝数分析使用10 μmol·L-1AMPK抑制剂Compound C预处理AML-12细胞1 h,分别加入0或0.5 mmol·L-1的DMI培养4 h,加入0或150 μmol·L-1H2O2继续培养4 h,然后分析mtDNA拷贝数。检测方法同1.8节。
1.11 数据分析
利用SPSS 17.0软件对数据先进行单因素方差分析,再进行差异显著性检验;利用Graph Pad Prism 5.0软件绘图。统计结果均以平均值±标准误表示。
2 结果与分析
2.1 衣康酸二甲酯(DMI)及H2O2对AML-12细胞活力的影响
与对照组相比,0.031 25~0.5 mmol·L-1DMI和0~150 μmol·L-1H2O2处理对AML-12细胞活力均无显著影响(P>0.05),但0.75~1 mmol·L-1DMI和200~500 μmol·L-1H2O2处理则显著降低了AML-12的细胞活力(P<0.05)(图1)。结果提示,0~0.5 mmol·L-1DMI和0~150 μmol·L-1H2O2处理对AML-12细胞无毒副作用。因此,本试验后续选择0.5 mmol·L-1DMI和150 μmol·L-1H2O2作为最终处理浓度。
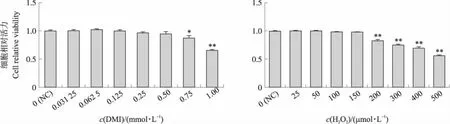
图1 衣康酸二甲酯(DMI,A)及H2O2(B)对AML-12细胞活力的影响Fig.1 Effect of dimethyl itaconate(DMI,A)or H2O2(B)on AML-12 cells viability *、**表示与对照(NC)组相比差异显著(P<0.05)和差异极显著(P<0.01)。下同。*,**indicate significant difference(P<0.05)and extremely significant difference(P<0.01)compared with the control(NC)group. The same below.
2.2 衣康酸二甲酯(DMI)对AML-12细胞mROS水平及线粒体膜电位的影响
结果如图2所示,红色荧光强度代表细胞中mROS堆积水平(图2-A);线粒体单体染色呈绿色荧光,越强代表线粒体膜电位水平越低;红色代表线粒体聚集体,越强代表线粒体膜电位水平越高(图2-B)。根据荧光强度的结果,与H2O2处理组相比,DMI处理显著抑制H2O2诱导的AML-12细胞中mROS水平的升高(图2-A)以及线粒体膜电位的异常降低(图2-B)。结果提示,DMI处理可抑制H2O2诱导的AML-12细胞中mROS的过度产生以及线粒体膜电位的降低。
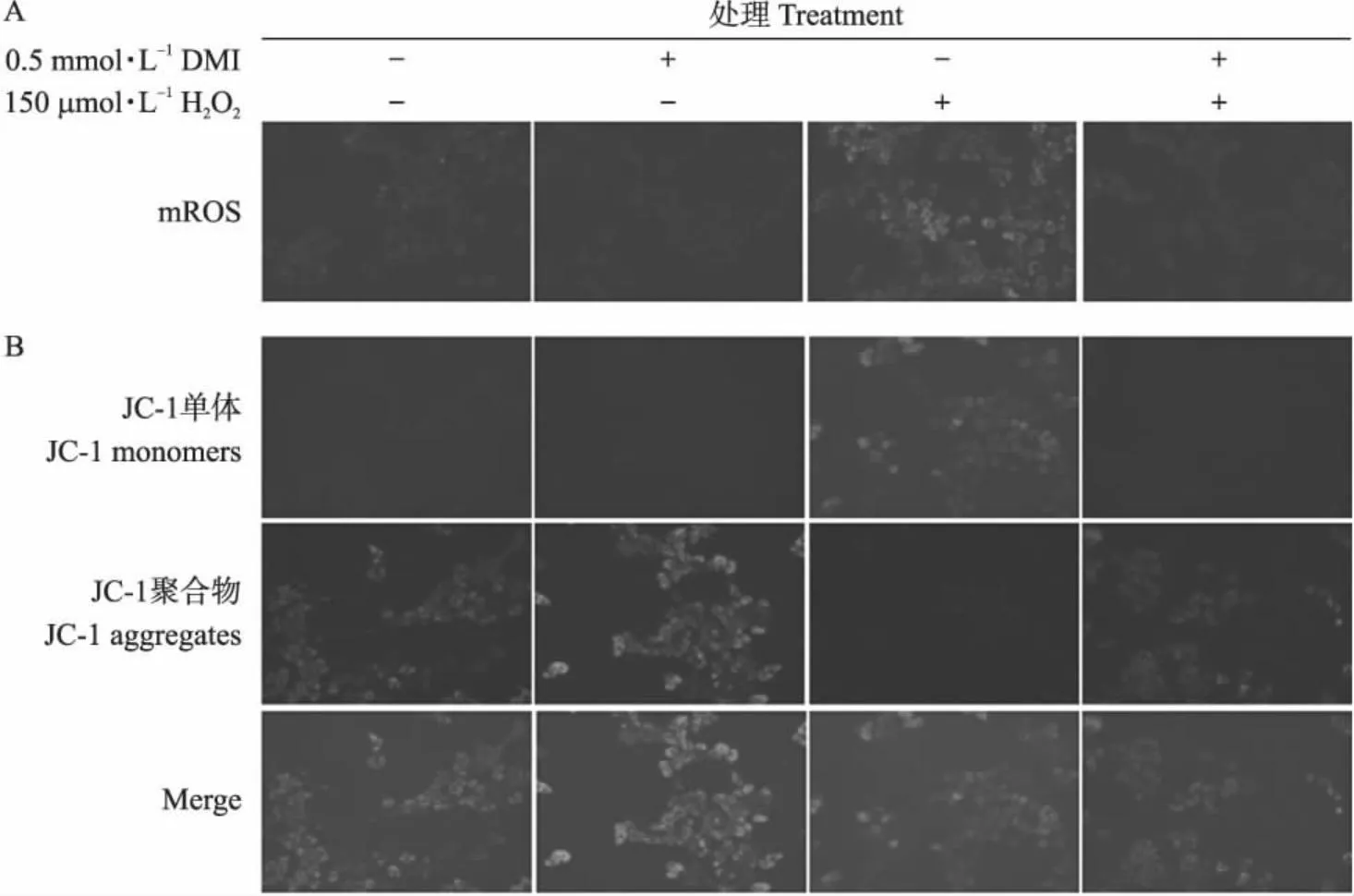
图2 DMI对H2O2诱导的AML-12细胞线粒体活性氧(mROS)(A)及线粒体膜电位(B)的调节作用(×200)Fig.2 Regulation of mROS(A)and mitochondrial membrane potential(B)in H2O2-induced AML-12 cells by DMI+、-分别表示添加、不添加此物质处理。图4、图5同此。+ and - indicate the addition and non-addition of this substance,respectively. Fig.4,Fig.5 are the same.
2.3 衣康酸二甲酯(DMI)对AML-12细胞ATP含量及mtDNA拷贝数的影响
由图3-A可见,与H2O2处理组相比,DMI处理显著缓解了H2O2诱导的AML-12细胞中ATP水平的下降(P<0.01)。同时,DMI处理可显著逆转H2O2诱导导致的mtDNA拷贝数的降低(图3-B)(P<0.01)。结果提示,DMI处理可抑制H2O2诱导的AML-12细胞中ATP合成的减少并保护线粒体的正常功能。
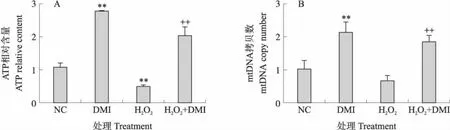
图3 DMI对AML-12细胞ATP含量(A)和mtDNA拷贝数(B)的影响Fig.3 Effects of DMI on ATP content(A)and mtDNA copy number(B)in AML-12 cells ++表示与H2O2组相比差异极显著(P<0.01)。下同。++indicate extremely significant difference(P<0.01)compared with the H2O2 group. The same below.
2.4 衣康酸二甲酯(DMI)通过激活AMPK-SIRT1信号通路缓解线粒体功能障碍
如图4所示,与NC组相比,H2O2处理显著降低AML-12细胞中p-AMPK、SIRT1、PGC1α、Nrf1和TFAM蛋白表达量(P<0.01)。与H2O2处理组相比,DMI处理则可显著升高H2O2诱导的AML-12细胞中p-AMPK、SIRT1、PGC-1α、Nrf1和TFAM蛋白的表达量(P<0.01)。结果提示,DMI处理可激活H2O2诱导的AML-12肝细胞中AMPK-SIRT1-PGC1α信号通路。

图4 DMI对AML-12细胞AMPK-SIRT1-PGC1α信号通路关键蛋白表达量的影响Fig.4 Effect of DMI on the expression level of key proteins in AMPK-SIRT1-PGC1α signaling pathway in AML-12 cells A. 蛋白免疫印迹条带 Protein Western blot;B-F. AMPK-SIRT1-PGC1α信号通路关键蛋白表达量Expression levels of key proteins in AMPK-SIRT1-PGC1α signaling pathway.
由图5可知:DMI处理可显著提高H2O2诱导的AML-12肝细胞中p-AMPK、SIRT1、PGC-1α、和Nrf1蛋白表达量,而AMPK抑制剂Compound C(CC)预处理则可明显消除DMI对p-AMPK、SIRT1、PGC1α和Nrf1蛋白表达的上调作用(P<0.01)。此外,Compound C预处理同样可明显消除DMI对H2O2诱导的AML-12细胞mtDNA拷贝数的上调(图5-F)(P<0.01)。结果提示,DMI通过激活AMPK-SIRT1-PGC1α信号通路可缓解H2O2诱导的AML-12细胞线粒体功能障碍。

图5 DMI通过激活AMPK-SIRT1-PGC1α信号通路缓解H2O2诱导的线粒体功能紊乱Fig.5 DMI alleviates H2O2-induced mitochondrial dysfunction by activating the AMPK-SIRT1-PGC1α signaling pathway A. 蛋白免疫印迹条带 Protein Western blot;B—E. AMPK-SIRT1-PGC1α信号通路关键蛋白表达水平 Expression levels of key proteins in AMPK-SIRT1-PGC1α signaling pathway;F. mtDNA拷贝数 mtDNA copy number.
3 讨论
作为营养物质代谢和联系的中心枢纽,线粒体是机体脂肪酸β-氧化、三羧酸循环及氧化磷酸化的主要场所[13];因而,维持线粒体正常的生理功能是保障机体代谢稳态的关键[14]。衣康酸作为三羧酸循环途径中产生的重要次生代谢产物,具有抗氧化、抗炎、抵抗病原体感染等多种生物学作用。作为衣康酸的功能类似物,DMI被发现在抗炎、免疫机能、氧化应激等方面同样具有广泛的调节作用[15],但关于DMI对线粒体功能障碍引发的相关代谢性疾病的调节效应及机制的研究仍然较少。
本研究发现,DMI可明显增强H2O2诱导的AML-12细胞中ATP水平以及mtDNA拷贝数。线粒体是机体产生ATP的主要场所,而mtDNA的转录翻译与线粒体生物合成密切相关,其可编码一系列线粒体呼吸的相关蛋白,包括氧化磷酸化的核心亚基[16];mtDNA突变将引起氧化磷酸化功能障碍而导致ATP合成减少,进一步影响线粒体生物学功能[17-18]。因此,线粒体DNA拷贝数降低和ATP合成能力减弱是线粒体功能障碍的主要表现[19]。此外,本研究发现DMI处理可明显抑制H2O2诱导的AML-12细胞mROS的过度产生。已有研究表明,位于线粒体基质中的mtDNA往往容易受到ROS的攻击而造成损伤[20]。以上结果提示,DMI缓解H2O2诱导的肝细胞线粒体功能障碍与其抑制活性氧的过度产生密切相关。同时,本研究发现DMI显著缓解H2O2刺激导致的AML-12细胞线粒体膜电位水平的降低。Zandalinas等[21]的研究表明,较高水平的MMP可促进ATP合成。以上结果证明DMI可通过抑制线粒体膜电位的降低以及活性氧过度产生而缓解肝细胞线粒体功能障碍。
本研究发现,H2O2处理可明显降低AML-12细胞中p-AMPK蛋白水平,而DMI处理则可明显增强H2O2诱导的AML-12细胞中p-AMPK蛋白水平。AMPK是调节线粒体生物发生的关键效应因子,其对线粒体功能的调控多是通过激活下游相关转录因子实现的[22]。通过对AMPK下游分子检测,我们发现DMI处理显著上调了H2O2诱导的AML-12肝细胞中SIRT1、PGC-1α和Nrf1蛋白表达,提示DMI可激活AMPK-SIRT1-PGC1α信号通路。Cantó等[23]研究表明,在成肌细胞(C2C12)肌管中,AMPK通过调节NAD+代谢和SIRT1活性来下调PGC-1α的乙酰化水平,从而控制机体的能量消耗。作为一种转录共激活因子[24],PGC-1α主要通过上调Nrf1和TFAM的表达水平来刺激线粒体生物发生,从而促进mtDNA的复制与转录,改善线粒体功能[25-26]。因此,AMPK-SIRT1-PGC-1α信号通路在维持线粒体功能中发挥着至关重要的作用。为了进一步验证AMPK是否在DMI预防AML-12细胞线粒体功能障碍中起关键作用,我们使用AMPK抑制剂Compound C预处理细胞。结果发现,Compound C预处理逆转了DMI对SIRT1、PGC-1α和Nrf1蛋白表达的上调作用;尤为重要的是,本研究发现Compound C预处理同样明显消除了DMI对H2O2诱导的AML-12细胞mtDNA拷贝数的上调。以上结果证明DMI通过激活AMPK-SIRT1-PGC1α信号通路来调节mtDNA的转录,进而缓解由H2O2诱导的肝细胞线粒体功能障碍。
综上所述,本研究证实了DMI通过激活AMPK-SIRT1-PGC1α信号通路缓解肝细胞线粒体功能障碍,研究结果为DMI作为一种生理调节剂用于预防畜禽线粒体功能障碍引发的相关营养代谢性疾病提供一定的理论依据及应用基础。
