铜山源水库春夏季浮游植物群落特征及其与环境因子的关系
2024-01-30王元元苏敬华黄若晗吴骏驰王丽卿上海海洋大学环境DNA技术与水生态健康评估工程中心上海006太湖流域管理局水利发展研究中心上海0044上海市环境科学研究院上海00上海海洋大学农业农村部鱼类营养与环境生态研究中心上海006
周 晗,蔡 梅,王元元,苏敬华,黄若晗,吴骏驰,王丽卿,4,张 玮,4① (.上海海洋大学环境DNA技术与水生态健康评估工程中心,上海 006;.太湖流域管理局水利发展研究中心,上海 0044;.上海市环境科学研究院,上海 00;4.上海海洋大学农业农村部鱼类营养与环境生态研究中心,上海 006)
浮游植物是水体中重要的初级生产者,在水体物质循环和能量转化过程中起到关键作用,其种类和数量的变化直接或间接地影响水质和其他水生生物的分布格局[1]。同时,不同种类浮游植物对水环境有不同的敏感响应和特异适应性。因此,不同类型水体中浮游植物群落特征不同,影响其分布格局的环境因子也会有所差异。非生物环境因子和生物环境因子的改变均与水库中浮游植物的群落变化关系密切[2]。对长江及其河口区的研究[3]发现,氮磷浓度和比例以及水温、浊度等理化因素的改变对浮游植物群落组成具有一定影响。胡洋等[4]通过监测和分析东太湖浮游生物群落证明,浮游动物可通过下行效应控制可食藻类生物量,进而导致浮游植物群落结构变化。陈立婧等[5]研究结果表明,城市人工滩涂湖泊——滴水湖浮游植物群落结构受到水温和总氮的影响。由此可见,不同类型水体浮游植物群落结构受到不同环境要素的影响。
水库是人工建造拦河坝形成的湖泊,其生态系统流动性和自净能力不及河流[6]。我国水库空间分布格局与黑河-腾冲线大致相同,东南沿海、珠三角和长江中下游地区水库水体面积广,水文情势复杂[7]。水库水体流动性较差并且在一定程度上受人为调节影响,这导致其浮游植物群落结构变化也与河流有较大差异[8]。张辉等[9]认为水温是影响大型贫营养水库新丰江水库浮游植物群落结构的关键因素,其后依次为透明度和电导率。上海青草沙水库作为饮用水水源地,其浮游植物群落结构受到水温、营养盐、高锰酸盐指数(CODMn)、溶解氧和透明度的影响[10]。而在水温变化较小的热带小型贫营养水库,由降雨引起的营养盐浓度变化是浮游植物群落改变的主要原因[11]。可见,由于气候、地势等因素的影响,不同类型水库浮游植物群落受到不同环境因子影响。
铜山源水库位于浙江省西部的衢江支流铜山源上,水库兴利库容约为1.15亿m3,总库容为1.72亿m3,平均水深为10 m左右,最大水深为41 m,为中营养水库,主要承担了浙西地区农田灌溉和周边地区水力供电的功能,同时在防洪和养殖等方面也具有重要价值[12-14]。21世纪初,水库曾为控制浮游植物而放养大量鲢鱼[14]。铜山源水库过往的生态学研究总体偏少,并且已有报道主要集中在灌溉和水产养殖等方面,在水库水质理化因子以及浮游植物群落结构等水生态基础数据方面还比较匮乏。
通过研究铜山源水库浮游植物群落及水质重要理化因子,结合水库氮磷营养的上行效应和浮游动物的下行效应,采用典范对应分析(CCA)等统计方法,综合分析春季至夏季浮游植物群落差异的主要影响因素,为铜山源水库水生态研究提供重要基础数据,也为同类型水库水生态研究和保护提供参考。
1 材料与方法
1.1 采样点与采样时间
根据铜山源水库形态和环境特点,设置6个采样点(图1),其中,St1和St2位于近岸,水深较浅,St3位于库中,St4和St5位于河流入库处,St6为泄洪口。于2021年3、5和7月分别进行采样。
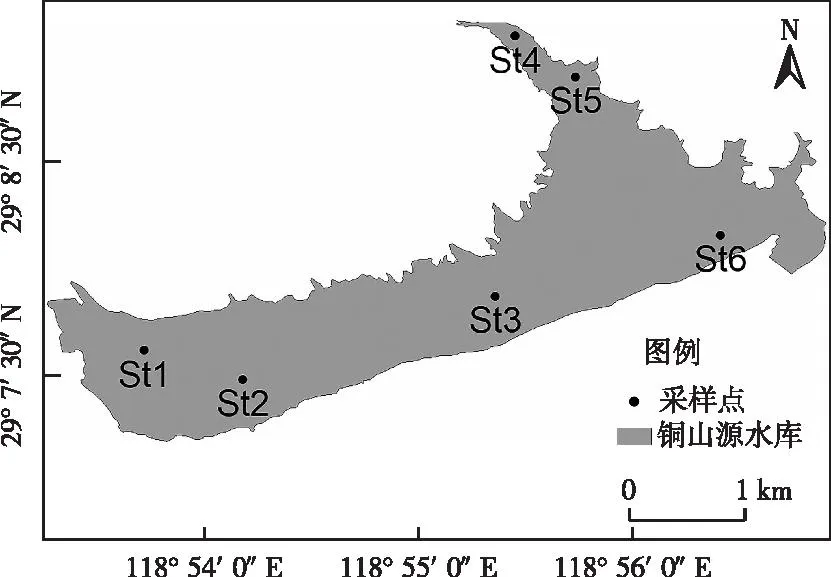
图1 铜山源水库采样点分布Fig.1 Distribution of sampling sites in Tongshanyuan Reservoir
1.2 浮游植物样品采集与鉴定
浮游植物采集:在表层水深0.5和2 m处采集10 L混合水样,取1 L加入4%福尔马林和鲁氏碘液进行固定,并于实验室静置48 h后采用虹吸法吸去上层清液[15],浓缩至50 mL,获得浮游植物定量样品。使用25#浮游生物网以“∞”字形拖动约3 min后,收集20~30 mL样品于聚乙烯瓶,用4%福尔马林溶液进行现场固定[16],之后均浓缩至20 mL,获得浮游植物定性样品。取0.1 mL浮游植物样品浓缩液摇匀后取样于浮游植物计数框中进行鉴定与计数,浮游植物分类标准主要参照文献[17-18]。
1.3 环境参数采样与测定
非生物环境因子:水温、pH、溶解氧(DO)浓度和氧化还原电位(ORP)等理化指标采用美国YSI ProPlus便携式多参数水质分析仪现场检测,水体透明度采用赛氏盘测定。采集水样总磷(TP)、总氮(TN)、氨氮(NH4+-N)和叶绿素(Chl-a)浓度以及高锰酸盐指数(CODMn)和重铬酸盐指数(CODCr)参照《水和废水监测分析方法》(第4版)[19]进行检测。
生物环境因子:采集表层水深0.5和2 m处混合水样20 L,将混合水样用13#浮游生物网过滤到500 mL样品瓶中,加入4%福尔马林固定,静置48 h后浓缩至20 mL[20]。在显微镜下对浓缩样品中浮游动物种类进行鉴定和计数,浮游动物鉴定参照文献[21-23],生物量参照体长-体重的回归方程[24-25]进行计算。
1.4 数据分析
物种优势度指数(Y)计算公式为
Y=nifi/N。
(1)
式(1)中,N为各采样点所有物种总个体数;ni为物种i个体数;fi为各采样点物种i出现频率。当Y>0.02时,该物种为群落中优势种[2]。
Shannon-Wiener多样性指数(H′)可用来表征不同种类个体分配上的均匀性,反映群落结构复杂程度和稳定性,计算公式为
(2)
式(2)中,S为浮游植物总种数;Pi为物种i个体数与所有物种总个体数的比值,ni/N;ni为物种i个体数;N为浮游植物总个体数[26]。
采用Excel 2019对数据进行预处理,采用SPSS 23.0对数据进行单因素方差分析,采用Origin 2019绘制柱状图和点线图,采用ArcGIS 10.2绘制浮游生物物种组成、密度和生物量空间分布图。采用R软件中vegan软件包对浮游动物群落进行主坐标分析(PCoA),并采用ggplot2软件包绘图。采用Canoco 5.0对浮游植物群落与环境因子进行典范对应分析(CCA)。
2 研究结果
2.1 水体环境因子
于3和7月对铜山源水库水质进行检测,ρ(TN)变化范围为0.40~1.64 mg·L-1,呈现下降趋势,ρ(TP)变化范围为0.02~0.10 mg·L-1,变化不大。CODMn变化范围为1.47~4.66 mg·L-1,CODCr变化范围为2.79~19.11 mg·L-1,两者均呈现上升趋势。平均水温由3月的15.77 ℃升至7月的30.53 ℃。ρ(DO)变化范围为7.30~10.77 mg·L-1,随水温升高呈现下降趋势。水体整体呈现弱碱性,随水温上升,pH由8.22上升至9.43。水体TN/TP有所下降,由28.03降至17.84(表1)。同一月份各点位间水质指标差异均不显著。在3月,St1和St4点位TP和TN与ρ(Chl-a)的比值均大于其他点位。
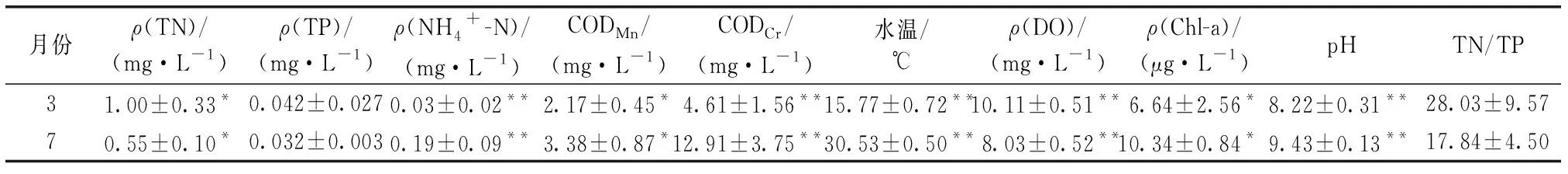
表1 铜山源水库环境因子数据Table 1 Data of environmental factors of Tongshanyuan Reservoir
2.2 浮游植物的种类组成和优势种
铜山源水库共鉴定出浮游植物7门57属96种(包括变种、变型),主要包括蓝藻门26种,占总种类数的27.0%,绿藻门35种,占总种类数的36.5%,硅藻门24种,占总种类数的25%。其余包括隐藻门4种,裸藻门4种,甲藻门2种,金藻门1种。不同月份浮游植物门类组成见表2。表3显示,Y>0.02的优势种有13种。3月主要优势种为硅藻门的小环藻(Cyclotellasp.)和蓝藻门的微囊藻(Microcystissp.)。5月主要优势种为蓝藻门的微囊藻(Microcystissp.)和水华束丝藻(Aphanizomenonflos-aquae)。7月主要优势种为绿藻门的网状空星藻(Coelastrumreticulatum)和蓝藻门的微囊藻(Microcystissp.)。
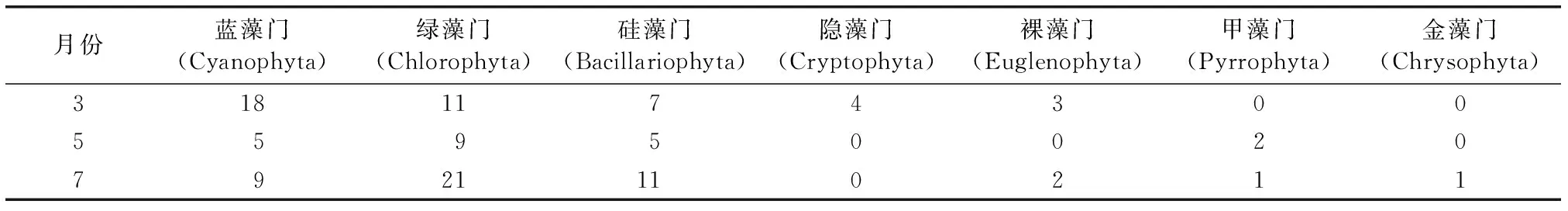
表2 铜山源水库各月份浮游植物门类组成Table 2 The phytoplankton compositions in the various months at Tongshanyuan Reservoir

表3 铜山源水库浮游植物优势种和优势度Table 3 Dominant genera and dominance of phytoplankton at Tongshanyuan Reservoir
2.3 浮游植物密度和生物量
3月铜山源水库浮游植物平均密度为14.33×106L-1,5月有所下降,为7.47×106L-1,7月又有较大增长,达到20.00×106L-1,为3月的1.4倍。浮游植物生物量变化也与密度呈类似趋势,最大值为7月的3.92 mg·L-1,分别为3月的2.45倍和5月的4.67倍。各采样点藻类密度和生物量分布见图2。3月浮游植物以硅藻门为主,5月蓝藻门占据优势,7月绿藻门又得到较大增长。在空间上,3月St6点位硅藻密度高于其他点位;5月St3点位浮游植物密度较低;7月浮游植物密度较大时,水库藻类分布整体较为均衡。
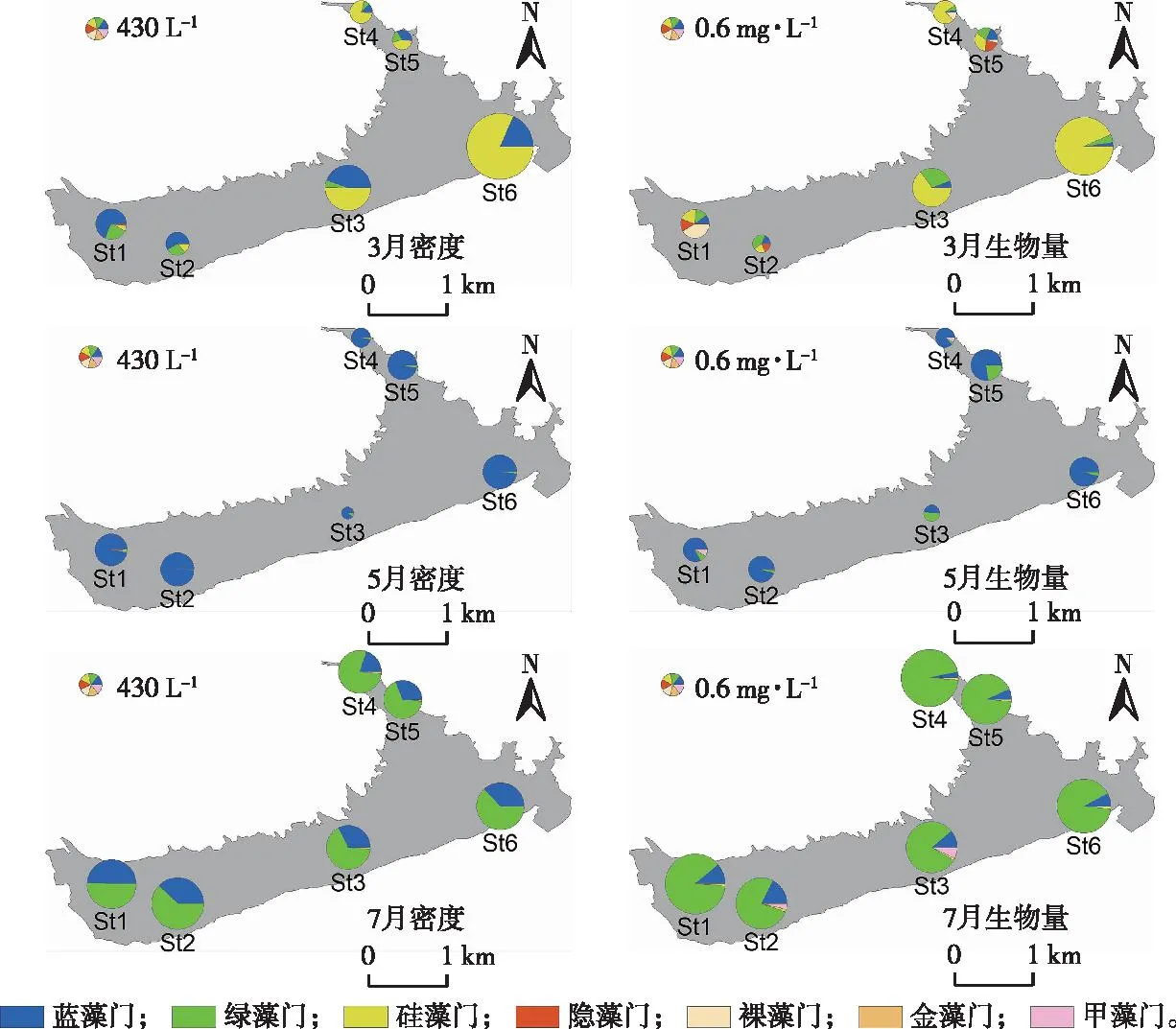
图2 不同月份铜山源水库浮游植物密度和生物量分布Fig.2 Distribution of phytoplankton density and biomass in different months in Tongshanyuan Reservoir
2.4 浮游植物多样性
图3为铜山源水库不同点位不同时期多样性指数差异。7月各采样点多样性指数(平均值为1.77)明显高于5月(平均值为1.36)和3月(平均值为1.32)。水库生物多样性整体相近,St4和St5点位作为入水口,其生物多样性略高于位于水库中心的St3和St6点位。
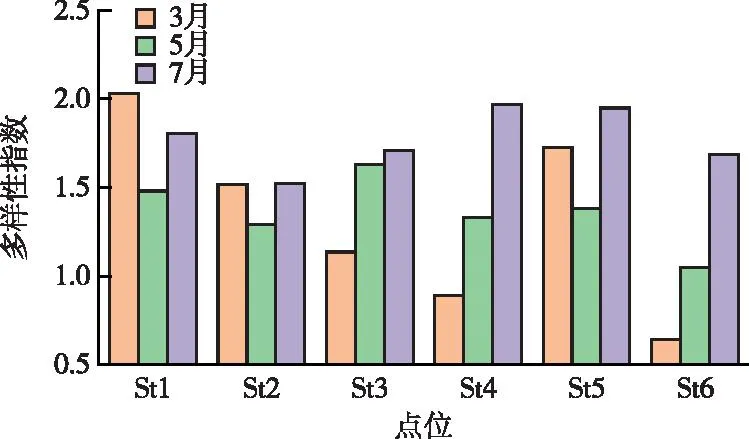
图3 铜山源水库浮游植物 Shannon-Wiener 多样性指数Fig.3 Shannon-Wiener diversity index of phytoplankton in Tongshanyuan Reservoir
2.5 浮游植物群落的时空相似性比较
采用PCoA方法对铜山源水库水体浮游植物群落相似性进行比较(图4)。结果表明,PCoA第1轴解释率为37.34%,第2轴解释率为23.85%,总解释率为62.91%。Anosim相似性分析结果表明,3、5和7月浮游植物群落结构存在显著差异(R2=0.974 9,P=0.001)。
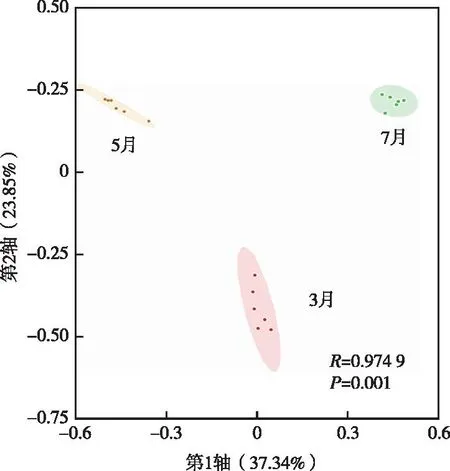
图4 铜山源水库不同季节浮游植物PCoA分析Fig.4 Principal coordinate analysis for phytoplankton communities in the Tongshanyuan Reservoir
2.6 浮游植物群落与环境因子的关系
先对数据进行去趋势对应分析(DCA),结果表明排序轴最大梯度长度为4.14(>3),可以采用CCA方法分析浮游植物群落与环境因子的相关性。选取pH、水温、溶解氧、总氮、总磷、氨氮、CODCr、CODMn、电导率(EC)、原生动物、轮虫、枝角类和桡足类13个非生物和生物环境因子与浮游植物群落进行CCA分析。结果(图5)表明,水温(F=3.5,P=0.002)、TN(F=2.6,P=0.042)和TP(F=2.9,P=0.042)是显著影响库区浮游植物群落结构和组成的环境因子。
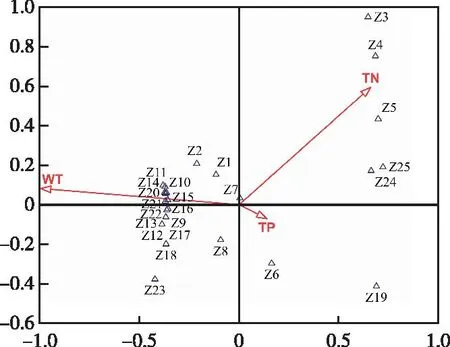
Z1为伪鱼腥藻,Z2为微囊藻,Z3为隐球藻,Z4为简单衣藻,Z5为双对栅藻,Z6为小球藻,Z7为空球藻,Z8为弓形藻,Z9为卵囊藻,Z10为单生卵囊藻,Z11为空星藻,Z12为网状空星藻,Z13为并联藻,Z14为微小四角藻,Z15为鼓藻,Z16为栅藻,Z17为单针藻,Z18为纺锤藻,Z19为小环藻,Z20为桥弯藻,Z21为舟形藻 ,Z22为卵形藻,Z23为布纹藻,Z24为卵形隐藻,Z25为扁裸藻。WT为水温,TN为总氮,TP为总磷。图5 浮游植物与主要环境因子的CCA分析Fig.5 Canonical correlation analysis of phytoplankton and main environmental factors
2.7 浮游动物对浮游植物的影响
铜山源水库浮游动物分布均匀,各点位浮游动物总密度变化范围为432.00~2 524.03 L-1,生物量变化范围为0.06~4.43 mg·L-1。随着夏季来临,浮游动物平均密度呈先上升后下降趋势,而生物量呈不断上升趋势(图6)。浮游动物中,体型较小的原生动物占比较高,而大型浮游动物较少,枝角类优势种主要为盔形透明溞(Daphniagaleata),桡足类优势种主要为汤匙华哲水蚤(Sinocalanusdorrii)及其幼体。对比各月份浮游动物与浮游植物生物量比值(BZp/BPhyt,图7)可见,5月BZp/BPhyt显著高于3和7月。
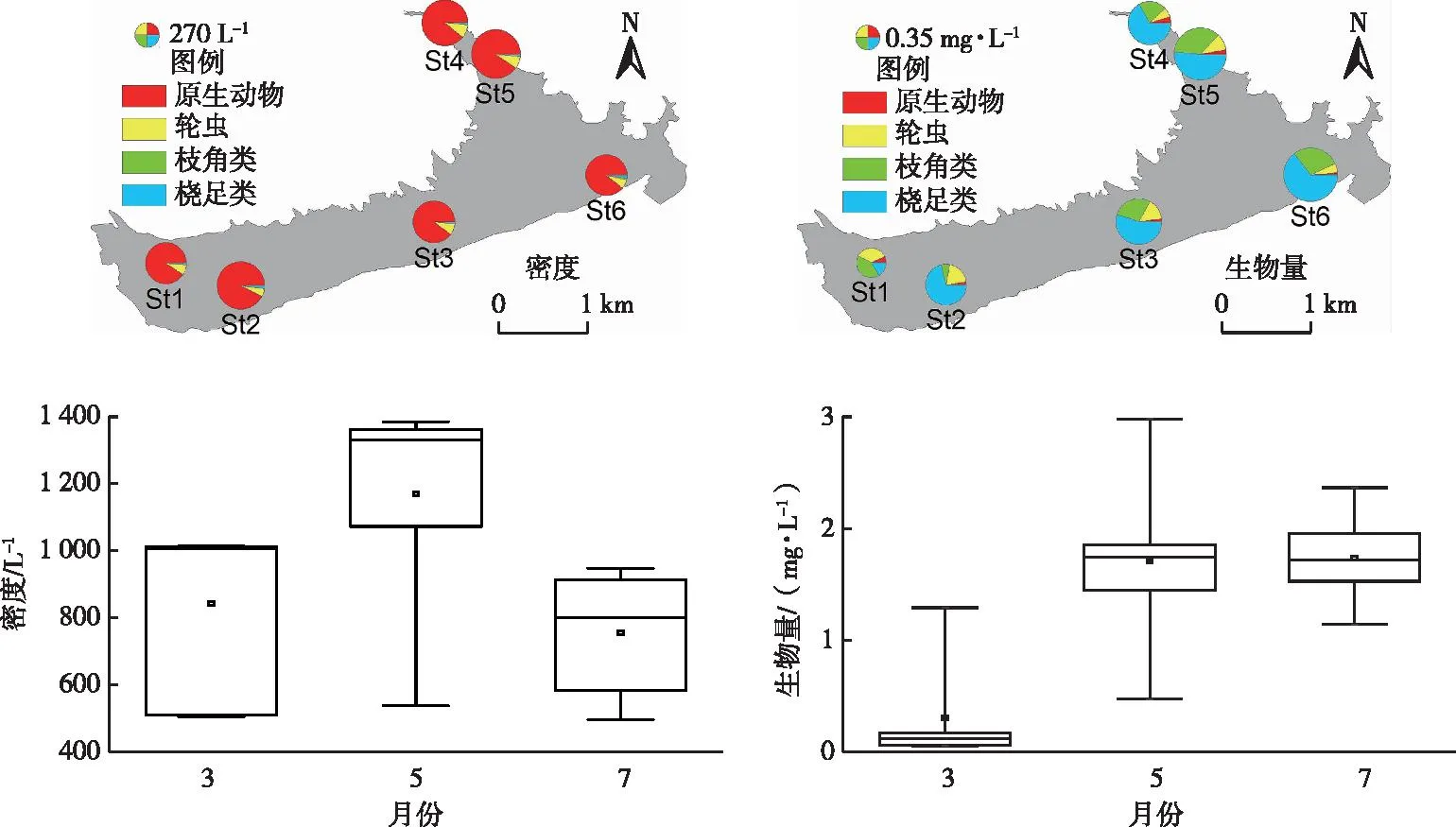
图6 铜山源水库浮游动物密度和生物量分布和变化Fig.6 Distribution of zooplankton density and biomass in Tongshanyuan Reservoir
3 讨论
3.1 铜山源水库浮游植物季节变化特征
由春季到夏季期间,铜山源水库水体磷含量基本没有变化,而氮含量下降和亚热带水库夏季高光热条件对藻类生长会产生一定程度影响。笔者调查发现,硅藻门的小环藻、绿藻门的空球藻和网状空星藻以及蓝藻门的微囊藻和水华束丝藻为铜山源水库优势度最高的藻种,这与同为中营养水平的三峡水库优势种[27]相似。绿藻门的空球藻在水库整个春夏季均为优势种,而硅藻门的小环藻则在春季温度较低时成为优势种,这是由于空球藻对物质的利用程度更大,能够过量吸收磷,在3月可以不受磷条件限制。但小环藻的低光照耐受性和空球藻的低温耐受性使它们不能在水温高、光照强的7月成为优势种[28]。微囊藻生长繁殖能力强,在整个春夏季均为优势种。7月,网状空星藻优势度最高,而2000年8和9月水库优势藻种为绿球藻[12],铜山源水库优势种已发生改变。综合来看,铜山源水库春夏季浮游植物群落结构呈现明显变化,由硅藻-绿藻型变为蓝藻型,再变为绿藻-蓝藻型。
铜山源水库作为蓄洪水库,水流可能带来水源地溪流中的浮游植物,使靠近水源的采样点浮游植物物种更丰富。浮游植物群落Shannon-Wiener多样性指数能在一定程度上反映水库环境情况[29]。水库整体Shannon-Wiener多样性指数小于3,表明生物多样性较低,种类组成单一,群落结构不稳定,而位于水库中心的点位浮游植物多样性最低,类似情况在红枫水库也有发现[30]。
水库浮游植物细胞密度和生物量在不同月份差异较大,与我国其他省份亚热带水库对比发现,春季至夏季浮游植物细胞密度基本上呈现上升趋势,例如,凌塘水库浮游植物密度在6月达到峰值,南湾水库在9月达到峰值,汤浦水库在5、6月达到峰值[31-33]。铜山源水库浮游植物细胞密度在3月呈上升趋势,5月有所回落,7月又上升,这与多数水库浮游植物密度和生物量在春季至夏季呈上升趋势的情况相近,但也有所不同[34]。
3.2 浮游植物的群落变化与环境因子的关系
影响浮游植物群落结构变化的因素主要有水温、总氮和总磷3个指标。其中,水温对藻类群落结构变化有极显著作用。温度能够在控制藻类呼吸作用强度和光合作用酶促反应速率的同时,也控制水体各种物质溶解度[35]。CCA分析结果表明,裸藻门和隐藻门浮游植物与水温呈现负相关,多数蓝藻门和绿藻门浮游植物与温度则呈现正相关。而在硅藻门藻类与水温的关系中,优势种小环藻与水温呈现负相关。硅藻适合生长温度为10~25 ℃,蓝藻门对高温的耐受力更强,其生长最适温度为25~35 ℃,绿藻适合生长温度则与蓝藻类似[10,36]。铜山源水库位于亚热带,水温变化明显。3月水库平均水温为15.7 ℃,水体优势种中存在硅藻,7月水温约为30 ℃,绿藻则成为优势种,可见温度上升使绿藻和蓝藻在水库中能获得更加优势的地位。张俊芳等[31]认为驱动汤浦水库浮游植物功能群季节演替的关键环境因子是水温。胡艺等[30]对红枫水库的研究也得出类似结论,水温升高导致藻类生长繁殖速度加快,也会反作用于水体指标。氮和磷是浮游植物生长繁殖所必需的营养物质,与浮游植物多样性、丰度和生物量息息相关[37]。硅藻门浮游植物与总磷的相关性更强,而蓝藻门浮游植物与总氮的相关性更强。笔者调查发现,7月铜山源水库总氮和总磷均值低于3月,这与太湖流域主要河口调查结果[38]类似,其原因可能与夏季降水量上升和高温引起的反硝化作用有关。钟卫鸿等[12]推测2000年铜山源水库水体尚未处于最优N/P条件,若库区TN/TP比例升高至25左右,则可能导致绿球藻暴发。也有研究[39]表明,当TN/TP范围为12∶1~25∶1时,藻类产生量随TN/TP下降而增加。笔者调查中,3月铜山源水库平均TN/TP为28,可见3月时库区已满足蓝藻和绿藻暴发增长的条件,随着温度上升,蓝藻门的微囊藻丰度升高,随后在7月则有所下降,7月TN/TP也降为18。由于浮游植物对水体中营养盐的利用导致TN/TP下降,而总氮水平下降可能在一定程度上限制蓝藻进一步暴发。有研究[40-41]表明,铜绿微囊藻和小球藻共同培养后,降低水体N浓度或适当提高P浓度后,小球藻将获得竞争优势。
浮游动物的牧食作用对各门类藻类变化的影响不显著。浮游动物与浮游植物生物量的比值(BZp/BPhyt)可以反映水体中食物网的有效性。水库5月BZp/BPhyt显著高于3和7月,表明5月出现较强的藻类牧食效应,这可能与早春至夏季的季节变化导致优势种也发生改变有关,这与BLANK等[42]发现BZp/BPhyt在6月初出现高峰的结果较为一致。而夏季BZp/BPhyt出现下降的原因可能是鱼类在高温季节牧食作用活跃,导致浮游动物生物量下降,进而引起浮游植物丰度上升[43-44]。
4 结论
(1)春季至夏季,铜山源水库库区浮游植物群落结构组成发生显著变化,硅藻和蓝藻优势度呈一定程度下降趋势,绿藻优势度则呈上升趋势。
(2)水温、TP和TN为影响藻类群落变化的关键环境因子。水温上升时,绿藻门藻类增长迅速,硅藻门优势种则受到一定限制。
(3)浮游动物密度和生物量的改变对藻类群落结构变化的影响不显著。在春夏季交替过程中,5月浮游动物对浮游植物的牧食作用更强,这可能是5月浮游植物减少的原因。
