外周血炎症指标对初诊多发性骨髓瘤患者预后的预测价值
2024-01-30黄宵莓黄柏明黄训俊吴菁李若林
黄宵莓 黄柏明 黄训俊 吴菁 李若林

[摘要] 目的 探讨中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、单核细胞与淋巴细胞比值(monocyte-to-lymphocyte ratio,MLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)等外周血炎症指标对初诊多发性骨髓瘤(multiple myeloma,MM)患者预后的预测价值。方法 采用回顾性方法,收集百色市人民医院血液科收治的77例初诊MM患者和77例健康体检者外周血NLR、MLR、PLR并比较差异。再以均值为临界值将初诊MM患者分为高NLR组、低NLR组、高MLR组、低MLR组、高PLR组、低PLR组,比较各组患者预后情况以及与总生存期(overall survival time,OS)的关系。结果 初诊MM患者的NLR、MLR、PLR明显高于健康对照组,差异统计学意义(P均<0.05)。高NLR和高MLR患者血清β2-微球蛋白(β2-microglobulin,β2-MG)水平较低NLR和低MLR组高,差异有统计学意义(P<0.05)。高NLR组、高MLR组和高PLR组患者OS较低NLR组、低MLR组和低PLR组患者短,预后较差,差异均有统计学意义(P均<0.05)。单因素Cox回归分析结果显示,国际分期体系(international staging system,ISS)分期、肌酐(creatinine,Cr)、β2-MG、白蛋白(albumin,ALB)、NLR、MLR及PLR与总生存情况有关(P<0.05);多因素Cox比例风险回归分析结果显示,NLR、MLR、PLR不是影响初诊MM患者预后的独立危险因素,差异无统计学意义(P>0.05)。按患者伴有影响预后的炎症指标(高NLR、高MLR、高PLR)数量,将患者分为0或1个危险因素组,2个危险因素组和3个危险因素组,3组患者OS的比较,差异有统计学意义(P=0.001)。患者伴有的预后危险因素数量越多,OS越短。结论 初诊MM患者炎症指标升高与患者OS短、预后差有关,它们可能作为评估初诊MM患者的病情及预后指标。
[关键词] 多发性骨髓瘤;炎症指标;中性粒细胞与淋巴细胞比值;单核细胞与淋巴细胞比值;血小板与淋巴细胞比值;预后
[中图分类号] R733.3 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.02.004
Predictive value of peripheral blood inflammatory indicators in patients with new-diagnosed multiple myeloma
HUANG Xiaomei1, HUANG Boming2, HUANG Xunjun3, WU Jing4, LI Ruolin4
1.Department of Clinical Laboratory, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, Guangxi, China; 2.Department of Clinical Laboratory, the People’s Hospital of Baise, Baise 533000, Guangxi, China; 3.Department of Hematology, the People’s Hospital of Baise, Baise 533000, Guangxi, China; 4.Clinical Medical Experiment Center, the First Affiliated Hospital of Guangxi Medical University, Nanning 530021, Guangxi, China
[Abstract] Objective To explore the predictive value of peripheral blood inflammatory indicators such as neutrophil-to- lymphocyte ratio (NLR), monocyte-to-lymphocyte ratio (MLR) and platelet-to-lymphocyte ratio (PLR) on the prognosis of patients with primary diagnosis of multiple myeloma (MM). Methods Using a retrospective method, 77 patients with first diagnosis of MM admitted to the Department of Hematology of Baise People’s Hospital and 77 healthy medical checkups with peripheral blood NLR, MLR and PLR were collected and compared the differences. Then the patients with primary diagnosis of MM were categorized into high NLR group, low NLR group, high MLR group, low MLR group, high PLR group, low PLR group using the mean value as the critical value, and the prognosis of the patients in each group as well as the relationship with overall survival time (OS) were compared. Results The NLR, MLR, and PLR of patients with initial diagnosis of MM were significantly higher than those of healthy controls, and the differences were statistically significant (all P<0.05). Serum β2-microglobulin (β2-MG) levels were higher in patients with high NLR and high MLR than in the low NLR and low MLR groups, and the difference was statistically significant (P<0.05). Patients in the high NLR, high MLR and high PLR groups had less OS and poorer prognosis than those in the low NLR, low MLR and low PLR groups, and the differences were statistically significant (all P<0.05). Univariate Cox regression analysis showed that international staging system (ISS) stage, creatinine (Cr), β2-MG, albumin (ALB), NLR, MLR and PLR were associated with overall survival (P<0.05); multivariate Cox proportional risk regression analysis showed that NLR, MLR, and PLR were not independent risk factors affecting the prognosis of patients with primary diagnosis of MM, and the difference was not statistically significant (P>0.05). According to the number of inflammatory indexes (high NLR, high MLR, high PLR) that affected the prognosis, the patients were divided into 0 or 1 risk factor group, 2 risk factor groups and 3 risk factor groups, and the comparison of OS between the three groups was statistically significant (P=0.001). The greater the number of concomitant risk factors for prognosis, the shorter the OS. Conclusion Elevated inflammatory indicators (NLR, MLR, PLR) in patients with primary diagnosis of MM were associated with less OS and poorer prognosis of the patients, and they may be used as indicators to assess the condition and prognosis of patients with primary diagnosis of MM.
[Key words] Multiple myeloma; Inflammatory indicators; Neutrophil-to-lymphocyte ratio; Monocytes to lymphocytes ratio; Platelet-to-lymphocyte ratio; Prognosis
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性克隆性疾病,约占所有癌症的1%,约占所有血液系统恶性肿瘤的10%[1]。临床表现为高钙血症、贫血、肾功能损害、溶骨性病变等,与其他转移到骨骼的恶性肿瘤不同,多发性骨髓瘤的溶骨性病变缺乏新的骨形成,严重影响患者生存[2]。尽管通过生物靶向治疗技术、新药物和自体干细胞移植等治疗手段,MM治疗和预后已有极大提升,但MM仍无法完全治愈[3-4]。MM患者的临床过程变化很大,对化疗药物的反应也各不相同。患者的总生存期(overall survival,OS)可从几个月到几年不等,其中多数患者容易面临疾病进展或复发的高风险,严重影响患者预后。目前,细胞分子遗传学检查是判断MM患者预后较准确的生物学依据,但由于检测难度大且费用较高,限制了在临床上的广泛应用[5]。近年来,关于外周全血细胞计数的炎症指标与肿瘤预后之间关系的研究不断增多,研究发现中性粒细胞与淋巴细胞比值(neutrophil/ lymphocyte ratio,NLR)、单核细胞与淋巴细胞比值(monocytes/ lymphocytes ratio,MLR)、血小板与淋巴细胞比值(platelet/lymphocyte ratio,PLR)与多种恶性肿瘤的不良预后有关,如卵巢癌、淋巴瘤、直肠癌等[6-8]。然而关于NLR、MLR和PLR对初诊MM患者的预后价值研究相对较少且结论存在争议[9-14]。本研究回顧性分析77例初诊MM患者NLR、MLR和PLR与其预后的关系,进一步探讨它们对初诊MM总生存期的预测价值,为临床医生早期诊断、干预或选择最佳的治疗方案提供建议。
1 资料与方法
1.1 研究对象
回顾性分析2018年2月至2023年3月百色市人民医院血液科收治的77例初诊MM的患者作为研究对象,所有入选患者诊断均符合《中国多发性骨髓瘤诊治指南(2020年修订版)》[15]。排除严重感染、慢性肝病、既往已确诊或伴随其他恶性肿瘤等对外周血中性粒细胞、淋巴细胞、血小板计数产生严重影响的病例。其中男性43例,女性34例,中位年龄61(37~86)岁。另选取77例同时期健康体检者作为对照组,其中男性46例,女性31例,中位年龄60(38~79)岁。两组研究对象的性别和年龄比例,差异均无统计学意义(P>0.05)。本研究经医院伦理委员会批准(伦理审批号:LW2023081002)。
1.2 方法
收集健康体检者与初次确诊为MM患者初次化疗前的中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数,分别计算各组的NLR、MLR、PLR。同时收集MM患者初次治疗前钙(calcium,Ca)、肌酐(creatinine,Cr)、β2-微球蛋白(β2-microglobulin,β-MG)、乳酸脱氢酶(lactate dehydrogenase,LDH)、白蛋白(albumin,ALB)、血红蛋白(haemoglobin,HGB)、平均血小板体积(mean platelet volume,MPV)等相关指标。根据NLR、MLR、PLR数值取各自均值为临界值,将77例MM患者分为高NLR组(NLR≥2.80)、低NLR组(NLR<2.80);高MLR组(MLR≥0.49)、低MLR组(MLR<0.49);高PLR组(PLR≥156)、低PLR(PLR<156)。OS定义为从患者确诊时间到因任何原因死亡或随访截止时间,随访截至2023年3月31日。
1.3 统计学方法
采用SPSS24.0统计学软件对数据进行处理分析,计量资料服从正态分布以均数±标准差(![]() )表示,采用t检验,计数资料比较采用χ2检验,不同水平NLR MLR、PLR患者的生存期比较采用Kapian-Meier法绘制生存曲线和Log-rank法比较生存曲线差异,并用Cox比例风险回归模型进行单因素和多因素危险因素分析。P<0.05为差异有统计学意义。
)表示,采用t检验,计数资料比较采用χ2检验,不同水平NLR MLR、PLR患者的生存期比较采用Kapian-Meier法绘制生存曲线和Log-rank法比较生存曲线差异,并用Cox比例风险回归模型进行单因素和多因素危险因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 初诊MM患者与健康对照组NLR、MLR、PLR之间的比较
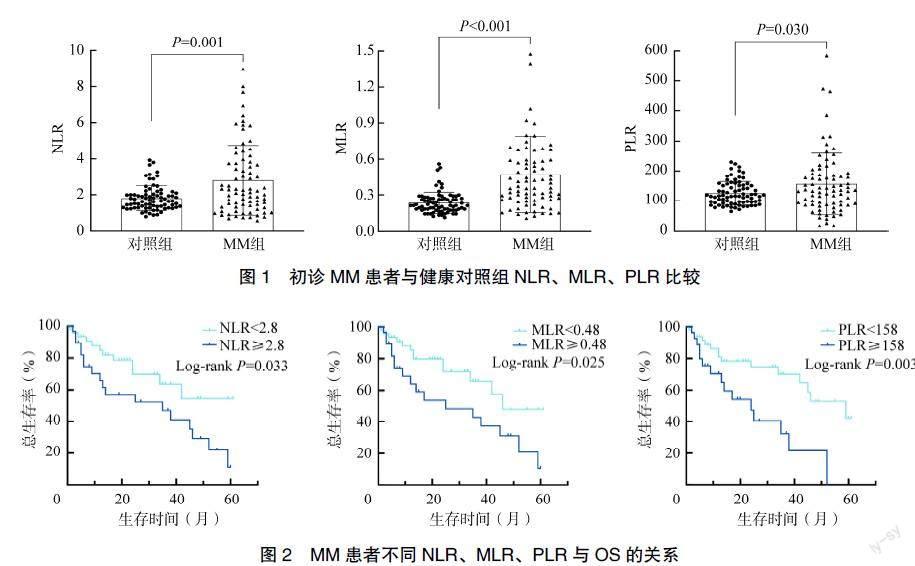
MM患者的NLR、MLR、PLR 明显高于健康对照组(NLR:2.80±1.95 vs. 1.80±0.69,MLR:0.49±0.39 vs. 0.23±0.09,PLR:155.83±87.19 vs. 125.22±39.53),差异有统计学意义(t=4.232、6.246、2.481,P均<0.05),见图1。
2.2 不同NLR、MLR、PLR与初诊MM患者OS的比较
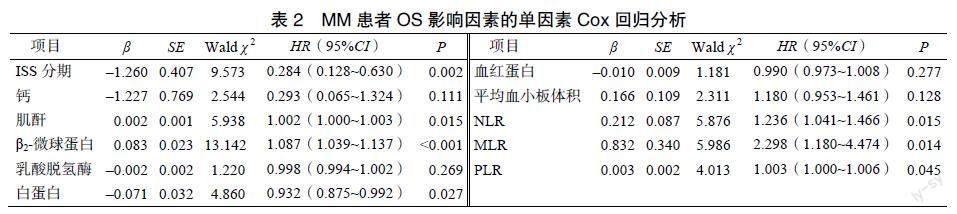
通过Kapian-Meier生存分析法发现,高NLR组和低NLR组的中位生存时间分别为12个月和29个月(c2=4.564,P=0.033),高MLR组和低MLR组的中位生存时间分别为12个月和29个月(c2=7.244,P=0.007),高PLR组和低PLR组的中位生存时间分别为13个月和28个月(c2=6.333,P=0.012),高NLR/MLR/PLR组总体生存时间较低NLR/MLR/PLR组短,预后较差,差异均有统计学意义(P均<0.05),结果见图2。
2.3 不同NLR、MLR、PLR与MM患者相关临床指标的比较
以均值为临界值将初诊MM患者分为高NLR组、低NLR组、高MLR组、低MLR组、高PLR组、低PLR组,通过χ2检验分析各组与患者年龄、性别、国际分期体系(international staging system,ISS)分期、Ca、Cr、β2-MG、LDH、Alb、HGB、MPV等临床指标方面的关系,结果显示,血清β2-MG水平在不同NLR、MLR组间差异有统计学意义(P<0.05),其余差异无统计学意义(P>0.05),见表1。
2.4 初诊MM患者预后生存的危险影响因素分析
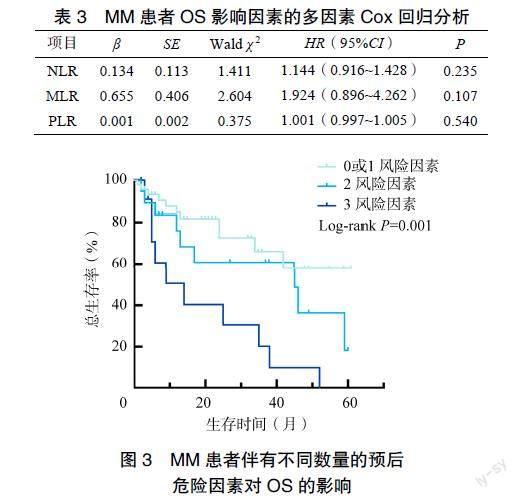
采用单因素Cox回归分析结果显示,患者ISS分期、Cr、β2-MG、Alb、NLR、MLR及PLR水平是影响初诊MM患者预后的危险因素,差异具有统计学意义(P<0.05),而患者Ca、LDH、HGB及MPV水平对MM预后无统计学意义(P>0.05),见表2。多因素Cox回归分析的结果显示,NLR、MLR、PLR并不是影响初诊MM患者预后的独立危险因素,差异无统计学意义(P>0.05),见表3。
2.5 以NLR、MLR、PLR建立风险分层对总生存时间的影响
按患者伴有影响预后的炎症指标(高NLR、高MLR、高PLR)数量,将患者分为0或1个危险因素组(n=46,59.74%),2个危险因素组(n=19,24.68%)和3个危險因素组(n=12,15.58%),3组患者的中位OS时间分别29个月、18个月、12个月,差异有统计学意义(P=0.001)。患者伴有的预后危险因素数量越多,中位OS时间越短,见图3。
3 讨论
随着对MM生物学特性的深入研究,发现MM的疾病进展与骨髓肿瘤微环境的变化有关[16]。骨髓肿瘤微环境可促进骨髓瘤细胞的增殖和生存,并影响其耐药性[17]。全身炎症反应在肿瘤的发展和进展中扮演着重要角色,可促进肿瘤的生长和转移,严重影响肿瘤相关微环境的变化,并与肿瘤患者的预后相关[18]。基于这些理论,从全血细胞计数中获得的一系列炎症相关指标,包括NLR、MLR和PLR,由于其容易获得且价格低廉,已经被进一步用于反映MM患者的炎症状态及评估预后情况[9-11]。
本研究结果表明,NLR、MLR和PLR这3个全身性炎症指标在初诊MM患者的预后评估中都具有重要作用。初诊MM患者NLR、MLR、PLR明显高于健康对照组,生存分析结果显示,高NLR组、高MLR组和高PLR组OS低于低NLR组、低MLR组和低PLR组,两组间差异有统计学意义(P<0.05)。这3个炎症指标通过反映机体免疫状态与肿瘤微环境之间的平衡关系,揭示了肿瘤与免疫系统之间的紧
密交互作用。NLR作为一个反映机体抗肿瘤和促肿瘤平衡的指标,其升高可能意味着肿瘤微环境中中性粒细胞相对增加,而淋巴细胞相对减少。这种情况可能导致机体炎症反应的加剧,淋巴细胞抗肿瘤作用减弱,进而为肿瘤的发展提供有利环境[19]。
本研究结果表明,高NLR与MM患者预后不良相关,这表明NLR可能作为MM患者预后的危险因素。类似地,MLR的升高与肿瘤相关巨噬细胞的增加有关,这些巨噬细胞可以促进浆细胞增殖和血管生成,进一步支持MM免疫逃避和进展。从而降低机体对肿瘤的免疫监视能力[20]。本研究发现,高MLR与MM患者预后不良相关,进一步验证了其作为危险因素的潜力。同样,PLR的增加也与炎症反应有关,血小板的增多可能会激活凝血系统,释放生长因子,并刺激多种信号转导机制,从而促进肿瘤的进展[21]。本研究结果显示,高PLR与初诊MM患者的不良预后相关,支持其作为预后危险因素的观点。本研究进一步将NLR、MLR、PLR 3种炎症指标结合起来,形成一种简单实用的危险分层,初诊MM患者伴有的预后危险因素数量越多,中位OS时间越短,可为预后提供信息。
尽管本研究结果表明3种炎症指标(NLR、MLR、PLR)均与初诊MM患者的预后不良相关,高NLR、高MLR、高PLR的初诊MM患者OS较短,NLR、MLR、PLR是初诊MM患者预后的危险因素,但通过多因素分析结果,NLR、MLR和PLR并不是独立的预后危险因素。这与部分研究结果不一致[12-14],这可能由于不同研究临界值的选取和研究对象临床特征的异质性所导致。目前,主要有3种方式用于临界值的选取,即中位数、平均值和ROC曲线取截点。在本研究中选择了平均值NLR=2.80、MLR=0.49和PLR=156作为临界值,这也可能是不同研究结果存在差异的原因之一。此外,不同的研究可能涵盖不同的人群,其临床特征的异质性也可能导致患者的NLR、MLR、PLR等指标变化比例存在差异。NLR、MLR、PLR能否成为初诊MM患者预后的独立危险因素,需要更大样本量及多中心的研究进一步证实。
本研究还比较了高/低NLR组、高/低MLR组、高/低PLR组的相关临床指标差异,结果显示,高NLR和高MLR患者血清β2-MG水平较低NLR和低MLR组高,差异有统计学意义(P<0.05)。这种现象可能与炎症损伤微血管有关,进而引发肾小球病变。由于各指标之间的联系可能受到许多因素的影响,如样本量、患者人群的异质性、检测方法等,需要进行更大规模、多中心的研究,以涵盖更广泛的人群去充分证实β2-MG与NLR和MLR之间的确切关联。
綜上所述,外周血炎症指标(NLR、MLR、PLR)有望作为简单、廉价且易获得的检测指标,用于评估多发性骨髓瘤患者的预后。当然,本研究存在一定局限性,比如存在人口群体特性方面的差异、有限的样本量和随访时间等。因此,NLR、MLR、PLR三者在初诊MM患者中的预后诊断价值仍需要进行更大规模的样本量、多中心和较长时间的随访期研究来进一步证实。为了提高预后评估的准确性,下一步的研究重点将是将NLR、MLR、PLR与其他免疫功能指标联合使用,形成一种简单实用的风险分层方法来评估新诊断MM患者的预后,为患者的个体化治疗提供更为有效的依据。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] RAJKUMAR S V. Multiple myeloma: 2016 update on diagnosis, risk-stratification, and management[J]. Am J Hematol, 2016, 91(7): 719–734.
[2] ZHANG X, DUAN J, WEN Z, et al. Are the derived indexes of peripheral whole blood cell counts (NLR, PLR, LMR/MLR) clinically significant prognostic biomarkers in multiple myeloma? A systematic review and Meta-analysis[J]. Front Oncol, 2021, 11: 766672.
[3] JIAO Y, YI M, XU L, et al. CD38: targeted therapy in multiple myeloma and therapeutic potential for solid cancers[J]. Expert Opin Investig Drugs, 2020, 29(11): 1295–1308.
[4] PARRONDO R D, AILAWADHI S, SHER T, et al. Autologous stem-cell transplantation for multiple myeloma in the era of novel therapies[J]. JCO Oncol Pract, 2020, 16(2): 56–66.
[5] HANBALI A, HASSANEIN M, RASHEED W, et al. The evolution of prognostic factors in multiple myeloma[J]. Adv Hematol, 2017, 2017: 4812637.
[6] KOVÁCS A R, SULINA A, KOVÁCS K S, et al. Prognostic significance of preoperative NLR, MLR, and PLR values in predicting the outcome of primary cytoreductive surgery in serous epithelial ovarian cancer[J]. Diagnostics (Basel), 2023, 13(13): 2268.
[7] TEZOL O, BOZLU G, SAGCAN F, et al. Value of neutrophil-to-lymphocyte ratio, monocyte-to-lymphocyte ratio, platelet-to-lymphocyte ratio and red blood cell distribution width in distinguishing between reactive lymphadenopathy and lymphoma in children[J]. Bratisl Lek Listy, 2020, 121(4): 287–292.
[8] ERGEN Ş A, BARLAS C, YILDIRIM C, et al. Prognostic role of peripheral neutrophil-lymphocyte ratio (NLR) and platelet-lymphocyte ratio (PLR) in patients with rectal cancer undergoing neoadjuvant chemoradiotherapy[J]. J Gastrointest Cancer, 2022, 53(1): 151–160.
[9] ZENG Q, LIU Z, LI Q, et al. Prognostic value of neutrophil to lymphocyte ratio and clinicopathological characteristics for multiple myeloma: A Meta- analysis[J]. Medicine (Baltimore), 2018, 97(41): e12678.
[10] 崔壮壮, 张媛媛, 金北平, 等. 中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值对初诊多发性骨髓瘤患者总生存和无进展生存的预测意义[J]. 解放军医学院学报, 2019, 40(2): 121–126.
[11] 杨文慧, 孙延庆, 张启科, 等. 中性粒细胞/淋巴细胞比值及单核细胞/淋巴细胞比值在多发性骨髓瘤患者中的预后意义[J]. 中国实验血液学杂志, 2021, 29(1): 122–130.
[12] SHI L, QIN X, WANG H, et al. Elevated neutrophil- to-lymphocyte ratio and monocyte-to-lymphocyte ratio and decreased platelet-to-lymphocyte ratio are associated with poor prognosis in multiple myeloma[J]. Oncotarget, 2017, 8(12): 18792–18801.
[13] 彭千涯, 馬瑞娟, 郭睿娜, 等. 淋巴细胞/单核细胞比率与校正血钙作为新诊断多发性骨髓瘤预后标志物的意义[J]. 中国实验血液学杂志, 2022, 30(1): 152–157.
[14] TIAN Y, ZHANG Y, ZHU W Q, et al. Peripheral blood lymphocyte-to-monocyte ratio as a useful prognostic factor in newly diagnosed multiple myeloma[J]. Biomed Res Int, 2018, 2018: 9434637.
[15] 中国医师协会血液科医师分会, 中华医学会血液学分会, 中国医师协会多发性骨髓瘤专业委员会. 中国多发性骨髓瘤诊治指南(2020年修订)[J]. 中华内科杂志, 2020(5): 341–346.
[16] ROMANO A, CONTICELLO C, CAVALLI M, et al. Immunological dysregulation in multiple myeloma microenvironment[J]. Biomed Res Int, 2014, 2014: 198539.
[17] ZHOU J, MAUERER K, FARINA L, et al. The role of the tumor microenvironment in hematological malignancies and implication for therapy[J]. Front Biosci, 2005, 10: 1581–1596.
[18] DOLAN R D, LAIRD B J A, HORGAN P G, et al. The prognostic value of the systemic inflammatory response in randomised clinical trials in cancer: A systematic review[J]. Crit Rev Oncol Hematol, 2018, 132: 130–137.
[19] BELTRAN B E, CASTRO D, DE LA CRUZ-VARGAS J A, et al. The neutrophil-lymphocyte ratio is prognostic in patients with early stage aggressive peripheral T cell lymphoma[J]. Br J Haematol, 2019, 184(4): 650–653.
[20] CENCINI E, SICURANZA A, CIOFINI S, et al. Tumor- associated macrophages in multiple myeloma: key role in disease biology and potential therapeutic implications[J]. Curr Oncol, 2023, 30(7): 6111–6133.
[21] CHEN Y, YUAN J, TANG F, et al. Research progress on the correlation between platelet aggregation and tumor progression[J]. Histol Histopathol, 2023, Online ahead of print.
(收稿日期:2023–10–18)
(修回日期:2023–11–15)
