阻塞性睡眠呼吸暂停低通气综合征合并代谢综合征的患病情况及影响因素分析
2024-01-30孙婷婷魏翠英
孙婷婷 魏翠英


[摘要] 目的 探討阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)合并代谢综合征(metabolic syndrome,MS)的患病情况,分析影响OSAHS合并MS的相关因素。方法 收集2020年8月至2022年10月在包头医学院第一附属医院住院并诊断为OSAHS的患者290例,根据患者是否合并MS分为OSAHS合并MS组(n=150)和单纯OSAHS组(n=140),并依据呼吸暂停低通气指数(apnea hypopnea index,AHI)将OSAHS合并MS组患者分为轻度组、中度组、重度组3个亚组。记录患者的一般情况、生化指标及睡眠参数,采用Logistic回归分析明确影响OSAHS合并MS的相关因素。结果 (1)290例OSAHS患者中,MS的合并率为51.7%,男性患者多于女性,50~59岁是OSASH合并MS患病的高峰期。(2)两组患者的体质量指数(body mass index,BMI)、收缩压、高血压史、糖尿病史、AHI、空腹血糖(fasting blood glucose,FBG)、三酰甘油(triglyceride,TG)、高密度脂蛋白-胆固醇(high density lipoprotein-cholesterol,HDL-C)、尿酸(uric acid,UA)的比较差异有统计学意义(P<0.05);Logistic回归分析显示,BMI、FBG、TG、HDL-C、UA、高血压史、糖尿病史是影响OSAHS合并MS的独立危险因素(P<0.05)。(3)不同严重程度的三组OSAHS合并MS患者的性别、年龄、BMI、AHI、TG、HDL-C、UA的比较差异有统计学意义(P<0.05),Logistic回归分析结果显示,BMI、TG、HDL-C是影响不同严重程度OSAHS合并MS的独立危险因素(P<0.05)。结论 住院OSAHS患者有较高的MS合并率。OSAHS合并MS与BMI、血压、血糖、血脂、尿酸水平等多种因素有关。超重和血脂异常在诱导疾病加重的过程中发挥重要作用。
[关键词] OSAHS;代谢综合征;患病率;影响因素
[中图分类号] R587.1 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.02.005
Analysis of prevalence and influencing factors of OSAHS complicated with metabolic syndrome
SUN Tingting, WEI Cuiying
Department of Geriatrics, the First Affiliated Hospital of Baotou Medical College, Inner Mongolia University of Science and Technology, Baotou 014010, Inner Mongolia, China
[Abstract] Objective To investigate the prevalence of obstructive sleep apnea-hypopnea syndrome (OSAHS) combined with metabolic syndrome (MS), and analyze the related factors affecting OSAHS combined with MS. Methods Totally 290 patients with OSAHS hospitalized in the First Affiliated Hospital of Baotou Medical College and diagnosed as OSAHS were collected from August 2020 to October 2022. According to whether the patients were complicated with MS, they were divided into OSAHS combined with MS group and simple OSAHS group. According to apnea hypopnea index (AHI), the patients of OSAHS combined with MS group were divided into three subgroups: mild group, moderate group and severe group. The general condition, biochemical indicators and sleep parameters of patients were recorded, and the relevant factors affecting OSAHS with MS were determined by logistic regression analysis. Results (1) Among the 290 patients with OSAHS, ;the incidence of MS was 51.7%, male patients were more than female patients, and the peak of OSASH with MS was between 50 and 59 years old. (2) body mass index (BMI), systolic blood pressure, hypertension history, diabetes history, AHI, fasting blood glucose (FBG), triglyceride (TG), high density lipoprotein-cholesterol (HDL-C), uric acid (UA) were statistically different between the two groups (P<0.05); Logistic regression analysis showed that BMI, FBG, TG, HDL-C, UA, history of hypertension and history of diabetes were independent risk factors for OSAHS with MS (P<0.05). (3) There were statistically significant differences in gender, age, BMI, AHI, TG, HDL-C and UA among the three groups of OSAHS with MS with different severity (P<0.05). Logistic regression analysis showed that BMI, TG and HDL-C were independent risk factors affecting OSAHS with MS with different severity (P<0.05). Conclusion (1) The inpatients with OSAHS have a high incidence of MS. (2) OSAHS combined with MS is related to BMI, blood pressure, blood glucose, blood lipid, blood uric acid level and other factors. (3) Overweight and dyslipidemia play an important role in the process of inducing disease aggravation.
[Key words] OSAHS; Metabolic syndrome; Prevalence; Influencing factors
随着老龄化社会的到来,阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)与代谢综合征(metabolic syndrome,MS)成為影响人类健康的重要慢性疾病,受到越来越多的关注。OSAHS以睡眠打鼾伴呼吸暂停为主要特征,可继发多系统损伤,引起多种并发症,MS就是其中之一[1]。MS是一组以超重、高血压、高血糖及血脂异常为主要表现的临床症候群[2]。此前已完成大量动物实验,并从分子机制解释OSAHS与MS各组分间的关联,希望以此来改善OSAHS与MS导致的全身代谢紊乱性损伤。然而,从流行病学角度来说,对疾病的认识还不够彻底,与疾病相关的危险因素仍有待进一步探究。本研究通过回顾性分析内蒙古科技大学包头医学院第一附属医院住院OSAHS患者的临床资料,旨在探讨OSAHS合并MS的患病情况,分析影响OSAHS合并MS的相关危险因素,以期为预防MS的发生及延缓病情进展提供科学的理论依据。
1 资料与方法
1.1 研究对象
收集2020年8月至2022年10月在包头医学院第一附属医院收治住院并诊断为OSAHS的患者为研究对象。(1)纳入标准:①诊断为OSAHS; ②年龄≥18周岁。(2)排除标准:①中枢性睡眠呼吸暂停患者;②长期服用镇静安眠类药物的患者;③MS诊断依据缺失,如一般资料或生化指标缺失。(3)分组标准:①将OSAHS患者中符合MS诊断标准的患者纳入OSAHS合并MS组,其余患者纳入单纯OSAHS组;②将OSAHS合并MS组患者依据呼吸暂停低通气指数(apnea hypopnea index,AHI)进一步分为轻度组、中度组、重度组三个亚组。本研究经包头医学院医学伦理审查委员会批准[伦理审批号:包医伦审2021第(030)号]。
1.2 方法
1.2.1 资料收集 通过包头医学院第一附属医院病案系统检索病例资料,采取整群抽样的方法,选取时间段内所有满足条件的OSAHS患者。收集患者的一般资料:姓名、性别、年龄、身高、体质量指数(body mass index,BMI),高血压、糖尿病病史,入院次日晨起血压;生化指标:空腹血糖(fasting blood glucose,FBG)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白-胆固醇(high density lipoprotein-cholesterol,HDL-C)、低密度脂蛋白-胆固醇(low density lipoprotein- cholesterol,LDL-C)、尿酸(uric acid,UA)、Cys-C;睡眠参数:呼吸暂停低通气指数(apnea hypoventilation index,AHI)。
1.2.2 疾病诊断标准
(1)OSAHS诊断标准:采用中华医学会呼吸病学分会(2015版)建议的诊断标准,有夜间睡眠打鼾伴呼吸暂停等症状,整夜监测≥7h睡眠中,AHI≥5n/h即可诊断,并根据AHI将病情分为轻度(AHI 5~15n/h),中度(AHI 15~30n/h)和重度(AHI>30n/h)。
(2)MS诊断标准:采用中华医学会糖尿病学分会(2004版)建议的诊断标准,具备以下4项中的3项或全部者可确诊为MS:① 超重和(或)肥胖:体质量指数(body mass index,BMI)≥25kg/m2;② 高血糖:FBG≥6.1mmol/L(110mg/dl)和(或)FBG≥7.8mmol/L(140mg/dl),和(或)已确诊糖尿病并治疗者;③ 高血压:收缩压/舒张压≥140/90mmHg(1mmHg=0.133kPa),和(或)已确诊高血压并接受治疗者;④ 血脂紊乱:空腹TG≥1.7mmol/L(150mg/dl),和(或)空腹HDL-C< 0.9mmol/L(35mg/dl)(男),<1.0mmol/L(39mg/dl)(女)。
1.3 统计学方法
采用SPSS 26.0统计学软件对数据进行处理分析,服从正态分布的定量资料以均数±标准差(![]() )表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。定性资料以计数(百分率)[n(%)]表示,组间比较采用χ2检验。影响因素分析采用Logistic回归分析,以P<0.05为差异有统计学意义。
)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。定性资料以计数(百分率)[n(%)]表示,组间比较采用χ2检验。影响因素分析采用Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 OSAHS合并MS的患病情况
本研究共纳入290例OSAHS患者,合并MS的有150例,MS的合并率为51.7%。其中,男性患者108例,女性患者42例,男性患者多于女性,且50~59岁是OSASH合并MS患病的高峰期。
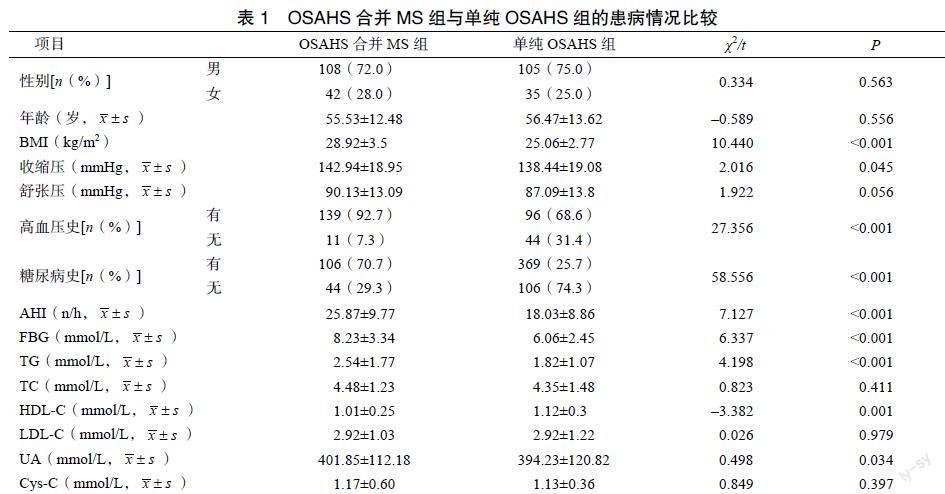
2.2 OSAHS合并MS组与单纯OSAHS组的患病情况比较
两组患者的性别、年龄、舒张压、TC、LDL-C、Cys-C均差异无统计学意义(P>0.05);两组患者的BMI、收缩压、高血压史、糖尿病史、AHI、FBG、TG、HDL-C、UA差异有统计学意义(P<0.05),见表1。
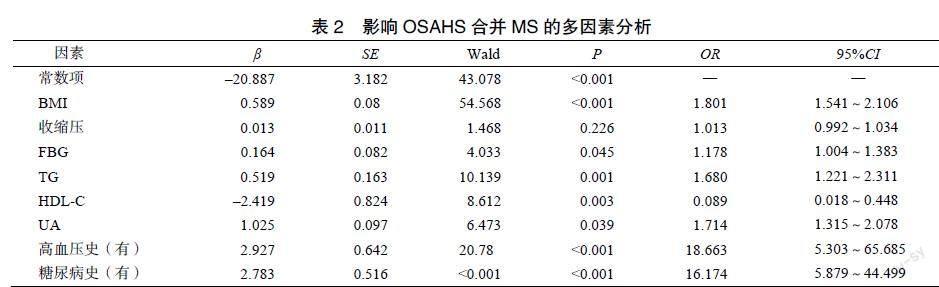
2.3 影响OSAHS合并MS的多因素分析
以OSAHS有无合并MS为因变量(有=1,無=0),以单因素分析筛选出差异有统计学意义的相关因素为自变量进行Logistic回归分析,结果显示,OSAHS合并MS与BMI、FBG、TG、UA、高血压史、糖尿病史呈正相关(P<0.05),与HDL-C呈负相关(P<0.05),可认为BMI、FBG、TG、HDL-C、UA、高血压史、糖尿病史是影响OSAHS合并MS的独立危险因素,见表2。
2.4 不同严重程度的OSAHS合并MS患者的患病情况比较
三组患者的收缩压、舒张压、高血压史、糖尿病史、FBG、TC、LDL-C、Cys-C均差异无统计学意义(P>0.05),三组患者的性别、年龄、BMI、AHI、TG、HDL-C、UA的差异有统计学意义(P<0.05),见表3。
2.5 影响不同严重程度OSAHS合并MS的多因素分析
以不同严重程度OSAHS合并MS为因变量(轻中度=0,重度=1),以单因素分析筛选出差异有统计学意义的相关因素为自变量进行Logistic回归分析,结果显示,不同严重程度的OSAHS合并MS与BMI、TG呈正相关(P<0.05),与HDL-C呈负相关(P<0.05),可认为BMI、TG、HDL-C是影响不同严重程度OSAHS合并MS的独立危险因素,见表4。
3 讨论
OSAHS与MS均为临床常见病,探讨OSASH合并MS的患病情况及相关影响因素,对于疾病的早期预防及早期诊疗具有重要意义。在不同研究中,OSAHS合并MS的患病率差异较大,国外研究结果显示,OSAHS合并MS的患病率波动在40%~80%[3-5]。国内一项大样本的临床研究结果显示,OSAHS患者MS的患病率为43.6%[6]。本研究结果显示,住院OSAHS患者中,MS的患病率为51.7%,本研究的患病率高于国内大样本研究的患病率,可能与不同地区人群的饮食习惯、民族差异等因素有关。苏小凤等[7]研究发现,我国北方地区OSAHS患病率高于南方地区。郑海芳等[8]研究发现,蒙古族人群MS患病率高于其他民族。我市地处北方,居民以汉族和蒙古族为主,偏好肉食与奶制品,这可能是OSAHS合并MS患病率较高的原因之一。
本研究显示,OSAHS合并MS患者男性居多,且50~59岁年龄段是OSAHS合并MS患病的高峰期。此结果与潘悦达等[9]研究结果一致,这与多种因素有关:(1)生理结构差异:男性口咽部较长且舌部肥厚,这使得男性上呼吸道发生塌陷的风险明显高于女性[9]。(2)内脏脂肪差异:内脏脂肪面积与AHI呈正相关,而女性内脏脂肪(约占总体脂的5%~8%)远低于男性(约占总体脂的10%~20%)[10]。(3)性激素水平差异:当雌激素水平降低时,女性患OSAHS及MS的风险均相应增加。一项队列研究结果显示,处于围绝经期的女性,年龄每增加1岁,AHI就增加4%[11]。同时,雌激素受体表达下调促使皮下脂肪向内脏转移,增加MS的患病风险[12]。因此,要重点关注围绝经期女性合并症的患病情况。
本研究结果再次证实,BMI、FBG、TG、HDL-C是影响OSAHS合并MS的独立危险因素。既往研究发现,OSAHS与MS各组分密切相关,OSAHS可通过多种机制引起BMI增加、血压升高、糖脂代谢紊乱,进而引发MS[13]。近来还有研究发现,UA水平与OSAHS病情严重程度相关,可能是OSAHS的独立危险因素,与本研究结果一致[14]。因此,临床工作中,对于确诊为OSAHS的患者,要鼓励其减重,定期监测血压、血糖、血脂、尿酸水平,警惕MS的发生,并给予其及时合理的干预措施。本研究进一步分析了影响不同严重程度OSAHS合并MS的相关因素,结果显示,超重和血脂异常在诱导疾病加重的过程中发挥重要作用。研究显示,BMI与AHI呈正相关,BMI增加会直接导致病情进展[15]。另外,OSAHS严重程度还与TG水平呈正相关[16]。因此,对于合并症患者,要更加关注其BMI及血脂水平的变化,要结合具体情况,为其提供最佳的治疗方案。
综上,住院OSAHS患者有较高的MS合并率,OSAHS合并MS受多种因素的影响,临床上应尽早关注OSAHS患者的病情状况,及时合理的干预可以延缓病情进展,降低再入院率和病死率,提高远期生活质量,减轻社会经济负担。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] 何权瀛, 王莞尔. 阻塞性睡眠呼吸暂停低通气综合征诊治指南(基层版)[J]. 中国呼吸与危重监护杂志, 2015, 14(4): 398–405.
[2] 中华医学会糖尿病学分会代谢综合征研究协作组. 中华医学会糖尿病学分会关于代谢综合征的建议[J]. 中华糖尿病杂志, 2004(3): 5–10.
[3] BARREIRO B, GARCIA L, LOAANO L, et al. Obstructive sleep apnea and metabolic syndrome in spanish population[J]. Open Respir Med J, 2013, 7: 71–76.
[4] AGRAWAL S, SHARMA S K, SREENIVAS V, et al. Prevalence of metabolic syndrome in a north Indian hospital-based population with obstructive sleep apnoea[J]. Indian J Med Res, 2011, 134(5): 639–644.
[5] AKAHOSHI T, UEMATSU A, AKASHIB T, et al. Obstructive sleep apnoea is associated with risk factors comprising the metabolic syndrome[J]. Respirology, 2010, 15(7): 1122–1126.
[6] 郭文彬, 劉玉璞, 许华俊. 阻塞性睡眠呼吸暂停与代谢综合征: 基于大样本临床数据库的相关性研究[J]. 中华耳鼻咽喉头颈外科杂志, 2021, 56(12): 1263–1269.
[7] 苏小凤, 刘霖, 仲琳, 等. 中国阻塞性睡眠呼吸暂停综合征患病率的Meta分析[J]. 中国循证医学杂志, 2021, 21(10): 1187–1194.
[8] 郑海芳, 庞慧, 赵灵燕. 蒙古族人群代谢综合征流行病学特征及影响因素研究[J]. 中国预防医学杂志, 2022, 23(2): 87–93.
[9] 潘悦达, 王东博, 韩德民. 我国成人阻塞性睡眠呼吸暂停低通气综合征患病率的Meta分析[J]. 医学信息, 2019, 32(7): 81–85.
[10] BOULOUKAKI L, MERMIGKIS C, MARKALIS M, et al. Cardiovascular effect and symptom profile of obstructive sleep apnea: does sex matter?[J]. Clin Sleep Med, 2019, 15(12): 1737–1745.
[11] BOZKURT N C, BEYSEL S, KARBEK B, et al. Visceral obesity mediates the association between metabolic syndrome and obstructive sleep apnea syndrome[J]. Metab Syndr Relat Disord, 2016, 14(4): 217–221.
[12] MEDINA-CONTRERAS J, VILLALOBOS-MOLINA R, ZARAIN-HERZBERG A, et al. Ovariectomized rodents as a menopausal metabolic syndrome model[J]. Mol Cell Biochem, 2020, 475(1-2): 261–276.
[13] DRAGER L F, POLOTSKY V Y, ODONNELL C P, et al. Translational approaches to understanding metabolic dysfunction and cardiovascular consequences of obstructive sleep apnea[J]. Am J Physiol Heart Circ Physiol, 2015, 309(7): H1101–H1111.
[14] MIRER A G, YOUNG T, PALTA M, et al. Sleep- disordered breathing and the menopausal transition among participants in the sleep in midlife women study[J]. Menopause, 2017, 24(2): 157–162.
[15] SUN Z, SHEN W. Effect of intermittent hypoxia on lipid metabolism in liver cells and the underlying mechanism[J]. Chin J Hepatol, 2014, 22(5): 369–373.
[16] GAINES J, VGONTZAS A N, FERNANDEZ-MENDOZA J, et al. Increased inflammation from childhood to adolescence predicts sleep apnea in boys: A preliminary study[J]. Brain Behav Immun, 2017, 64: 259–265.
(收稿日期:2023–03–06)
(修回日期:2023–11–15)
