不同浓度吗啡复合罗哌卡因对乳腺癌MDA-MB-231细胞增殖、迁移、侵袭和细胞周期的作用影响
2024-01-30张鑫宇陈刚谭宇桔刘艳茹李云云姜爱华
张鑫宇 陈刚 谭宇桔 刘艳茹 李云云 姜爱华
[摘要] 目的 觀察不同浓度的吗啡复合罗哌卡因对乳腺癌MDA-MB-231细胞增殖、转移侵袭和细胞周期的影响。方法 人乳腺癌细胞MDA-MB-231细胞接种于培养板24h,随机分为8组:对照组(C组)、罗哌卡因400μg/ml组(R组)、吗啡3μg/ml组(LM组)、吗啡30μg/ml组(MM组)、吗啡300μg/ml组(HM组)、罗哌卡因400μg/ml组+吗啡3μg/ml组(R+LM组)、罗哌卡因400μg/ml+吗啡30μg/ml组(R+MM组)和罗哌卡因400μg/ml+吗啡300μg/ml组(R+HM组)。处理乳腺癌细胞MDA-MB-231细胞24h后,检测其增殖能力、迁移能力、侵袭能力和细胞周期。结果 人乳腺癌细胞MDA-MB-231细胞的增殖抑制情况:单独应用吗啡时,LM组、MM组、HM组均对人乳腺癌细胞MDA-MB-231细胞的增殖具有抑制作用(P<0.05),并且抑制率随着吗啡浓度的升高而依次增加。单独应用罗哌卡因时对人乳腺癌细胞MDA-MB-231细胞的增殖具有抑制作用(P<0.05)。吗啡与罗哌卡因联合应用时,高浓度吗啡组与罗哌卡因具有协同作用。人乳腺癌细胞MDA-MB-231细胞的迁移情况:单独应用吗啡时,LM组、MM组、HM组均能够抑制细胞迁移率(P<0.05),迁移率随着吗啡浓度的升高而依次降低。单独应用罗哌卡因能够抑制细胞迁移率(P<0.05)。吗啡与罗哌卡因联合应用时,低浓度和中浓度吗啡组与罗哌卡因具有协同作用(P<0.05)。人乳腺癌细胞MDA-MB-231细胞的侵袭情况:单独应用吗啡时,MM组、HM组均能够抑制细胞侵袭能力(P<0.05),并且侵袭能力随着吗啡浓度的升高而依次降低,单独应用罗哌卡因时能够抑制细胞的侵袭能力(P<0.05)。吗啡与罗哌卡因联合应用时,中、高浓度组吗啡和罗哌卡因具有协同作用。人乳腺癌细胞MDA-MB-231细胞的细胞周期情况:单独应用高浓度吗啡,能够抑制细胞进入G2/M期(P<0.05)。单独应用罗哌卡因,能够抑制细胞进入G2/M期(P<0.05),低浓度吗啡与罗哌卡因联合应用对于将细胞抑制在G0/G1期和S期具有协同作用(P<0.05)。结论 吗啡复合罗哌卡因能够抑制乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭,具有联合作用并呈剂量依赖性。
[关键词] 吗啡;罗哌卡因;增殖;迁移;侵袭;细胞周期;乳腺癌;MDA-MB-231细胞
[中图分类号] R614 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.02.015
Effects of different concentrations of morphine in combination with ropivacaine on proliferation, migration, invasion and cell cycle in MDA-MB-231 breast cancer cells
ZHANG Xinyu1,2, CHEN Gang2, TAN Yuju2, LIU Yanru1, LI Yunyun1, JIANG Aiqhua2
1.the Second Clinical Medical College of Binzhou Medical University, Yantai 264000, Shandong, China; 2.Department of Anesthesiology the Affiliated Yantai Yuhuangding Hospital of Qingdao University Medical College, Yantai 264000, Shandong, China
[Abstract] Objective To investigate the effects of different concentrations of morphine in combination with ropivacaine on proliferation, migration, invasion and cell cycle in MDA-MB-231 breast cancer cells. Methods MDA-MB-231 breast cancer cells were inoculated on the culture plate for 24h and randomly divided into 8 groups: Control group (C), ropivacaine 400μg/ml group (R), morphine 3μg/ml group (LM), morphine 30μg/ml group (MM), morphine 300μg/ml group (HM), ropivacaine 400μg/ml group+ morphine 3μg/ml group (R+LM), ropivacaine 400μg/ml+ morphine 30μg/ml group (R+MM), and ropivacaine 400μg/ml+ morphine 300μg/ml group (R+HM). After treaments of MDA-MB-231 breast cancer cells for 24h, these proliferation, migration, invasion and cell cycle were evaluated. Results When using morphine alone, the proliferation inhibitive effect was positively correlated with the concentration of morphine. The proliferation was significantly inhibited by morphine of LM, MM, HM group (P<0.05). When using ropivacaine alone, the proliferation was significantly inhibited (P<0.05). When using morphine combined with ropivacaine, the high concentration morphine group has a synergistic effect with ropivacaine group on proliferation inhibition (P<0.05). When using morphine alone , the migration rate decreases sequentially with the increase of morphine concentration. The migration rate was significantly inhibited by morphine of LM, MM, HM group (P<0.05). When using ropivacaine alone, the migration rate was inhibited (P<0.05). When using morphine combined with ropivacaine, the low and medium concentration morphine group have a synergistic effect with ropivacaine group on migration rate (P<0.05). When using morphine alone, the number of cell invasion was decreased with the concentration of morphine increasing (P<0.05). The MM and HM groups inhibited cell invasion ability. When using ropivacaine alone, the invasiveness of cells was also inhibited (P<0.05). When using morphine combined with ropivacaine, the medium and high concentration morphine groups have a synergistic effect with ropivacaine group on inhibiting cell invasion ability (P<0.05). When using morphine alone, the cell cycle progression was inhibited into G2/M Phase (P<0.05). When using ropivacaine alone, the cell cycle progression was inhibited into G2/M phase (P<0.05). The combination of low concentration morphine and ropivacaine has synergistic effect on arresting at G0/G1 and S phase (P<0.05). Conclusion Morphine combined with ropivacaine inhibits the Proliferation, migration and invasion of MDA-MB-231 breast cancer cells in a dose-dependent manner.
[Key words] Morphine; Ropivacaine; Proliferation; Migration; Invasion; Cell cycle; Breast cancer; MDA-MB-231 cells
乳腺癌是当今女性发病率和死亡率第一的恶性肿瘤,大约占女性新发癌症总数的30%以上[1]。乳腺癌的复发和转移是乳腺癌患者死亡的主要原因。流行病学调查显示乳腺癌患者的麻醉方式是影响患者的术后肿瘤复发率的因素之一[2]。研究表明,围手术期和术后使用局部麻醉药,能够减少术中全身阿片类药物的使用并降低阿片类药物所致的并发症[3]。罗哌卡因是一种新型长效酰胺类局部麻醉药,吗啡是一种广泛应用的阿片类药物,临床上已经将吗啡复合罗哌卡因广泛应用于乳腺手术的神经阻滞麻醉[4]。乳腺肿瘤包块切除术往往需要通过手术切除获得的组织进行快速病理诊断,因此吗啡复合罗哌卡因用于乳腺恶性肿瘤切除术时的安全性引起了麻醉学者和乳腺外科学者的广泛关注。目前罗哌卡因能够抑制乳腺癌细胞的增殖,吗啡对乳腺癌组织的影响存在争议[5-10]。本研究旨在通过离体细胞实验观察不同浓度的吗啡复合罗哌卡因对MDA- MB-231细胞增殖、迁移、侵袭和细胞周期是否存在影响。
1 材料与方法
1.1 主要试剂与材料
人乳腺癌MDA-MB-231细胞(购自中国科学院上海生物化学与细胞生物学研究所),盐酸吗啡注射液(购自中国东北制药沈阳第一分公司),盐酸罗哌卡因粉剂(购自美国阿拉丁公司),胎牛血清(购自德国PAN公司),DMEM培养基,CCK8,DMSO,15ml,50ml离心管,EP管(均购自中国山东思科捷生物技术有限公司),Transwell,Matrigel胶(均购自美国康宁公司),细胞周期试剂盒(购自中国碧云天公司)。
1.2 方法
1.2.1 细胞培养 细胞复苏成功后接种于培养皿,静置37℃、5%CO2、95%湿度的培养箱内,用含10%胎牛血清的DMEM培养基进行培养,隔天换液。观察细胞贴壁70%~80%时,用胰蛋白酶消化传代。
1.2.2 实验分组 共分为8组,分别用含有不同药物的DMEM培养基培养。具体分组及每组培养基如下:不加药物对照组(C组)、罗哌卡因400μg/ml组(R组)、吗啡3μg/ml组(LM组)、吗啡30μg/ml组(MM组)、吗啡300μg/ml组(HM组)、罗哌卡因400μg/ml组+吗啡3μg/ml组(R+LM组)、罗哌卡因400μg/ml+吗啡30μg/ml组(R+MM组)和罗哌卡因400μg/ml组+吗啡300μg/ml组(R+HM组)。
1.2.3 CCK8法测定MDA-MB-231细胞的增殖活性 取对数生长期的细胞,消化,调整密度至5×104个/ml接种于1块96孔培养板,每组种6个复孔,每孔100µl。常规培养24h后,更换为含不同药物的培养基200µl,继续培养24h后,吸弃原培养液,每孔加入180µlDMEM培养基、20µlCCK8溶液,混匀,培养1h。平板床摇匀细胞,用酶标仪测定450nm时各孔光吸收值(A值)A值大小与细胞活力成正比。
1.2.4 划痕实验检测细胞迁移率变化 将MDA-MB- 231细胞接种于6孔板,调整浓度为1×106个/ml。每组设3个复孔。放入37℃、5%CO2、95%湿度的培养箱内培养24h至细胞贴壁生长90%。用马克笔在6孔板背后画横线,每孔穿过5条线。用20µl枪头比着直尺垂直于背后直线划线。按照不同分组处理细胞,分别在0h和24h取样拍照。每个样品取5个视野测量距离。细胞迁移率=(0h划痕距离−24h划痕距离)/0h划痕距离×95%。
1.2.5 Transwell法测侵袭细胞数 MDA-MB-231细胞撤去血清按不同分组处理培养24h,使用Matrigel胶在Transwell上室铺胶。胰酶消化MDA-MB-231细胞、计数细胞,使用不完全培养基将细胞调整至细胞密度为1×105个/ml,取200µl细胞悬液于Transwell上室,下室加入500µl含10%胎牛血清的DMEM完全培养基。将24孔板置于37℃、5%CO2、95%湿度的培养箱培养24h,室温下4%多聚甲醛固定20min。去除固定液后加入0.1%結晶紫染液染色10min。用棉签擦去Matrigel胶和上室内的细胞,拍照计数穿过滤膜的细胞数:随机选取5个视野,取平均值并统计细胞数。
1.2.6 细胞周期分析 将MDA-MB-231细胞消化后按照分组接种于6孔板放入37℃、5%CO2、95%湿度的培养箱内培养24h至细胞贴壁生长90%。按照不同分组对6孔板内细胞进行处理,继续培养24h。消化细胞并收集,用PBS溶液洗涤细胞2次,弃去上清液。加入70%乙醇,‒20℃固定过夜。1000r/min离心5min收集细胞,用1ml PBS重悬细胞。每管细胞样品中加入0.5ml碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37℃避光温浴30min。用流式细胞仪在激发波长488nm波长处检测红色荧光同时检测光散射情况,结果用细胞周期拟合软件ModFit分析。
1.3 统计学方法
采用SPSS 26.0统计学软件对数据进行处理分析,符合正态分布的计量资料用均数±标准差(![]() )表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,用析因设计方差分析是否有联合作用,以P<0.05为差异有统计学意义。
)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,用析因设计方差分析是否有联合作用,以P<0.05为差异有统计学意义。
2 结果
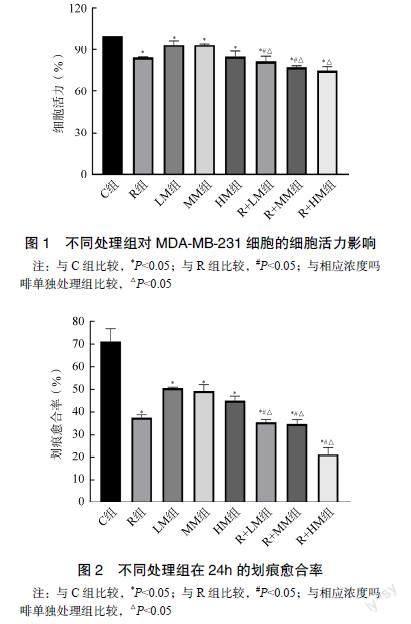
2.1 CCK8法测不同分组对MDA-MB-231细胞增殖的影响
不同分组培养24h后,各处理组均对MDA-MB- 231细胞增殖具有抑制作用(P<0.05)。低、中浓度吗啡联合罗哌卡因对抑制细胞增殖无协同作用(P<0.05),高浓度吗啡与罗哌卡因联合应用具有协同作用(P<0.05),但是联合用药组增殖抑制作用仍强于各药单独应用(P<0.05)。见图1。
2.2 划痕实验法测不同分组对MDA-MB-231细胞迁移的影响
不同分组培养24h后,C组划痕两侧细胞伤口几乎愈合,LM组、MM组、HM组划痕两侧细胞伤口愈合较慢,R组、R+LM组、R+MM组、R+HM组划痕两侧细胞伤口愈合最慢,见图2。经Image J处理后计算划痕愈合率,各处理组的划痕愈合速度均受到抑制(P<0.05),低、中浓度吗啡联合罗哌卡因应用具有协同作用(P<0.05)。高浓度吗啡联合罗哌卡因对抑制划痕愈合无联合作用,但是抑制作用明显强于各药单独应用(P<0.05),见图2。
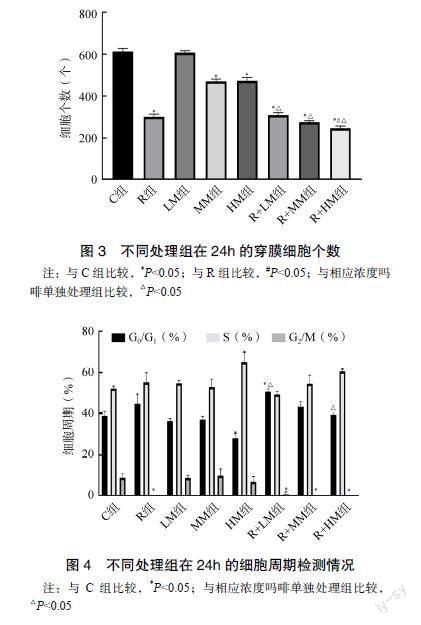
2.3 Transwell法测不同分组对MDA-MB-231细胞侵袭的影响
不同分组培养24h后,C组、LM组侵袭细胞数最多,MM组、HM组侵袭细胞数较多,R组、R+LM组、R+MM组、R+HM组侵袭细胞数最少。罗哌卡因和中、高浓度吗啡单独应用均抑制细胞侵袭(P<0.05),中、高浓度吗啡联合罗哌卡因对细胞侵袭的抑制有协同作用(P<0.05)。见图3。
2.4 细胞周期分析法测不同分组对MDA-MB-231细胞周期的影响
不同分组培养24h后,R组、R+LM组、R+MM组、R+HM组细胞G2/M期细胞明显少于C组、LM组、MM组和HM组(P<0.05)。R+LM组将细胞周期抑制在G0/G1期和S期有协同作用(P<0.05),见图4。
3 讨论
近年来乳腺癌已成为当今女性发病率和死亡率第一的恶性肿瘤,大约占女性新发癌症总数的30%以上[1]。乳腺癌的复发和转移是乳腺癌患者死亡的主要原因。已经严重影响妇女的生存周期和生命质量。
麻醉药物联合应用对肿瘤细胞生长和转移的影响是麻醉领域的研究热点。选择那些既能提供满意的围术期镇痛又能抑制肿瘤细胞生长和转移的药物是摆在麻醉医生面前的一项重要课题。当前罗哌卡因复合吗啡对乳腺癌手术进行前锯肌神经阻滞可以在乳腺癌切除术中达到良好镇痛效果[4]。吗啡复合罗哌卡因对人乳腺癌细胞MDA-MB-231细胞生长和转移的影响国内外尚未见报道。该复合麻醉剂对乳腺癌预后的影响尚不明确。罗哌卡因可以抑制乳腺癌细胞的增殖和转移,已经得到广泛报道[11-13]。尽管已经进行了大量研究,吗啡对乳腺癌细胞生长的影响目前仍存在争议。一些研究认为吗啡可以促进乳腺癌细胞的生长,另一些研究认为吗啡可以通过多种机制抑制或促进肿瘤的生长。Tegeder等[13]研究认为高浓度吗啡可以显著抑制MCF-7和MDA-MB-231细胞的生长。Bimonte等[14]研究则认为吗啡促进了乳腺癌细胞的生长。出现不同的结果的原因可能与实验中不同的吗啡剂量相关。因此本研究旨在探讨罗哌卡因复合不同浓度梯度的吗啡能够对乳腺癌细胞生长和转移产生何种影响。
既往研究表明,吗啡在前锯肌神经阻滞中发挥镇痛的最佳剂量为4mg[4]。基于贴近临床为原则,经过预实验筛选,本实验选取的吗啡实验浓度为3~300μg/ml。罗哌卡因则依据相关文献的常用有效剂量,经过预实验筛选,选取400μg/ml罗哌卡因进实验[8]。
与对照组比较,加入3μg/ml和30μg/ml、300μg/ml吗啡处理24h后对乳腺癌细胞的增殖抑制明显。并且随着作用浓度的增加,吗啡表现出的对细胞增殖抑制的作用变强。此结果与Gurwell等[15]的观点基本一致。CCK8结果经析因设计方差分析结果显示,3μg/ml吗啡、30μg/ml吗啡与400μg/ml罗哌卡因联合应用后无协同作用,300μg/ml吗啡联合400μg/ml罗哌卡因对增殖抑制具有协同作用。
根据不同分组观察测量迁移距离,对细胞运动情况进行观察。结果发现24h后,对照组与3μg/ml和30μg/ml吗啡处理组划痕两侧细胞几乎愈合,而400μg/ml罗哌卡因组与罗哌卡因400μg/ml+吗啡3μg/ml组、罗哌卡因400μg/ml+吗啡30μg/ml组和罗哌卡因400μg/ml+吗啡300μg/ml组的MDA-MB-231细胞经过划痕后两侧细胞仍有距离。400μg/ml罗哌卡因组、300μg/ml吗啡组和400μg/ml罗哌卡因+3μg/ml吗啡组划痕两侧细胞“伤口”愈合较慢,400μg/ml罗哌卡因+30μg/ml吗啡组和400μg/ml罗哌卡因+300μg/ml吗啡组划痕两侧细胞“伤口”愈合最慢。经过析因设计方差分析结果显示3μg/ml吗啡、30μg/ml吗啡与400μg/ml罗哌卡因联合应用后有协同作用,300μg/ml吗啡联合400μg/ml罗哌卡因对抑制MDA-MB-231细胞迁移没有协同作用,但是抑制作用明显强于各药单独应用。
根据侵袭细胞数,对细胞侵袭能力进行观察。24h后,与对照组相比,3μg/ml和30μg/ml吗啡处理组侵袭细胞数差异无统计学意义;400μg/ml罗哌卡因组与罗哌卡因400μg/ml+吗啡3μg/ml組、罗哌卡因400μg/ml+吗啡30μg/ml组和罗哌卡因400μg/ml+吗啡300μg/ml组侵袭细胞数明显减少;400μg/ml罗哌卡因+30μg/ml吗啡组和400μg/ml罗哌卡因+300μg/ml吗啡组侵袭细胞数最少。经过析因设计方差分析结果显示3μg/ml吗啡与400μg/ml罗哌卡因联合应用后无协同作用,30μg/ml、300μg/ml吗啡联合400μg/ml罗哌卡因对抑制MDA-MB-231细胞侵袭具有协同作用。
單独应用吗啡处理,浓度为3μg/ml和30μg/ml时细胞周期没有发生显著变化,浓度为300μg/ml时G2期细胞明显少于对照组,G0/G1期和S期细胞明显多于对照组。单独应用400μg/ml罗哌卡因时G2期细胞明显少于对照组,G0/G1期和S期细胞明显多于对照组。各浓度吗啡与400μg/ml罗哌卡因联合应用时G2期细胞明显少于对照组,G0/G1期和S期细胞明显多于对照组。经过析因设计方差分析证实,30μg/ml吗啡与400μg/ml罗哌卡因能够发挥协同作用,将MDA-MB-231细胞抑制在G1期和S期。
本实验结果显示,吗啡复合罗哌卡因应用于MDA-MB-231细胞后,抑制了该细胞的增殖、迁移和侵袭,并且将细胞周期抑制在了G0/G1期和S期。为临床更好地使用吗啡复合罗哌卡因作为麻醉剂提供了实验依据。综上所述,吗啡复合罗哌卡因具有联合作用能明显抑制乳腺癌MDA-MB-231细胞的增殖、迁移和侵袭,其机制可能与抑制细胞周期有关,其上下游机制有待后续实验进行研究。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] WANG F, YU Z G. Current status of breast cancer prevention in China[J]. Chronic Dis Transl Med, 2015, 1(1): 2–8.
[2] LENNON FE, MOSS J, SINGLETON P A. The μ-opioid receptor in cancer progression: is there a direct effect?[J]. Anesthesiology, 2012, 116(4): 940–945.
[3] ZYLLA D, STEEL G, GUPTA P. A systematic review of the impact of pain on overall survival in patients with cancer[J]. Support Care Cancer, 2017, 25(5): 1687–1698.
[4] 林建宏, 刘晓飞, 王倩, 等. 超声引导下不同浓度吗啡复合罗哌卡因前锯肌平面阻滞对乳腺癌患者术后镇痛效果的影响[J]. 山东医药, 2020, (23): 70–73.
[5] HAGHJOOY-JAVANMARD S, GHASEMI A, LAHER I, et al. Influence of morphine on TLR4/NF-kB signaling pathway of MCF-7 cells[J]. Bratisl Lek Listy, 2018, 119(4): 229–233.
[6] GACH K, WYREBSKA A, FICHNA J, et al. The role of morphine in regulation of cancer cell growth[J]. Naunyn Schmiedebergs Arch Pharmacol, 2011, 384(3): 221–230.
[7] CHEN Y, QIN Y, LI L, et al. Morphine can inhibit the growth of breast cancer MCF-7 cells by arresting the cell cycle and inducing apoptosis[J]. Biol Pharm Bull, 2017, 40(10): 1686–1692.
[8] 夏明, 王少華, 童建华, 等. 不同浓度罗哌卡因对乳腺癌MCF-7细胞增殖和细胞周期的作用研究[J]. 临床麻醉学杂志, 2016, 32(7): 680–683.
[9] LI R, XIAO C, LIU H, et al. Effects of local anesthetics on breast cancer cell viability and migration[J]. BMC Cancer, 2018, 18(1): 666.
[10] MATOS A C, MARQUES I A, PIRES A S, et al. The potential effect of lidocaine, ropivacaine, levobupivacaine and morphine on breast cancer pre-clinical models: a systematic review[J]. Int J Mol Sci, 2022, 23(3): 1894.
[11] ZHAO L, HAN S, HOU J, et al. The local anesthetic ropivacaine suppresses progression of breast cancer by regulating miR-27b-3P/YAP axis[J]. Aging(Albany NY), 2021, 13(12): 16341–16352.
[12] CASTELLI V, PIROLI A, MARINANGELI F, et al. Local anesthetics counteract cell proliferation and migration of human triple-negative breast cancer and melanoma cells[J]. J Cell Physiol, 2020, 235(4): 3474–3484.
[13] TEGEDER I, Grösch S, SCHMIDTKO A, et al. G protein-independent G1 cell cycle block and apoptosis with morphine in adenocarcinoma cells: involvement of P53 phosphorylation[J]. Cancer Res, 2003, 63(8): 1846–1852.
[14] BIMONTE S, BARBIERI A, REA D, et al. Morphine promotes tumor angiogenesis and increases breast cancer progression[J]. Biomed Res Int, 2015, 3: 161508.
[15] GURWELL J A, HAUSER K F. MorPhine does not affect astrocyte survival in developing primary mixed-glial cultures[J]. Brain Res Dev Brain Res, 1993, 76(2): 293–298.
(收稿日期:2023–06–11)
(修回日期:2023–11–24)
