生物合成FeS及其稳定性柱迁移研究
2024-01-29严宁珍
任 霞,严宁珍,刘 璟
(西南大学 资源环境学院, 重庆 400716)
金属纳米硫化亚铁(FeS)是一种四方单硫铁化物,能够释放两种电子供体Fe(Ⅱ)和S(-Ⅱ)。这两种电子供体作为很好的还原剂(Yuetal., 2020),可诱导氧化态金属离子还原至低价态,从而通过吸附或形成硫化物相的方式固定环境中的重金属,已广泛用于被砷、镉、铬等污染场地的修复(Xiongetal., 2009; Tanetal., 2020)。FeS可将吸附的砷阳离子转化为硫化物形式,如毒砂(FeAsO4)和雌黄(As2S3)等难溶态,因此降低了砷的迁移性和毒性,达到修复去除目的。FeS提供的S(-Ⅱ)可与强酸废水中的As(Ⅲ)之间快速形成As2S3沉淀,获得良好的As(Ⅲ)去除效果(Liuetal., 2016)。在天然砂填充的多孔柱体系中合成FeS,其对砷污染地下水的As(Ⅲ)固定效率高达83% (Tiwarietal., 2020)。
纳米FeS的合成一般通过混合硫化钠(过量)和氯化亚铁来制备(Butleretal., 1998),也有研究通过微生物方式合成生物型纳米FeS,且这类微生物广泛存在于厌氧环境中(Zhouetal., 2018)。在课题组前期对生物FeS的合成及其对砷的修复研究中,刘璟等在2016年首次利用嗜酸性铁还原菌和硫酸盐还原菌成功合成了生物FeS并包覆于灰岩,发现FeS呈纳米级的颗粒状晶体,比表面积大,其对溶液中As(Ⅴ)的去除效率比单纯使用灰岩提高了28倍(Wangetal., 2016; Liuetal., 2017)。Zhou等(2017)的研究发现生物合成的矿物主要由四方硫铁矿(FeS0.9)组成,拉曼振动和红外光谱技术进一步证实矿物是FeS且为生物来源,并发现纳米颗粒在10 h内完全氧化。Zhou等( 2021)等继续探讨了在不同pH值和氧化剂条件下,对生物FeS去除As(Ⅴ)产物稳定性的影响。然而目前对生物纳米FeS的稳定性及其在土壤中迁移能力的研究还较少。CMC是纤维素的水溶性衍生物,具有高效的螯合和分散作用,且成本低,环境相容性高,是最常用的稳定剂之一(Devi and Dalai, 2019)。有研究发现,经CMC稳定的零价铁(ZVI)纳米颗粒比单独ZVI颗粒具有粒径更小,比表面积、分散性和反应活性更高的特点(Devi and Dalai, 2019),具有将其直接输送到受污染区域,从而对受污染的土壤和地下水进行原位修复的潜力(Zhaoetal., 2016)。在用CMC稳定硫酸盐还原菌生成的生物型FeS复合物时,CMC分子在吸附FeS颗粒表面的同时,产生一层负电荷,这能够有效降低颗粒的聚集沉降(Heetal., 2021)。Abia Ⅱ等(2011)进行的一项研究中,利用石英砂模拟地下多孔介质,将Fe2+和氧化剂(如溶解氧)泵入其填充的柱装置中,研究砷的迁移行为和去除效果,以开发一种原位的地下水污染修复处理(Abia Ⅱ, 2011)。
因此,本研究采用铁还原菌和硫酸盐还原菌合成生物纳米FeS的制备方法,探讨其生成量的控制,并使用羧甲基纤维素钠(CMC)作为颗粒稳定剂,探究在CMC作用前后FeS的沉降速率、稳定性差异和效果,并建立石英砂柱,进一步研究CMC-FeS在多孔介质中的迁移行为,以期对土壤污染修复提供理论参考。
1 材料和方法
1.1 嗜酸性铁还原菌Acidiphilum cryptum JF-5(JF-5)的培养
称取0.5 g胰酶大豆肉汤(TSB)溶于917 mL超纯水中,高温灭菌30 min得到溶液①; 称取18.016 g葡萄糖溶于水并定容至100 mL,经0.22 μm的微孔滤膜过滤灭菌得到溶液②; 称取19.995 g Fe2(SO4)3溶于水并定容至100 mL,经0.22 μm的微孔滤膜过滤灭菌得到溶液③: 称取100 mg维生素B12、80 mg p-氨基酸、20 mg D-生物素、200 mg烟酸、100 mg Ca-D-泛酸酯、200 mg盐酸硫胺素和300 mg盐酸哆吡胺溶解于1 L超纯水中,完全溶解后经0.22 μm的微孔滤膜过滤灭菌,并存放于4℃的阴暗处得到溶液④;称取1.5 g FeCl2·4 H2O 溶解于10 mL 25% HCl溶液中,并继续向该溶液中添加70 mg ZnCl2、100 mg MnCl2·4 H2O、190 mg CoCl2·6 H2O、2 mg CuCl2·2 H2O、24 g NiCl2·6 H2O、36 mg Na2MoO4·2 H2O和6 mg H3BO3,并定容至1 L后高压灭菌得到溶液⑤; 添加 0.5 g NaOH、0.003 g Na2SeO3·5 H2O和 0.004 g Na2WO4·2 H2O至1 L超纯水中,完全溶解后高压灭菌得到溶液⑥。上述6种溶液配制完成后,分别取10 mL溶液②、70 mL溶液③、溶液④、⑤、⑥各1 mL加入溶液①中,混合均匀完成培养基配制。接种后的JF-5菌在厌氧条件下于30℃的恒温培养箱中培养,培养液颜色变无色即微生物还原完成。
1.2 硫酸盐还原菌Desulfovibrio vlugaris miyazaki(SRB)的培养
培养基组成如下(1 L): 2.0 g DL-乳酸钠、0.5 g K2HPO4、1.0 g Na2SO4、2.0 g MgSO4·7 H2O、2.0 g CaCl2·2 H2O和1.0 g酵母提取物。接种的SRB菌在厌氧条件下于30℃恒温培养箱培养5~7 d,具有浓烈臭鸡蛋味气体即培养完成。
所有使用的化学品均为分析纯及以上;实验用水均采用超纯水(18.25 MΩ cm)。
1.3 生物合成FeS
在前期研究中,使用1 L SRB菌液和25 mL JF-5菌液混合并静置3 d所获得的黑色物质即为生物纳米FeS颗粒(Zhouetal., 2019)。本次研究沿用上述合成方法,但考虑需探讨混合溶液中不同n(Fe)/n(S)值对FeS矿物合成量及沉降行为的研究,故修改如下:在50 mL离心管中分别加入不同体积、对数生长最佳的SRB菌液和JF-5菌液(均为7 d),其具体体积及对应n(Fe)/n(S)值见表1。体系中n(Fe)/n(S)值按照SRB和JF-5菌液混合后培养基中Fe和S的量设定。密封并锡箔避光后在30℃恒温条件下静置48 h以熟化。FeS生成量按美国哈希标准悬浮颗粒物方法进行,仪器采用Hach DR2500(美国哈希公司)。上述实验均开展3组平行实验。需要说明的是上述合成的FeS并非纯FeS矿物,可能包含针铁矿和有机成分(Zhouetal., 2017),但我们仍将其命名为生物纳米FeS。
称取适量冷冻干燥后的矿物样品,用 X射线衍射仪(XRD)分析其矿物相。X射线衍射仪工作电压40 kV,扫描角度为5°~80°,管流40 mA,采用国际衍射数据中心XRD分析软件Jade进行矿物相的分析。

表 1 实验所用 JF-5 与 SRB 菌液体积及混合溶液的n(Fe)/n(S)值
1.4 生物FeS纳米颗粒的自然沉降
通过监测FeS吸光度的变化,探讨其沉降速率,建立FeS悬浮液的吸光度随时间的变化曲线。对7组细菌混合溶液在熟化48 h后摇匀,在波长为620 nm下、4 h内每10 min记录一次吸光度。同时,为了探究CMC对FeS是否有稳定效果,同样的操作在熟化48 h后摇匀,取5 mL FeS悬浮液稀释到20 mL 0.1% CMC溶液中,并以25 mL 0.1% CMC为空白,立即在波长为620 nm下、4 h内每10 min读取一次吸光度。同一实验均开展3次平行实验,统计过程取其平均值和上下误差。
1.5 CMC-FeS柱迁移实验
选用矿物石英砂填入实验所用柱装置,进行纳米FeS的穿透实验。石英砂在天然土壤和沉积物中普遍存在,是影响许多无机和有机化合物迁移的重要成分(Sposito, 1984),在本实验中作为惰性支撑材料,不会与纳米颗粒发生复杂反应,能有效监测和模拟纳米颗粒在多孔介质中的运移能力。柱实验装置如图1。柱长40 cm,内径3.4 cm,柱中填充烘洗后的石英砂(2 000~4 000 μm)共340 g,柱底部由蠕动泵(Leadfluid BT100L)泵入向上流溶液,根据填充石英砂所消耗的超纯水量总体积为110±3 mL(n=3,n代表次数),孔隙率为0.41。柱顶部用带孔的盖子密封,以橡胶管连接流出液收集器。柱外层两个端口连接恒温控制器(GE Multi Tp Ⅲ),设定温度并保持在30℃。在柱的上下端口设置两个水压探头,并与水压传感器(CR1000, Campbell Scientific公司, 美国)和计算机连接,每10 min记录一次水压变化。水压探头采用水压计(Control公司, Traceable)和输出电压信号进行修正,其输出水压(psi)与实际压力具有显著的线性关系(R2=0.999)(图2)。
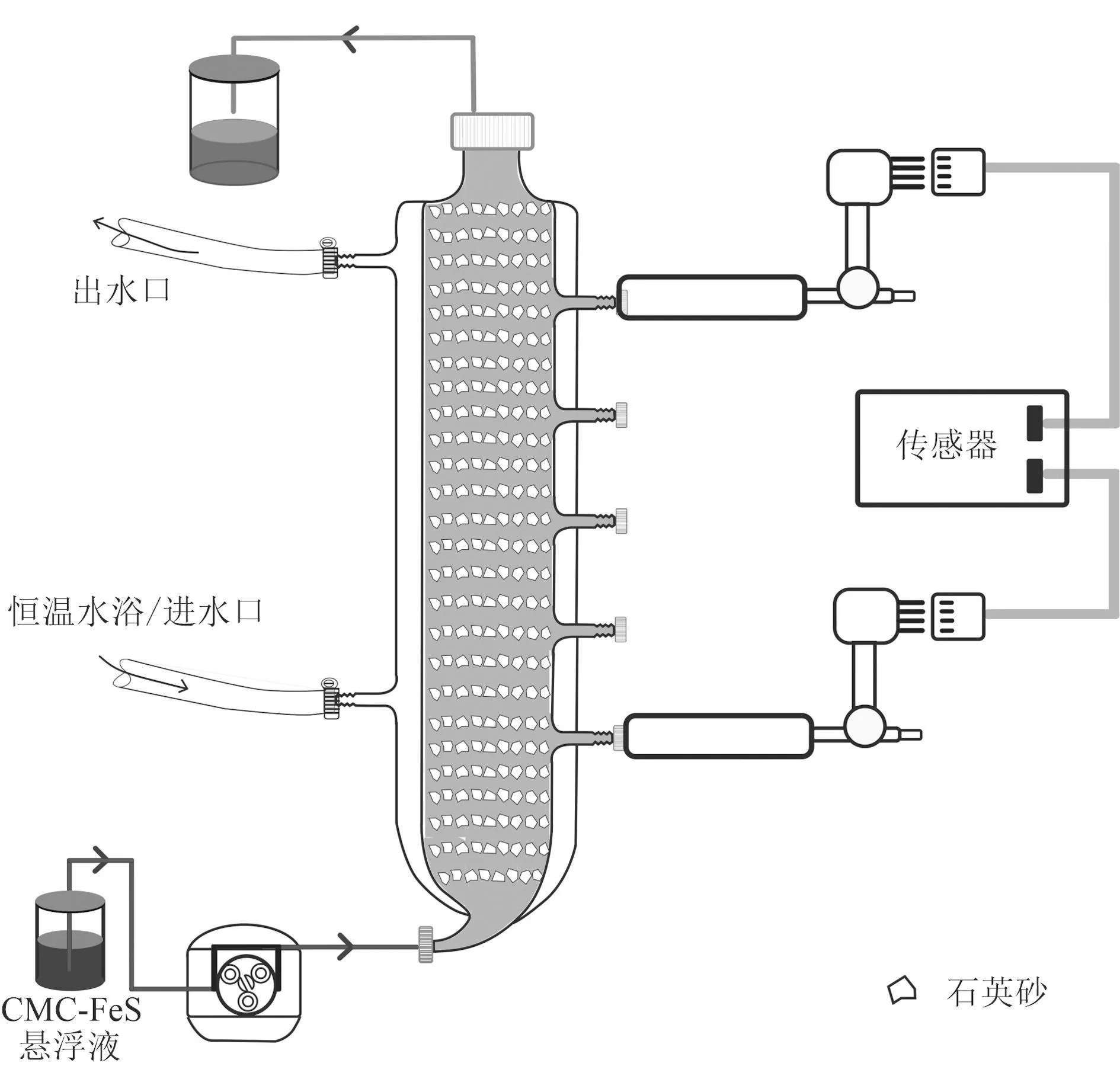
图 1 柱实验装置示意图Fig. 1 Schematic diagram of the column experimental setup

图 2 水压探头与实时传感器采集压力数据的拟合曲线Fig. 2 The fitting curve of piezometer data and collected pressure data from on-line sensors
基于上述合成控制实验,我们选取FeS产量最大组[n(Fe)/n(S)=0.2]进行柱实验迁移实验,实验过程为:先在通入高纯度N2(>99%) 15 min后的超纯水中配备0.1% CMC溶液,并继续通入N25 min;然后,对生物合成n(Fe)/n(S)=0.2下的 FeS纳米颗粒以10 000 rpm、5 min离心并倒掉上清液,将FeS沉淀与0.1% CMC溶液以m(FeS)/m(CMC)=2进行混合,即得到CMC-FeS悬浮液。设置蠕动泵流速分别为90、180、360 mL/h,通入FeS-CMC悬浮液(总铁=50 mg/L, pH=7.0)13.5 h;每30 min收集一次流出液样品,分析样品中SS(悬浮颗粒物浓度, mg/L)和总铁含量。
1.6 总铁测定及压力数据收集
流出液以6 M HCl酸化(1 mL样品: 2mL HCl,能够完全溶解FeS颗粒),采用美国哈希标准方法#265测定总铁含量,以空白作为背景。对于柱迁移实验,我们以FeS-纯水悬浮液作为CMC-FeS的对比控制组。样品测定3次,取平均值。实验过程中收集的柱压力数据从Campbell Scientific LoggerNet软件导出,采用Excel以时间和导水率进行作图。
2 结果和讨论
2.1 生物纳米FeS的XRD表征分析
实验室生物合成的样品为黑色沉淀,XRD分析表明,其主要矿物相与PDF00-024-0073卡对应,化学组成为四方硫铁矿(FeS0.9)(图3),另外也存在一定针铁矿衍射峰,可能是由于样品制样过程中快速氧化所致。

图 3 生物纳米FeS样品的XRD图Fig. 3 XRD spetrum of biological-nano FeS sample
2.2 不同n(Fe)/n(S)值条件下合成FeS的量及沉降差异
如图4所示,混合细菌溶液中S的量必须要高于Fe的量才能合成FeS,即S必须要过量;当n(Fe)/n(S)值为0.1和0.2时,悬浮颗粒物的量较大,说明FeS生成量最多,溶液中悬浮颗粒物浓度(SS)分别达到2 166和2 400 mg/L,其次为0.3。随着Fe的量继续增多,悬浮颗粒物的生成量逐渐减少。
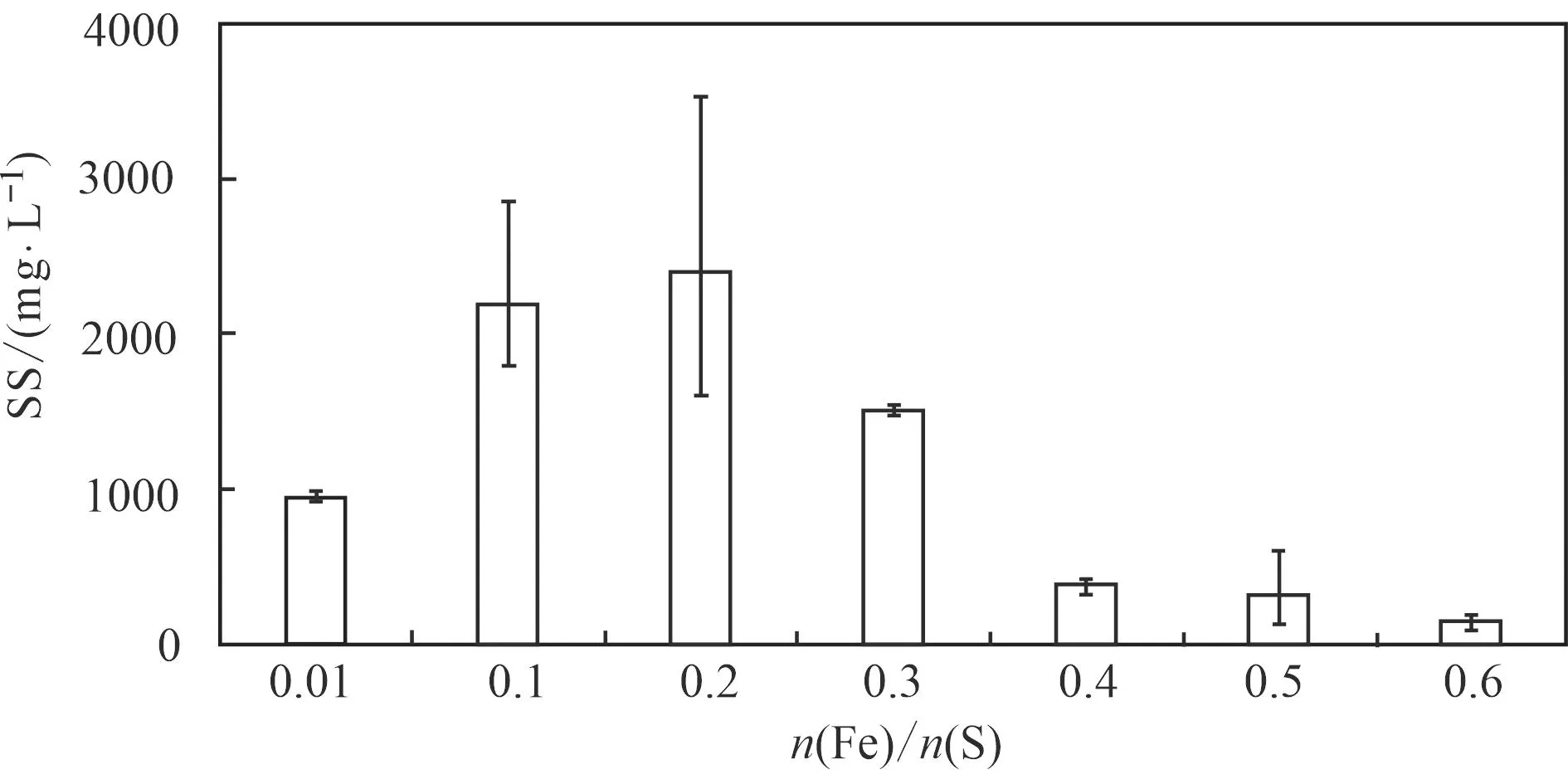
图 4 不同n(Fe)/n(S)值条件下合成FeS量的差异Fig. 4 Differences in the amount of FeS synthesized from different n(Fe)/n(S)
同时,对各个n(Fe)/n(S)值下悬浮液中 FeS 颗粒的沉降进行验证,结果如图5所示,悬浮液吸光度随着时间增加都在逐渐减小,在4 h内基本达到稳定状态,即基本沉淀下来;不同n(Fe)/n(S)值下吸光度值及下降幅度不同,与图4对应,当n(Fe)/n(S)值为0.1~0.3时,颗粒物生成量最多,吸光度值较大,下降幅度也较大;其他则较小,其中n(Fe)/n(S)值为0.01和0.4时,吸光度值的变化较为稳定;当n(Fe)/n(S)值为0.5和0.6时,管中几乎观察不到黑色颗粒物的存在,而只有细菌菌体与溶液中的无机沉淀物,其原因可能是其沉降规律与其他比例有所不同,表现为吸光度逐渐增加。综上,当n(Fe)/n(S)值为0.1、0.2和0.3时,生物纳米FeS生成量最大,沉降也最快。图6为n(Fe)/n(S) 值为0.1~0.4下,FeS在纯水和在CMC溶液中沉降变化的斜率对比图,可以看出,FeS在CMC溶液中的斜率变化总体都低于纯水条件,CMC的稳定效果都比较明显,斜率值也较为接近,整体沉降变缓,达到了较高 FeS产量的同时,增加了其稳定性;在n(Fe)/n(S) 值为0.2时,FeS的自然沉降速率最大从0.07降到了0.02。
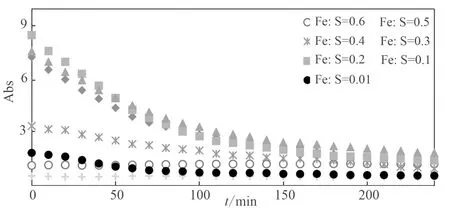
图 5 波长620 nm下不同n(Fe)/n(S)值的细菌混合溶液吸光度(Abs)随时间的变化Fig. 5 Absorbance (Abs) of mixed solution of bacteria with different n(Fe)/n(S) at 620 nm wavelength changes with time
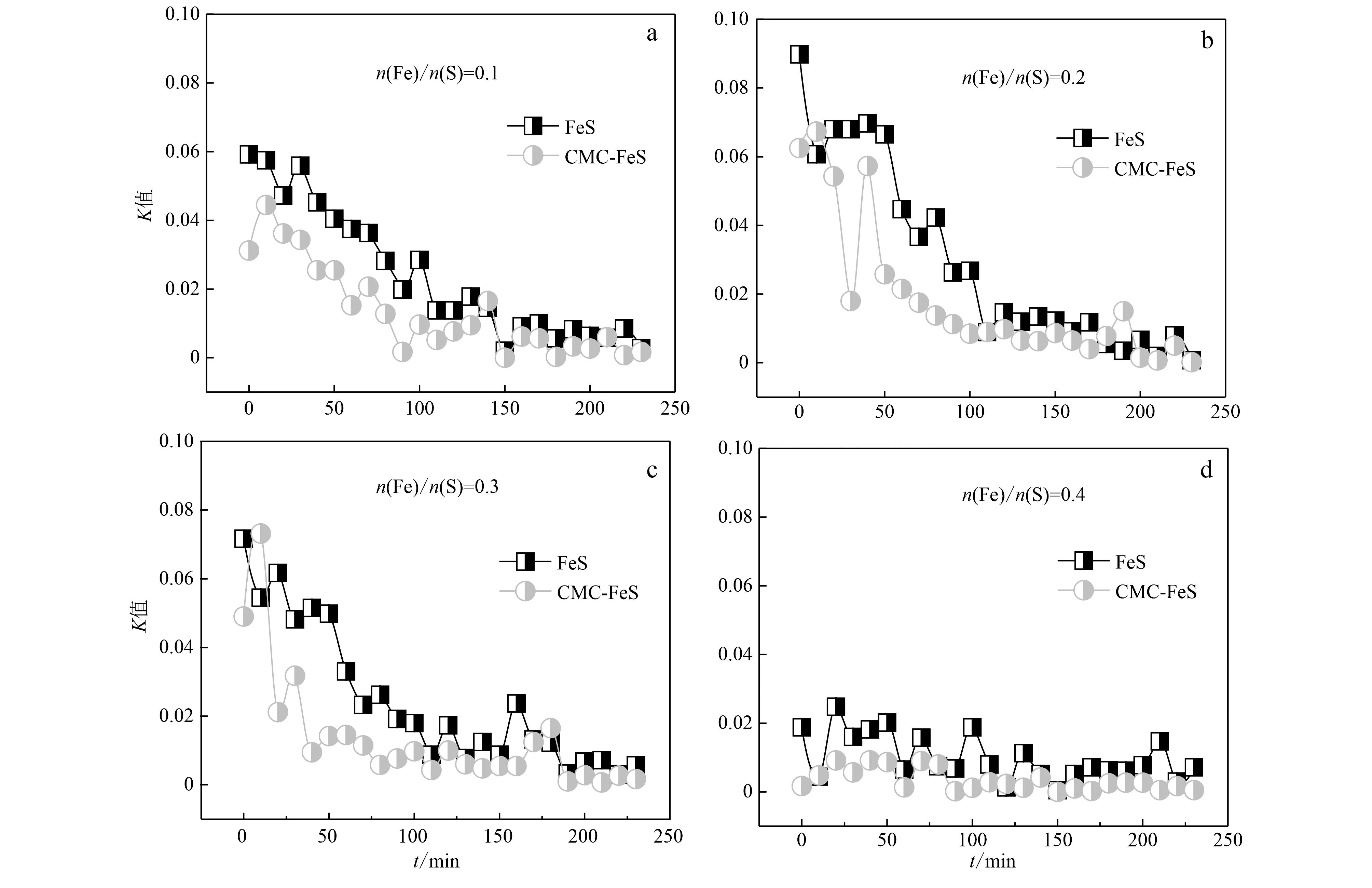
图 6 n(Fe)/n(S)值为0.1~0.4下生物纳米FeS在纯水与CMC溶液中吸光度值变化的斜率(K)对比Fig. 6 Comparison of the slopes (K) of the absorbance values of biological-nano FeS in pure water and CMC solutions when n(Fe)/n(S) were 0.1~0.4
以上这些说明CMC有效地强化了体系的稳定性。
2.3 FeS在石英砂柱中的迁移
为了探究生物纳米FeS的迁移性,在系列石英砂柱中开展了FeS穿透实验,其迁移行为可以用对流扩散模型(Heetal., 2019)表达,如方程(1):
Ce/C0=0.5erfc[Pe1/2(1-Vxt/LRf)/2(Vxt/LRf)1/2]
(1)
式中,C0为x=0时入口处的FeS悬浮液浓度(mg/L);L为柱填充长度(cm);Ce为距离L出口处的悬浮液浓度(mg/L);erfc为余差函数;Pe为佩克莱数,用于衡量对流和扩散作用;Vx为达西流速(流量除以横截面积)(cm/s);Rf为滞留因子;t为时间(s)。方程刻画了出口和入口处FeS浓度的比例,相应的滞留因子可以通过这个公式对实验数据拟合获得。实验在不同流速下进行,系统的导水率是反映系统渗透性变化的关键因素,对水流通过柱体系过程中的导水率进行记录研究。达西定律通过饱和导水率来描述柱子的渗透性(Liuetal., 2013),它可根据公式(2)获得:
Q=AHCsat(DH/DZ)
(2)
其中,Q为流速(mL/h);A为柱内实际横截面积(cm2);HCsat为饱和导水率(cm/h);DH为mm水柱,由输出水压psi换算而来, 1 psi=703.07 mm;DZ为两传感器节点的垂直高差(mm)。
使用悬浮颗粒物和总铁浓度,对生物纳米FeS在石英砂柱中的迁移行为进行表征,结果如图7所示,CMC-FeS悬浮液能够在石英砂柱中具有良好的迁移性。在90 mL/h条件下,生物纳米FeS在纯水中的迁移有限(图7a、7b),完全穿透的时间为2.5 h,仅约4% FeS取得完全穿透。因为在纯水中没有任何分散效果,FeS在输送过程中表现出聚集沉积性,较少进入柱中, 且随着实验进行,聚集的颗粒逐渐表现出氧化并溶解。而相同条件下, 生物纳米FeS在CMC溶液中(图7c、7d)迁移性显著高于纯水(图7a、7b),CMC-FeS首先在2.5 h处完成穿透,在持续一段时间后继续在8 h处取得完全穿透(悬浮固体和总铁),约50%(Ce/C0=0.5)的流入CMC-FeS离开了柱并保持不变;在CMC溶液中的生物纳米FeS得到充分悬浮较少沉淀,输送过程更易进行,所以在相同流速下,进入柱中更多,更易迁移穿透,流出柱中也更多。

图 7 不同流速下,纯水-FeS(a、b)和CMC-FeS(c、d)通过石英砂柱后流出液中SS(a、c)和总铁浓度(b、d)的变化Fig. 7 Changes of SS (a, c) and total iron concentration (b, d) in the effluent of purewater-FeS (a, b) and CMC-FeS solution (c, d) after passing through the quartz sand column in different flow rates
生物纳米FeS在CMC溶液中的迁移过程受流速影响(图7c、7d)。在最低流速下FeS穿透较慢且分两阶段进行,与之相比,流速为180 mL/h时,FeS取得完全突破时间缩短(1.5 h),约70%的FeS离开了柱并保持不变,这也说明FeS在迁移穿透期间,仍有约30%持续保留于柱中。在流速越大的迁移体系下,生物纳米FeS穿透越快且流出越多,对流扩散模型拟合效果更佳(0.85>0.82)。在流速为360 mL/h体系下,FeS在1 h时即取得完全穿透,穿透前期约90%总铁流出柱外,而悬浮固体达到了130%,两者都在4.5 h后有所下降,到实验结束点(13.5 h)均为90%。
3个流速下CMC-FeS悬浮颗粒物的穿透效果如表2。从图7c、7d和表2可以看出,在CMC实验条件下,除360 mL/h的悬浮固体表现差异较大外,FeS的柱迁移行为均很好地符合对流扩散模型方程,且流速越大,Rf值越小,迁移与穿透越快;即90 mL/h下Rf值最大,代表柱内FeS或铁浓度较高,产生较大压力差,使得渗透性最低(图8)。在180 mL/h下Rf值较小,体系水压力差集中分在0.1~0.5之间(图未展示),渗透系数显著高于90 mL/h和360 mL/h(p<0.05),三者渗透系数平均值分别为15.73、243.97和34.02 cm/h。从实验现象观察得出,90 mL/h下,FeS集中在填充柱下端,而在180 mL/h下则均匀分布于整个填充柱,体系中流出FeS黑色颗粒更多,而留存更少,从而使得柱压差变小。从过滤理论也能得出,随着纳米颗粒的积累,顶层的流动剪切力增加,分布会更加均匀。因此,也能观察到在更大流速360 mL/h时,柱内渗透性仍高于90 mL/h,维持在25~50之间,但总体低于180 mL/h,这可能是由于最大流速下CMC-FeS迁移性最好,流出柱中也最多,但同时也更多地进入柱中,柱体系中留存也多,从而导致了压力差较大、渗透性较差的结果,由此也不是实际应用中的最优选择。因此,最低和最高流速下可能都不利于CMC-FeS在原位环境修复中的应用,因此,流速为180 mL/h可作为最优选择,为实际应用提供参考。
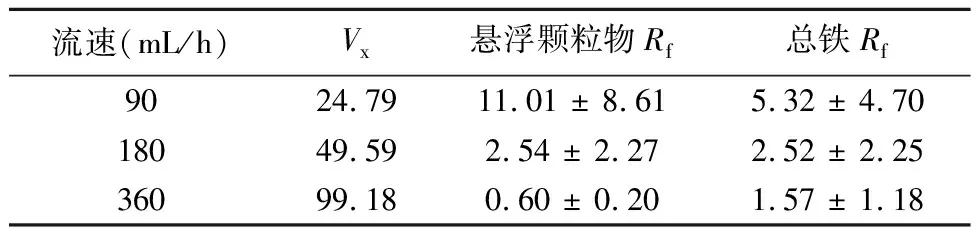
表 2 不同流速下Ce/C0拟合后的Rf值比较Table 2 Comparison of Rf values after Ce/C0 fitting at different flow rates
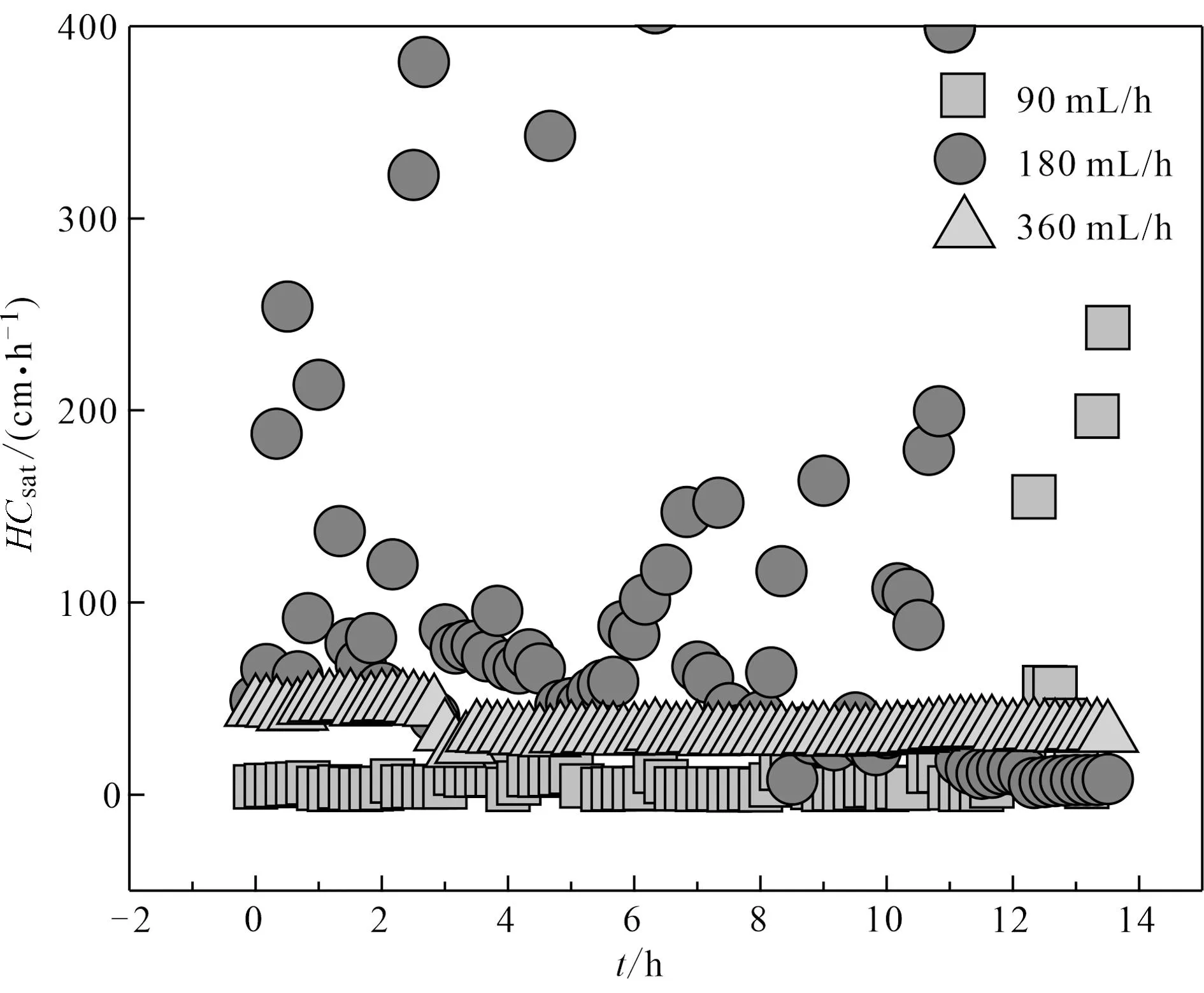
图 8 不同流速下CMC-FeS悬浮颗粒物通过柱中的渗透压变化Fig. 8 Variation of osmotic pressure of CMC-FeS suspended particulates passing through the column at different flow rates
3 结论
本研究主要探讨嗜酸性铁还原菌(JF-5)和硫酸盐还原菌(SRB)不同比例下对于生物FeS生成量的差异,以及CMC对生物FeS稳定性的影响及迁移行为研究,其主要结论如下:
(1) JF-5和SRB在n(Fe)/n(S)=0.2时,生成量最多,达2 400 mg/L。
(2) 在n(Fe)/n(S)=0.2的情况下,引入0.1% CMC到生物纳米FeS颗粒体系中,能有效强化体系稳定性,依据沉降速率K值比较,其自然沉降速率最大从0.07降低到0.02。
(3) 对流扩散模型能够很好地描述CMC-FeS的迁移行为,其模型相关性最高达0.85,而单纯FeS迁移仅有非常低的相关性(R2=0.20),进一步说明CMC强化稳定性迁移效果。在3种流速迁移下(90、180和360 mL/h),中等流速能够获得最佳渗透性,其渗透系数平均值为243.97 cm/h。
