基于甜味受体信号通路探讨玉竹多糖的降血糖作用
2024-01-29杨华生龚芬芳
杨华生,龚芬芳,柳 婷,李 婷,吴 璐
(江西中医药大学,江西 南昌 330004)
玉竹为百合科植物玉竹Polygonatumodoratum(Mill.)Druce 的干燥根茎,主要含有玉竹多糖、黄酮、皂苷等成分,其中玉竹多糖降血糖作用确切,是玉竹研究聚焦的成分,也是评价玉竹质量的主要指标[1]。近年来研究发现,甜味受体与降血糖作用关系密切[2]。
甜味受体属于味觉受体第一家族成员(taste receptor family 1member,T1R)[3]。T1R 由T1R1、T1R2、T1R3 构成,T1R2 和T1R3 以二聚体的形式构成甜味受体。甜味受体不仅存在于味蕾感知甜味,还存在于肠道介导胃肠激素释放[4]。甜味剂与T1R2/T1R3 结合后,α-gustducin 活化,cAMP上升,Ca2+内流,胰高血糖素样肽-1 (glucagonlikepeptide1,GLP-1)分泌[5]。也有研究表明,甜味剂还可通过瞬时受体电位M 亚型5 (TRPM5)途径促进GLP-1 分泌[6]。GLP-1 不仅能促进胰岛素的分泌[7],还能影响葡萄糖的肠道吸收。一般认为,葡萄糖通过刷状缘膜的钠/葡萄糖协同转运蛋白1 (sodium-glucose cotransporter 1,SGLT-1)吸收进入细胞,然后通过基底膜的葡萄糖转运蛋白2 (glucose transporter 2,GLUT-2)进入血液。研究发现,GLP-1 的释放是由刷状缘膜上SGLT-1 介导的[8]。因此,本研究采用高脂高糖饮食联合链脲佐菌素诱导糖尿病模型,研究玉竹多糖对糖尿病大鼠空腹血糖、血脂、胰脏和肝脏组织形态、糖耐量、GLP-1、胰岛素及甜味受体信号通路中信号蛋白T1R2、T1R3、α-gustducin、TRPM5、SGLT-1、GLUT-2 mRNA 表达的影响,并进一步采用细胞模型验证,从甜味受体的角度阐明玉竹多糖降血糖机理,为玉竹的应用及评价提供依据。
1 材料
1.1 仪器 罗氏LightCycler® 96 实时荧光定量PCR 仪、罗氏活力型血糖仪(瑞士Roche 公司);核酸蛋白测定仪(美国赛默飞公司); 激光共聚焦显微镜、倒置显微镜(德国徕卡公司); 生化培养箱(上海博泰实验设备有限公司); 多功能酶标仪(瑞士Tecan 公司); GEL DOC XR+凝胶成像系统(美国Bio-Rad 公司); DYY-7C 型电泳仪(北京六一仪器有限公司)。
1.2 药物与试剂 玉竹饮片购自安徽道源堂中药饮片有限公司,经江西中医药大学付小梅教授鉴定为百合科植物玉竹Polygonatumodoratum(Mill.)Druce 的干燥根茎。M5 Realtime PCR Super mix(批号21DB2535,北京聚合美生物科技有限公司); GLP-1 试剂盒(批号R0996G011S,武汉菲恩生物科技有限公司); 胰岛素试剂盒 (批号A322001245,杭州联科生物技术股份有限公司);胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、cAMP 试剂盒 ( 批号 20210106、20210107、20210107、20210106、20210611,南京建成生物工程研究所有限公司); 苏木素染色液、伊红染色液、链脲佐菌素(STZ)、柠檬酸钠缓冲液(批号20210226、20210204、616S0210、A20201109,北京索莱宝科技有限公司); 盐酸二甲双胍(批号ABS0267,中美上海施贵宝制药有限公司); RNA提取试剂盒(批号20210424,北京聚合美生物科技有限公司); 透析膜 ( 3 000 Da,批号SP132680,上海源叶生物科技有限公司)。
1.3 实验动物及细胞株 SPF 级SD 雄性大鼠,体质量(180±20)g,购自湖南斯莱克景达实验动物有限公司[实验动物生产许可证号SCXK (湘)2019-0004],饲养于江西中医药大学动物房,环境室温20~25 ℃,相对湿度40% ~60%,12 h 光照和12 h 黑暗交替,自由进食饮水,实验操作均符合实验动物使用指导原则,实验方案取得江西中医药大学伦理委员会审核批准 (伦理号JZSYDWLL-20201215)。人十二指肠腺癌细胞HuTu-80 细胞株,购自上海富衡生物科技有限公司。
2 方法
2.1 玉竹多糖的制备及表征 取玉竹饮片,粉碎,加水回流提取2 次,每次2 h,过滤,合并滤液,浓缩至生药量0.25 g/mL。取提取液,加适量Sewage 试剂,振荡摇匀,收集上清液,重复操作5次; 合并上清液,加入乙醇,冷藏,收集沉淀,干燥,得玉竹粗多糖。取玉竹粗多糖适量,超纯水溶解,使用3 500 Da 透析膜去除小分子物质,浓缩干燥即得玉竹纯化多糖。采用苯酚-硫酸法测定多糖的含量,采用考马斯亮蓝G-250 法测定蛋白质的含量,采用HPLC-ELSD 法测定低分子糖的含量,采用PMP 柱前衍生-HPLC 法分析玉竹多糖中单糖的组成,采用红外光谱法分析玉竹多糖中的官能团结构,对玉竹多糖进行表征。
2.2 动物实验
2.2.1 模型制备、分组及给药 将大鼠随机分为正常组(8 只)和造模组(40 只),正常组大鼠给予普通饲料喂养,造模组大鼠给予高脂高糖饲料(66.5%基础饲料+10%猪油+20%蔗糖+2.5%胆固醇+1% 胆酸钠)喂养,饲养4 周后,禁食12 h,腹腔注射2% STZ [30 mg/kg,溶于0.1 mmol/L 柠檬酸缓冲液(pH 4.5)],1 周后再次禁食12 h,腹腔注射2% STZ,72 h 后测定大鼠空腹血糖,空腹血糖值≥11.1 mmol/L,表明造模成功[9]。将造模成功的大鼠随机分为模型组、二甲双胍组(200 mg/kg)和玉竹多糖低、中、高剂量组 (100、200、400 mg/kg,按临床剂量及纯化多糖得率换算),每天灌胃给药1 次,持续8 周。
2.2.2 空腹血糖测定 给药前及给药后的第2、4、6、8 周末,禁食12 h 后尾静脉取血,采用血糖仪测定大鼠的空腹血糖 (fasting blood glucose,FBG)。
2.2.3 口服葡萄糖耐量实验及血清GLP-1、胰岛素检测 给药第7 周末,各组大鼠禁食过夜,然后以2 g/kg 葡萄糖溶液灌胃,分别在灌胃后0、0.5、1、1.5、2 h 这5 个时间点,尾静脉取血,采用血糖仪测定血糖值,绘制“时间-血糖” 曲线,并计算其血糖曲线下面积(AUC)[10]。同时,在相同的时间点,分别从眼睑内采集血样,离心,收集血清,严格按照相应试剂盒说明书检测各组大鼠血清GLP-1、胰岛素水平。
2.2.4 血脂水平检测 给药结束后,各组大鼠禁食12 h,腹腔注射10%水合氯醛进行麻醉,腹主动脉取血,室温静置4 h,4 ℃、3 000 r/min 离心10 min,分离血清,按试剂盒说明书检测大鼠血清TG、TC、HDL-C、LDL-C 水平。
2.2.5 胰脏、肝脏组织形态学观察 给药结束后,麻醉大鼠,取胰脏、肝脏组织于4%多聚甲醛中固定24 h,流水冲洗20 min,梯度乙醇脱水,常规石蜡包埋、切片,HE 染色,于光学显微镜下观察胰脏、肝脏组织形态。
2.2.6 RT-qPCR 法检测回肠组织甜味信号表达给药结束后,麻醉大鼠,取回肠于-80 ℃超低温冰箱保存。实验时,取回肠组织约30 mg 于匀浆器中,按RNA 提取试剂盒说明书提取总RNA,逆转录合成cDNA 后进行PCR 反应。以β-actin为内参,引物由生工生物工程(上海)股份有限公司合成,序列见表1。扩增反应条件为95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,共50 个循环,最后另外获取熔解曲线。每个样品设3 个平行孔,反应结束后,得到各孔循环阈值(CT值),采用2-ΔΔCT法计算各目的基因mRNA 相对表达量。
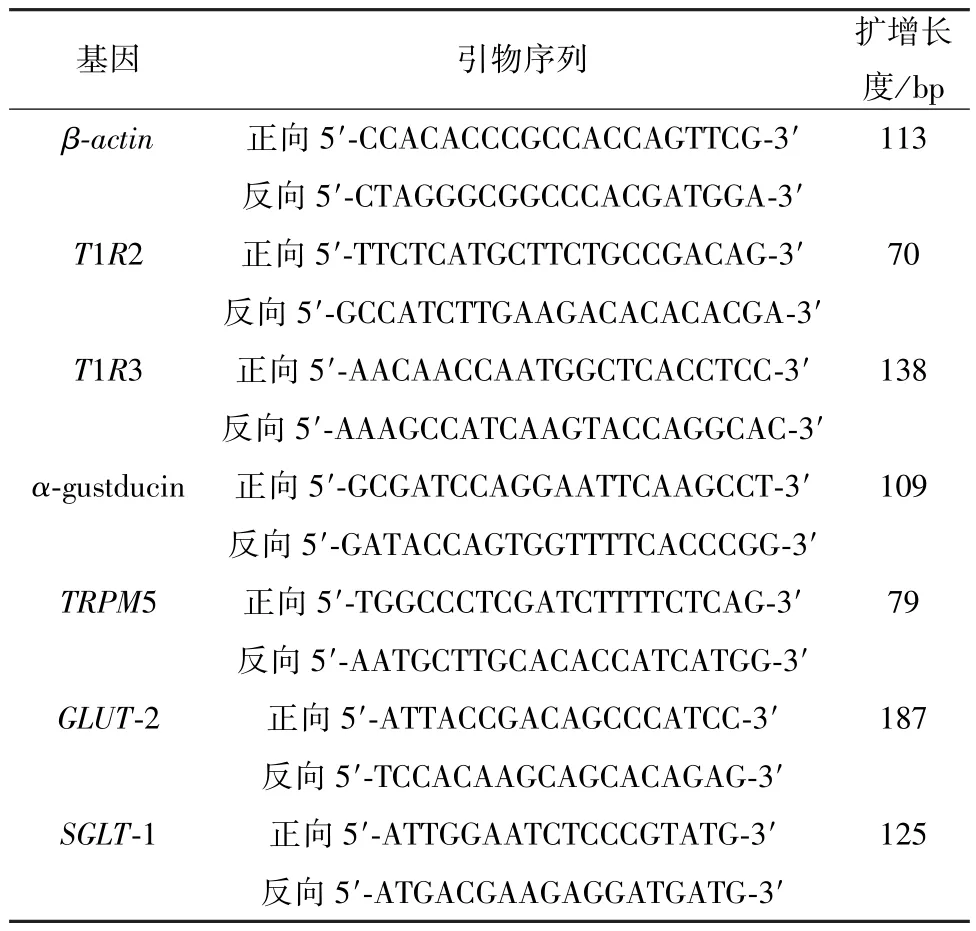
表1 引物序列ⅠTab.1 Primer sequences Ⅰ
2.3 细胞实验
2.3.1 细胞内cAMP 水平及细胞分泌GLP-1 水平检测 取对数生长期的HuTu-80 细胞,按每孔4×105个的密度接种于6 孔板中,细胞贴壁后吸去培养基,分别加入低、高剂量玉竹多糖溶液(0.1、0.4 mg/mL),正常组加入等体积细胞培养液,孵育48 h 后吸去培养基,加入无糖培养基孵育3 h,再加入0.2 mg/mL 葡萄糖溶液孵育15 min,弃培养基,加裂解液,收集细胞,离心后取上清,按试剂盒说明书检测细胞内cAMP 水平。另取对数生长期的HuTu-80 细胞,分组及操作同上,加入0.2 mg/mL 葡萄糖溶液孵育1 h 后,吸取细胞培养液于EP 管内,离心后取上清液,按试剂盒说明书检测细胞外GLP-1 水平。
2.3.2 激光共聚焦法检测钙离子荧光强度 取对数生长期的HuTu-80 细胞,以1×106/mL 的密度接种于激光共聚焦培养皿底孔中,静置,贴壁。按“2.3.1” 项下方法分组及给药处理,加入无糖培养基孵育3 h,避光加入150 μL 2 μmol/L Fluo-3/AM,37 ℃孵育10 min,PBS 清洗 2 次,再加入0.2 mg/mL葡萄糖溶液孵育5 min,吸去培养液,PBS 清洗2 次,加入PBS 缓冲液后放入培养箱中继续培养15 min,于激光共聚焦显微镜下观察并拍照,采用Image Pro Plus 软件对图片进行分析,测定每张图片的荧光强度总和,以单位面积荧光强度为指标,分析Ga2+水平[11]。
2.3.3 RT-qPCR 法检测HuTu-80 细胞甜味受体表达 取对数生长期的HuTu-80 细胞,以1×106/mL的密度接种于6 孔板中,按“2.3.1” 项下方法分组及给药处理,孵育48 h 后,利用RNA 提取试剂盒提取HuTu-80 细胞总RNA,逆转录后进行PCR反应,操作步骤同“2.2.6” 项。以GAPDH为内参,引物序列见表2。
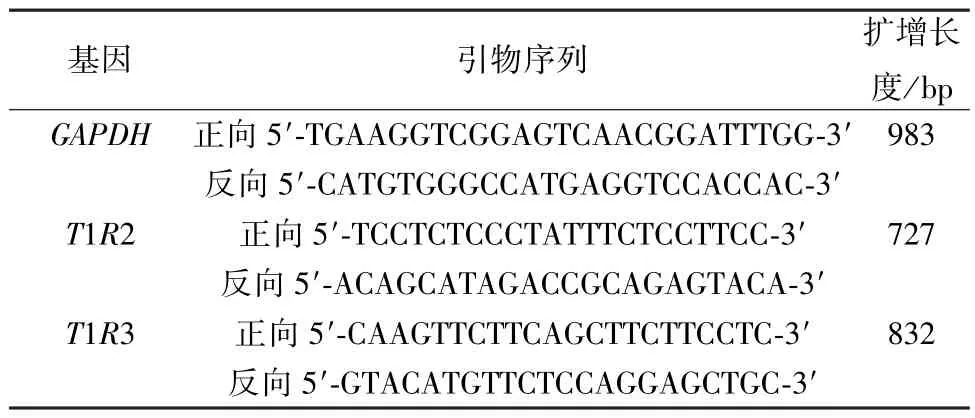
表2 引物序列ⅡTab.2 Primer sequences Ⅱ
2.4 统计学分析 通过SPSS 20.0 软件进行处理,数据以(±s)表示,各组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 玉竹多糖的表征 玉竹经过水提、祛蛋白、醇沉、去小分子物质后,得到玉竹纯化多糖,其纯度为88.29%,杂质蛋白质含量为0.19%,且不含有葡萄糖、木糖、鼠李糖、果糖、蔗糖等低分子糖,见图1A ~1B。单糖组成测定结果见图1C ~1D,结果显示,玉竹多糖由甘露糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖5 种单糖组成,其摩尔比为21.08 ∶2.31 ∶14.13 ∶3.32 ∶0.41。红外分析图见图1E,研究表明,3 364.21 cm-1为羟基的伸缩振动峰,2 934.19 cm-1的强肩峰是糖环中的C-H伸缩振动峰,这2 个是典型的多糖特征峰[12];1 629 cm-1、1 421.95 cm-1表明多糖中含有糖醛酸[13]; 1 024.14 cm-1处的吸收峰表明了吡喃环的存在[14]; 930.88 cm-1处出现的强吸收峰,表明玉竹多糖主要由β 型糖苷键组成[15]; 816.18 cm-1处的尖峰表明可能存在α 型糖苷键[16]。以上结果表明,玉竹多糖是一种含有羧基、β 型糖苷键、吡喃环,可能含有α 型糖苷键的多糖。
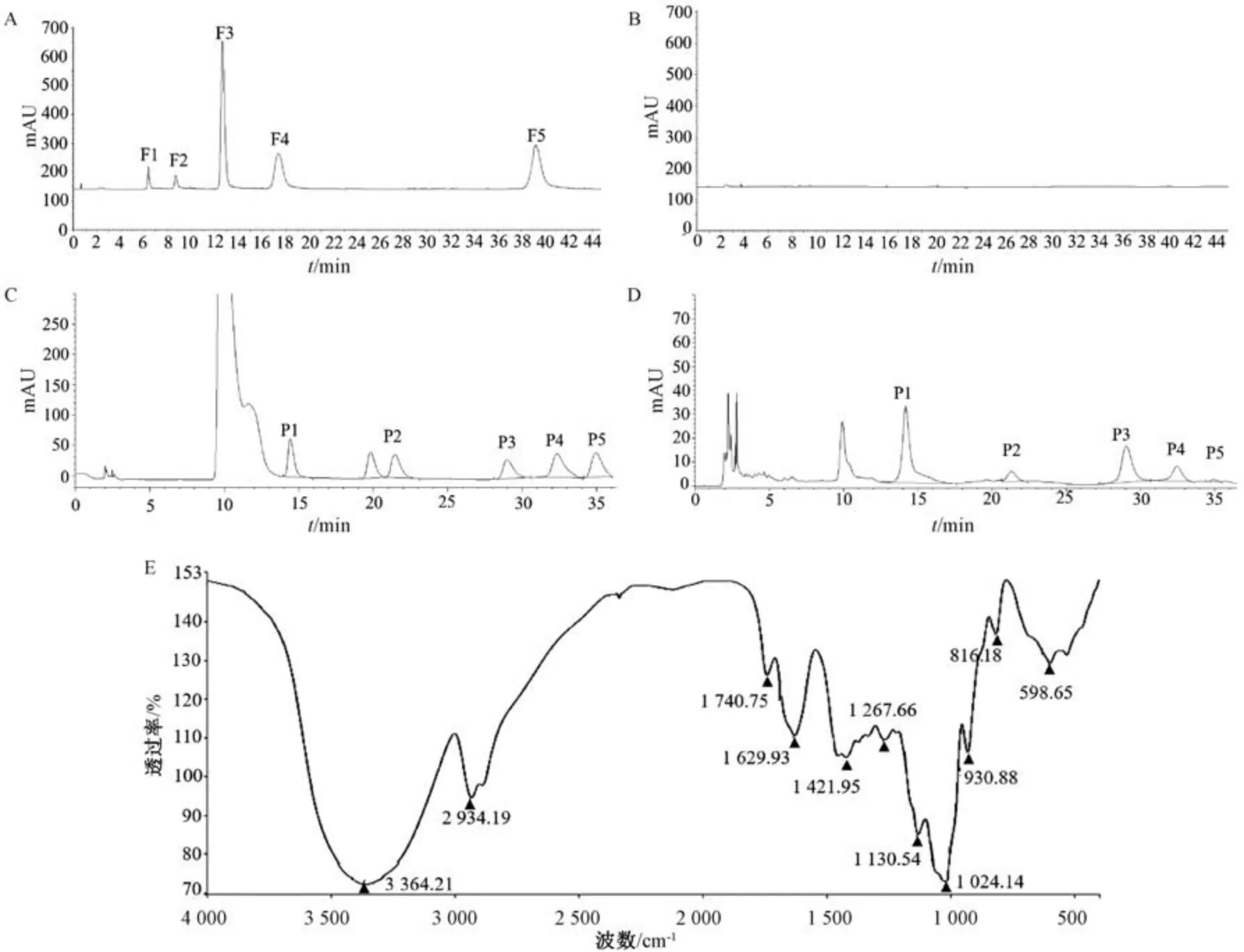
图1 玉竹多糖的纯度、单糖组成、官能团分析Fig.1 Purity,monosaccharide composition and functional group analysis of P.odoratum polysaccharides
3.2 玉竹多糖对糖尿病大鼠空腹血糖的影响 如图2 所示,与正常组比较,模型组大鼠FBG 水平升高(P<0.05); 与模型组比较,给药第2 周起,玉竹多糖中、高剂量组和二甲双胍组大鼠FBG 水平降低(P<0.05)。

图2 给药期间大鼠FBG 水平变化(x±s,n=8)Fig.2 Changes of rat FBG level during drug administration (x±s,n=8)
3.3 玉竹多糖对糖尿病大鼠口服葡萄糖耐量的影响 如图3A 所示,正常组大鼠基础血糖低,口服葡萄糖后,血糖升高,但0.5 h 后逐渐下降; 模型组大鼠基础血糖高,口服葡萄糖后,血糖持续升高,1.5 h 后才开始逐渐下降,而玉竹多糖高剂量组大鼠1.0 h 后开始下降。进一步计算各组AUC值,如图3B 所示,与正常组比较,模型组大鼠AUC 增加(P<0.05); 与模型组比较,玉竹多糖中、高剂量组和二甲双胍组大鼠AUC 降低(P<0.05)。

图3 玉竹多糖对糖尿病大鼠口服葡萄糖耐量的影响(x±s,n=8)Fig.3 Effects of P.odoratum polysaccharides on OGTT of diabetic rat (x±s,n=8)
3.4 玉竹多糖对糖尿病大鼠血清GLP-1、胰岛素分泌的影响 如图4A 所示,与正常组比较,模型组大鼠血清GLP-1 水平在各个时间点均降低(P<0.05); 与模型组比较,玉竹多糖中、高剂量组和二甲双胍组大鼠血清GLP-1 水平在各个时间点均升高(P<0.05)。如图4B 所示,与正常组比较,模型组大鼠血清胰岛素水平在0、0.5、1、1.5 h时均降低(P<0.05),在2 h 时升高(P<0.05);与模型组比较,玉竹多糖中、高剂量组和二甲双胍组大鼠血清胰岛素水平在各时间点均升高(P<0.05),且在1 h 时出现胰岛素分泌高峰。
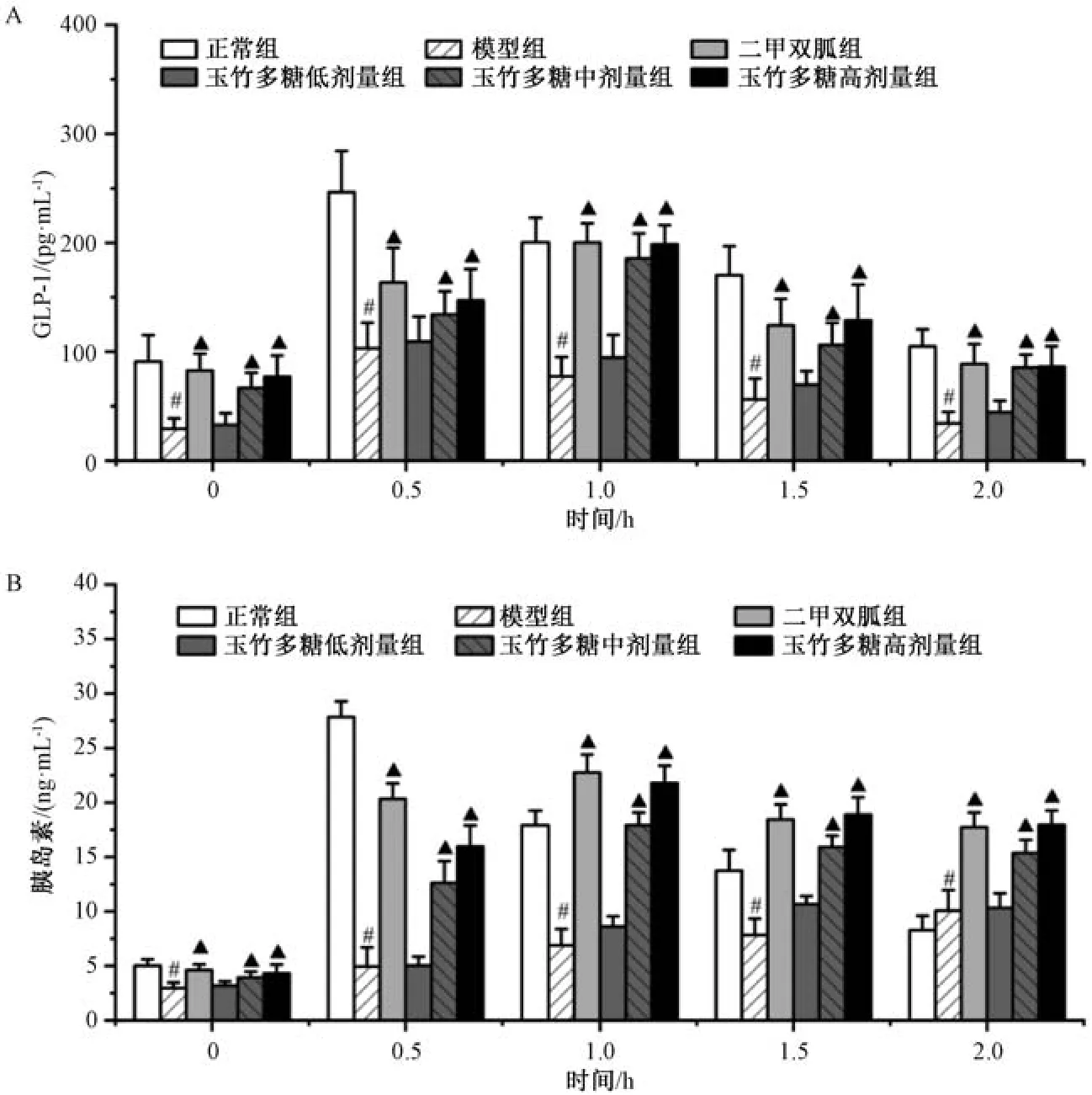
图4 玉竹多糖对糖尿病大鼠血清GLP-1 及胰岛素分泌的影响(x±s,n=8)Fig.4 Effects of P.odoratum polysaccharides on serum levels of GLP-1 and insulin in diabetic rat (x±s,n=8)
3.5 玉竹多糖对糖尿病大鼠血脂水平的影响 如表3 所示,与正常组比较,模型组大鼠血清TG、TC、LDL-C 水平升高(P<0.05),HDL-C 水平降低(P<0.05); 与模型组比较,玉竹多糖中、高剂量组和二甲双胍组大鼠血清TG、TC、LDL-C 水平降低(P<0.05),玉竹多糖高剂量组大鼠血清HDL-C 水平升高(P<0.05)。
表3 玉竹多糖对糖尿病大鼠血脂水平的影响(mmol/L,x±s,n=8)Tab.3 Effects of P.odoratum polysaccharides on blood lipid level of diabetic rat models (mmol/L,±s,n=8)

表3 玉竹多糖对糖尿病大鼠血脂水平的影响(mmol/L,x±s,n=8)Tab.3 Effects of P.odoratum polysaccharides on blood lipid level of diabetic rat models (mmol/L,±s,n=8)
注:与正常组比较,#P<0.05; 与模型组比较,▲P<0.05。
组别TCTGLDL-CHDL-C正常组1.18±0.230.63±0.070.39±0.091.32±0.19模型组2.73±0.18#2.15±0.22#1.22±0.06#0.80±0.24#二甲双胍组1.60±0.19▲1.04±0.24▲0.68±0.06▲1.20±0.26▲玉竹多糖低剂量组2.72±0.312.01±0.251.17±0.110.88±0.21玉竹多糖中剂量组1.91±0.17▲1.44±0.26▲0.80±0.06▲0.96±0.19玉竹多糖高剂量组1.76±0.22▲1.18±0.21▲0.73±0.07▲1.10±0.18▲
3.6 玉竹多糖对糖尿病大鼠胰脏、肝脏组织形态的影响 如图5 所示,正常组大鼠胰岛组织结构清晰,细胞分布均匀; 而模型组大鼠胰岛组织萎缩变形,边界模糊不清,细胞空泡变性; 与模型组比较,玉竹多糖中、高剂量组大鼠胰岛组织损伤得到改善,胰岛面积增大,结构趋向完整,边界清晰,细胞数目增多。同时,正常组大鼠肝组织结构和形态正常,且没有炎症细胞浸润; 模型组大鼠肝索紊乱,肝细胞质有一定程度的空泡结构,组织结构紊乱、排列不规则,细胞内液态积聚增多; 与模型组比较,玉竹多糖中、高剂量组大鼠肝细胞损伤得到改善,肝脏细胞内液态积聚减少,受损细胞数量减少,细胞形态、个体间排列情况均有所改善。

图5 玉竹多糖对糖尿病大鼠胰脏、肝脏组织形态的影响(×100)Fig.5 Effects of P.odoratum polysaccharides on the morphology of pancreas and liver in diabetic rat (×100)
3.7 玉竹多糖对糖尿病大鼠甜味受体通路相关蛋白mRNA 表达的影响 如图6 所示,与正常组比较,模型组大鼠回肠组织T1R2、T1R3、αgustducin、TRPM5 mRNA 表达降低(P<0.05),而SGLT-1、GLUT-2 mRNA 表达升高(P<0.05); 与模型组比较,玉竹多糖高剂量组T1R2、T1R3、αgustducin、TRPM5 mRNA 表达升高(P<0.05),中剂量组T1R3、TRPM5 mRNA 表达升高 (P<0.05),各剂量组SGLT-1、GLUT-2 mRNA 表达无明显变化(P>0.05)。

图6 玉竹多糖对糖尿病大鼠甜味受体通路相关蛋白mRNA 表达的影响(x±s,n=8)Fig.6 Effects of P.odoratum polysaccharides on mRNA expressions of sweet receptors in diabetic rat (x±s,n=8)
3.8 玉竹多糖对HuTu-80 细胞cAMP、Ca2+、GLP-1 水平和T1R2、T1R3 mRNA 表达的影响 如图7A 所示,与正常组比较,玉竹多糖各剂量组细胞内cAMP、GLP-1 水平均升高(P<0.05)。如图7B 所示,与正常组比较,玉竹多糖各剂量组细胞T1R2、T1R3 mRNA 表达升高(P<0.05)。如图7C所示,与正常组(0.007±0.002)比较,玉竹多糖低、高剂量组细胞内Ca2+荧光强度 (0.019 ±0.002、0.044±0.008)增强(P<0.05)。
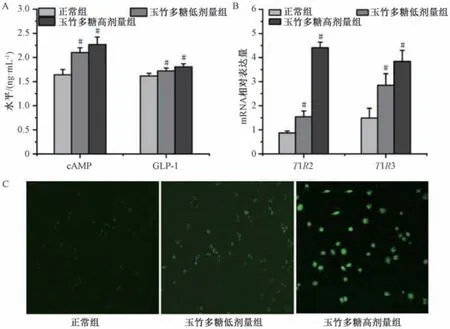
图7 玉竹多糖对HuTu-80 细胞cAMP、Ca2+、GLP-1 水平和T1R2、T1R3 mRNA 表达的影响(±s,n=6)Fig.7 Effects of P.odoratum polysaccharides on cAMP,Ca2+,GLP-1 levels and T1R2,T1R3 mRNA expressions in HuTu-80 cells (±s,n=6)
4 讨论
糖尿病是一组由多种病因引起的,胰岛素分泌缺陷和(或)作用受损,以慢性高血糖为特征的内分泌代谢性疾病。西医学上的“糖尿病” 与中医学的“消渴” 有一定关联,消渴的基本病机为“阴虚燥热”。玉竹味甘,甘能补阴。甘味,又可称为“甜味”,激动舌头味蕾上的甜味受体即可感觉到“甜味”,激动胃肠道的甜味受体则可促进GLP-1 的分泌,降低血糖,改善 “阴虚” 证/症状。因此,“甜味受体” 在一定程度上可把糖尿病、阴虚联系起来。研究表明,糖尿病发生过程中,甜味受体及其信号分子α-gustducin、TRPM5表达下调,GLP-1 分泌减少[17]。基于本研究动物实验、细胞实验的结果,结合文献[18-20]报道,推测玉竹多糖主要通过促进T1R2、T1R3、αgustducin、TRPM5 mRNA 表达,增强甜味受体信号通路的强度,在体内葡萄糖的参与下,促进GLP-1的分泌,从而发挥降血糖作用。因此,可从“甜味受体” 的角度,同时阐释玉竹治疗阴虚证、糖尿病的作用机制,即多糖降血糖作用与甜味受体T1R2、T1R3 及信号分子α-gustducin、TRPM5 的表达密切相关。
SGLT-1、GLUT-2 是肠道吸收葡萄糖的转运体,SGLT-1 与Na+、葡萄糖结合成复合物,以主动转运的方式将葡萄糖转入细胞内,而GLUT-2 则通过被动转运的方式将葡萄糖转入细胞内,二者维持机体葡萄糖代谢平衡[21]。研究发现,糖尿病会导致SGLT-1 和GLUT-2 在肠道中的表达量异常增加[22]。本研究发现,玉竹多糖对糖尿病大鼠回肠组织SGLT-1、GLUT-2 mRNA 表达无明显影响,提示玉竹多糖降血糖作用与SGLT-1、GLUT-2 无明显关联。
中药多糖是一种由糖苷键构成的高分子物质。研究表明,多糖具有免疫调节、抗病毒、抗肿瘤、抗氧化、抗凝血、护肝、降血糖等药理活性[23]。多糖在临床上可制备成注射剂,也可开发成口服制剂,且含多糖的中药,主要给药方式为口服。有报道称,多糖是通过水解为寡糖起作用[24],但目前多认为,多糖起效的部位是在“肠道”,如多糖可通过肠道菌群[25]、紧密连接蛋白[26]等发挥药理作用。进一步研究表明,多糖在肠道中可以通过激活多种核受体调控相关蛋白的表达[27]。因此,本研究从肠道甜味受体的角度阐明玉竹多糖的降血糖机制,也在一定程度上证实多糖的作用部位是在“肠道”,但玉竹多糖是通过何种机制影响肠道中甜味受体信号蛋白的表达,还有待深入研究。
