单筛过滤法体外分离培养原代大鼠脑微血管内皮细胞及其鉴定
2024-01-28张帆李柏霖刘海琴唐元瑜
张帆,李柏霖,刘海琴,唐元瑜*
(1 福建中医药大学针灸学院,福州 350122;2 福建中医药大学中医学院,福州 350122;3 海军军医大学第二附属医院长征医院呼吸与危重症医学科,上海 200003)
脑微血管内皮细胞( brain microvascular endothelial cells,BMECs)是构成血脑屏障的重要细胞组份之一[1],在调节血液和大脑间的物质交换、维持中枢神经系统的稳态等方面发挥着关键作用,与临床缺血性脑卒中、高血压脑病、血管性痴呆等疾病的发生密切相关,是开展脑血管疾病研究的重要载体和工具细胞[2]。
目前国内外尚未成功建立大鼠BMECs细胞株,其主要的原代培养方法包括物理过筛法[3,4]、化学酶消化法[5,6]和组织块法[7,8]。然而,每种方法都有其优缺点,如化学酶消化法需要较长的消化时间和较高的实验成本,而组织块法则存在重复性较差和细胞纯度较低等问题。为此课题组参考国内外相关文献,通过不断优化实验技术条件,最终采用实验成本较低的单筛过滤法,成功培养出了数量足够、活性较好、纯度较高的大鼠BMECs。现报道如下。
材料和方法
1 实验动物
选取4 周龄的Sprague Dawley 大鼠4 只,雌雄不拘。购自上海斯莱克动物有限责任公司,动物质量合格证号为SCXK(闽)2022-0004。
2 主要试剂及仪器
胎牛血清(Gibco 公司);M199 培养基(Gibco公司);0.25%胰蛋白酶混合酶液(含EDTA)(南京凯基生物公司);肝素(南京新百药业有限公司);Triton-100(Solarbio 公司);Ⅱ型胶原酶(北京鼎国昌盛生物技术有限责任公司);Rabbit Anti rat-Ⅷ因子抗体(北京博奥森生物科技公司);生物素标记的羊抗兔IgG、免疫组织化学试剂盒SABC 即用型、DAB 显色剂均购自武汉博士德生物公司。超净工作台(苏州安泰空气技术公司);水平离心机(湖南湘仪公司);二氧化碳培养箱(美国Thermo 公司);倒置相差显微镜(德国Leica 公司)。
3 大鼠BMECs 的原代培养
选取4 周龄SD 大鼠4 只,经断颈处死、75%酒精浸泡消毒后,剪开颅骨,用眼科镊无菌取出大脑皮质。在玻璃培养皿中去除脑干、小脑及皮质表面的软脑膜、大血管等。将大脑皮质剪碎成大小约1mm×1mm×1mm 的组织小块,使其通过孔径为40 μm 的细胞筛网,收集网上截留的组织于15ml 锥底离心管中。离心,弃上清,向离心管底部沉淀中加入5 ml 0.1%Ⅱ型胶原酶,37℃水浴震摇消化15~20 min。预冷PBS 液漂洗消化后的沉淀物,予M199 完全培养基4ml 重悬,接种于50 ml 进口Nunc 培养瓶中,并将其静置于37 ℃、5% CO2培养箱中,每隔24 h 换液1 次。
4 大鼠BMECs 的传代培养
待细胞培养至接近90%的融合度时,吸取全部培养液,用37 ℃预热的PBS 液漂洗2 次,然后加入4 ml 0.25%胰蛋白酶(含0.02%EDTA)溶液,室温下消化5~10 min,期间间断性地轻微震荡培养瓶,以促进细胞脱落。镜下观察到大部分细胞变圆缩,开始从瓶壁脱落时,滴加4 ml 培养液以终止消化,吹打混匀,离心,收集沉淀,按1∶2 的传代比例分瓶接种后,静置于37 ℃、5% CO2培养箱中培养。
5 倒置生物显微镜观察大鼠BMECs 的细胞形态
将培养有BMECs 的培养瓶置于倒置显微镜下观察细胞形态、贴壁、出芽及融合等生长状况,并拍照记录。
6 免疫细胞化学染色法检测大鼠BMECs 第Ⅷ因子相关抗原
待传代于培养皿中的BMECs 增殖生长接近80%融合度时,用PBS 液漂洗5 min×3 次,滴加预冷的4%多聚甲醛,常温固定细胞15 min;PBS 液漂洗5 min×3 次,滴加0.3% Triton X-100 常温透膜15 min;PBS 液漂洗5 min×3 次,滴加5%BSA 室温封闭20 min;甩弃封闭液,滴加稀释度1∶300 的兔抗大鼠Ⅷ因子多克隆抗体,置于湿盒中4 ℃过夜;PBS液漂洗5 min×3 次,滴加羊抗兔IgG 二抗,37 ℃孵育30 min;PBS 液漂洗5 min×3 次,滴加SABC,37 ℃孵育30 min;PBS 液漂洗5 min×3 次,DAB 室温显色2 min;PBS 液再次充分漂洗后,置于倒置显微镜下观察并拍照。
结 果
1 原代大鼠BMECs 形态
倒置显微镜下可见:接种于培养瓶中的脑微血管段呈长短不一的短棍状(图1B、C);24 h 后贴壁的血管段周围爬出短梭形细胞,呈“蜈蚣虫样”的出芽式生长(图1D—F);48 h 后以血管段为中心的岛屿状或团簇样分布的细胞集落形成(图1G—I);72 h 后集落逐渐扩大,并相互融合成片(图1J—L);96 h 后血管段逐渐塌陷,管形消失,细胞铺满瓶底,呈典型的单层、铺路石样、镶嵌式贴壁生长(图1M—O)。
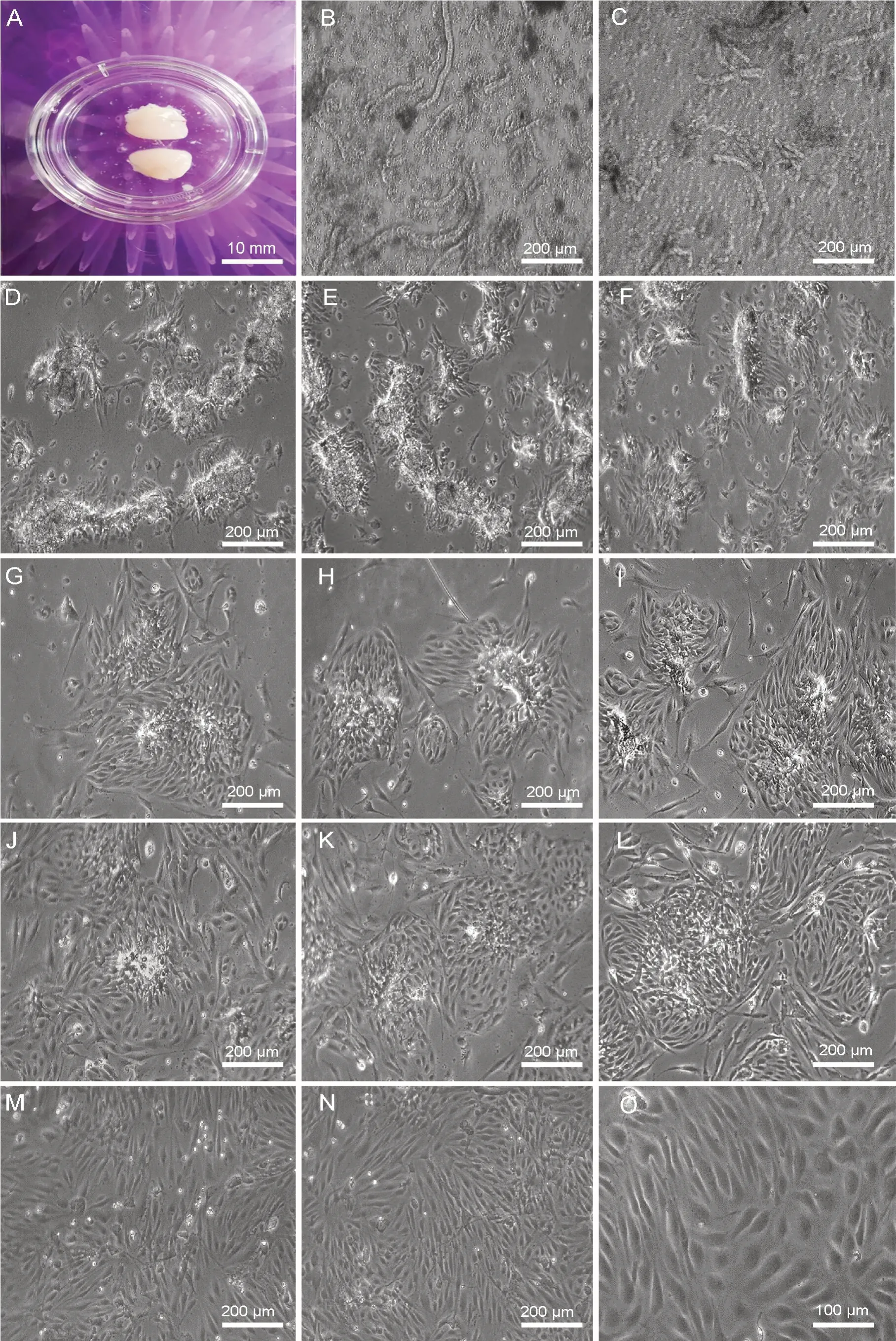
图1 原代大鼠BMECs 生长情况及形态 A,解剖获得的大鼠大脑皮质;B 和C,短棍状的脑微血管段;D—F,24 h 后血管段周围爬出短梭形细胞,呈“蜈蚣虫样”出芽式;G—I,48 h 后以血管段为中心的岛屿状或团簇样分布的细胞集落形成;J—L,72 h 后细胞集落扩大,并逐渐融合成片;M—O,96 h 后细胞铺满瓶底,呈典型的单层、鹅卵石样、镶嵌式排列。比例尺:A,10 mm; B to N,200 μm;O,100 μmFig. 1 Growth and morphology of rat BMECs in primary culture. A, rat cerebral cortex obtained from dissection; B and C, short rod-like segments of brain microvessels; D to F, short spindle-shaped cells crawling out around the vessel segments after 24 h, exhibiting budding, centipede-like growth;G to I, cell colonies distributed in an island-like or cluster pattern centered around the vessel segments were formed after 48 h; J to L, the cell colonies expanded and gradually fused into patches by 72 h; M to O, cells covered the bottom of the flask, presenting a typical monolayer, cobblestone-like,mosaic arrangement, after 96 h. Scale bar∶ A, 10 mm; B to N, 200 μm; O, 100 µm
2 传代大鼠BMECs 形态
1—3 代传代细胞,其形态均一,均为短梭形,细胞间隙较大,表现为典型的单层、鹅卵石样、镶嵌式贴壁生长(图2)。
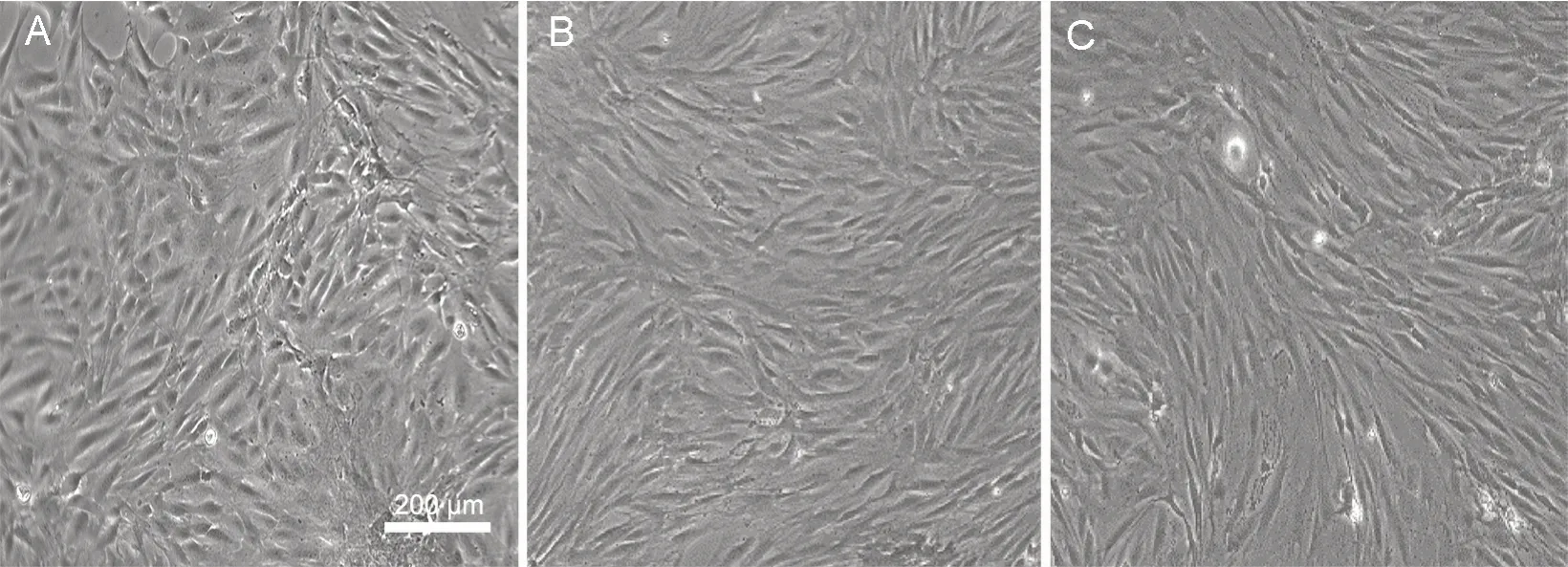
图2 传代细胞生长情况及形态学观察。 A—C,分别为1—3 代BMECs 传代细胞,其形态均一,为短梭形,呈典型的单层、鹅卵石样、镶嵌式排列。比例尺,200 μmFig. 2 Growth and morphological observation of passaged cells. A to C, the 1st to 3rd passage BMECs, all of which have a uniform morphology, being short spindle-shaped, and presenting a typical monolayer, cobblestone-like, mosaic arrangement. Scale bar, 200 μm
3 大鼠BMECs 第Ⅷ因子相关抗原免疫细胞化学染色的检测
免疫细胞化学染色检测第Ⅷ因子相关抗原表达,倒置显微镜不同放大倍数下均可见细胞胞质淡染成棕红色,表达为阳性,阳性细胞率达99%以上(图3)。

图3 大鼠BMECs 第Ⅷ因子相关抗原表达检测 A—C,分别为不同倍数下细胞Ⅷ因子相关抗原免疫细胞化学染色,阳性细胞率达99%以上。比例尺:A,200 μm;B,100 μm;C,50 μmFig. 3 Detection of VIII factor-related antigen expression in primary culture of rat BMECs. A to C, immunocytochemical staining of factor VIII-related antigen at different magnifications, showing a positive cell rate of over 99%. Scale bar∶ A, 200 μm; B, 100 μm; C, 50 μm.
讨 论
过筛法,是一种极具推广性的BMECs 体外组织分离培养方法,其基本原理是采用一定孔径大小的细胞筛网分离脑微血管段并进行体外培养。由于其操作简单、污染机率小、实验成本低,国内外诸多学者都倾向于采用此方法开展原代BMECs 的培养及其生物学特性研究。
大鼠BMECs 的原代培养始于20 世纪70 年代末,自国外学者BRENDEL[9]首次采用微孔过滤法获得300 μm 以下的脑微血管段以来,过筛方法也在不断地改进和优化中,目前主要包括单筛过滤和双筛过滤。根据实验目的和要求的不同,选用的筛网目数也不一样,如郭洋等[10]采用200 目和250 目两种筛网连续过滤脑组织,获得了直径在61 μm~74 μm之间的微血管;鲍欢等[11]则采用100 目和200 目筛网,获得了直径在75 μm~150 μm 的微血管。在使用双筛过滤法时,由于使用了双层细胞筛网,导致脑微血管容易被筛网过度截留,造成其数量顿减而不能满足实验要求,因此研究者往往通过增加实验大鼠的数量以弥补微血管段的损失,这也无形中增加了实验成本和污染机率。为此,单筛过滤法被广泛采用,如赵春雨[12]、徐建文等[13]采用200 目细胞筛网单层过滤,在筛网上均获得了直径在75 μm 以上的脑微血管,其数量也大幅度增加,实验效率也相应得到了提高。
然而,我们在实验中发现,尽管使用200 目筛网能获得75 μm 以上脑微血管,但仍然有一定数量的更加细小的微血管可以通过200 目筛网而遗漏在网下的滤液中,并且其数量较大,不容忽视。因此,我们增加了筛网目数以减小孔径大小,将200 目细胞筛改进为375 目进行单筛过滤,结果网上收集到的微血管数量明显大幅度增加。后续实验结果也进一步证实所培养的BMECs 增殖速度明显加快,96 h即可铺满瓶底,达到融合状态。其细胞形态均表现为内皮细胞样的典型的单层、鹅卵石样、镶嵌式排列;第Ⅷ因子相关抗原免疫细胞化学染色检测,细胞胞质呈现棕红色,表达为阳性,阳性细胞率高达99%以上,提示所培养的内皮细胞纯度较高。
综上,我们积极改进物理过筛法,选用375 目细胞筛网,采取单筛过滤方法,成功地获得了纯度较高、活性较好的原代大鼠BMECs,为后期开展脑血管疾病的基础研究提供了重要的细胞生物学实验载体。
