敲低额外11-19 白血病融合基因蛋白通过激活线粒体通路诱导非小细胞肺癌A549 细胞凋亡
2024-01-28周铮铮徐凯陈义钢孙庆科
周铮铮,徐凯,陈义钢,孙庆科*
(1 无锡市第八人民医院肿瘤科,无锡 214000;2 无锡市第二人民医院普外科,无锡 214000;3 火箭军特色医学中心胸心外科,北京 100088)
肺癌是全球发病率和死亡率均最高的癌症[1],其包括小细胞肺癌、大细胞肺癌与非小细胞肺癌(non-small cell lung cancer, NSCLC),其中NSCLC病例约占据总肺癌的80%[2]。由于烟草消费量增加和环境污染严重,NSCLC 的发病率每年都在增加[3,4]。虽然针对NSCLC 已经取得了重要的临床进展,但由于NSCLC 发展的分子机制尚不清楚,因此肺癌最终治疗效果尚不尽人意[3-5]。。
额外11-19 白血病融合基因蛋白(extra eleven-nineteen leukemia fusion gene protein, EEN)是含有SH3 结构域的蛋白质[6],在哺乳动物中高度保守,且在多种生物活动中有重要作用,如内吞、肿瘤发生和发展[7-9]。然而,EEN 在NSCLC 细胞增殖和存活以及肿瘤生长中的作用仍有待研究。因此,本研究通过观察EEN 在NSCLC 组织和A549 细胞中的表达,然后观察下调EEN 表达对A549 细胞生长与凋亡的影响及其机制,为揭示EEN 在NSCLC 发生发展中的作用与机制提供依据。
材料和方法
1 实验试剂及仪器
A549 和BEAS-2B 细胞均购自中科院上海细胞库,RPMI-1640 培养基和胎牛血清均购自美国Gibco公司,shRNA-EEN 质粒与对照shRNA-Con 质粒、小鼠抗Bax、Bcl-2、Caspase-3、Cleaved Caspase-3、EEN、细胞色素c(cytochrome c,Cyt-c)、COX IV、β-actin和GAPDH一抗和辣根过氧化物酶缀合的羊抗小鼠IgG二抗均购自美国Santa Cruz Biotechnologies 公司;MTT 试剂、TUNEL 原位细胞凋亡检测试剂盒、ROS 检测试剂盒、线粒体膜电位(JC-1)检测试剂盒、细胞质核分离试剂盒、细胞蛋白提取试剂盒和Western blot 用ECL 化学发光试剂均购自上海碧云天生物技术公司;细胞凋亡AnnexinV-FITC/PI 流式细胞术检测试剂盒购自美国BD Biosciences公司。FACScanto II 型流式细胞仪购自美国BD Biosciences 公司;SpectraMax i3x 型荧光酶标仪购自美国Molecular Devices 公司。
2 组织样本
收集2019 年1 月至2021 年1 月我院病理科留存的行NSCLC 手术切除的NSCLC 原发癌中心的肿瘤组织和配对的距肿瘤侵润周围约2 cm 的相邻癌旁组织,共25 对组织。
3 细胞培养和细胞转染
将A549 细胞在含有10%胎牛血清的RPMI-1640 培养基中于37 ℃、5% CO2细胞培养箱中培养。取对数期A549 细胞,无血清培养基同步化12 h后,按照转染说明书步骤进行sh-EEN 和sh-Con 转染,转染48 h 后收获细胞用于分析。
4 MTT 检测
将已转染sh-EEN 和sh-Con 的A549 细胞接种到96 孔板(4×103细胞/孔)中,分别在37 ℃、5%CO2 细胞培养箱中培养24 h、48 h、72 h 和96 h,然后向每孔中加入20 μg/mL MTT 试剂,在37 ℃下孵育2.5 h。然后,除去培养基,加入100 μL MTT 增溶溶液,在37℃下震荡使完全溶解,在酶标仪上用620 nm 的参比滤光器在590 nm 处测量吸光度。
5 Annexin V-FITC/PI 流式细胞术
收获转染sh-EEN 和sh-Con 的A549 细胞,用冰冷PBS 洗涤,重悬浮于结合缓冲液中,室温下用Annexin V-FITC 和PI 避光染色10 min,流式细胞仪分析细胞凋亡。
6 TUNEL 分析
将转染sh-EEN 和sh-Con 的A549 细胞用4%多聚甲醛中固定后,用Triton-X 100 在4 ℃通透细胞5 min,按照TUNEL 原位细胞凋亡检测试剂盒操作说明书,用TUNEL 反应混合物在37 ℃避光条件下标记细胞1 h,DAPI 染核5 min。使用Olympus BX50荧光显微镜随机选择5 个视野,并采用Image-Pro Plus 软件计数TUNEL 阳性细胞数目。
7 细胞内ROS 水平DCFH-DA 探针酶标仪检测
按照ROS 检测试剂盒说明书,在室温避光条件下使用荧光探针DCFH-DA 处理转染sh-EEN 和sh-Con 的A549 细胞,通过荧光酶标仪分别在480 nm和525 nm 的激发和发射波长下检测细胞荧光强度值。
8 线粒体膜电位JC-1 探针-流式细胞术检测
按照线粒体膜电位JC-1 检测试剂盒说明书,在室温避光条件下使用JC-1 探针处理转染sh-EEN 和sh-Con 的A549 细胞,通过FACScanto II 流式细胞仪在525 nm 的发射波长下检测细胞荧光强度值。
9 蛋白印迹实验
用冰冷的PBS 洗涤细胞,按照细胞质核分离试剂盒和细胞蛋白提取试剂盒说明书提取细胞质蛋白、线粒体蛋白和细胞全蛋白,BCA 法测定蛋白浓度,进行8% SDS-PAGE 凝胶电泳。电泳分离的蛋白经半干转移到硝酸纤维素膜上。膜用5%脱脂乳封闭后,在4 ℃下用1 ∶2000 稀释的抗EEN、Bax、Bcl-2、Caspase-3、Cleaved Caspase-3、Cyt-c、COX IV 抗体以及1 ∶5000 稀释的抗GAPDH 和β-actin 一抗孵育过夜。TBST 洗膜后,在4 ℃下用1 ∶2000稀释的辣根过氧化物酶缀合的羊抗小鼠IgG 二抗孵育1 h。TBST 洗膜后,使用ECL 化学发光试剂使得目的蛋白显像。通过Image-Pro Plus 软件定量蛋白的光密度值,然后细胞质和全蛋白以β-actin或GAPDH的光密度值为参考,线粒体蛋白以COX IV 的光密度值为参考,量化目的蛋白的相对表达水平。
10 统计学方法
本研究中的所有数据至少来自3 次独立实验,定量数据表示为平均值±标准差,使用SPSS17.0 软件进行统计学分析。两组数据比较采用成组t检验。P值小于0.05 被认为差异具有统计学意义。
结 果
1 EEN 在NSCLC 组织和A549 细胞中表达上调
免疫组织化学染色显示,NSCLC 组织中EEN表达水平高于癌旁组织(图1A、B)。Western blot结果显示,与正常肺上皮细胞BEAS-2B 细胞相比,EEN 在A549 细胞中的表达显著增高(图1C、D)。
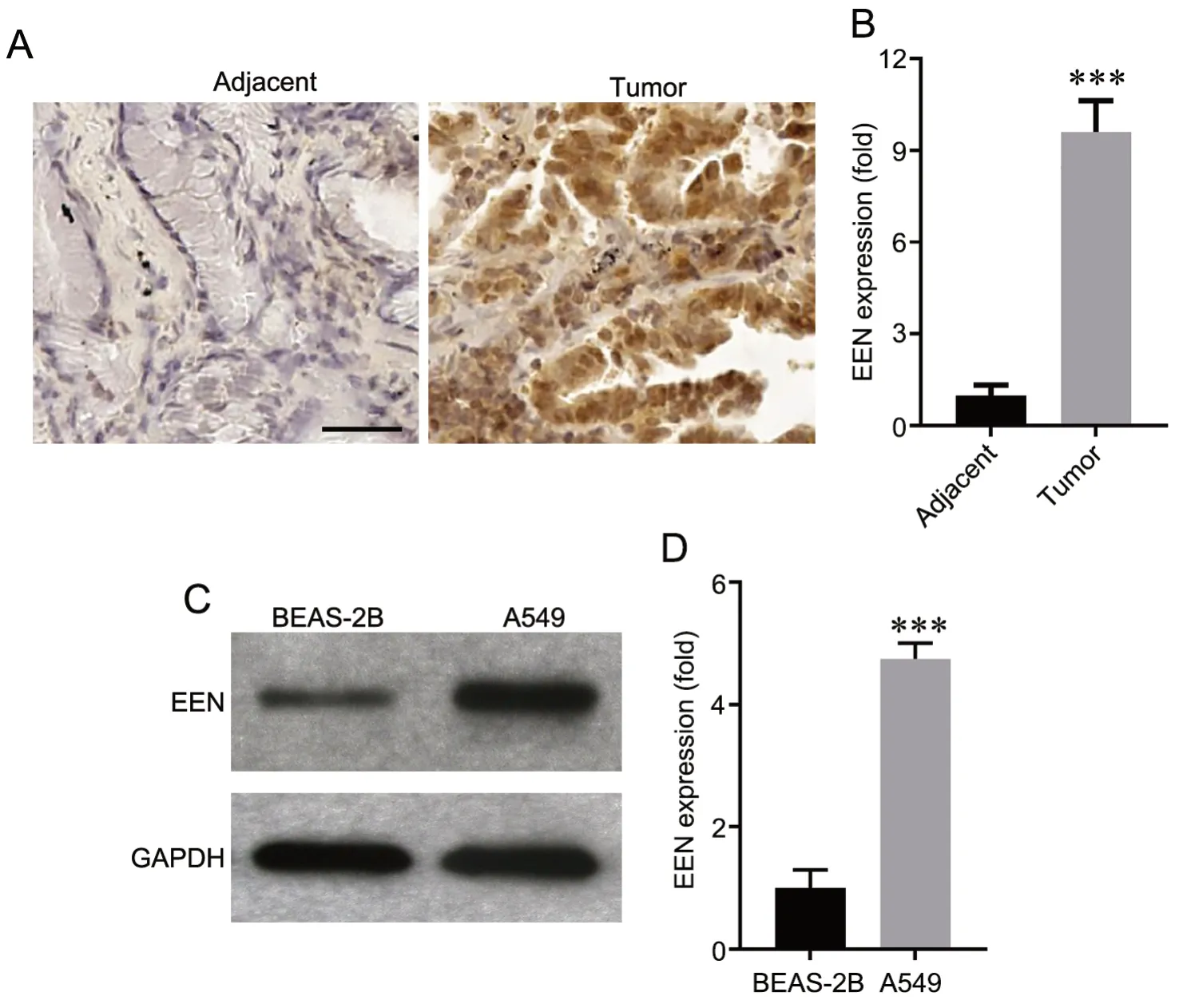
图1 NSCLC 组织和A549 细胞中EEN 表达增加。A 和B,NSCLC 肿瘤组织和癌旁组织中代表性EEN 免疫组织化学染色图像(A)和EEN表达量的定量分析结果(B);比例尺,50μm。C 和D,A549 细胞和BEAS-2B 细胞中EEN 表达的代表性Western blot 检测(C)和定量分析(D)。***P<0.001 vs BEAS-2B 细胞或sh-Con 转染细胞;n=3Fig. 1 Increased EEN expression in NSCLC tissues and A549 cells. A and B, representative EEN immunohistochemical staining images (A) and quantitative analysis results of EEN expression level (B) in NSCLC tumor tissues and adjacent tissues; scale bar, 50μm; C and D, representative Western blot detection (C) and quantitative analysis (D) of EEN expression in A549 cells and BEAS-2B cells. ***P<0.001 vs adjacent tissues or BEAS-2B cells; n=3
2 敲低EEN 抑制A549 细胞增殖
为了解EEN 在A549 细胞的作用,先用sh-EEN转染细胞观察敲低EEN 后的生物学效应。Western blot 检测显示,转染sh-EEN 的的A549 细胞中EEN的表达明显降低(图2A、B),表明敲低EEN 的细胞构建成功。MTT 分析显示,与转染sh-Con 的A549细胞相比,转染sh-EEN 的A549 细胞增殖力显著减弱(图2C)。
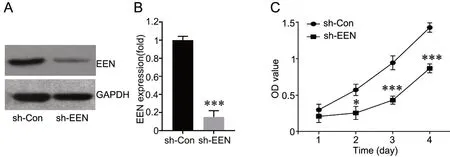
图2 敲低EEN 抑制A549 细胞的增殖。A 和B,sh-EEN 沉默A549 细胞EEN 表达效果的代表性Western blot 检测(A)和定量分析(B)。C,MTT 分析敲低EEN 对A549 细胞增殖的影响。*P<0.05,***P<0.001 vs sh-Con;n=3Fig. 2 Effect of EEN knockdown on A549 cell proliferation. A and B, representative Western blot detection (A) and quantitative analysis (B) for silencing effect of sh-EEN on EEN expression in A549 cells. C, MTT assay for the effect of silencing EEN on A549 cell proliferation. *P<0.05, ***P<0.001 vs sh-Con; n=3
3 敲低EEN 表达促进A549 细胞凋亡
Annexin V-FITC/ PI染色流式细胞术分析发现,敲低EEN 表达后,A549 细胞的凋亡率明显升高(图3A、B)。TUNEL 染色结果发现,与转染sh-Con 的A549细胞比较,转染sh-EEN的A549细胞中TUNEL阳性比例显著升高(图3C、D)。

图3 敲低EEN 引起A549 细胞凋亡。A 和B,敲低EEN 对A549 细胞凋亡影响的代表性Annexin V-FITC/ PI 染色流式细胞术检测(A)和统计分析结果(B)。C 和D,敲低EEN 对A549 细胞凋亡影响的代表性TUNEL 荧光染色(C)和统计分析结果(D);绿色示TUNEL 阳性细胞(凋亡细胞);比例尺,20μm。***P<0.001 vs sh-Con 转染细胞;n=3Fig. 3 A549 cells apoptosis induced by EEN knockdown. A and B, representative flow cytometry detection by Annexin V-FITC/ PI staining (A) and statistical analysis results (B) of the effect of EEN knockdown on apoptosis of A549 cells. C and D, representative TUNEL staining (C) and statistical analysis results (D) of the effect of EEN knockdown on apoptosis of A549 cells; green, TUNEL-positive cell (apoptotic cells); scale bar, 20 μm.***P<0.001 vs sh-Con transfected cells; n=3
4 敲低EEN 促进A549 细胞ROS 产生和线粒体膜电位丢失
荧光探针DCFH-DA 检测ROS 水平的酶标仪分析显示,转染sh-EEN 的A549 细胞内ROS 水平显著高于转染sh-EEN 的A549 细胞(图4A、B)。线粒体膜电位的JC-1 探针-流式细胞术分析表明,转染sh-EEN 的A549 细胞的绿色荧光所占百分比显著高于转染sh-Con 的A549 细胞(图4C、D),表明敲低EEN 降低A549 细胞线粒体膜电位。
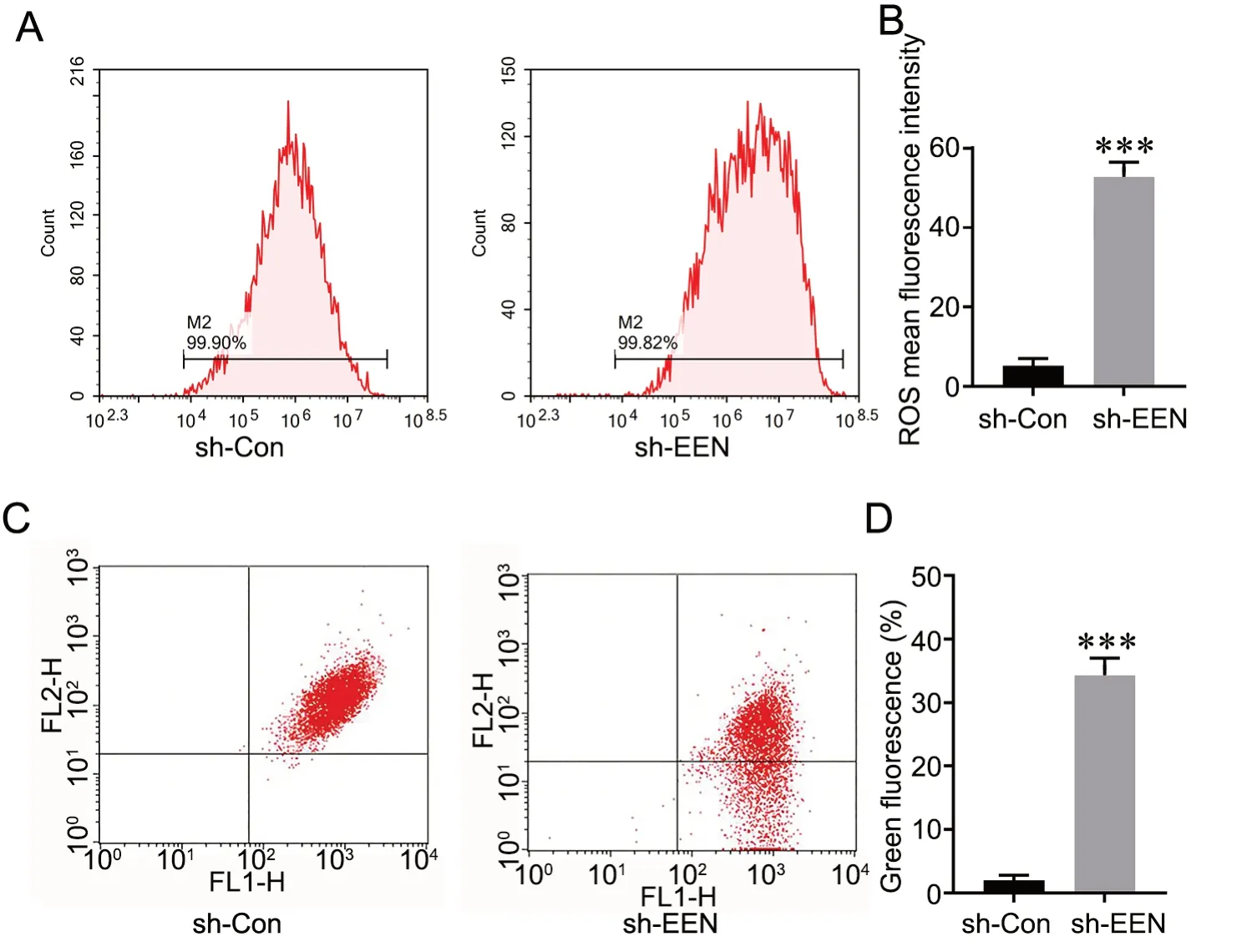
图4 敲低EEN 对A549 细胞ROS 水平和线粒体膜电位的影响。A 和B,敲低EEN 对A549 细胞内ROS 水平影响的代表性DCFH-DA 染色检测(A)和统计学分析(B)。C 和D,敲低EEN 对A549 细胞线粒体膜电位影响的代表性JC-1 染色流式细胞术检测(C)和统计学分析(D)。Mean±SD, n=3, ***P<0.001 vs. sh-Con 转染细胞。Fig. 4 Effect of EEN knockdown on ROS level and mitochondrial membrane potential in A549 cells. A and B, representative DCFH-DA staining assay for (A) and statistical analysis of (B) the effect of EEN knockdown on ROS level in A549 cells. C and D, representative JC-1 staining flow cytometry assay (C) and statistical analysis (D) for the effect of knocking down EEN on mitochondrial membrane potential in A549 cells. ***P<0.001 vs sh-Con transfected cells; n=3
5 敲低EEN 上调促凋亡蛋白水平
Western blot 分析表明,敲低EEN 可降低线粒体中Cyt-c 水平(图5A、B),增加细胞质中Cyt-c水平(图5A、C1)。此外,与转染sh-Con 的A549比较,转染sh-EEN 的A549 细胞中Bax 水平升高,Bcl-2 水平降低,同时Cleaved Caspase-3 水平升高(图5D—G)。
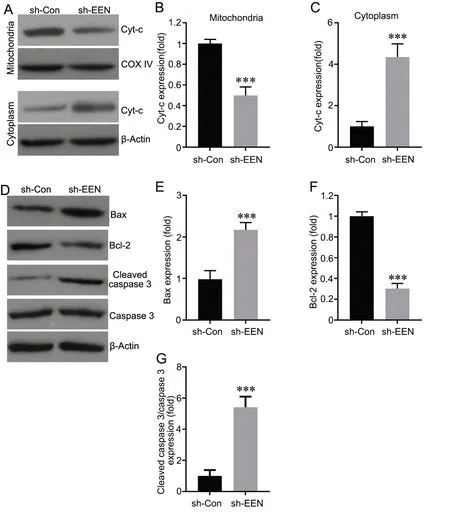
图5 敲低EEN 对凋亡相关蛋白表达的影响。A—C,线粒体和细胞质中Cyt-c 表达的代表性Western blot 检测(A)和统计学分析(B 和C)。D—G,Bax、Bcl-2、Cleaved caspase-3 表达的代表性Western blot 检测(D)及统计学分析(E-G)。Mean±SD, n=3, ***P<0.001 vs. sh-Con转染细胞。Fig. 5 Effect of EEN knockdown on the expression of apoptosis-related proteins. A to C, representative Western blot assay (A) and statistical analysis(B and C) for the expression of Cyt-c in mitochondria and cytoplasm. D to G, representative Western blot assay (D) and statistical analysis (E to G) for the levels of Bax, Bcl-2 and Cleaved caspase-3 expression. ***P<0.001 vs sh-Con transfected cells; n=3
讨 论
在临床上,大多数NSCLC 患者确诊时已出现转移[10]。虽然,NSCLC 的整体5 年生存率在过去10年中略有增加(从15.7%增加到17.4%)[4-5],但这种结果仍然不尽人意。因此,必须进一步加强针对NSCLC 进展机制的研究,开发针对NSCLC 有效的的疗法。
有研究报道EEN 通过介导胰岛素样生长因子1(IGF-1)分泌来调节多发性骨髓瘤细胞的增殖和存活[8],EEN 过表达与白血病发病相关[11]。然而,EEN 在NSCLC 细胞增殖和存活以及肿瘤生长中的作用仍不清楚。本研究发现EEN 在NSCLC 组织和A549 细胞中高表达,提示EEN 表达可能与肺癌进展有关。为进一步明确EEN 与NSCLC 的关系,我们通过sh-EEN 来干扰EEN 在A549 细胞中的表达,结果发现,敲低EEN 可以抑制A549 细胞增殖并诱导其凋亡。诱导肿瘤细胞凋亡是最有效的癌症治疗方法之一[12]。细胞凋亡主要通过死亡受体介导的途径和线粒体依赖途径介导[13]。线粒体依赖途径在细胞凋亡诱导过程中起重要作用,其起源于线粒体去极化,由Bcl-2 蛋白家族成员调节,触发Cyt-c 释放到细胞质中,从而引起Caspase-3 活化并最终导致细胞凋亡[14]。因此,本研究进一步研究敲低EEN 诱导细胞凋亡的途径,发现敲低EEN 能促使A549 细胞线粒体膜电位丢失。另外,细胞内ROS 水平升高可使细胞线粒体膜电位的去极化,并发生细胞凋亡[14]。本研究发现,敲低EEN 能促使细胞ROS 水平升高,推测线粒体膜电位丢失可能与下调EEN 促使ROS生成水平相关,但具体机制有待进一步研究。线粒体膜电位的去极化与细胞凋亡相关的线粒体功能障碍有关[15,16]。为进一步确认下调EEN 是影响线粒体依赖途径,本研究通过Western blot 检测线粒体依赖途径相关关键凋亡分子的表达,发现敲低EEN 可降低线粒体中Cyt-c 蛋白的表达同时增加其在细胞质中的表达,提示敲低EEN 能促进A549 细胞Cyt-c 释放到细胞质。本研究还发现,下调EEN 可增加Bax表达、降低Bcl-2 表达,同时增加Cleaved Caspase-3表达,由此表明敲低EEN 通过线粒体依赖途径促使A549 细胞凋亡。
