手机电磁辐射对耳蜗超微结构及边缘细胞的影响△
2024-01-27林怡叶青程剑彬吴立锦
林怡 叶青 程剑彬 吴立锦
(1.福建省老年医院耳鼻咽喉科 福州 350000; 2.福建省立医院耳鼻咽喉科 福州350001)
近年来,由于科技发展带来的通信便利性及生活电子化,智能手机的使用越来越普遍。第45 次《中国互联网络发展状况统计报告》显示,截至2020 年3 月,我国手机即时通信用户规模达8.09 亿人[1]。然而,手机带来便利的同时,与其产生的电磁辐射相关的健康风险也受到人们的广泛关注。手机电磁辐射是一种射频辐射,国际癌症研究机构将手机排放的射频电磁辐射定义为一种可能的人类致癌物[2]。美国国家毒理局进行的短期研究(19 周)和意大利拉马齐尼研究所进行的长期研究(2 年)均报道电磁辐射暴露使Sprague-Dawley(SD)大鼠大脑恶性胶质瘤和心脏神经鞘瘤的发病率增加。
双耳是通话过程中手机电磁辐射的直接效应器官,其暴露距离最近、暴露时间最长。最近的一项研究[3]表明,慢性电磁辐射会导致听力损失相关基因的表达失调,促进前庭神经鞘瘤细胞的转化并导致听力损失。内耳和听觉中枢是听觉系统中电磁辐射损伤的关键,其中耳蜗将来自中耳的声音信号转换为神经电信号以传导至听觉中枢,是内耳的重要结构[4]。此外,剂量学在人体接触电磁辐射的风险评估中起着重要的作用,但长期手机电磁辐射暴露是否会对耳蜗超微结构产生影响还缺乏相关证据。在本研究中,为模拟出实际生活中长期使用手机通信的电磁波辐射强度,我们将SD 大鼠暴露于每日不同时长的手机通话状态中,建立手机电磁波辐射大鼠模型,探讨不同辐射暴露时间下长期手机电磁辐射对大鼠听觉功能、耳蜗超微结构及边缘细胞的影响。
1 材料与方法
1.1 实验动物及分组
健康成年SD 大鼠40 只(体重200 ~250 g,雌雄不限)由福建医科大学实验动物中心提供[动物编号:SYXK(闽)2018-0001]。适应性喂养10 d 并完善耳部检查以排除耳部病变后,采用随机数字表法将大鼠分为4组,每组各10只:对照组(不接受辐射,28 d)、辐射6 h 组(辐射6 h/d,28 d)、辐射12 h 组(辐射12 h/d,28 d)、辐射24 h 组(辐射24 h/d,28 d)。实验过程中大鼠的生活环境、光照、温度、外界声音、饮食恒定,以更精确保证单纯电磁辐射对耳蜗的影响。
1.2 手机电磁辐射暴露
将大鼠置于相同暴露参数的环境下28 d,根据实验分组每日接受不同时长的手机电磁辐射暴露,对照组大鼠除不接受电磁辐射外其余处理与辐射组相同。将塑料质大鼠笼置于大小为75 cm×45 cm×60 cm 的长方形外包细铁丝网的木质辐照箱内,辐照盒为大小约28 cm×11 cm×23 cm 的长方形塑料盒。辐射源:SM-G3608 4G 手机(三星电子有限公司产品)。鼠在笼中为自由体位,手机处于通话状态,手机频率为 900 MHz,功率密度为0.05 MW/cm2,比吸收率(specific absorption rate,SAR)为0.76 W/kg。使用电磁辐射测定仪(北京龙震天科技发展有限公司;型号:LZT6200)进行暴露前测试。手机置于辐照箱内大鼠头部的水平位置,距离大鼠耳部约7 cm。
1.3 听觉功能评价
电磁辐射暴露实验结束后,参照文献[5]所述方法分别测试对照组及辐射各组大鼠的听性脑干反应(auditory brainstem response,ABR)、40 Hz 听 觉 事件相关电位(auditory event-related potential,AERP)1 kHz 反应阈及听性稳态反应(auditory steady-state response,ASSR)1 kHz、2 kHz 和4 kHz 三个反应阈,以评价手机电磁辐射暴露对大鼠听觉功能的影响。
1.4 耳蜗组织制备及结构观察
听觉功能评价实验结束后,使用戊巴比妥(50 mg/kg)深度麻醉大鼠并采用断头法处死大鼠,打开听泡,完整取出颞骨并分离耳蜗,在25 倍显微镜下打开圆窗和卵圆窗,于蜗顶用耳科纤维手术器械开一小孔。在含2 mmol/L CaCl2的0.1 mol/L 二甲胂酸钠缓冲液(pH=7.4)中用2.5%戊二醛灌注耳蜗至鼓室及前庭阶,然后用同样的固定液浸泡1 h。磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤后,剥离蜗管骨壁,梯度浓度乙醇脱水后干燥,用离子溅射镀膜仪喷金镀膜,通过扫描电子显微镜(scanning electron microscope,SEM)观察耳蜗超微结构。光镜下观察标本则使用4%多聚甲醛灌注耳蜗并固定48 h,10 %乙二胺四乙酸(ethylenediamine tetra-acetic acid,EDTA)脱钙14 d(每隔48 h 更换一次溶液),PBS 洗涤后进行石蜡包埋,平行蜗轴切片(片厚4µm)。石蜡切片脱蜡至水,苏木精-伊红(hematoxylineosin,HE)染色后脱水封片,光镜下观察。
1.5 彗星实验检测耳蜗边缘细胞DNA 损伤
参照文献[6]所述方法进行耳蜗边缘细胞提取及培养。使用彗星实验检测试剂盒(美国Trevigen 公司)检测耳蜗边缘细胞DNA 损伤情况。根据制造商说明,制备耳蜗边缘细胞悬液(1×105cells/mL)后在37 ℃条件下将细胞悬液与低熔点琼脂糖混合,将混合物涂布在预处理的载玻片上4 ℃冷却30 min,用裂解液避光处理1 h 后进行凝胶电泳。乙醇脱水并干燥后,SYBR® Green 染色,荧光显微镜观察DNA 损伤程度,CASP 彗星分析软件分析尾部DNA 百分含量(tail DNA %)、尾矩(tail moment)及尾长(tail length)3 个指标,从而比较细胞DNA 损伤程度。
1.6 流式细胞仪检测电磁辐射对细胞凋亡的影响
使用FITC Annexin V 细胞凋亡检测试剂盒(美国BD Pharmingen 公司)检测耳蜗边缘细胞的凋亡情况。根据说明,将耳蜗边缘细胞以1×106cells/mL的浓度重悬于1×结合缓冲液中,然后取100 µL 溶液(即1×105个细胞)转移到5 mL 培养管内,加入5 µL FITC Annexin V 和5 µL 碘化丙啶后将细胞置于黑暗中室温(25 °C)孵育15 min。在每个试管中加入400 µL 1×结合缓冲液,在1 h 内通过流式细胞仪(美国Beckman Coulter 公司)进行分析。
1.7 流式细胞仪检测辐射后活性氧水平
活性氧(reactive oxygen species, ROS)检测试剂盒购自上海碧云天公司。根据说明,以1:1 000 的比例用无血清培养液稀释荧光染料2,7-二氯二氢荧光素、二乙酸酯(2,7-dichlorodi hydrofluorescein diacetate,DCFH-DA)至工作浓度为10 µmol/L,将耳蜗边缘细胞悬浮于稀释好的DCFH-DA 中,37 ℃培养20 min。每隔3~5 min颠倒混匀,使探针和细胞充分接触。使用无血清细胞培养液充分洗涤细胞,以去除未进入细胞内的DCFH-DA。收集细胞并使用流式细胞仪检测ROS 水平。
1.8 统计学处理
采用软件SPSS 20.0 对数据进行统计分析,符合正态分布的计量资料以表示。组间比较使用单因素方差分析及Turkey 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 手机电磁辐射对大鼠听觉功能的影响
通过检测大鼠ABR 反应阈、40 Hz AERP 1 kHz反应阈,以及ASSR 1 kHz、2 kHz 和4 kHz 反应阈以评价电磁辐射对大鼠听觉功能的影响。由表1 可见,随着辐射时间的增加,反应阈逐渐升高;各辐射组大鼠的听觉功能指标反应阈均高于对照组,差异均有统计学意义(P值均<0.05)。

表1 对照组与辐射各组大鼠的ABR、40 Hz AERP、ASSR 各反应阈 单位: dB HL
2.2 手机电磁辐射对大鼠耳蜗超微结构的影响
2.2.1 扫描电镜观察
对照组外毛细胞纤毛束呈V 型排列,且均排列整齐,未出现纤毛粘连、倒伏或脱落(图1A)。辐射6 h 组外毛细胞个别纤毛出现倒伏,其余结构未观察到特异性变化(图1B)。辐射12 h 组部分外毛细胞纤毛排列紊乱,第二、三排纤毛出现粘连、倒伏及脱落情况(图1C)。辐射24 h 组外毛细胞纤毛大部分出现粘连、倒伏或脱落,仅剩个别外毛细胞纤毛结构及排列保持完整(图1D)。

图1 对照组与辐射各组大鼠耳蜗扫描电镜图(×3500) A.对照组;B.辐射6 h 组;C.辐射12 h 组;D.辐射24 h 组。
2.2.2 光学显微镜观察
对照组大鼠耳蜗柯蒂器结构完整,靠蜗轴侧单排内毛细胞及其外侧外毛细胞排列整齐,细胞结构清楚,无明显肿胀或破裂(图2A)。辐射6 h 组,柯蒂器形态改变,螺旋隧道结构异常,个别外毛细胞排列不齐,其余结构未见明显异常(图2B)。辐射12 h 组,柯蒂器形态异常,螺旋隧道结构破坏,部分外毛细胞丢失,耳蜗内可见少量血细胞渗出(图2C)。辐射24 h 组,柯蒂器形态异常,螺旋隧道结构破坏且内外毛细胞均出现丢失,盖膜结构破坏,耳蜗内多个部位可见血细胞渗出(图2D)。

图2 对照组与辐射各组大鼠耳蜗HE 染色图(HE×40)A.对照组;B.辐射6 h 组;C.辐射12 h 组;D.辐射24 h 组。↑示血细胞渗出。
2.3 手机电磁辐射对耳蜗边缘细胞的影响
通过检测大鼠耳蜗边缘细胞DNA 损伤程度、细胞凋亡率及ROS 水平,评估手机电磁辐射对边缘细胞的影响。由表2 可见,各辐射组大鼠的耳蜗边缘细胞尾部DNA 百分含量(%)、尾矩(μm)和尾长(μm)与对照组比较差异均无统计学意义(P值均>0.05)。由图3A 可见,各辐射组大鼠的耳蜗边缘细胞凋亡率与对照组比较差异无统计学意义(P>0.05)。ROS水平检测结果表明,辐射6 h 组和辐射12 h 组大鼠耳蜗边缘细胞ROS 水平与对照组比较并未出现显著差异(P>0.05);而辐射24 h 组大鼠耳蜗边缘细胞ROS 水平高于对照组,差异具有统计学意义(P<0.001)(图3B)。

图3 手机电磁辐射对耳蜗边缘细胞的影响 A.对照组与辐射各组大鼠耳蜗边缘细胞的凋亡情况;B.对照组与辐射各组大鼠耳蜗边缘细胞的相对ROS 水平。与对照组比较,***示P <0.001,差异具有统计学意义。
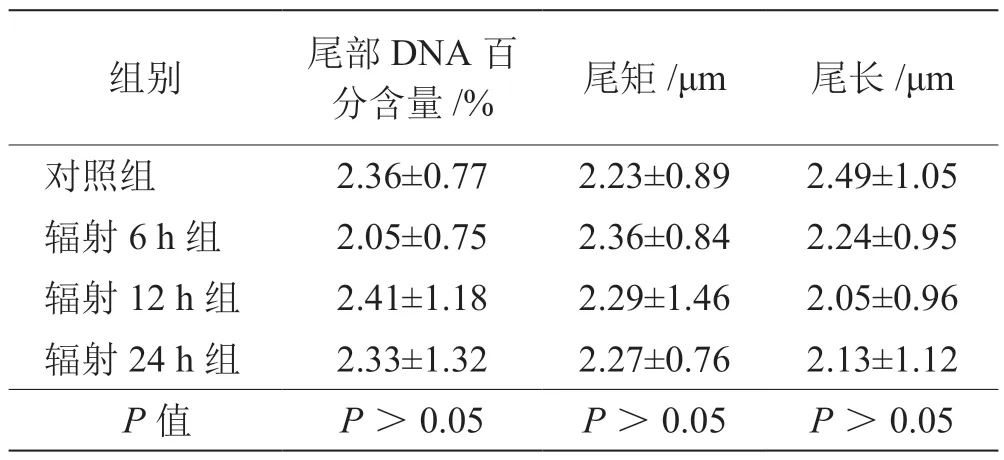
表2 对照组与辐射各组大鼠耳蜗边缘细胞彗星实验参数值
3 讨论
在手机通话过程中,双耳比身体其他部位更为靠近电磁辐射的来源,手机电磁辐射对双耳的潜在生物学效应可能比其他器官更为严重。耳蜗作为听觉信号的转换中枢,手机电磁辐射对其的相关影响仍然存在争议。不同的辐射频率和暴露时间可能会导致手机电磁辐射对耳蜗的影响表现出不同的结果。手机的全球移动通信系统通常采用900 MHz 或1800 MHz 频段,Seckin等[7]指出,连续进行1 800 MHz电磁辐射暴露(出生后21 d,1 h/d)可导致幼鼠耳蜗中段的细胞凋亡与坏死,且会造成毛细胞间的连接复合体受损、支持细胞肿胀及柱细胞染色质和细胞质凝聚;而Yang等[8]则报道,1 800 MHz 手机电磁辐射暴露24 h 并不会对SD 大鼠耳蜗边缘细胞的DNA 造成损伤,也不会导致边缘细胞凋亡率增加。高频的短期手机电磁辐射暴露对耳蜗的影响研究结果不尽相同。在本研究中,我们将大鼠暴露于900 MHz 手机电磁辐射,并设计为每组每日接受不同时长的手机电磁辐射,持续28 d,大大增加了辐射暴露周期,以模拟实际生活中成人长时间频繁使用手机通讯的状态。
ABR 通过记录电位响应短暂的听觉刺激,以评估听觉通路到达中脑水平的传导,可以量化听觉器官的活动和功能[9]。早期的一项研究指出,当人体头部暴露于手机电磁辐射15 min 后,ABR 的第五波(Ⅴ)出现延迟[10];但Gupta等[9]报道长期使用手机(1 年以上)并未观察到ABR 在病例组和对照组之间存在差异。而在本研究中,受手机电磁辐射暴露28 d 后大鼠的ABR 反应阈、40 Hz AERP 1 kHz 反应阈,以及ASSR 1 kHz、2 kHz 和4 kHz 反应阈均显著高于对照组,并且随着每日暴露时长的增加,反应阈值也出现升高。实验结果与Gupta等[9]的研究出现差异,可能是由于我们在长期辐射暴露的基础上考虑了每日辐射时长的因素,辐射频率和辐射周期的增加反映了手机电磁辐射对大鼠听觉功能的累积效应。
外毛细胞能够放大声音诱发的耳蜗机械反应,是内耳的“生物马达”,也是耳蜗中最容易受到伤害的结构之一[11]。哺乳动物的外毛细胞具有非常典型的“V”形静纤毛束,这些立体纤毛是机电转换的核心,将声音震动转换为可以由大脑解读的神经信号[12]。外毛细胞的丧失或功能衰竭是出现听力缺陷的主要原因。在本研究中,随着每日手机电磁辐射暴露时长的增加,扫描电镜结果显示大鼠耳蜗外毛细胞纤毛出现排列紊乱、倒伏、粘连甚至脱落的情况,与Seckin等[7]的研究结果一致。此外,光镜则更直观地观察到螺旋器形态变化及结构破坏,特别是辐射12 h组和辐射24 h 组耳蜗内出现了血细胞渗出。辐射对耳蜗损伤的机制之一可能是辐射引起血管纹及其中微小血管的损伤,导致血-迷路屏障的形态结构损害[13],可能出现血细胞渗出。此外,早期研究[14]发现,健康志愿者的耳部受手机辐射后其耳部皮肤血流量显著升高[14]。以上证据提示,频繁且长期暴露于手机电磁辐射后听觉功能下降可能与耳蜗出现病理性改变有关。
边缘细胞是血管纹的主要细胞成分之一,能够吸收中间细胞产生的钾离子,对耳蜗电位的产生和维持具有重要作用;边缘细胞的丢失或功能障碍导致耳蜗电位的减少[15]。我们的实验结果显示,无论每日接受的辐射时长如何,手机电磁辐射暴露28 d后各辐射组大鼠的耳蜗边缘细胞DNA 损伤情况及细胞凋亡率与对照组相比差异无统计学意义,与Yang等[8]的研究结果一致。众所周知,线粒体DNA 是三磷酸腺苷(adenosine triphosphate,ATP)的重要生物学来源,ROS 升高可损伤线粒体DNA,导致严重后果,包括呼吸链受损,ATP 合成降低,线粒体膜电位崩溃,甚至细胞凋亡[16]。由于边缘细胞比其他细胞含有更多的线粒体,它们特别容易受到ROS 的攻击,而内耳的氧化损伤是感音神经性耳聋的原因[17]。世界卫生组织(WHO)将氧化应激评定为与射频电磁辐射暴露最为相关的健康风险结果之一[18]。体外及体内研究[19-20]表明,手机电磁辐射会导致氧化应激水平上升。尽管在我们的研究结果中并未观察到边缘细胞DNA 损伤及凋亡增加,但辐射24 h 组大鼠的ROS 水平升高说明长时间手机电磁辐射的确会导致耳蜗边缘细胞的氧化应激,但更长期的手机电磁辐射暴露引起的耳蜗氧化应激是否会导致边缘细胞功能障碍或凋亡仍需进一步研究。此外,ROS 的过度产生导致外毛细胞损失是噪声性听力损失的原因之一[21],因此ROS 也与耳蜗超微结构,特别是外毛细胞的损伤有关,ROS 的激活可能是手机电磁辐射产生生物学效应的主要机制。
综上所述,长期手机电磁辐射暴露可引起SD大鼠耳蜗超微结构损伤,并导致听觉功能下降,但不足以引起耳蜗边缘细胞的DNA 损伤和凋亡,更长时间的辐射暴露会引起ROS 水平升高,而ROS 的激活可能是手机电磁辐射产生生物学效应的主要机制。
