急性髓细胞样白血病中PXK的表达及临床意义
2024-01-26梁萍胡溢洪杨雨旋何旻蕙韩语诚邹先琼
梁萍 胡溢洪 杨雨旋 何旻蕙 韩语诚 邹先琼
收稿日期:2023-07-10;修回日期:2023-09-07。
基金項目:国家自然科学基金项目(81760490);广西自然科学基金项目(2020GXNSFDA238026)。
作者简介:梁萍,实习生,主要从事肿瘤免疫研究。
* 通信作者:邹先琼,教授,主要从事分子免疫方面的研究。E-mail: zouxq019@glmc.edu.cn。
摘 要:含PX结构域的丝氨酸/苏氨酸激酶基因(PXK)是一种多组织广谱表达的基因,在免疫相关疾病中发挥了重要作用。本研究的目的是通过多个数据库中的多个生物信息学方法分析PXK与急性髓细胞样白血病(AML)发生发展的相关性。利用UALCAN 数据库在线分析 PXK 在 AML 不同亚型中的表达情况;利用LinkedOmics网站分析PXK表达水平与AML临床病理特征的相关性;利用Kaplan-Meier Plotter数据库分析PXK在AML中mRNA的表达情况,并评估PXK在AML中对生存率的影响;利用String和GEPIA数据库分析PXK互作蛋白网络及表达相关性;利用quanTIseq算法分析PXK基因与肿瘤浸润免疫细胞相关性;利用“xCell”R包分析PXK基因表达水平与多个免疫检查点表达相关性;利用Metascape数据库对PXK及其共表达基因进行功能富集分析,并预测其生物学功能。结果显示,PXK在多种癌症肿瘤组织中较正常组织高表达,在AML中的表达水平显著上调,并对AML患者的各临床病理特征、生存率及预后产生影响,但高表达PXK的AML患者预后较好。PXK在AML组织中高表达,并与AML的发生发展密切相关,可能是AML诊断、治疗效果及预后评估的重要指标之一。
关键词:急性髓细胞样白血病;PXK;表达;预后
中图分类号:Q811.4 文献标志码:ADOI:10.3969/j.issn.1007-7146.2023.05.008
The Expression and Clinical Significance of PXK in Acute Myeloid Leukemia
LIANG Ping1, 2a, HU Yihong1, 2b, YANG Yuxuan1, 2a, HE Minhui1, 2b, HAN Yucheng1, 2b, ZOU Xianqiong1, 2b*
(1. Stomatological Hospital Affiliated to Guilin Medical University, Guilin 541004, China; 2. Guilin Medical University a. College of Intelligent Medicine and Biotechnology; b. School of Basic Medicine, Guilin 541199, China)
Abstract: PX domain containing serine/threonine kinase (PXK) is a multitissue, broad-spectrum expressed gene that plays an important role in immune-related diseases. The objective of this study was to analyze the relationship between PXK and the development of acute myelocytic leukemia (AML) by using bioinformatics methods in multiple databases. The UALCAN database was utilized to conduct an online analysis of PXK expression in various subtypes of AML. LinkedOmics was utilized to analyze the correlation between the expression level of PXK and the clinicopathologic features of AML. The Kaplan-Meier Plotter database was used to analyze the mRNA expression of PXK in AML and to evaluate the effect of PXK on survival in AML. PXK interacting protein network and expression correlation were analyzed by String and GEPIA databases. The correlation between PXK gene and tumor infiltrating immune cells was analyzed by quanTIseq algorithm, and “xCell” R package was used to analyze the correlation between PXK gene expression and multiple immune checkpoints. PXK and its co-expressed genes were functionally enriched in the Metascape database to anticipate their biological roles. The findings revealed that PXK was highly expressed in various cancer tumor tissues when compared to normal tissues, and the expression level of PXK in AML was significantly up-regulated, which had an effect on the clinicopathological features, survival rate, and prognosis of AML patients, whereas the prognosis of AML patients with high PXK expression was better. PXK is highly expressed in AML tissues and is closely related to the initiation and progression of AML, which may be one of the important indicators for the diagnosis, treatment and prognosis evaluation of AML.
Key words: acute myeloid leukemia; PXK; expression; prognosis
(Acta Laser Biology Sinica, 2023, 32(5): 450-459)
急性髓细胞样白血病(acute myelocytic leukemia,AML)是一种特征为骨髓谱系异常分化的母细胞的克隆扩张的骨髓恶性疾病[1]。未成熟髓细胞增殖的后果包括未成熟祖细胞(母细胞)的积累、正常造血功能的受损,从而导致严重感染、贫血和出血[2]。每年的AML患者新增数量可达20 050例,易复发导致高死亡率[3],其凶险程度可见一斑。成人急性白血病最常见的形式是AML[4],其生存期最短,5年生存率为24%,其病因是异质性的,其中部分患者与之前接受治疗、从事职业或暴露于环境中的DNA损伤药物有关,但大多数AML病例的病因仍不明确[1]。目前,大多数肿瘤都采用手术和放化疗的方法。AML的标准诱导治疗方案是“3+7”,即蒽环类药物结合阿糖胞苷,对于挽救性治疗,可以选择靶向治疗联合强化疗方案[5]。然而,放化疗极易损伤患者周围健康的组织,并且影响患者的身心健康。
含PX结构域的丝氨酸/苏氨酸激酶(PX domain containing serine/threonine kinase,PXK)是斯洛布家族(slob family)中一类相对分子质量较大的蛋白,分子质量约为93 248 Da,在人類中其编码基因定位于3p14.3,在多种组织中表达,包括大脑、心脏、骨骼肌和外周血淋巴细胞[6]。PXK编码包含N端PX结构区的578个氨基酸残基,中心为蛋白激酶样结构域和C端WH2结构域[7]。PXK参与配体诱导的表皮生长因子(epidermal growth factor receptor,EGFR)的内化和降解[8]。PXK也可以结合和调节大脑Na、K-ATP酶亚基ATP1B1和ATP1B3,参与调节电兴奋性和突触传输[9]。PXK与多种自身免疫性疾病有相关性,是重要的免疫疾病标志物。本研究的目的在于通过探究PXK对急性髓系白血病的发生发展作用,为AML的治疗提供新的思路和方法。
1 材料与方法
1.1 PXK在AML及在其临床亚型中的表达分析
使用Kaplan-Meier Plotter数据库分析比较PXK基因在正常外周血样本和AML患者外周血样本中 mRNA 的表达量[10]。通过 UALCAN 数据库(http://ualcan.path.uab.edu)获得急性髓系白血病 TCGA 数据,AML 总例数为171例,其中 M0(n=16)、M1(n=42)、M2(n=39)、M3(n=16)、M4(n=35)、M5(n=18)、M6(n=2)、M7(n=3)。通过 UALCAN 数据库在线分析 PXK 在 AML 不同亚型中的表达情况。
1.2 PXK的表达与临床病理特征之间的关系分析
利用LinkedOmics网站分析PXK的表达水平与AML各临床病理特征之间的关系[11]。
1.3 PXK在AML中相关性基因分析
利用UALCAN数据库对PXK的相关性基因进行分析,选取与PXK正相关的前50个基因。采用String数据库(https://cn.string-db.org/)分析PXK信号转导通路,构建与其相互作用的蛋白网络,得到PXK的紧密相关基因。运用 GEPIA数据库进行相关性分析验证[12]。
1.4 PXK在AML中免疫细胞浸润水平分析
应用quanTIseq算法分析PXK在AML中的免疫细胞浸润情况[13]。基于反卷积算法的quanTIseq可以利用bulk samples的RNA_seq数据预测肿瘤样本中不同种类免疫细胞的组成,支持包括B细胞、NK细胞、巨噬细胞、T细胞等11种类型的免疫细胞浸润水平分析[14]。鉴于PXK表达与免疫浸润的关联,我们接下来通过xCell R包分析研究PXK表达与免疫检查点基因表达之间的相关性。
1.5 PXK的表达量与AML患者预后相关性分析
运用Kaplan-Meier Plotter数据库分析PXK的表达水平与AML患者的预后关系[15]。通过Kaplan-Meier Plotter可以检索所感兴趣的基因分析患者生存数据,进而了解患者的生存分析图形和预后信息[16]。
1.6 PXK及其共表达基因的基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路富集分析
Metascape是一款涵盖多种物种的基因组数据和生物信息学数据的基因功能注释分析工具,可以快速进行大规模的生物信息学分析[17]。筛选得出PXK的主要相关基因之后,采用Metascape数据库对靶基因PXK进行基因本体(gene ontology,GO)富集分析,注释靶基因的生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF),确定其参与的主要代谢通路并进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genome,KEGG)通路富集分析[18]。
1.7 统计学方法
AML与正常外周血样本中PXK基因表达,以及在AML各亚型(M0~M7)中的表达差异采用t检验。PXK与主要相互作用基因的相关性和PXK基因表达与患者预后关系采用Kaplan-Meier模型进行分析。PXK表达水平与免疫细胞浸润水平的相关性采用Spearman 秩相关检验。所用数据采用在线统计学分析,*P<0.05,**P<0.01,***P<0.001,P<0.05被认为差异具有统计学意义。
2 结果与分析
2.1 PXK在AML及在其临床亚型中的表达分析
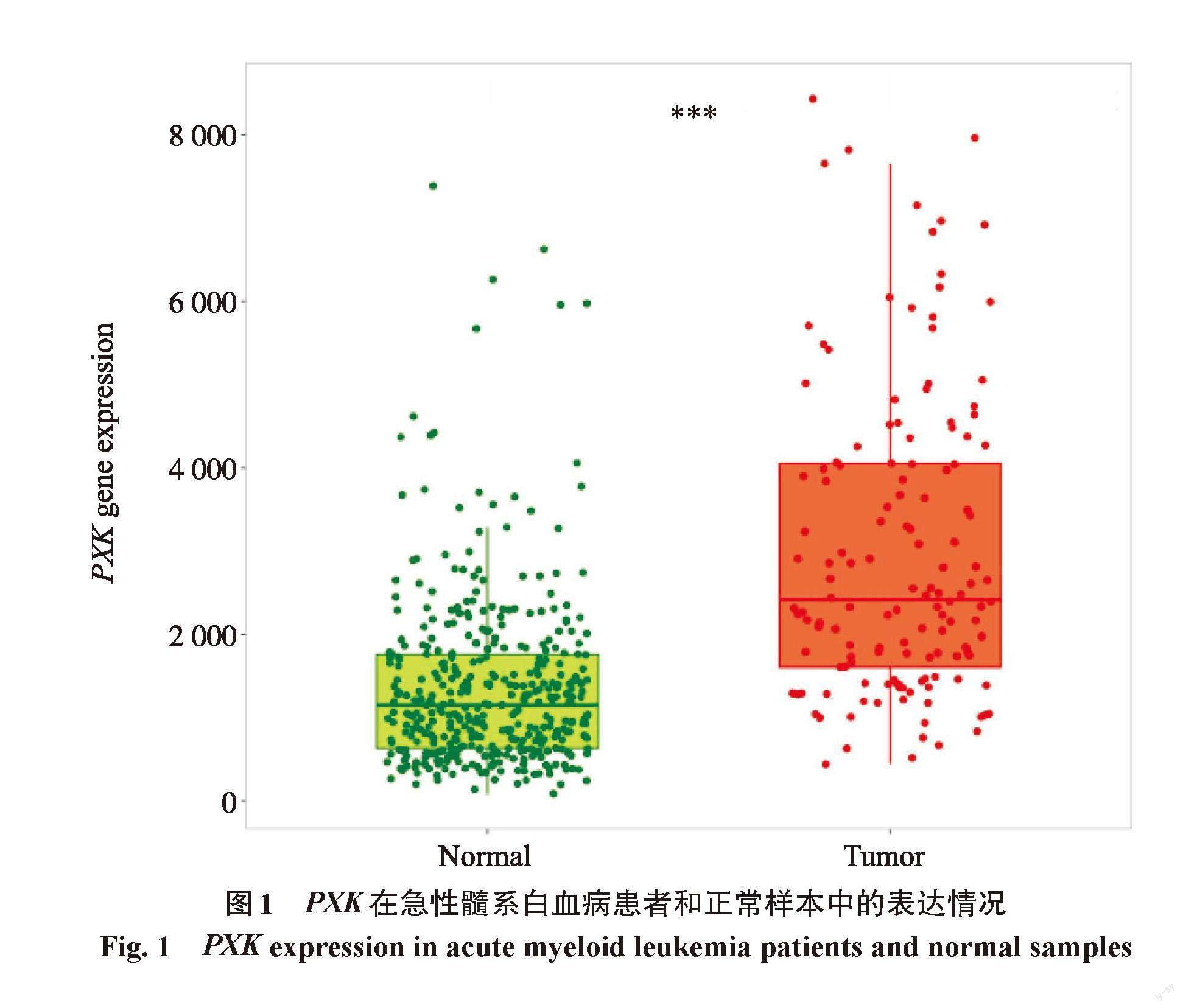
Kaplan-Meier Plotter数据库分析结果表明,与正常外周血样本相比,PXK基因在AML样本中明显高表达,且差异具有统计学意义(P<0.05)(图1)。
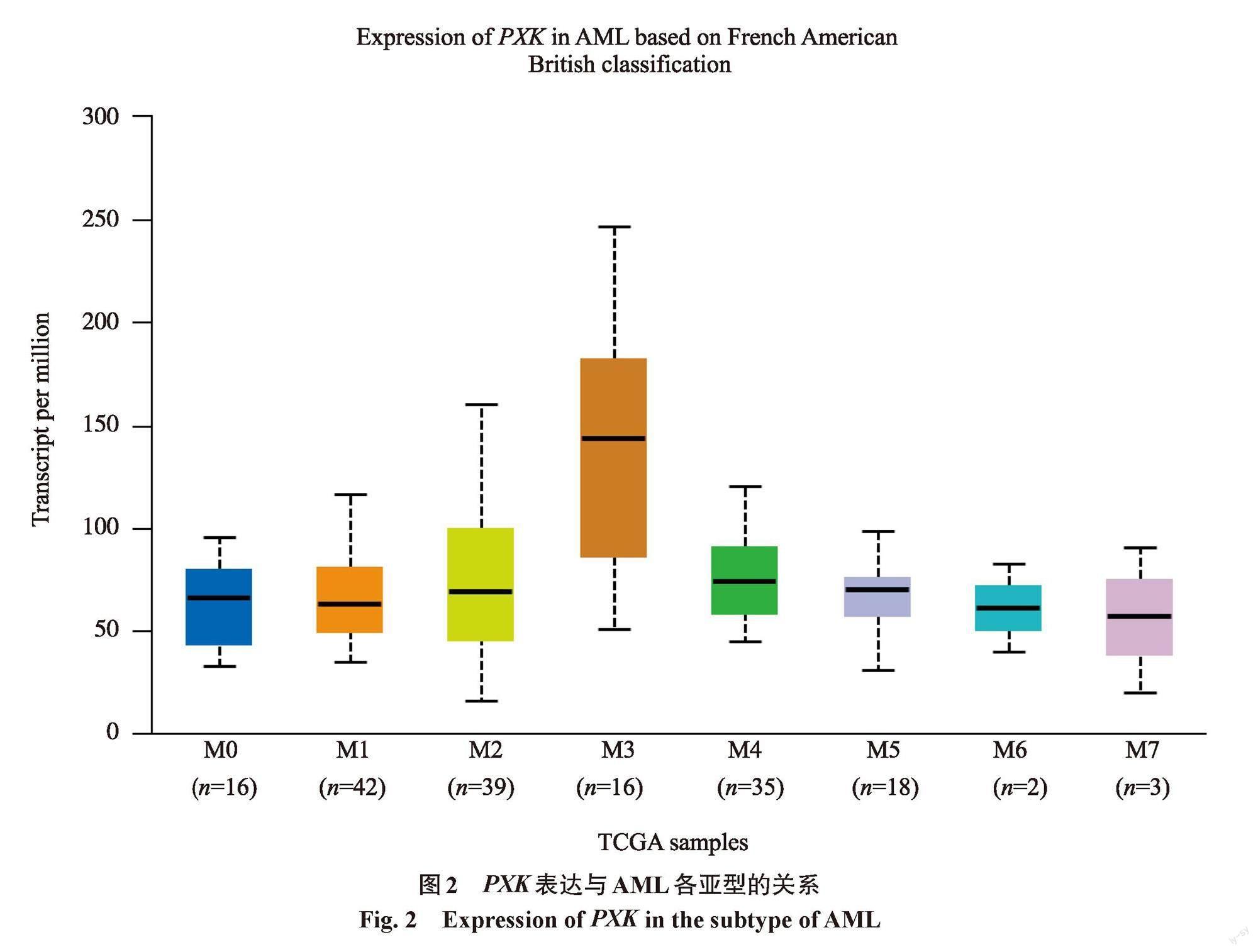
利用UALCAN数据库分析PXK在AML不同临床亚型中表达情况,PXK在M3和 M2中高表达,在M6和M7中表达最低。其中,M0-vs-M2(P=4.661×10-2),M0-vs-M3(P=0.008×10-2),M0-vs-M4(P=4.209×10-2),M1-vs-M3(P=0.058×10-2),M2-vs-M3(P=0.036×10-2),M3-vs-M4(P=0.051×10-2),M3-vs-M5(P=0.011×10-2),M3-vs-M7(P=2.821×10-2),表达差异具有统计学意义 (图 2)。
2.2 PXK的表达与临床病理特征之间的关系分析
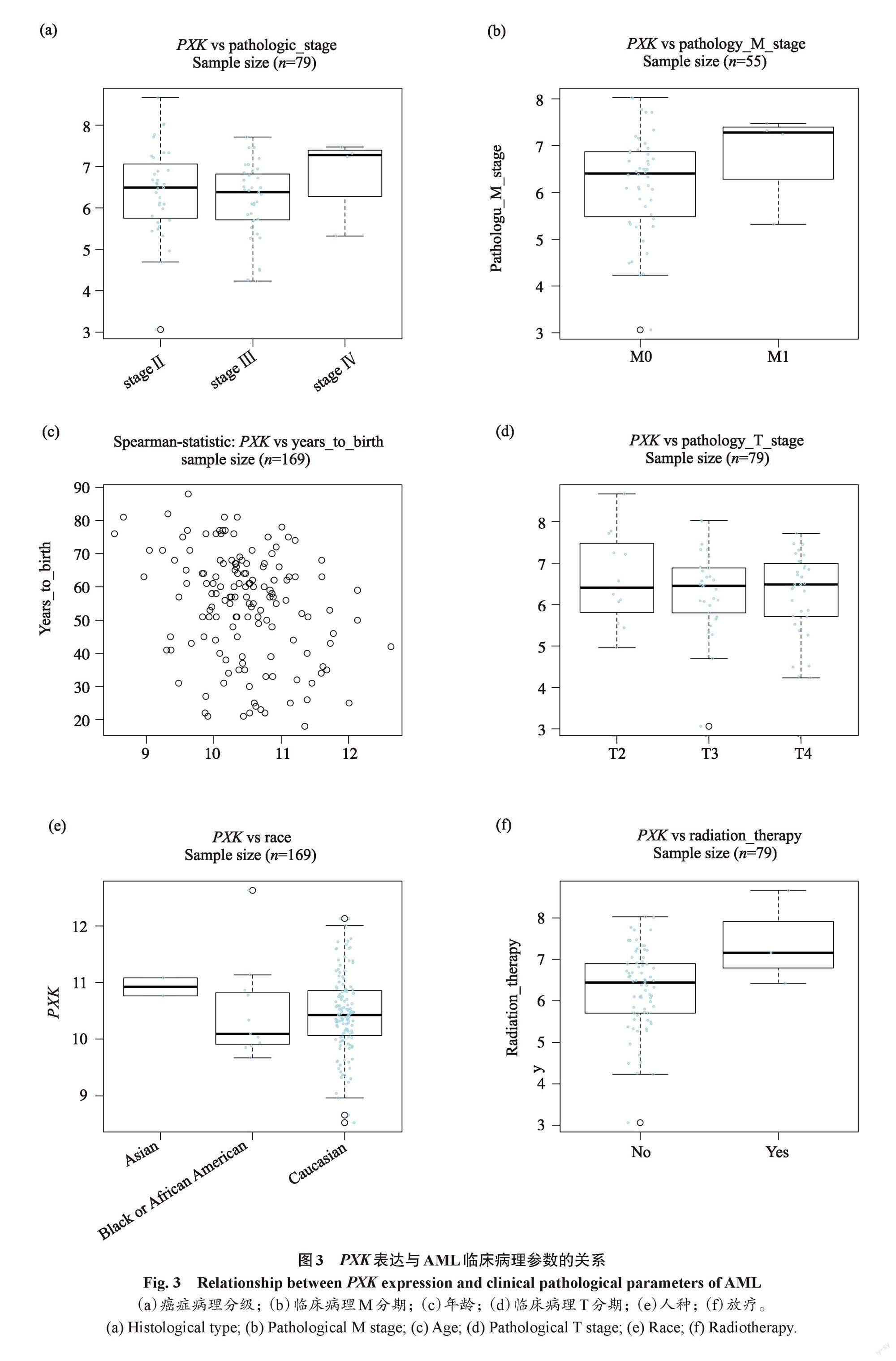
PXK表达与AML的临床病理分级、临床M分期、年龄、人种等相关。PXK在不同的病理分级中表现显著,stage IV期显著高于stage Ⅱ期、stage Ⅲ期(图3a)。在临床M分期中,M1分期的PXK表达较其他分期组显著提高(图3b)。PXK的表达随着患者的年龄增大而增高(图3c)。在临床T分期中,T2分期的PXK表达显著高于其他分期组(图3d)。在全球三大人种中,PXK在亚洲人种的表达显著高于其他人种(图3e)。未进行放疗的患者中PXK的表達量低于放疗患者的表达量(图3f)。PXK表达与AML的种族(P=2.046)、年龄(P=-5.285×10-2)、放疗(P=1.327×10-1)、S分期(P=2.427)、M分期(P=1.614×10-1)、T分期(P=4.755×10-1)相关,差异具有统计学意义(P<0.05)。
2.3 PXK与AML中相互作用蛋白的关系
采用String数据库分析获得与PXK互作的蛋白网络,蛋白质互作作用(protein protein interaction,PPI)富集P=2.81×10-5,差异具有统计学意义(图4)。在PPI网络中分析得出与PXK主要相互作用的有酪氨酸蛋白激酶BLK (BLK proto-oncogene, Src family tyrosine kinase,BLK)、核糖核酸酶P蛋白亚基p14 (ribonuclease P/MRP subunit p14,RPP14)、酪氨酸蛋白磷酸酶非受体22型 (protein tyrosine phosphatase non-receptor type 22,PTPN22)、含PHD和RING 指形结构域的蛋白质1 (PHD and ring finger domains 1,PHRF1)和UDP-N乙酰葡糖胺:betaGalβ-1,3-N-乙酰葡糖胺基转移酶2 (UDP-GlcNAc:betaGal beta-1,3-N-acetylglucosaminyltransferase 2,B3GNT2)。同时利用GEPIA数据库对PXK与BLK、RPP14、PTPN22、PHRF1和B3GNT2分别进行相关性分析,结果显示,PXK与BLK、PTPN22、RPP14之间有显著的相关性,PXK vs BLK(P=0.045),PXK vs PTPN22(P=1.8×10-5),PXK vs RPP14(P=0.02)(图5)。
2.4 PXK基因与免疫细胞浸润水平的关系
quanTIseq分析结果显示,PXK基因表达水平与多种免疫细胞类型,包括B细胞、CD8+T细胞、CD4+T细胞和巨噬细胞,存在显著的相关性(P<0.05)。另外,我们发现,在急性髓系白血病中,PXK基因表达水平与CD8+T细胞的浸润程度呈现显著的正相关性(P<0.001),有统计学意义(图6)。
在xCell R包分析中,我们选择了38个常见的免疫检查点基因, 横坐标代表不同肿瘤组织,纵坐标代表不同的免疫浸润评分,不同颜色代表相关系数,负值代表负相关,正值代表正相关,相关性越强颜色越深。有趣的是,我们发现在 AML中,PXK的表达与15个免疫检查点标志物显著相关,如CD8+T细胞、CD4+T细胞、B细胞等。这些结果表明,PXK可能在AML的免疫浸润和免疫逃逸中起着至关重要的作用。
2.5 PXK的表达与AML患者预后的关系
运用Kaplan-Meier Plotter数据库对734个样本进行总生存期(overall survival,OS)预后分析,对353个样本进行无病生存期(event free survival,EFS)预后分析,得出PXK低表达组无病生存时间及总体生存时间更短,预后更差,P<0.05具有统计学意义(图7)。
2.6 PXK共表达基因的GO注释分析和KEGG通路富集分析
为阐明PXK的作用机制,通过Metascape数据库对PXK共表达基因进行了GO及KEGG富集分析。结果表明,PXK共表达基因显著参与对雌二醇的反应、动作电位、糖稳态、行为白细胞迁移、蛋白同源寡聚化、囊泡介导的转运调节、细胞-细胞连接组装、内分泌系统发育、激素介导的信号通路、蛋白质成熟、髓系细胞分化的调节、对伤害反应的正向调节、对无机物的反应以及固有免疫反应等(图8)。此外,PXK共表达基因也在在响应细胞周期调控、DNA损伤修复和细胞凋亡过程中显著富集(图8)。
3 讨论
有关数据表明,成年人最常见的急性白血病类型是急性髓系白血病,发病率高达75%~80%。成年AML患者(18~60岁)5年后的总体生存率约为 40%,老年AML患者(>60岁)的总体生存率仅为10%左右[19]。急性髓系白血病是目前全球发病率和死亡率较高的恶性肿瘤之一,其复杂的分子机制和不同亚型异质性大导致传统的放疗以及诱导方案无法给患者带来最优治疗效果。因此,通过寻找 AML发生发展的关键分子或靶点,深入探讨PXK的发病机制,对于早期干预AML的发生发展以及判断预后,从而降低急性髓系白血病患者的发病率和死亡率具有重要意义。
PXK是斯洛布家族中重要的一员,介导与肌动蛋白相互作用、调节质膜Na+-K-ATP酶参与调节电兴奋性和突触传递过程、参与EGFR的内化和降解以及信号转导等重要生物学过程[20]。随着对PXK的深入研究,越来越多的研究表明,其与免疫疾病的发生发展有着密不可分的联系。PXK在恶性肿瘤中表现出一定的作用,例如,王信等[21]研究发现,PXK mRNA在系统性红斑狼疮(systemic lupus erythematosus,SLE)患者外周血白细胞中表达上调,与患者的抗SmD1抗体的产生及 C3、C4的下降有一定相关性。对系统性硬化症(systemicscleroderma,SSc)的研究发现,PXK蛋白激酶区域与另一个锌指基因1(JAZF1)并列编码一种核蛋白,并作为转录抑制因子发挥作用,与体内的胶原沉积和骨形态发生有关,从而影响皮肤疾病(如SSc和SLE)的关键过程[22]。在不明原因复发性妊娠丢失(unexplained recurrent pregnancy loss,URPL)研究中发现,子宫内膜异位症患者卵巢的卵母细胞转录组与健康供体的卵母细胞核的转录组进行比较时,PXK表达水平显著下调[23]。PXK与SLE的自身抗体产生相关[24],而抗磷脂抗体与URPL患者高发病率有关,因此推测,PXK可能通过自身免疫影响不孕,卵巢早衰等与URPL相关联。此外,PXK基因在肾嫌色细胞癌、弥漫性大B细胞淋巴瘤、皮肤黑素瘤、肝细胞肝癌、胃癌的表达水平均高于邻近癌旁组织,PXK与AML预后分析和肿瘤突变负荷有显著相关性[25]。恶性细胞生长的特征是由突变或异常的外部信号传导引起的正常细胞内信号传导的破坏。磷酸肌醇3-激酶(PI3K)/蛋白激酶B (AKT)/哺乳动物雷帕霉素(mTOR)途径的靶标(PI3K/AKT/mTOR途径)在AML中异常上调,是造血细胞的核心,并调节增殖、分化和存活等关键功能[26]。使用特异性抑制剂靶向 PI3K/AKT/mTOR 通路可抑制白血病细胞生长[27]。抑制PI3K/AKT/NF-κB通路的活化可以抑制AML细胞的恶性生物学行为,进而诱导细胞程序性死亡[28]。然而,关于PXK在AML中的作用较少有报道。本研究通过综合多个在线数据库和在线工具的生物信息学方法,对PXK在AML中的表达情况及其发生发展进行了分析,为AML在临床上的诊断及治疗提供了新的思路。
本研究结果表明,PXK在多种恶性肿瘤中表达异常,在AML肿瘤组织中高表达,并与临床病理分期呈负相关关系,有利于PXK患者生存。PXK 在 AML M3 和 M2亚型中高表达,在 M6 和 M7 中低表达,说明PXK高水平表达或具有缓解AML恶化程度的功能。进一步分析发现,PXK表达与急性髓系细胞样白血病的临床病理分级、临床M分期、年龄、人种显著相关。除了阐明PXK在AML中的临床意义,本研究还进一步分析了与PXK相关的基因和蛋白质的相互作用,同时验证在急性髓系细胞样白血病中PXK主要相关基因,结果表明,PXK基因与BLK、PTPN22和RPP14具有显著相关性。Uniport数据库显示,BLK是参与B淋巴细胞发育、分化和信号传导的一种非受体酪氨酸激酶。研究表明,BLK基因参与PI3K/AKT/NF-κB信号通路的激活及细胞周期信号的增强[29],且BLK多态性与系统性硬化症[30]、类风湿关节炎易感性有显著相关性[31]。PTPN22作为 T 细胞受体信号传导的负调节因子,可以正向调节Toll样受体诱导的1型干扰素产生,并促进由1型干扰素介导的宿主抗病毒反应。PTPN22通过T细胞中的14-3-3τ激活PI3K通路[32]。PTPN22基因被抑制后,通過AKT和细胞外信号调节激酶(ERK)信号通路,可引起T细胞白血病细胞系(Jurkat)凋亡的发生[33]。PTPN22基因的变异与系统性红斑狼疮[34]和类风湿性关节炎易感性有关[35]。RPP14是核糖核酸酶P的成分,核糖核酸酶复合物通过切割其5'末端产生成熟的tRNA。BLK和PTPN22基因在PI3K/AKT/NF-κB信号通路的激活过程中起着重要作用,而PXK的多态性与系统性红斑狼疮、系统性硬化症相关,与BLK、PTPN22、RPP14基因显著相关,提示PXK可能通过PI3K/AKT/NF-κB信号通路介导AML细胞增殖、侵袭和转移,从而影响AML的发生发展。PXK作为一种免疫相关性细胞因子,与CD4+T细胞、CD8+T细胞、B细胞、巨噬细胞的表达呈正相关,与CD8+T细胞、CD4+T细胞、B细胞等15个免疫检查点标志物相关(P<0.005),表明PXK可调控免疫细胞的活性,在AML的免疫浸润和免疫逃逸中或起着至关重要的作用。在OS和EFS预后分析中发现,高表达 PXK 组的 AML 患者较低表达组患者预后差,说明PXK具有作为预测 AML 患者预后的新的生物标志物的潜力。PXK及其相关基因主要富集在对雌二醇的反应、动作电位、糖稳态、行为白细胞迁移、蛋白同源寡聚化,这些基因在响应细胞周期调控、DNA损伤修复和细胞凋亡过程中显著富集。这提示这些基因可能与细胞周期调控相关的蛋白质及细胞黏附和迁移相关的蛋白质相互作用,从而介导AML细胞增殖、侵袭和转移等过程。
综上所述,本研究揭示了PXK的低水平表达与AML的恶性程度以及患者的不良预后显著相关,推测 PXK对于AML的发生发展具有抑制作用,对于预测肿瘤的疗效以及预后具有重要意义。PXK可能是一个潜在的肿瘤预后生物标志物。此外,PXK可能通过PI3K/AKT/NF-κB信号通路抑制AML的发生发展。本研究为探讨PXK在AML中的具体作用机制提供了新的方向,为PXK作为AML预防或治疗药物应用于临床治疗提供了一定的理论基础。然而,本研究中采用的生物信息学方法显示的是基于不同的数据库分析得到的结果,由于不同数据库收集的样本量不同,分析结果也不尽相同。PXK在肿瘤中的作用机制尚不清楚,仍需要进一步深入研究。
参考文献(References):
[1] SHORT N J, RYTTING M E, CORTES J E. Acute myeloid leukaemia [J]. The Lancet, 2018, 392(10147): 593-606.
[2] AD?S L, ITZYKSON R, FENAUX P. Myelodysplastic syndromes [J]. The Lancet, 2014, 383(9936): 2239-2252.
[3] MA L, WANG J, ZHANG Y, et al. BRD4 PROTAC degrader MZ1 exerts anti-cancer effects in acute myeloid leukemia by targeting c-Myc and ANP32B genes [J]. Cancer Biology & Therapy, 2022, 23(1): 1-15.
[4] ARBER D A. The 2016 WHO classification of acute myeloid leukemia: what the practicing clinician needs to know [J]. Seminars in Hematology, 2019, 56(2): 90-95.
[5] TIAN C, LI Y Y, HU D Z. Advances of targeting therapy in acute myeloid leukemia [J]. Journal of Experimental Hematology, 2018, 26(4): 1253-1256.
[6] ZOU X, QIU G, CHEN C, et al. Expression pattern and subcellular localization of five splice isoforms of human PXK [J]. International Journal of Molecular Medicine, 2005, 16(4): 701-707.
[7] PAUNOLA E, MATTILA P K, LAPPALAINEN P. WH2 domain: a small, versatile adapter for actin monomers [J]. FEBS Letters, 2002, 513(1): 92-97.
[8] TAKEUCHI H, TAKEUCHI T, GAO J, et al. Characterization of PXK as a protein involved in epidermal growth factor receptor trafficking [J]. Molecular and Cellular Biology, 2010, 30(7): 1689-1702.
[9] PEDERSEN N M, RAIBORG C, BRECH A, et al. The PtdIns3P-binding protein Phafin 2 mediates epidermal growth factor receptor degradation by promoting endosome fusion [J]. Traffic, 2012, 13(11): 1547-1563.
[10] LI M, ZHAO H. Bioinformatics analysis of the expression and clinical significance of the NUP210 gene in acute myeloid leukaemia [J]. International Journal of Hematology, 2022, 27(1): 456-462.
[11] GU Y, CHU M Q, XU Z J, et al. Comprehensive analysis of SPAG1 expression as a prognostic and predictive biomarker in acute myeloid leukemia by integrative bioinformatics and clinical validation [J]. BMC Medical Genomics, 2022, 15(1): 38.
[12] 楊小燕, 李鹏, 吴西军, 等. RUNX3基因在急性髓系白血病中的表达及预后意义[J]. 现代生物医学进展, 2020, 20(2): 313-318, 323.
YANG Xiaoyan, LI Peng, WU Xijun, et al. Expression and prognostic significance of RUNX3 gene in acute myeloid leukemia [J]. Progress in Modern Biomedicine, 2020, 20(2): 313-318, 323.
[13] XIE Q, TANG Z, LIANG X, et al. An immune-related gene prognostic index for acute myeloid leukemia associated with regulatory T cells infiltration [J]. International Journal of Hematology, 2022, 27(1): 1088-1100.
[14] 齊鑫, 陈圣伦, 左嘉晨, 等. 嗜乳脂蛋白基因在肺腺癌中的功能及预后作用: 多组学融合与生存分析[J]. 电子科技大学学报, 2021, 50(6): 828-836.
QI Xin, CHEN Shenglun, ZUO Jiachen, et al. Function and prognostic role of lactophilin gene in lung adenocarcinoma: multi-omics fusion and survival analysis [J]. Journal of University of Electronic Science and Technology of China, 2021, 50(6): 828-836.
[15] 张湘豫, 张艳群, 卢梦云, 等. 多数据库分析肝细胞癌中GLTPD2的表达及临床意义[J]. 激光生物学报, 2022, 31(1): 27-35.
ZHANG Xiangyu, ZHANG Yanqun, LU Mengyun, et al. Multi-database analysis of GLTPD2 expression and clinical significance in hepatocellular carcinoma[J]. Acta Laser Biology Sinica, 2022, 31(1): 27-35.
[16] NIE L, ZHANG Y, YOU Y, et al. The signature based on seven genomic instability-related genes could predict the prognosis of acute myeloid leukemia patients [J]. International Journal of Hematology, 2022, 27(1): 840-848.
[17] 杨馨悦, 叶嘉民, 杨帆, 等. 生物信息学分析揭示主动脉瘤潜在的诊断标志物和发病机制 [J]. 岭南心血管病杂志, 2022, 28(2): 151-159.
YANG Xinyue, YE Jiamin, YANG Fan, et al. Bioinformatics analysis reveals potential diagnostic markers and pathogenesis of aortic aneurysms [J]. South China Journal of Cardiovascular Diseases, 2022, 28(2): 151-159.
[18] EVANGELISTA J E, XIE Z, MARINO G B, et al. Enrichr-KG: bridging enrichment analysis across multiple libraries [J]. Nucleic Acids Research, 2023, 51(W1): W168-W179.
[19] SHALLIS R M, WANG R, DAVIDOFF A, et al. Epidemiology of acute myeloid leukemia: recent progress and enduring challenges [J]. Blood Reviews, 2019, 36: 70-87.
[20] ENGQVIST-GOLDSTEIN A E, DRUBIN D G. Actin assembly and endocytosis: from yeast to mammals [J]. Annual Review of Cell and Developmental Biology, 2003, 19: 287-332.
[21] 王信, 陈琳洁, 李志军, 等. PXK mRNA在系统性红斑狼疮患者外周血白细胞中的表达 [J]. 蚌埠医学院学报, 2014, 39(1): 30-33, 37.
WANG Xin, CHEN Linjie, LI Zhijun, et al. Expression of PXK mRNA in peripheral blood leukocytes from patients with systemic lupus erythematosus [J]. Journal of Bengbu Medical College, 2014, 39(1): 30-33, 37.
[22] MARTIN J E, ASSASSI S, DIAZ-GALLO L M, et al. A systemic sclerosis and systemic lupus erythematosus pan-meta-GWAS reveals new shared susceptibility loci [J]. Human Molecular Genetics, 2013, 22(19): 4021-4029.
[23] FERRERO H, CORACH?N A, AGUILAR A, et al. Single-cell RNA sequencing of oocytes from ovarian endometriosis patients reveals a differential transcriptomic profile associated with lower quality [J]. Human Reproduction, 2019, 34(7): 1302-1312.
[24] JIN J, CHOU C, LIMA M, et al. Systemic sclerosis is a complex disease associated mainly with immune regulatory and inflammatory genes [J]. Open Rheumatology Journal, 2014, 8: 29-42.
[25] 段福慧, 王光明. 腫瘤突变负荷与免疫细胞浸润联合分析在胃癌预后评估中的临床意义 [J]. 海南医学, 2022, 33(24): 3129-3135.
DUAN Fuhui, WANG Guangming. Clinical significance of combined analysis of tumor mutational load and immune cell infiltration in the prognostic assessment of gastric cancer [J]. Hainan Medical Journal, 2022, 33(24): 3129-3135.
[26] NEPSTAD I, HATFIELD K J, GRONNINGSAETER I S, et al. The PI3K-AKT-mTOR signaling pathway in human acute myeloid leukemia (AML) cells [J]. International Journal of Molecular Sciences, 2020, 21(8): 2907.
[27] DOS SANTOS C, RECHER C, DEMUR C, et al. The PI3K/AKT/mTOR pathway: a new therapeutic target in the treatment of acute myeloid leukemia [J]. Bulletin Du Cancer, 2006, 93(5): 445-447.
[28] LIU Y Q, SHEN J Z, YIN Y, et al. The effects and regulatory mechanism of targeting CXC chemokine receptor 1/2 combined with Ara-C on the malignant biological behaviors of U937 cells of acute myeloid leukemia [J]. Journal of Experimental Hematology, 2023, 31(2): 364-376.
[29] ANBAZHAGAN K, RABBIND SINGH A, ISABELLE P, et al. Human pre-B cell receptor signal transduction: evidence for distinct roles of PI3kinase and MAP-kinase signalling pathways [J]. Immunity, Inflammation and Disease, 2013, 1(1): 26-36.
[30] GOURH P, AGARWAL S K, MARTIN E, et al. Association of the C8 orf13-BLK region with systemic sclerosis in North-American and European populations [J]. Journal of Autoimmunity, 2010, 34(2): 155-162.
[31] HUANG H, HUANG S C, HUA D J, et al. Interaction analysis between BLK rs13277113 polymorphism and BANK1 rs3733197 polymorphism, MMEL1/TNFRSF14 rs3890745 polymorphism in determining susceptibility to rheumatoid arthritis [J]. Autoimmunity, 2017, 50(7): 403-408.
[32] BAI B, WANG T, ZHANG X, et al. PTPN22 activates the PI3K pathway via 14-3-3τ in T cells [J]. FEBS Journal, 2023, 290(18): 4562-4576.
[33] BAGHBANI E, BARADARAN B, PAK F, et al. Suppression of protein tyrosine phosphatase PTPN22 gene induces apoptosis in T-cell leukemia cell line (Jurkat) through the AKT and ERK pathways [J]. Biomed Pharmacother, 2017, 86: 41-47.
[34] EID R, HAMMAD A, ABDELSALAM M, et al. Tumor necrosis factor receptor II and PTPN22 genes polymorphisms and the risk of systemic lupus erythematosus in Egyptian children [J]. Lupus Science & Medicine, 2021, 30(9): 1449-1458.
[35] BUDLEWSKI T, SARNIK J, GALITA G, et al. SNP in PTPN22, PADI4, and STAT4 but Not TRAF1 and CD40 increase the risk of rheumatoid arthritis in polish population [J]. International Journal of Molecular Sciences, 2023, 24(8): 7586.
