辐射诱变筛选高生长速率的渐狭蜡蚧菌及其生物学特性研究
2024-01-26段珂屹刘安陈亮武小芬齐慧张祺玲王振邓明王克勤刘素纯
段珂屹 刘安 陈亮 武小芬 齐慧 张祺玲 王振 邓明 王克勤 刘素纯


收稿日期:2023-05-04;修回日期:2023-09-01。
基金项目:国家重点研发计划项目(2021YFE0111200-2);湖南省农业科技创新项目(2022CX119)。
作者简介:段珂屹,硕士研究生。
* 通信作者:刘素纯,教授,主要从事微生物发酵及安全控制的研究,E-mail: liusuchun@.163.com;
王克勤,研究员,主要从事生物资源高效利用及生物炼制技术的研究,E-mail: wkq6412@.163.com。
摘 要:本试验利用电子束及γ射线两种射线对渐狭蜡蚧菌(Lecanicillium attenuatum)3166进行诱变处理,研究适于渐狭蜡蚧菌诱变选育的吸收剂量以及诱变菌株生物学特性。结果表明:电子束及γ射线诱变渐狭蜡蚧菌的最适剂量均为200 Gy,渐狭蜡蚧菌的电子束辐射敏感性D10值为191 Gy、γ射线D10值为366 Gy;以产孢速率为指标筛选获得突变菌株8株,其中5株的菌丝生长及产孢速率较出发菌株显著提高,均为电子束诱变所得,产孢速率分别较出发菌株提高了30.45%、31.55%、23.66%、64.83%、68.77%;诱变菌株的胞外几丁质酶比活在培养5 d时达到峰值,诱变株Ⅱ111、Ⅱ164、Ⅱ181的几丁质酶比活分别较出发菌株显著提高29.29%、54.45%、19.18%,其中Ⅱ164酶比活可达1 707.41 U/mg prot;胞外蛋白酶比活在培养7 d时达到峰值,Ⅱ111、Ⅱ164、Ⅱ181的蛋白酶比活分別较出发菌株显著提高17.98%、13.17%、16.50%,其中Ⅱ111酶比活达到30.71 U/mg prot,且渐狭蜡蚧菌诱变株生长速率与胞外酶比活有强相关性。本研究为渐狭蜡蚧菌后续的害虫防治及开发利用提供了理论基础。
关键词:渐狭蜡蚧菌;辐射诱变;突变菌株;生物学特性;胞外酶比活
中图分类号:TL99;S476.1 文献标志码:ADOI:10.3969/j.issn.1007-7146.2023.05.006
Screening of Lecanicillium attenuatum with High Growth Rate by Radiation Mutation and Its Biological Characteristics
DUAN Keyi1, LIU An2, CHEN Liang2, WU Xiaofen2, QI Hui2, ZHANG Qiling2, WANG Zhen2,
DENG Ming2, WANG Keqin2*, LIU Suchun1*
(1. College of Food Science and Technology, Hunan Agricultural University, Changsha 410125, China; 2. Engineering Technology Research Center of Agricultural Biological Irradiation, Hunan Institute of Nuclear Agricultural Science and Space Mutation Breeding, Hunan Academy of Agricultural Sciences, Changsha 410125, China)
Abstact: In this study, electron beam and γ-ray were used to mutagenize Lecanicillium attenuatum 3166, and the absorbed dose suitable for mutation breeding of Lecanicillium attenuatum and the biological characteristics of the mutagenized strain were studied. The results showed that the optimal dose for electron beam and γ-ray mutagenesis of Lecanicillium attenuatum was 200 Gy, the electron beam D10 value of Lecanicillium attenuatum was 191 Gy, and the γ-ray D10 value was 366 Gy; eight mutant strains were screened and obtained with spore production rate as the index. Among them, the hypha growth and spore production rate of five strains significantly increased compared with the parent strain, which were all obtained by electron beam mutagenesis. The spore production rate increased by 30.45%, 31.55%, 23.66%, 64.83% and 68.77% respectively compared with the parent strain. The extracellular chitinase activity of the mutant strain reached the peak after five days of culture, and the chitinase activities of mutant strains Ⅱ111, Ⅱ164 and Ⅱ181 increased by 29.29%, 54.45% and 19.18% respectively, compared with that of the parent strain. The chitinase activity of mutant strain Ⅱ164 reached 1 707.41 U/mg prot; the extracellular protease activity reached its peak after 7-day culture, and the protease activities of Ⅱ111, Ⅱ164 and Ⅱ181 were significantly increased by 17.98%, 13.17% and 16.50% respectively as compared with those of the parent strain, wherein the enzyme activity of Ⅱ111 could reach 30.71 U/mg prot, and the growth rate of the mutant strain had a strong correlation with the extracellular enzyme activity. This study provides a theoretical basis for the follow-up pest control, development and utilization of Lecanicillium attenuatum.
Key words: Lecanicillium attenuatum; radiation mutagenesis; mutagenized strain; biological property; extracellular enzyme specific activity
(Acta Laser Biology Sinica, 2023, 32(5): 431-440)
渐狭蜡蚧菌(Lecanicillium attenuatum)属于子囊菌纲,肉座菌目,蜡蚧菌属[1],是一类重要的虫生真菌,对蚜虫[2-4]、粉虱[4-8]、蚧虫[9-10]、蓟马[11]和线虫[12]等都有致病作用,在生物防治上具有极大的潜力。对比其他生防真菌如绿僵菌、白僵菌,蜡蚧菌在制剂开发及商品利用方面研究较少,可能的原因之一是蜡蚧菌的生长较慢、大规模产孢力较弱。目前对蜡蚧菌的研究主要集中于分生孢子、产孢能力等生物学特性以及野生型蜡蚧菌防治害虫的方面,通过辐射诱变育种技术选育蜡蚧菌优良菌株的研究较少。
辐射诱变具有较高的微生物变异率、突变方向多样、效率高等优点,是微生物菌种选育的一个重要技术途径[13]。王楠等[14]利用60Co-γ射线辐照诱变猴头菌尖端菌丝,获得一株生物量和菌丝多糖产量明显提高且性状稳定遗传的突变菌株。韩晶晶等[15]利用电子束辐照诱变,筛选出一株高产酒精酵母YF1。付玉洁等[16]采用电子束辐照诱变丙酮丁醇梭菌,并辅以胁迫试验,经筛选最终获得了一株突变菌株S10,其丁醇产量较出发菌株产量提高了10%。由此可见,通过60Co-γ射线和电子束辐照改变微生物的遗传结果和功能,筛选出具有特定性状的优良突变型微生物是选育微生物的重要手段。
本研究通过电子束和60Co-γ射线两种射线辐射诱变渐狭蜡蚧菌,以产孢速率为指标初步筛选获得诱变菌株,从菌株生物学特性对比两种射线对菌株产生的影响,筛选出高产孢速率的诱变渐狭蜡蚧菌,为蜡蚧菌诱变育种提供理论基础。
1 材料与方法
1.1 培养基
基础培养基(高葡萄糖马铃薯琼脂培养基):葡萄糖5.0%、马铃薯浸粉0.5%、琼脂1.5%。
筛选培养基(高葡萄糖马铃薯培养基):葡萄糖5.0%、马铃薯浸粉0.5%。
几丁质酶诱导培养基:0.200%胶体几丁质、0.100% KH2PO4、0.200% Na2HPO4、0.030%NaCl、0.300%KNO3、0.030% MgSO4 ·7H2O、0.001% FeSO4和0.300%胰蛋白胨(tryptone)。
蛋白酶诱导培养基:1.0%麦芽糖、0.5%蛋白胨、0.004 8% MgSO4、1.1% Na2HPO4·12H2O、 1.2% NaH2PO4·2H2O。
1.2 渐狭蜡蚧菌菌株诱变前处理
选取培养适宜天数的蜡蚧菌平板,无菌生理盐水冲洗菌平板,收集洗下的粗孢液,通过过滤装置滤去菌丝,得到单孢子悬液并计数。调整浓度至106 CFU/mL,分装为10 mL每离心管。于室温条件下分别用10 MeV电子加速器及60Co-γ射线(辐射源活度为2.96×1016 Bq)辐照处理,辐照设计剂量分别为0(对照)、50(仅电子束)、100、200、400、600、800、1 000、1 200、1 500、2 000 Gy。每個剂量辐照2管。
1.3 渐狭蜡蚧菌辐射敏感性(D10)测定及致死率计算
将辐照后的孢悬液参考GB 4789.15 — 2016[17]中的方法进行平板计数,计算不同辐照吸收剂量处理孢悬液的活孢数,并以0 Gy(未辐照)孢悬液为空白对照。以辐照吸收剂量为横坐标(x),活孢浓度的lg值为纵坐标(y)作图,计算渐狭蜡蚧菌在60Co-γ射线和电子束辐射下的D10值。同时计算致死率,公式如式(1)。
(1)
1.4 渐狭蜡蚧菌辐照后菌株初筛与复筛
挑取致死率在80%~90%计数平板中的单菌落于基础培养基斜面纯培养,记为0代,并对其编号。培养后刮取孢子接种1代菌平板,按照1.2中方法制备浓度为103 CFU/mL孢悬液,吸取1 mL孢悬液接种于筛选培养基中,28℃、220 r/min培养96 h,每株菌2个平行。计算菌株0~96 h的产孢速率,作为筛选指标,选取产孢速率显著提高的菌株,得到初筛的高产孢速率诱变株;再以同样的方法复筛出产孢速率较高的菌株进行后续试验。
1.5 渐狭蜡蚧菌菌丝生长特性的测定
使用6 mm打孔器于基础培养基中央半打孔,留出沟壑。调整孢悬液浓度为107 CFU/mL,吸取10 μL孢悬液接种于培养基中央圆饼位置,静置片刻,于(28±0.5)℃下培养,第3天开始采用十字交叉法每天测量菌落直径,测量至第8天,每株菌3个重复。
1.6 渐狭蜡蚧菌诱变菌株遗传稳定性的测定
以诱变后挑选出来的初次接种的菌落为突变菌株0代,转接至斜面纯培养的突变菌株为1代,用于后续试验的菌株均为突变菌株2代。制备浓度为107 CFU/mL的诱变菌株2代孢悬液,取1 mL孢悬液接种至液体培养基中28℃、220 r/min培养72 h,培养后的孢液过滤去菌丝,调整浓度为107 CFU/mL,取1 mL接种至新培养基,培养条件同上一代,重复至传代6次,获得诱变菌株的第8代。对比菌株第2代和第8代的产孢速率,评估诱变菌株产孢的遗传稳定性。
1.7 渐狭蜡蚧菌几丁质酶比活的测定
几丁质粉10 g加入100 mL 85%的磷酸,充分溶解,放入4℃冰箱中溶胀24 h后将混合液倒入大烧杯,加入蒸馏水搅匀后5 000 r/min离心10 min,弃上清液,水洗沉淀,反复离心、水洗至pH 5.5,蒸馏水定容至1 000 mL,得到终质量分数为1%的胶体几丁质。配制几丁质诱导培养基,调pH至5.5,0.15 MPa、121℃灭菌30 min后冷却备用。
按照1.2的方法制备蜡蚧菌孢悬液,调整孢悬液浓度为106 CFU/mL,将1 mL孢悬液接种于几丁质酶诱导培养基中,置于摇床28℃、220 r/min培养。培养后取1 mL发酵液5 000 r/min 离心15 min,取上清液-80℃冷冻保藏待用。
几丁质酶活的测定采用Solarbio几丁质酶活性检测试剂盒,蛋白浓度测定采用BCA蛋白浓度测定试剂盒(微量法)。根据N-乙酰氨基葡萄糖标准曲线计算酶活性。酶比活力按照总蛋白浓度计算,定义为37℃下,每毫克蛋白每小时分解几丁质产生1 μg N-乙酰氨基葡萄糖的酶量为一个酶比活性单位。
1.8 渐狭蜡蚧菌蛋白酶比活测定
配制106 CFU/mL孢子悬液,取1 mL接入蛋白酶液体诱导培养基中,28℃、220 r/min条件下培养,6 000 r/min离心10 min,取上清液,-80℃冷冻待用。
蛋白酶活的测定参照相关文献[18-20]方法,在275 nm波长下测定反应液的吸光值,根据酪氨酸标准曲线计算蛋白酶活性,每组3个平行;蛋白浓度测定采用BCA蛋白浓度测定试剂盒(微量法);酶比活力按照总蛋白浓度计算,定义为37℃下,每毫克蛋白每分钟分解酪蛋白产生酪氨酸的酶量为一个酶比活性单位。
1.9 数据处理
采用SPSS 21.0软件进行数据处理,单因素ANOVA检验(显著水平P<0.05即有统计学意义)和成对样本t检验进行显著性分析。作图采用Origin2022等软件。
2 结果与分析
2.1 电子束及60Co-γ射线辐照对渐狭蜡蚧菌辐照敏感度的影响及辐照诱变剂量的确定
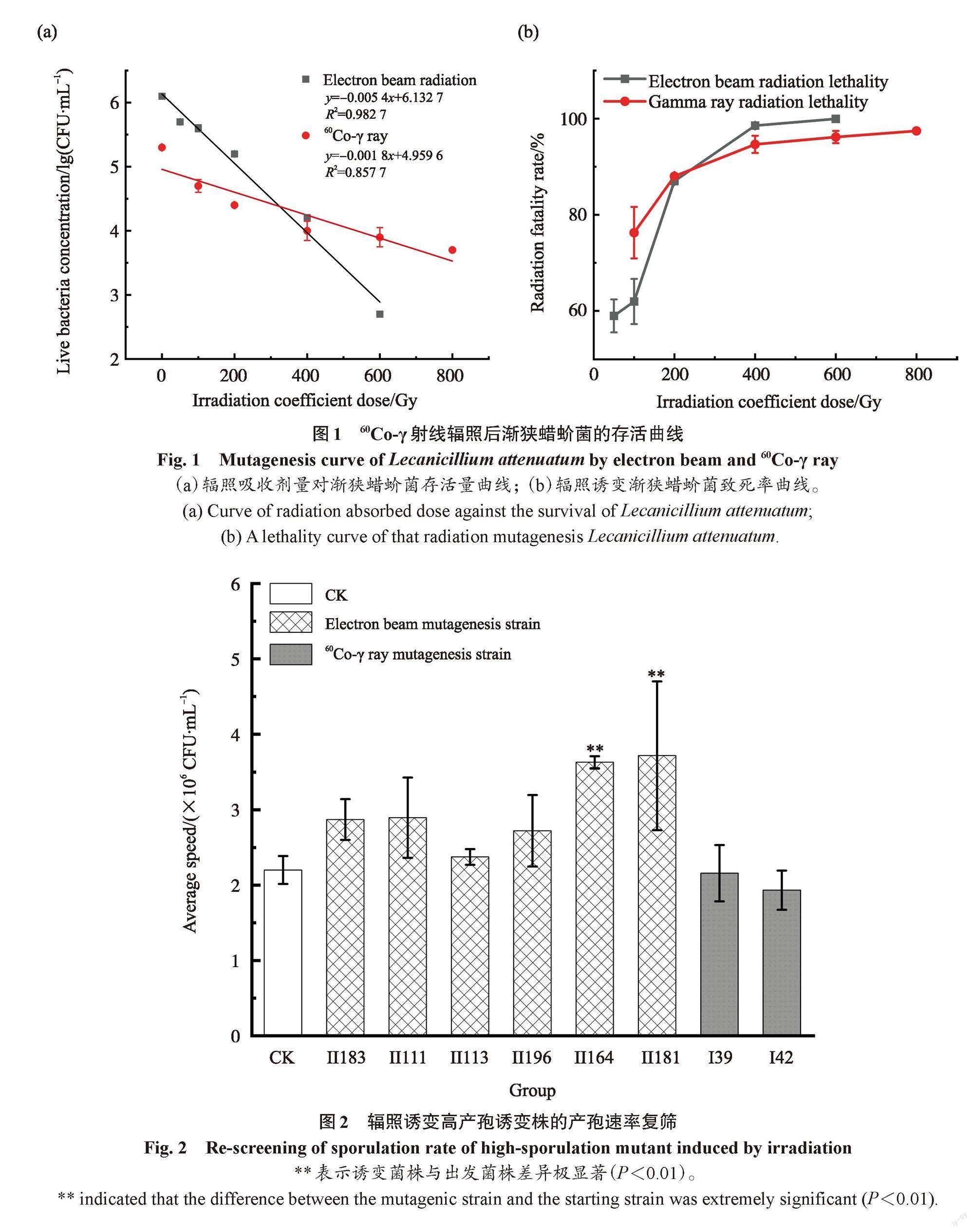
如图1a所示,电子束辐照吸收剂量与渐狭蜡蚧菌存活率的lg值关系曲线为y=-0.005 4x+6.132 7,R2=0.982 7;60Co-γ射线辐照吸收剂量与渐狭蜡蚧菌存活率的lg值关系曲线为:y=-0.001 8x+4.959 6,R2=0.857 7;依据公式算出电子束辐照吸收剂量的D10值为191 Gy, 60Co-γ射线辐照吸收剂量的D10值为366 Gy,说明本研究中的渐狭蜡蚧菌对电子束辐射更敏感。由图1b可知,两种射线在辐照吸收剂量达到400~600 Gy时对渐狭蜡蚧菌的影响开始保持同步,致死率均达到90%~100%,与徐岩[21]和张变英[22]的研究結果一致。前人研究认为,选择致死率为80%~90%的诱变菌株纯化分离,获得正突变菌株的概率更高,因此,本试验中电子束及60Co-γ射线辐照渐狭蜡蚧菌的适宜诱变剂量为200 Gy[23-24]。
2.2 诱变菌株产孢速率的初筛及复筛
将辐照后的孢子悬液分别稀释104、105、106倍,涂布于基础培养基平板中,28℃恒温培养4 d,挑出生长良好的菌落于基础培养基斜面中纯培养,共分离电子束诱变单菌株200株,60Co-γ射线诱变单菌株110株。根据1.4的方法,初筛得到29株产孢速率较高的电子束诱变株,12株产孢速率较高的60Co-γ射线诱变株。然后对41株初筛菌株用同样的筛选方法进行复筛,得到6株产孢速率较高的电子束诱变株,产孢速率分别较出发菌株CK提高了30.45%、31.55%、7.89%、23.66%、64.83%、68.77%。另外,得到了2株60Co-γ射线诱变株,但复筛时产孢速率较低;其中菌株Ⅱ164和Ⅱ181 的产孢速率在统计学上显著高于其他菌株(P<0.01),结果见图2。
2.3 电子束及60Co-γ射线辐照诱变对渐狭蜡蚧菌生长特性的影响
2.3.1 电子束及60Co-γ射线辐照对渐狭蜡蚧菌菌落生长速度的影响
由图3可知,8株诱变菌株生长趋势与CK一致,其中Ⅱ164、Ⅱ111号菌株培养6~8 d时的菌落直径均显著高于CK。培养5 d时,诱变菌落直径最高达到1.83 cm,与刘明科等[25]的研究相近。9株菌在3~8 d的菌落生长速率如图3d所示,其中Ⅱ164和Ⅱ111的生长速率都为0.28 cm/d,较CK有显著性差异(P<0.05),这与于士将等[26]研究中最快的菌株生长速率为2.86 mm/d的结果一致。由此推断,电子束辐照对渐狭蜡蚧菌3166的菌落生长正突变效应较强,60Co-γ射线辐照效果较弱。
2.3.2 电子束及60Co-γ射线辐照对渐狭蜡蚧菌产孢生长速率的影响
如图4所示:渐狭蜡蚧菌在0~48 h内主要生命活动为孢子萌发和菌丝生长,产孢量极少,产孢速率仅为102~103 (CFU·mL-1·h-1);48~72 h开始大量产孢,产孢速率急速上升至105~106 (CFU·mL-1·h-1);72~96 h时菌株最高产孢速率可达107 (CFU·mL-1·h-1)。以上结果表明,48~96 h是渐狭蜡蚧菌大量产孢的时期。殷华等[27]和谢明[28]研究了蜡蚧菌的发酵动力学,发现蜡蚧菌的产孢速率在培养24 h内即可达到106~107 (CFU·mL-1·h-1),培养时间相差较大是由于谢明研究中的孢悬液接种量较大为108 (CFU·mL-1·h-1),但其生长趋势与本研究中48~96 h内的产孢速率一致。
研究发现:0~72 h内Ⅱ183、Ⅱ111、Ⅱ113号菌株的产孢速率较CK显著提高(P<0.05);72~96 h内Ⅱ164、Ⅱ181号菌株产孢速率较CK显著提高(P<0.05)。结果表明,电子束辐照对渐狭蜡蚧菌3166的产孢能力有正向突变作用,60 Co-γ射线辐照对渐狭蜡蚧菌3166产孢能力未见有显著性突变作用。
2.4 辐照诱变渐狭蜡蚧菌产孢速率遗传稳定性
根据以上试验结果,选取了5株较出发菌株的产孢速率有显著性变化的诱变菌株,继代培养6次,测定第2代及第8代菌株在0~96 h内的产孢速率,评估产孢速率的遗传稳定性。由图5可知,5株诱变菌株经6次传代后,6代内产孢速率无显著变化(P>0.05),表明这5株诱变菌株均具有良好的产孢遗传稳定性。
2.5 渐狭蜡蚧菌菌株胞外酶的研究
2.5.1 诱变渐狭蜡蚧菌胞外酶比活随时间变化规律
绘制N -乙酰氨基葡萄糖标准曲线,x轴为几丁质酶比活,y轴为吸光度值,其标准曲线的线性方程为y=0.005 7x – 0.009 2,R2=0.999 2。测定突变菌株Ⅱ164号1~7 d的胞外几丁质酶比活力,如图6a所示,其几丁质酶比活力表现出随时间延长呈先升高后降低的趋势,这同董晶等[29]的研究一致。几丁质酶比活从第2天开始急剧升高,在第5天达到最高,每小时酶比活达到了1 707.41 U/mg prot。因此选择培养5 d的发酵液测定渐狭蜡蚧菌的几丁质酶比活。
绘制酪氨酸标准曲线,x轴为蛋白酶比活,y轴为吸光度值,其标准曲线的线性方程为y=0.007 7x + 0.014 3,R2=0.998 3。测定突变菌株Ⅱ164号1~7 d的胞外蛋白酶比活力,如图6 b所示,其蛋白酶比活力表现出随时间增加而增加的趋势,同彭国良等[30]的研究相似。蛋白酶比活力在7 d内属第7天为最高,每分钟酶比活力达到29.45 U/mg prot,且第4、5、6、7天的蛋白酶比活力之间存在显著差异,后续选择培养7 d的渐狭蜡蚧菌发酵液测定蛋白酶比活。
2.5.2 电子束辐照对渐狭蜡蚧菌胞外酶的影响
根据2.5.1的研究结果,制备渐狭蜡蚧菌培养5 d的胞外几丁质酶液和培养7 d的胞外蛋白酶液,分别测定几丁质酶比活和蛋白酶比活,结果如图7所示。突变菌株Ⅱ111、Ⅱ164、Ⅱ181的几丁质酶比活显著高于出发菌株CK(P<0.05),分别提高29.29%、54.45%、19.18%;Ⅱ111、Ⅱ164、Ⅱ181的蛋白酶比活显著高于出发菌株CK(P<0.05),分别提高17.98%、13.17%、16.50%。
2.6 诱变渐狭蜡蚧菌生长特性与胞外酶比活性的相关性分析
根据2.3.2的结果可知,渐狭蜡蚧菌在液体培养48~96 h内大量产孢,在此期间,几丁质酶比活也急剧上升,且由表1可知,蜡蚧菌几丁质酶比活和产孢浓度之间相关性达到极显著水平(P<0.01)。几丁质酶比活与菌落生长之间的相关系数为0.897,达到极显著水平(P<0.01),相比几丁质酶比活和产孢浓度之间相关性较低的原因是菌落的生長主要代表菌丝的生长状况,属于匀速生长。蛋白酶比活与菌落生长之间相关性达到显著水平(P<0.05),但与产孢浓度极显著相关(P<0.01)。由此可见,渐狭蜡蚧菌胞外酶比活与产孢量的相关性更强。前人研究发现,蜡蚧菌等虫生真菌胞外蛋白酶比活及几丁质酶比活与杀虫毒力存在相关性[29-33],且菌株生长速率、产孢量也与杀虫毒力存在极显著相关性[34-36],这与本研究中菌株生长特性与胞外酶比活之间的相关性的结论一致。
3 讨论
渐狭蜡蚧菌的杀虫机制是利用分生孢子附着在昆虫表皮后,分生孢子萌发并侵染虫体,并产生多种蛋白酶、几丁质酶等物质降解虫体角质层,使真菌顺利进入昆虫血腔,菌丝在昆虫体内生长,分泌内毒素等次级代谢产物,同时利用昆虫体内营养物质进行繁殖,最终入侵昆虫全器官,致昆虫死亡,达到防治虫害的作用[37-38]。可见分生孢子侵染和活性酶的产生是渐狭蜡蚧菌杀虫的两个重要过程,但由于渐狭蜡蚧菌产孢速度较慢,限制了其在田间的大规模应用。
为改善渐狭蜡蚧菌的应用现状,本研究采用电子束射线和60Co-γ射线辐射诱变生防真菌渐狭蜡蚧菌。诱变育种是扩大微生物应用空间的一大手段,其中辐射诱变更是选育微生物的重要手段,辐射能量使生物体各分子发生电离和激发,通过一系列反应产生活泼自由基,与大分子物质如核酸和蛋白质发生反应,引起分子结构的变化,致使生物体发生染色体畸变和基因突变等变化[39-40],再对突变后的菌株择优筛选,从而得到具有优良遗传性状的突变菌株。
本试验通过研究不同射线源诱变菌株的菌落特征和生长速率等方面,发现电子束对渐狭蜡蚧菌的诱变效果较60Co-γ射线明显,电子束诱变可显著提高渐狭蜡蚧菌与杀虫相关的胞外酶比活性,且渐狭蜡蚧菌的产孢量与胞外酶比活呈显著相关性,这与已有研究中生防真菌绿僵菌的产孢量下降后,酶活与昆虫致病力也随之降低[41-42]以及白僵菌的胞外酶酶活越高对昆虫的致死率越大[43-46]的结果一致。本研究可为辐照诱变技术提高蜡蚧菌菌株的害虫防治效果提供理论依据,也为蜡蚧菌后续的生防产品开发提供参考。
参考文献(References):
[1] ZARE R, GAMS W. A revision of Verticillium section Prostrata. Ⅳ. The genera Lecanicillium and Simplicillium gen. nov [J]. Nova Hedwigia, 2001, 73(1): 1-50.
[2] KIM H Y, LEE H B, KIM Y C, et al. Laboratory and field evaluations of entomopathogenic Lecanicillium attenuation CNU-23 for control of green peach aphid (Myzus persk) [J]. Journal of Microbiology and Biotechnology, 2008, 18(12): 1915-1918.
[3] KIM J J, KIM K C. Selection of a highly virulent isolate of Lecanicillium attenuatum, against cotton aphid [J]. Journal of Asia-Pacific Entomology, 2008, 11(1): 1-4.
[4] 孙大平, 路茜, 王鹏, 等. 4种病原真菌对桃蚜和温室白粉虱的致病力[J]. 吉林农业大学学报, 2021, 43(6): 664-672.
SUN Daping, LU Qian, WANG Peng, et al. Study on the pathogenicity of four pathogenic fungi to Myzus persicae and Bemisia tabaci in greenhouse[J]. Journal of Jilin Agricultural University, 2021, 43(6): 664-672.
[5] 李新民, 王克勤, 刘春来, 等. 蜡蚧轮枝菌生物学特性及其对温室白粉虱致病性的研究[J]. 植物保护, 2002(6): 28-31.
LI Xinmin, WANG Keqin, LIU Chunlai, et al. Biological characteristics of Verticillium lecanii and its pathogenicity to greenhouse whitefly[J]. Plant Protection, 2002(6): 28-31.
[6] 杨娟生. 基于RNAi技术的渐狭蜡蚧菌改造及其对柑橘木虱的控制效果评价[D]. 重庆: 西南大学, 2020.
YANG Juansheng. Transformation of Lecanicillium attenuatum based on RNAi technology and evaluation of its control effect on Citrus psylla[D]. Chongqing: Southwest University, 2020.
[7] 于士将. 渐狭蜡蚧菌 (Lecanicillium attenuatum) 介导的RNAi对柑橘粉虱毒力探究[D]. 重庆: 西南大学, 2015.
YU Shijiang. The virulence exploring of transgenic Lecanicillium attenuatum aganist citrus whitefly (Diaelorude citri) mediated by RNA interference[D]. Chongqing: Southwest University, 2015.
[8] 张召荣, 张艳军, 谢明. 一株来自热带地区蜡蚧菌的鉴定、生物学特性及其对烟粉虱的致病力[J]. 中国生物防治学报, 2015, 31(1): 64-70.
ZHANG Zhaorong, ZHANG Yanjun, XIE Ming. Identification, biological characteristics and pathogenicity to Bemisiatabaci of a strain from tropical areas[J]. China Journal of Biological Control, 2015, 31(1): 64-70.
[9] 袁盛勇, 孔琼, 张虹, 等. 蜡蚧轮枝菌MZ041024菌株对温室白粉虱和吹棉蚧的室内毒力[J]. 西南师范大学学报 (自然科学版), 2007(1): 111-114.
YUAN Shengyong, KONG Qiong, ZHANG Hong, et al. Indoor toxicity of Verticillium lecanii MZ041024 strain on greenhouse whitefly and Icerya purchasi[J]. Journal of Southwest Normal University (Natural Science Edition), 2007(1): 111-114.
[10] 袁盛勇, 闫鹏飞, 孔琼, 等. 蜡蚧轮枝菌对扶桑绵粉蚧的致病性研究[J]. 环境昆虫学报, 2016, 38(4): 748-754.
YUAN Shengyong, YAN Pengfei, KONG Qiong, et al. Study on the pathogenicity of Verticillium lecanii to Phenacoccus solenopsis[J]. Journal of Environmental Insects, 2016, 38(4): 748-754.
[11] 周葉鸣. 蜡蚧菌属真菌对西花蓟马的致病性[D]. 贵州: 贵州大学, 2021.
ZHOU Yeming. Pathogenicity of wax scale fungi to Frankliniella occidentalis[D]. Guizhou: Guizhou University, 2021.
[12] 赵洋. 渐狭蜡蚧菌对南方根结线虫卵孵化抑制及其几丁质酶基因LACHI1的克隆[D]. 青岛: 青岛农业大学, 2014.
ZHAO Yang. Incubation inhibition of wax scale bacteria on Meloidogyne incognita eggs and cloning of chitinase gene LACHI1[D]. Qingdao: Qingdao Agricultural University, 2014.
[13] 杨兆民, 张璐. 辐射诱变技术在农业育种中的应用与探析[J]. 基因组学与应用生物学, 2011, 30(1): 87-91.
YANG Zhaomin, ZHANG Lu. Application and analysis of radiation mutagenesis technology in agricultural breeding[J]. Genomics and Applied Biology, 2011, 30(1): 87-91.
[14] 王楠, 任大明, 龚涛, 等. 60Co-γ射线辐照诱变尖端菌丝选育猴头菌多糖高产菌株[J]. 中国食用菌, 2005(6): 37-39.
WANG Nan, REN Daming, GONG Tao, et al. Breeding of Hericiumerinaceus polysaccharide high-yielding strain by 60Co-γ ray irradiation mutagenesis of pointed hypha[J]. China Edible Fungus, 2005(6): 37-39.
[15] 韓晶晶, 吕江涛, 张琴, 等. 高能脉冲电子束诱变筛选高产酒精酵母及其发酵条件优化[J]. 辐射研究与辐射工艺学报, 2011, 29(3): 154-158.
HAN Jingjing, LYU Jiangtao, ZHANG Qin, et al. Screening of high-yield Alcohol yeast by high-energy pulsed electron beam mutagenesis and optimization of fermentation conditions [J]. Journal of Radiation Research and Radiation Technology, 2011, 29(3): 154-158.
[16] 付玉洁, 吕江涛, 王言, 等. 高能脉冲电子束诱变筛选丙酮丁醇梭菌及发酵研究[J]. 辐射研究与辐射工艺学报, 2011, 29(5): 297-301.
FU Yujie, LYU Jiangtao, WANG Yan, et al. Mutagenesis of Clostridium acetobutylicum by hebe and research of the fermentation[J]. Journal of Radiation Research and Radiation Technology, 2011, 29(5): 297-301.
[17] GB 4789.15—2016, 食品安全国家标准 食品微生物学检验霉菌和酵母计数[S]. 北京: 中国标准出版社, 2016.
GB 4789.15—2016, National Standard for Food Safety, Food microbiological examination, Mold and yeast counts[S]. Beijing: Standards Press of China, 2016.
[18] 卢招雄. 蜡蚧菌蛋白酶的纯化及酶学性质初步研究[D]. 福建: 福建农林大学, 2009.
LU Zhaoxiong. Preliminary studies of purification and charaction of protease produced from lecanicillium lecanii[D]. Fujian: Fujian Agriculture and Forestry University, 2009.
[19] 张晓林. 外源表皮降解蛋白酶基因(Cdep1)转化蜡蚧菌及其酶活性增强效果评价[D]. 北京: 中国农业科学院, 2016.
ZHANG Xiaolin. Transformation of exogenous epidermal degradation protease gene (Cdep1) into Ceratococcus sp. and evaluation of enhancement effect of its enzyme activity[D]. Beijing: China Academy of Agricultural Sciences, 2016.
[20] 张寒俊, 刘大川, 杨国燕. 紫外光谱法定量测定不同种蛋白酶活力的研究[J]. 粮食与饲料工业, 2004(9): 44-45.
ZHANG Hanjun, LIU Dachuan, YANG Guoyan. Study on quantitative determination of the activity of different kinds of protease by ultraviolet spectrometry[J]. Grain and Feed Industry, 2004(9): 44-45.
[21] 徐岩. 高产γ-淀粉酶黑曲霉菌株的电子束诱变育种及其产酶糖化力研究[D]. 吉林: 吉林农业大学, 2019.
XU Yan. Electron beam mutagenesis breeding of high γ-amylase yield Aspergillus niger strain and its enzyme saccharifying power[D]. Jilin: Jilin Agricultural University, 2019.
[22] 张变英. ~(60) Co-γ射线对白腐真菌和黑曲霉的诱变效应以及对木质素降解的研究[D]. 广西: 广西大学, 2003.
ZHANG Bianying. Mutation effect of ~ (60) Co-γ ray on white rot fungi and Aspergillus niger and its effect on lignin degradation[D]. Guangxi: Guangxi University, 2003.
[23] 袁超, 袁丹丹, 趙建刚, 等. 硫酸二乙酯与紫外线复合诱变选育糖化酶高产菌株的研究[J]. 食品与药品, 2018, 20(3): 219-223.
YUAN Chao, YUAN Dandan, ZHAO Jiangang, et al. Study on screening high-yielding glucoamylase strain by combined mutagenesis of diethyl sulfate and ultraviolet[J]. Food and Drug Administration, 2018, 20(3): 219-223.
[24] 沈雁飞, 单颖, 柳明杰. 降胆固醇嗜酸乳杆菌的诱变选育[J]. 微生物学杂志, 2012, 32(4): 30-34.
SHEN Yanfei, SHAN Ying, LIU Mingjie. Mutation breeding of cholesterol-lowering Lactobacillus acidophilus[J]. Journal of Microbiology, 2012, 32(4): 30-34.
[25] 刘明科, 闫芳芳, 齐禹哲, 等. 对桃蚜高毒力的蜡蚧菌菌株筛选[J]. 昆虫学报, 2020, 63(6): 751-758.
LIU Mingke, YAN Fangfang, QI Yuzhe, et al. Screening of wax scale bacteria with high toxicity to Myzus persicae[J]. Acta Entomology, 2020, 63(6): 751-758.
[26] 于士将, 潘琦, 王翠伦, 等. 重庆果园几种渐狭蜡蚧菌分离鉴定及生物学特性分析[J]. 中国园艺文摘, 2018, 34(2): 67-70.
YU Shijiang, PAN Qi, WANG Cuilun, et al. Isolation, identification and biological characteristics analysis of several wax scale fungi in Chongqing orchard[J]. China Gardening Abstract, 2018, 34(2): 67-70.
[27] 殷华, 李锋, 蒋继宏. 蜡蚧轮枝菌液体发酵的代谢动力学[J]. 安徽农业大学学报, 2004(3): 340-343.
YIN Hua, LI Feng, JIANG Jihong. Metabolic kinetics of liquid fermentation by Verticillium lecanii[J]. Journal of Anhui Agricultural University, 2004(3): 340-343.
[28] 谢明. 蜡蚧轮枝菌发酵生物学及发酵工程的研究[D]. 北京: 中国农业科学院, 2003.
XIE Ming. Study on fermentation biology and fermentation engineering of Verticillium lecanii[D]. Beijing: China Academy of Agricultural Sciences, 2003.
[29] 董晶, 谢映平, 刘卫敏, 等. 病原真菌降解两种蚧虫体壁过程中胞外酶作用[J]. 中国农业科学, 2015, 48(5): 889-899.
DONG Jing, XIE Yingping, LIU Weimin, et al. Effects of extracellular enzymes on the degradation of insect body wall by pathogenic fungi in two scale insects[J]. China Agricultural Sciences, 2015, 48(5): 889-899.
[30] 彭国良, 薛皎亮, 刘卫敏, 等. 蜡蚧轮枝菌入侵蚧虫表皮过程中蛋白酶和几丁质酶的作用[J]. 应用与环境生物学报, 2009, 15(2): 220-225.
PENG Guoliang, XUE Jiaoliang, LIU Weimin, et al. Effects of protease and chitinase on scale insect epidermis invasion by Verticillium lecanii[J]. Journal of Applied and Environmental Biology, 2009, 15(2): 220-225.
[31] 黄鹏, 余德亿, 林勇文, 等. 基质诱导培养蜡蚧轮枝菌蓟马防控菌株的胞外酶活性及毒力变化[J]. 福建农业学报, 2016, 31(2): 157-160.
HUANG Peng, YU Deyi, LIN Yongwen, et al. Extracellular enzyme activity and virulence changes of the substrate-induced culture strain of Verticillium lecanii thrips prevention and control[J]. Fujian Agricultural Journal, 2016, 31(2): 157-160.
[32] 韩珍珍. 蜡蚧霉对蚧虫的致病力及组织病理学研究[D]. 山西: 山西大学, 2010.
HAN Zhenzhen. Pathogenicity and histopathology of Verticillium lecanii on scale insects[D]. Shanxi: Shanxi University, 2010.
[33] 黄鹏, 余德亿, 姚锦爱, 等. 蜡蚧轮枝菌生物学特性及其与榕母管蓟马毒力的相关性[J]. 西北农林科技大学学报 (自然科学版), 2016, 44(11): 172-177.
HUANG Peng, YU Deyi, YAO Jinai, et al. Biological characteristics of Verticillium lecanii and its correlation with the virulence of Thrips banyan[J]. Journal of Northwest University of Agriculture and Forestry Science (Natural Science Edition) , 2016, 44(11): 172-177.
[34] 雷妍圆, 吕利华, 何余容, 等. 球孢白僵菌生物学特性与其对小菜蛾致病力相关性分析[J]. 中国生物防治, 2010, 26(2): 143-148.
LEI Yanyuan, LYU Lihua, HE Yurong, et al. Correlation between biological characteristics of Beauveria bassiana and its pathogenicity to Plutella xylostella[J]. Biological Control in China, 2010, 26(2): 143-148.
[35] 黃大庆, 姚剑. 球孢白僵菌菌株产孢量及其与毒力关系的研究[J]. 宿州师专学报, 2004(2): 106-108.
HUANG Daqing, YAO Jian. Spore production of Beauveria bassiana and its relationship with virulence[J]. Journal of Suzhou Teachers College, 2004(2): 106-108.
[36] 雷妍圆, 吕利华, 何余容, 等. 玫烟色棒束孢的生物学特性与其对小菜蛾致病力的相关性[J]. 植物保护学报, 2010, 37(3): 217-221.
LEI Yanyuan, LYU Lihua, HE Yurong, et al. Biological characteristics of Corynespora rosea and its correlation with pathogenicity to Plutella xylostella[J]. Acta Plant Protection, 2010, 37(3): 217-221.
[37] 李伟, 许维岸, 李照会. 蜡蚧轮枝菌 (Verticillium lecanii) 的致病机理及其生防应用研究新进展[J]. 山东农业大学学报 (自然科学版), 2001(4): 561-565.
LI Wei, XU Weian, LI Zhaohui. Pathogenic mechanism of Verticillium lecanii and new progress in its biocontrol application[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2001(4): 561-565.
[38] 谢文. 渐狭蜡蚧菌对西花蓟马的侵染及对生殖的影响[D]. 贵州: 贵州大学, 2022.
XIE Wen. Infection of Cercospora angustifolia to Frankliniella occidentalis and its effect on reproduction[D]. Guizhou: Guizhou University, 2022.
[39] 邵智韬. 电子束辐照诱变黑曲霉突变菌对米酒品质影响的研究[D]. 吉林: 吉林农业大学, 2019.
SHAO Zhitao. Study on the effect of Aspergillus niger mutant induced by electron beam irradiation on the quality of rice wine[D]. Jilin: Jilin Agricultural University, 2019.
[40] 杨兆民, 张璐. 辐射诱变技术在农业育种中的应用与探析[J]. 基因组学与应用生物学, 2011, 30(1): 87-91.
YANG Zhaomin, ZHANG Lu. Application and analysis of radiation mutation technology in agricultural breeding[J]. Genomics and Applied Biology, 2011, 30(1): 87-91.
[41] 谢鹏辉. 利用绿僵菌对椰心叶甲防治的研究[D]. 南昌: 南昌大学, 2006.
XIE Penghui. Study on the control of Brontispa longissima by Metarhizium anisopliae[D]. Nanchang: Nanchang University, 2006.
[42] 樊美珍, 胡锦江, 郭超, 等. 绿僵菌不同世代酯酶同工酶、脂肪酸等与其毒力关系的初步研究[J]. 西北林学院学报, 1991(1): 42-47.
FAN Meizhen, HU Jinjiang, GUO Chao, et al. Preliminary study on the relationship between esterase isoenzymes, fatty acids and virulence of Metarhizium anisopliae in different generations[J]. Journal of Northwest Forestry University, 1991(1): 42-47.
[43] GUPTA S C, LEATHERS T D, EL-SAYED G N, et al. Relationships among enzyme activities and virulence parameters in Beauveria bassiana infections of Galleria mellonella and Trichoplusiani[J]. Journal of Invertebrate Pathology, 1994, 64(1): 13-17.
[44] STLEGER R J, BIDOCHKA M J, ROBERTS D W, et al. Isoforms of the Cuticle-Degrading Pr1 proteinase and production of a metalloproteinase by Metarhizium anisopliae: ScienceDirect[J]. Archives of Biochemistry and Biophysics, 1994, 313(1): 1-7.
[45] EL-SAYED G N, COUDRON T A, IGNOFFO C M, et al. Chitinolytic activity and virulence associated with native and mutant isolates of an entomopathogenic fungus, Nomuraea rileyi[J]. Journal of Invertebrate Pathology, 1989, 54(3): 394-403.
[46] 彭國雄, 张永军, 杨星勇, 等. 球孢白僵菌不同世代菌株胞外蛋白酶与毒力的关系[J]. 中国生物防治, 2000(2): 61-64.
PENG Guoxiong, ZHANG Yongjun, YANG Xingyong, et al. Relationship between extracellular protease and virulence of Beauveria bassiana strains in different generations[J]. China Biocontrol, 2000(2): 61-64.
